Similar presentations:
Сероводород и сульфиды
1. Сероводород. Сульфиды.
I. Сероводород1. Состав, строение сероводорода
2. Нахождение в природе
3. Физические свойства. Физиологическое
воздействие на живые организмы
4. Получение
5. Химические свойства
II. Сульфиды металлов
1. Классификация сульфидов
2. Тест
2. Нахождение в природе
Сероводород входит в состав вулканических газов, атакже содержится в воде некоторых минеральных
источников. Сероводород образуется при гниении
серосодержащих остатков растительного и животного
происхождения.
3. Физические свойства. Физиологическое воздействие на живые организмы
Лавандой, ландышем, фиалкойИли простой еловой палкой
Пусть будет пахнуть – нам не жалко.
Но никогда не будет моды
На запах сероводорода!
«… Тогда услышал я (о, диво!) запах скверный,
Как будто тухлое разбилося яйцо»...
А. С. Пушкин
Это действительно о нем – о сероводороде. Сероводород – бесцветный
газ с характерным запахом тухлых яиц. t(пл.) = ─ 86°С, t(кип.) = ─ 60°С.
В 100 г воды при н.у. растворяется 467 мл сероводорода.
Сероводород очень токсичен. При содержании его в воздухе более
0,01% наступают тяжелые отравления. Он соединяется с железом
гемоглобина крови, что может привести к обморочному состоянию от
кислородного голодания. В присутствии паров органических веществ
токсичность сероводорода резко возрастает.
4. Получение сероводорода
В промышленности сероводород получают как побочныйпродукт при очистке нефти, природного и коксового газов.
В лаборатории его получают взаимодействием соляной
или разбавленной серной кислот с сульфидами цинка или
железа.
Составьте уравнение реакции взаимодействия сульфида
цинка и соляной кислоты:
ZnS + 2HCl = ZnCl2 + H2S
ZnS + 2H+ + 2Cl¯ = Zn2+ + 2Cl¯ + H2S
ZnS + 2H+ = Zn2+ + H2S
5.
Химические свойстваКакую степень окисления проявляет сера в сероводороде?
-2
Какие свойства характерны для соединений, в которых элемент
проявляет низшую степень окисления?
Сероводород – это сильный восстановитель.
Составьте уравнение реакции сгорания сероводорода в кислороде:
2H2S + 3O2 = 2SO2 + 2H2O (избыток кислорода)
2H2S + O2 = 2S + 2H2O
(недостаток кислорода)
опыт
Сероводород легко окисляется галогенами
, оксидом серы (IV),
хлоридом железа (III):
На воздухе сероводород окисляет
серебро, что и объясняет почернение
2H2S + SO2 = 2H2O + 3S
серебряных изделий, которое
H2S + 2FeCl3 + S + 2HCl
наблюдается со временем.
2H2S + 4Ag + O2 = 2Ag2S + 2H2O
6.
Сульфиды металловКак двухосновная, сероводородная средние (сульфиды)
кислота образует два ряда солей – кислые (гидросульфиды)
Нерастворимые сульфиды
металлов окрашены в
различные цвета.
2KOH + H2S = K2S + 2H2O
KOH + H2S = KHS + H2O
Ag+
Zn2+
Pb2+
Mn2+ Bi
3+
Cu2+
Sn2+
Hg2+ Cd2+
S2- Ag2S
ZnS
PbS
MnS
Bi2S3
CuS
SnS
HgS
CdS
Как и сероводород и сульфиды являются сильными восстановителями
Составьте уравнения реакций горения сульфида меди (II), рассмотрите
с т.зр. ОВР.
2CuS-2 + 3O20 = 2CuO-2 + 2S+4O2
S-2 ─ 6e → S+4 6 2 CuS (за счет S-2)─восстановитель, пр. окисления
O20 +4e →2O-2 4 3 О2 – окислитель, пр.восстановления
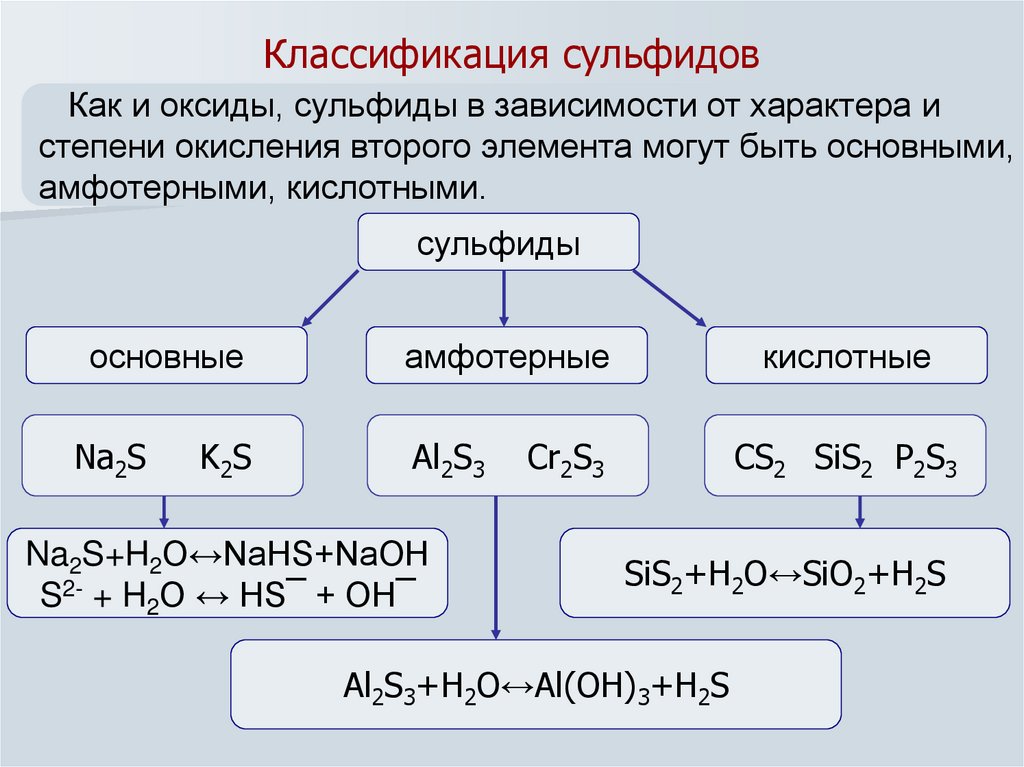
7. Классификация сульфидов
Как и оксиды, сульфиды в зависимости от характера истепени окисления второго элемента могут быть основными,
амфотерными, кислотными.
сульфиды
основные
Na2S
K2S
амфотерные
Al2S3
Na2S+H2O↔NaHS+NaOH
S2- + H2O ↔ HS¯ + OH¯
кислотные
Cr2S3
CS2 SiS2 P2S3
SiS2+H2O↔SiO2+H2S
Al2S3+H2O↔Al(OH)3+H2S






 chemistry
chemistry








