Similar presentations:
Сероводород. Сульфиды
1.
Сероводород.Сульфиды
2.
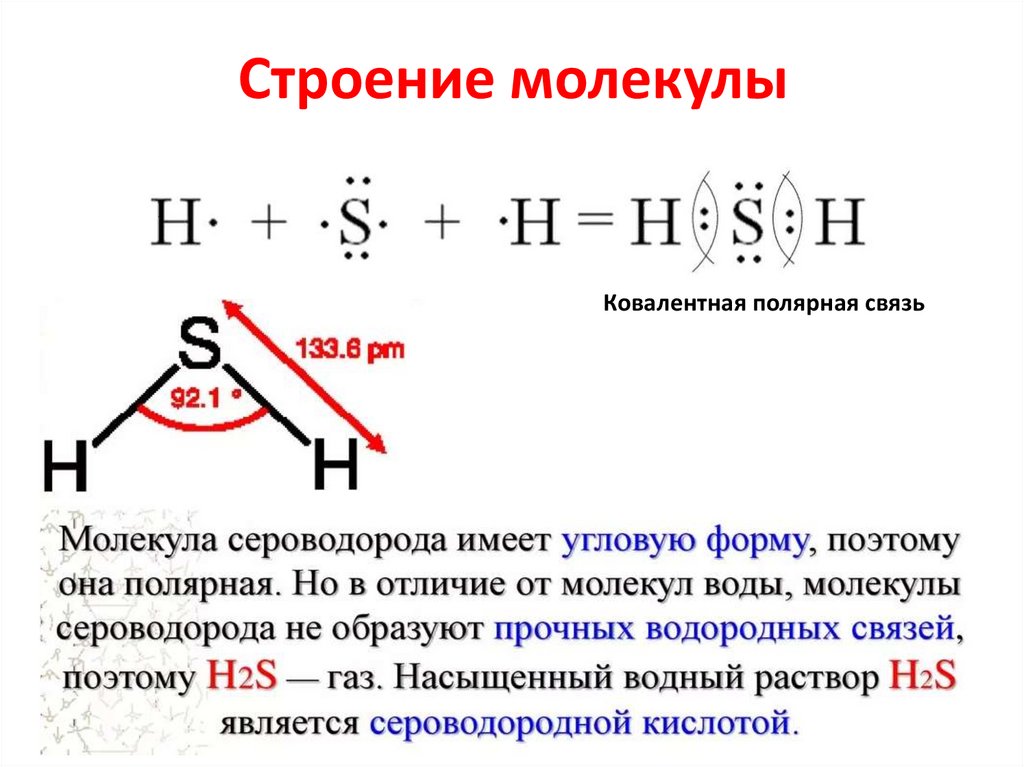
Строение молекулыКовалентная полярная связь
3.
Нахождение в природеСодержится в вулканических
газах
В Черном море на глубине
больше 200м
Минеральные источники
Кавказа
Образуется при гниении
белковых молекул
4.
Физические свойства• Газ, бесцветный, с запахом тухлых яиц,
ядовит!!! Разрушает гемоглобин крови
t°пл. = -86°C; t°кип. = -60°С.
• Растворим в воде (в 1V H2O растворяется
3V H2S при н.у.). Раствор сероводорода в
воде − сероводородная кислота
5.
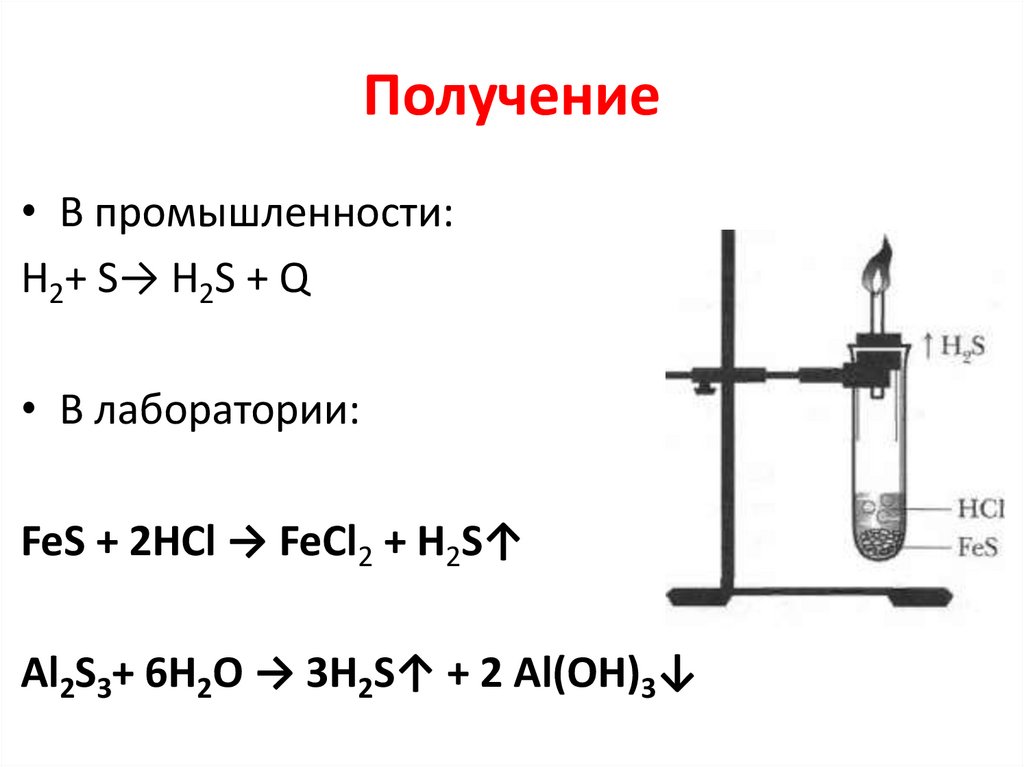
Получение• В промышленности:
H2+ S→ H2S + Q
• В лаборатории:
FeS + 2HCl → FeCl2 + H2S↑
Al2S3+ 6H2O → 3H2S↑ + 2 Al(OH)3↓
6.
Химические свойстваH2S − сильный восстановитель за счет S-2
1) +O2
2H2S + O2 (недост) → 2S ↓ + 2H2O
2H2S + 3O2 (изб) → 2SO2 + 2H2O
2) +Hal2
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
7.
Химические свойства3)+сложные вещества
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
t
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
2H2S + SO2 → 3S + 2H2O
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
8.
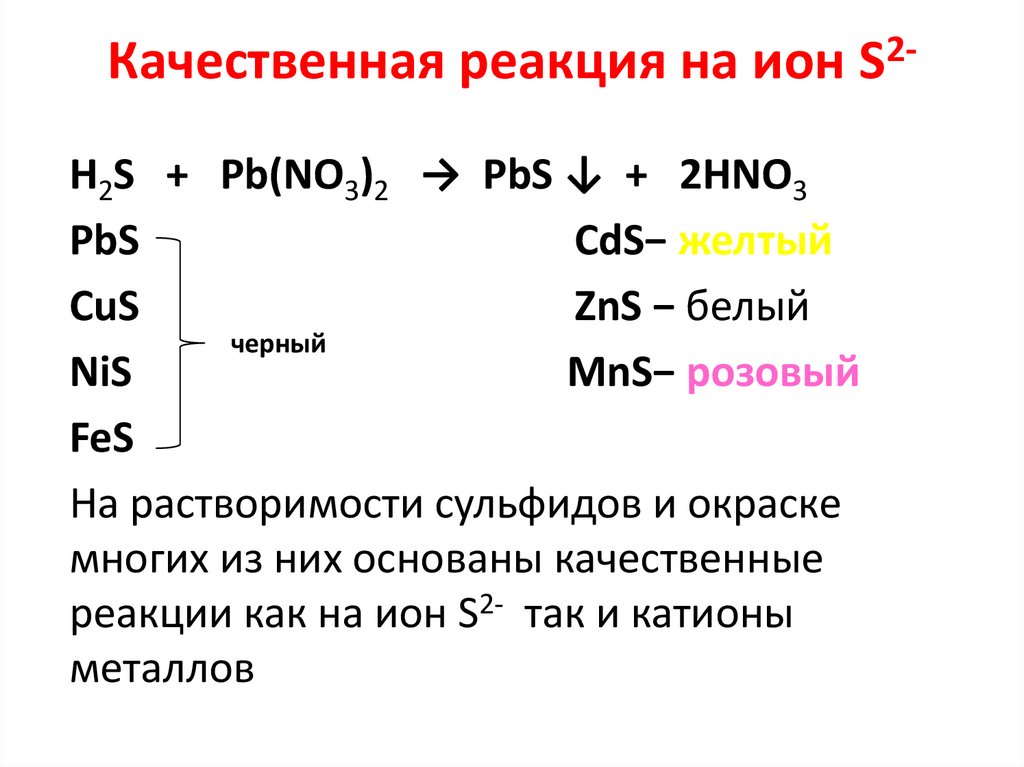
Сероводородная кислота• Слабая двухосновная кислота
1. H2S → H+ + HS2. HS- → 2H+ + S2Проявляет все общие свойства кислот:
1. H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. H2S + 2Na → Na2S + H2








 chemistry
chemistry








