Similar presentations:
Гидролиз солей
1.
Тема занятия: «Гидролиз солей»Девиз занятия:
«Единственный путь, ведущий к знанию, - это
деятельность»
(Б.Шоу)
План занятия
1.
Отчеты о выполнении творческими группами
исследовательских заданий
2.
Значение гидролиза
3.
Подведение итогов эксперимента
4.
Повторение знаний
2.
Гидролиз солей - это химическоевзаимодействие ионов соли с ионами
воды, приводящее к образованию слабого
электролита.
3.
4.
5.
6.
1. Какие вещества называются солями?2. Какие ионы отвечают за цвет индикатора в кислой
среде?
3. Какие ионы отвечают за цвет индикатора в щелочной
среде?
4. Есть ли эти ионы в средних солях?
5. Является ли вода электролитом?
6. Какая среда должна быть по вашему мнению в
растворах солей?
7.
Постановка проблемного вопросаПочему по разному ведут себя
соли в водном растворе?
Почему их растворы имеют
различную среду?
8.
Если рассматривать соль как продуктнейтрализации основания кислотой, то можно
разделить соли на четыре группы, для каждой из
которых гидролиз будет протекать по-своему.
9.
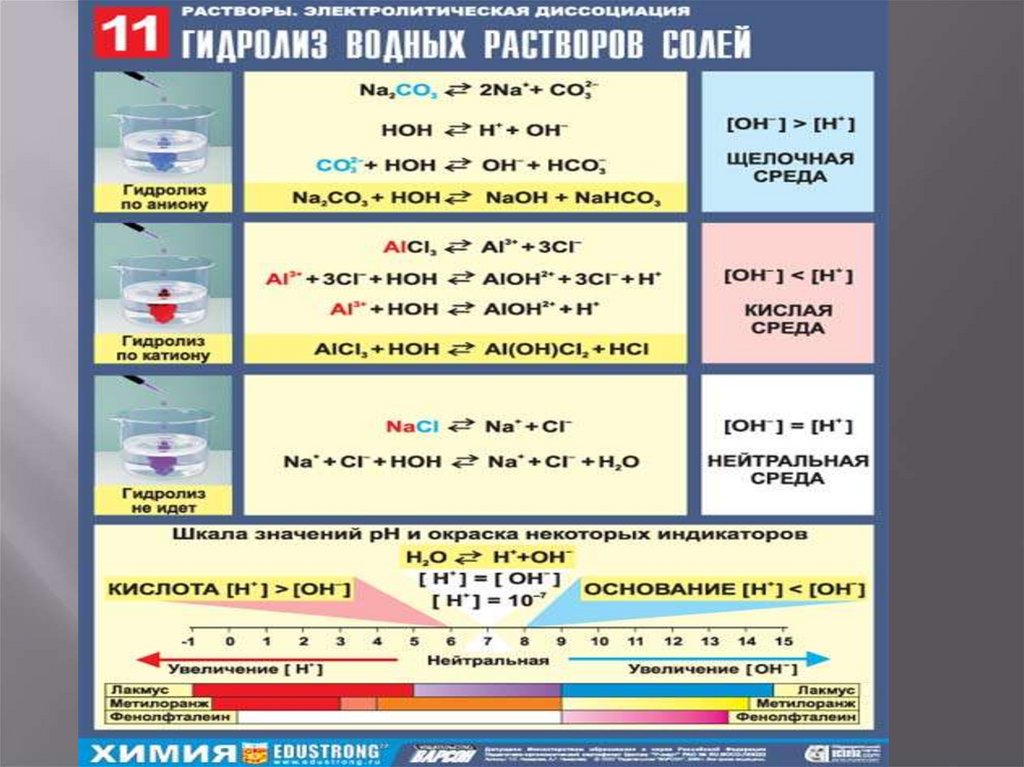
Гидролиз солей, образованных сильнымоснованием и слабой кислотой
K2CO3
Сокращенное – ионное уравнение реакции
CO32- + HOH
HCO3- + OH-
Полное ионное уравнение реакции
2K+ + CO32- + HOH
2K+ + HCO- + OH-
Молекулярное уравнение реакции
K2CO3 + H2O
KHCO3 + KOH
Среда раствора щелочная
Cамостоятельно написать уравнение реакции гидролиза соли Na2S
10.
11.
Гидролиз солей, образованных слабымоснованием и сильной кислотой
AlCl3
Al3+ + HOH
Al3+ + 3Cl- + HOH
AlCl3 + H2O
AlOH2+ + H+
AlOH2+ + H+ + 3ClAlOHCl2 + HCl
Среда раствора кислая
Самостоятельно написать уравнение реакции
гидролиза соли Zn(NO3)2
12.
13.
Гидролиз солей, образованных слабымоснованием и слабой кислотой
CH3COONH4
CH3COO- + NH4+ +HOH
CH3COONH4 + H2O
NH4OH + CH3COOH
NH4OH + CH3COOH
По справочнику определяем константы диссоциации
основания и кислоты, они практически одинаковы и
равны 1,8*10-5, поэтому реакция среды будет
нейтральной.
Если соль образована слабым основанием и слабой
кислотой различной силы, реакция среды может быть
слабокислой или слабощелочной.
Самостоятельно запишите уравнение реакции
гидролиза соли NH4CN, если константа диссоциации
основания больше, чем кислоты
14.
Гидролиз - процессобратимый. Повышение
концентрации ионов
водорода и гидроксидионов препятствует
протеканию реакции до
конца. Параллельно с
гидролизом проходит
реакция нейтрализации,
когда образующееся
слабое основание
(Мg(ОН)2, Fe(ОН)2 )
взаимодействует с
сильной кислотой, а
образующаяся слабая
кислота ( СН3СООН,
Н2СО3 ) - со щелочью.
15.
Гидролиз протекает необратимо, если врезультате реакции образуется нерастворимое
основание и (или) летучая кислота:
Al2S3 + 6H2O =>2Al(OH)3 + 3H2S
16.
Соли, образованные сильнымиоснованиями и сильными кислотами
KNO3
KNO3 + H2O
K+ + NO3- + HOH
HOH
KOH + HNO3
K+ + OH- + H+ + NO3H+ + OH-
Взаимодействия ионов соли с ионами воды не
произошло, среда раствора нейтральная.
17.
18. Значение гидролиза
19.
Применяя его вотношении жиров,
целлюлозы и
углеводов давно
получают мыло,
глицерин, этиловый
спирт и другие
ценные продукты.
20.
Очень часторассматриваемые
реакции являются
промежуточным
этапом в
многостадийных
синтезах других
продуктов целевого
назначения.
21.
Влияние температуры на гидролиз солейУсиление гидролиза с повышением
температуры объясняется увеличением
эндотермической диссоциации воды:
H2O
H+ + OH- - 57 кДж/моль,т.к. при этом
равновесие смещается в сторону прямой
реакции.
22.
Степень гидролиза – это отношение количествагидролизованной соли к общему количеству растворенной соли.
Чем слабее кислота или основание, тем больше степень
гидролиза.
Гидролиз соли – процесс обратимый, поэтому к нему применим
закон действия масс. Исходя из этого, можно найти
математическое выражение константы гидролиза.
Константа гидролиза величина постоянная и показывает
способность соли гидролизоваться.
Для уравнения: CH3COO- + HOH
CH3COOH +OH-
23.
24.
Cпасибо завнимание!






















 chemistry
chemistry








