Similar presentations:
Углерод – самый аллотропный элемент
1.
УГЛЕРОД – САМЫЙАЛЛОТРОПНЫЙ
ЭЛЕМЕНТ
2.
Строение углеродаУглерод обозначается символом C (лат. carboneum –
рождающий уголь), Углерод находится в 4 группе A во
2 периоде. Три изотопа этого элемента встречаются в
природе: 12C и 13C - стабильны, 14C- радиоактивный, с
периодом полураспада 5730 лет. Валентность атома
углерода в невозбужденном состоянии равна
двум. Агрегатное состояние углерода при нормальных
условиях — твердое вещество с атомной кристаллической
решеткой. Возможные валентности: 2, 4.Возможные степени
окисления: −4, 0, +2, +4.
3.
Аллотропия углеродаВыделяют два вида углерода в зависимости от образования
модификаций: Кристаллический углерод входит в состав твердых
веществ (алмаз, графит, графен, фуллерен, карбин).Аморфный
углерод образует мягкие вещества (уголь, кокс, сажа). Рассмотрим
подробнее основные аллотропные модификации углерода, их
физические свойства и применение.
4.
АлмазАлмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый
природный минерал, имеет высокую теплопроводность. Его используют в промышленности
для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что
алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок
применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы
называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между
всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет. При действии
излучения алмазы начинают светиться разными цветами. Такая игра света, хороший
показатель преломления и прозрачность делают этот драгоценный камень одним из самых
дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении и высоких
температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например,
Ni).При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают
графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее.
При прокаливании в кислороде алмаз сгорает, образуя диоксид углерод.
5.
ГрафитГрафит — темно-серое мягкое кристаллическое вещество со слабым
металлическим блеском. Хорошо электро- и теплопроводен, стоек при
нагревании в вакууме. Имеет слоистую структуру. На поверхности
оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах
термодинамических величин он принимается в качестве стандартного
состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но
легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают
искусственный графит из лучших сортов каменного угля.
6.
УгольУголь — мельчайшие кристаллики графита, полученные путем термического
разложения углеродсодержащих соединений без доступа воздуха.Угли имеют разные
свойства в зависимости от веществ, из которых получены. Наиболее важные сорта
угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в
металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря
пористому строению он обладает высокой адсорбционной способностью.
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при
сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с
ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого
топлива, дерева и продуктов его переработки. Применяются для поглощения паров
летучих жидкостей из воздуха.
7.
ГрафенГрафен представляет собой монослой графита. Впервые графен
был получен ручным механическим отщеплением в лабораторных
условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи
нагревания кремниевых пластин, верхний слой которых состоит из
карбида кремния. Под действием высоких температур происходит
отщепление атомов углерода, которые остаются на пластинке в
виде графена, а кремний испаряется. Графен представляет собой
тонкое и прочное вещество с высокой электропроводностью. В
настоящее время он широко используется в микроэлектронике и
автомобилестроении.
8.
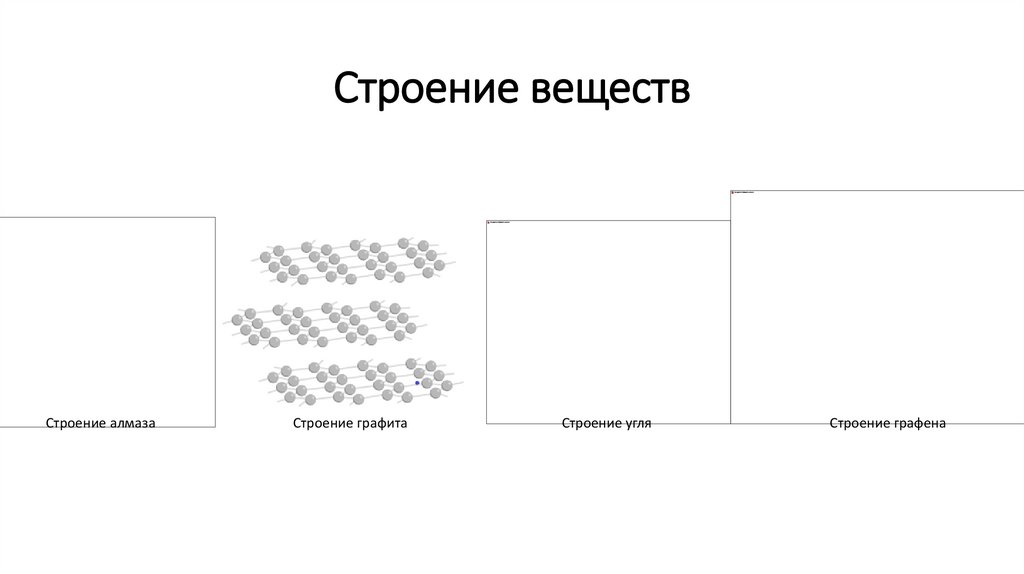
Строение веществСтроение алмаза
Строение графита
Строение угля
Строение графена







 chemistry
chemistry








