Similar presentations:
Теория электролитической диссоциации
1.
Теория электролитическойдиссоциации
2.
Цель урокаО знаком лен и е с поняти ям и : электр о л и ти ческая ди ссоц и ация,
электролиты и неэлектролиты, ионы.
Изучение сущности п р о ц ес са электролитической диссоциации.
Ф о р м и р о вани е навыков составлен и я уравне н и й ди сс о ц и ац и и
различных веществ.
2
3.
План урока1.Электропроводность.
2. Электролиты и неэлектролиты.
3.Теория электролитической диссоциации.
4. Ура вн е н и я электролитической ди с с о ц иации.
3
4.
Актуализация знанийВы уже знаете, что:
Электрический ток — направленное дв и жение зар я ж енн ых
частиц (электронов и л и ионов).
Ион — это положительно и л и отрицательно заряженная
частица, состоящая и з одного и л и нескольких атомов.
Раствор — это гомогенная система, содержащая н е м е не е двух
веществ.
Расплав — это жидкое состояние вещества, которое п р и
обычных условиях является твёрдым.
4
5.
6.
7.
ЭлектропроводностьЭлектропроводность — сп особность
веществ проводить электрический ток
Различают два механизма электропроводности:
п е р е н о с электронов
п е р е н о с ионов
Электронная
проводимость
Характерна для
металлов и сп лавов.
Ионная проводимость
Характерна для
с о е д ине ний ионного
строения, многих
растворов.
Диэлектрики — это вещества (материалы), которые плохо
п р о водят и л и совс е м н е п р о водят электр и ч е с ки й ток
(резина, пластики, стекло, растительное масло и др.)
7
8.
Электролиты и неэлектролитыП о поведению в растворах и расплавах выделяют две группы
веществ:
Электролиты — вещества, растворы и расплавы которых
обладают и о н н о й проводимостью.
Для них характерна ионная и л и ковалентная
сильнополярная связь. К н и м относятся почти все
неорганические кислоты, основания, соли.
Неэлектролиты — вещества, растворы и расплавы которых
не обладают и о н н о й проводимостью.
Для них характерна ковалентная неполярная и л и
малополярная связь. К н и м относятся большинство
органических
соединений.
8
9.
Электролитическая диссоциацияЭлектролитическая диссоциация — это
п р оц есс распада электролита п р и ра ств оре ни и
его в воде и л и ра сп лав лении на положительно
и отрицательно з а ряж е нные и о н ы — катионы
и анионы.
Пример:
Гидрок с ид натрия в в о д н о м растворе дис с оциирует на
отрицательно заряженные гидроксид -ионы и
положительно заряженные и о н ы натрия:
NaOH→ Na+ +O H –
9
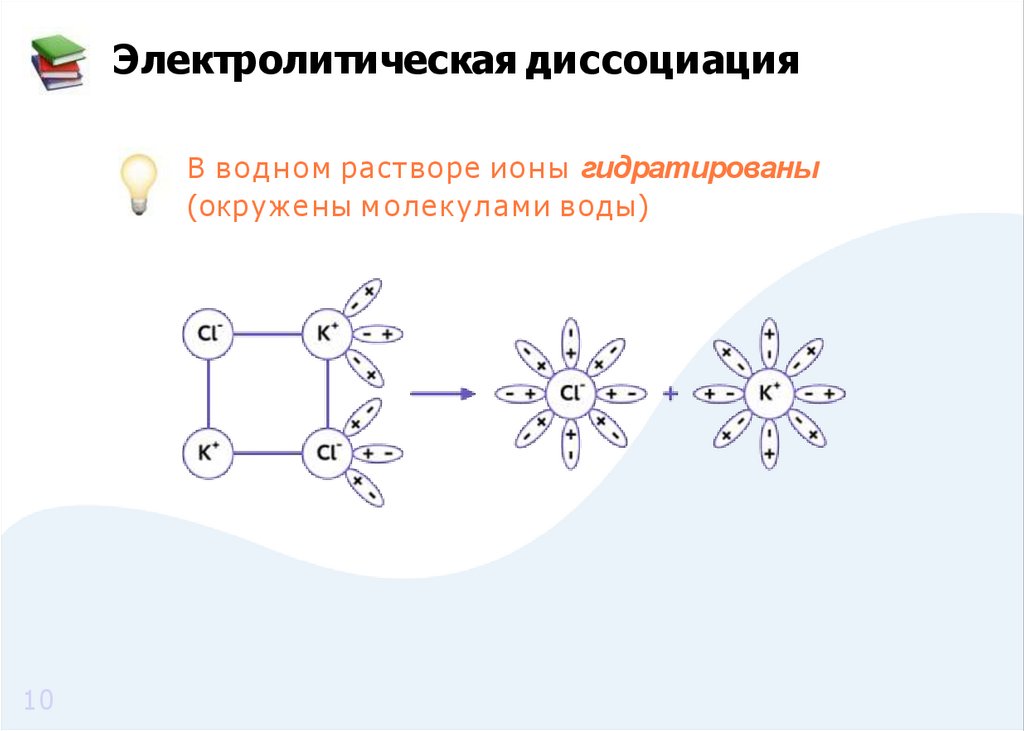
10.
Электролитическая диссоциацияВ в о д н о м растворе и о н ы гидратированы
(окр уж е ны м о лекулами воды)
10
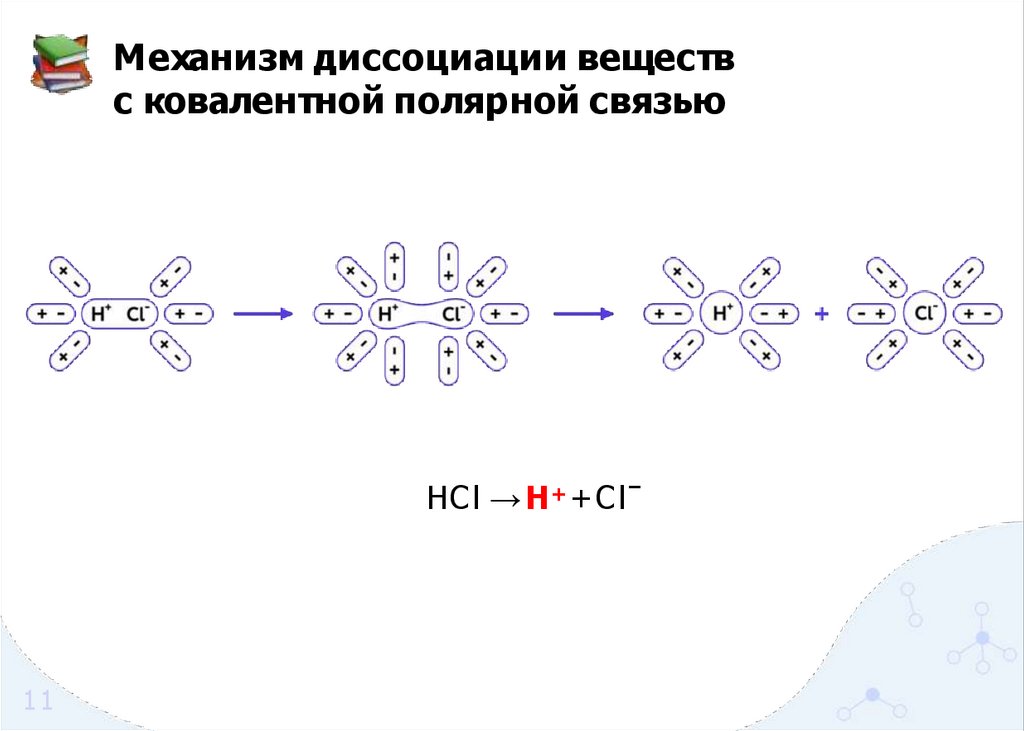
11.
Механизм диссоциации веществс ковалентной полярной связью
HCl → H + + C lˉ
11
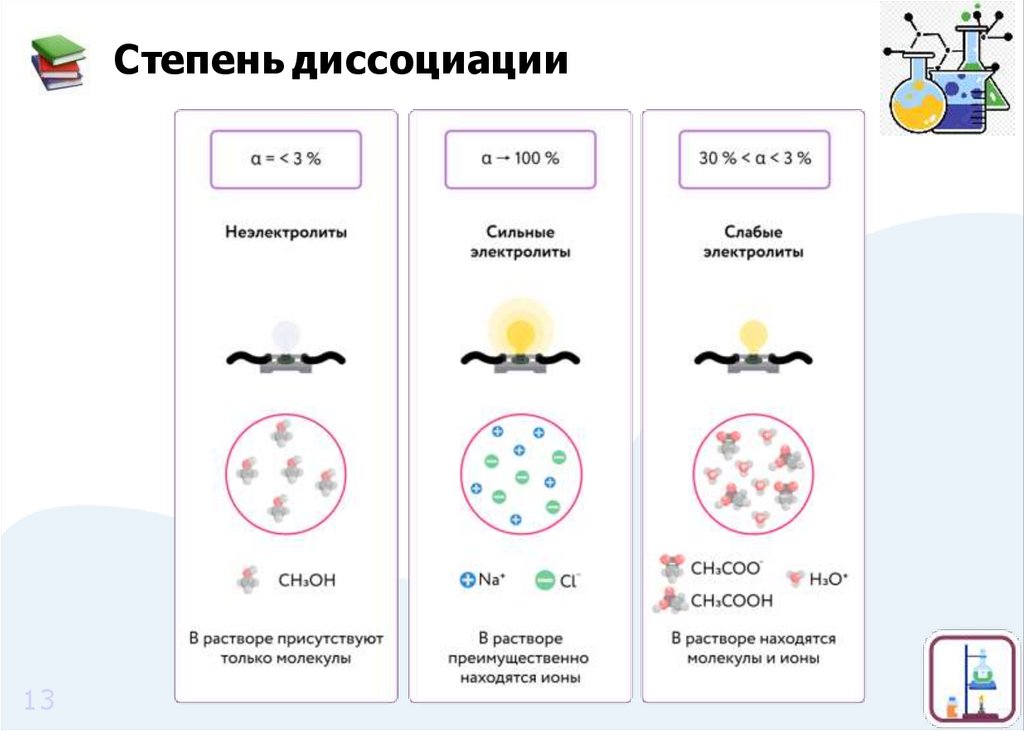
12.
Степень диссоциацииСтепень диссоциации показывает отношение числа
диссоциированных молекул к о б щ е м у числу молекул,
находящихся в растворе.
где α — степень д и с с о ц и ац и и ; n — число д и с с о ц и и р ованных
молекул;
N — о бще е число растворенных молекул.
•величина n может принимать значения от 0 до N
•величина α может принимать значения от 0 до 1 (или 100%)
12
13.
Степень диссоциации13
14.
Сильные и слабые электролитыСильные электролиты
В растворе или расплаве
диссоциируют полностью
14
Слабые электролиты
в растворе или расплаве
практически не
диссоциируют
• сильные кислоты: HClO 4 ,
HCl, HBr, H2SO4, HNO3 и
др.;
• слабые кислоты: H2S,
H2CO3 (CO2 + H2O), H2SiO3
и др.;
• сильные основания
(щёлочи): LiOH, NaOH,
KOH, Ca(OH)2, Ba(OH)2 и
др.;
• слабые основания и
амфотерные
гидроксиды: Cu(OH)2,
• практически все соли.
• вода.
Zn(OH)2, Fe(OH)3 и др.;
15.
Основные положения теорииэлектролитической диссоциации
1 . П р и растворении в воде и л и в расплавленном состоянии
электролиты диссоциируют (распадаются) на положительные и о н ы
(катионы) и отрицательные и о н ы (анионы).
2 . И о н ы отличаются от атомов как по строению, так и по свойствам.
3 . В водных растворах и о н ы химически связаны с молекулами воды,
т.е. о н и гид р атир о в аны .
4. Электролитическая диссоциаци я — п р о ц е с с обратимый для
слабых электролитов. Наряду с п р о ц е с с о м ди с с о ц и а ц и и (распад
электролита на ионы) протекает и обратный п р о ц е с с —
ассоциация (соединение ионов).
5 . В растворе и расплаве и о н ы движутся хаотически, а
под действием электрического тока и о н ы
приобретают направленное движение:
•положительно заряженные частицы движутся к
катоду, • отрицательно заряженные — к аноду.
15
16.
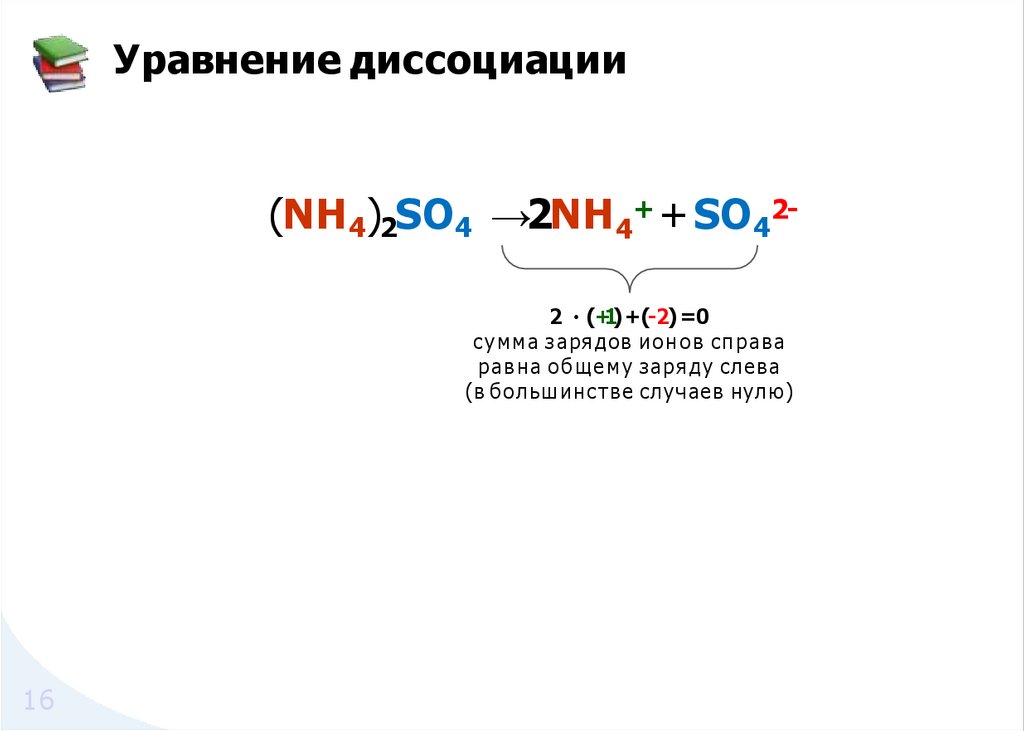
Уравнение диссоциации(NH 4)2SO4 →2NH 4+ + SO422 ・(+1)+(-2) =0
су мма зарядов ионов справа
равна о б щ е м у заря ду слева
(в большинстве случаев нулю)
16
17.
Диссоциация кислотКислоты — это сложные вещества, п р и
д и с с о ц и а ц и и которых в водных растворах в
качестве анионов отщепляются только и о н ы
водорода H+.
HAn
В с е раствор имые кислоты в водных растворах
диссоциир у ю т на и о н ы водор ода и кислотных
остатков
H N O 3→H + + N O 3ˉ
H+
17
О п р е деляют характе р ные
свой ства ки слот
18.
Диссоциация многоосновных кислотДиссоциац и я пр еимущественно протекает по 1
ступени
Много о сн о вн ые кислоты диссоциир ую т ступенчато
H 2SO 4 ⟶ H + + HSO 4 ˉ
H S O 4 ˉ ⇄ H + + SO 4 2ˉ
18
19.
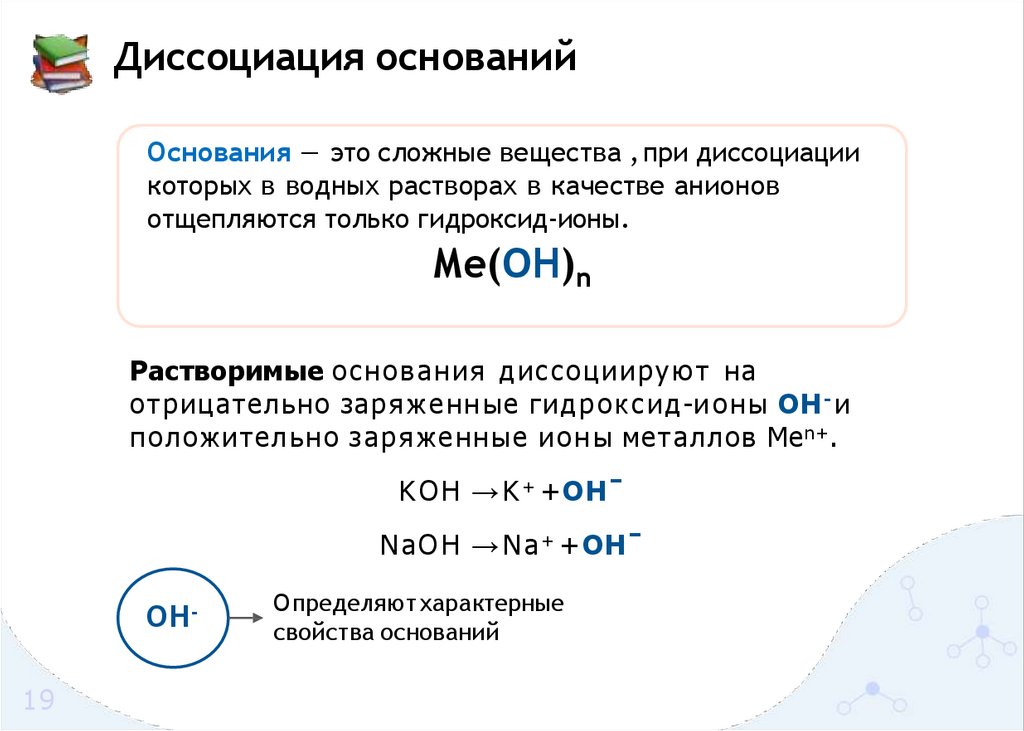
Диссоциация основанийОснования — это сложные вещества , при диссоциации
которых в водных растворах в качестве анионов
отщепляются только гидроксид-ионы.
Me(OH)n
Растворимые основания диссоциир уют на
отрицательно заряженн ые гидр о к с и д-и он ы OH - и
положительно заряженные и о н ы металлов Me n+.
K O H → K + + OHˉ
N aO H → N a + + OHˉ
OH19
Определяют характерные
свойства оснований
20.
Диссоциация средних солейCоли — это сложные вещества, которые в водных
растворах диссоциир ую т на катионы металлов
(или и о н ы а м м о н и я NH 4 + ) и анионов кислотных
остатков.
В с е растворимые соли в водных растворах
диссоциир уют на катионы металлов и анионы
кислотных остатков.
N aN O 3 →N a + + N O 3 AlCl 3 →Al 3+ + 3Cl -
20
21.
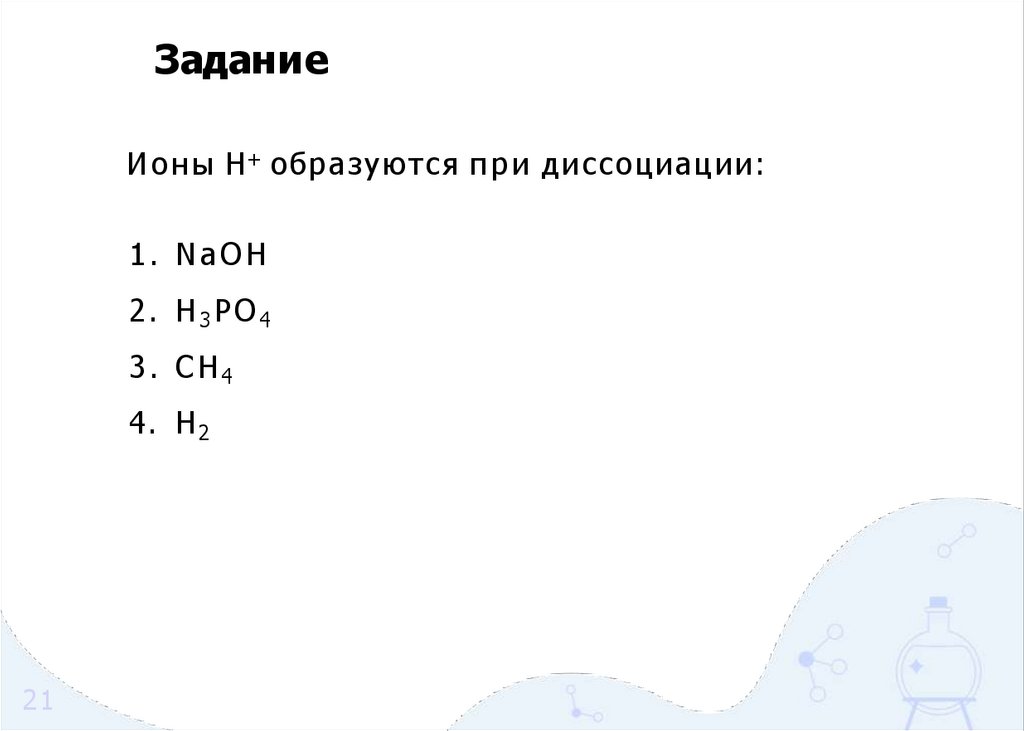
ЗаданиеИ о н ы H+ образуются п р и диссоциации:
1. NaOH
2. H3PO4
3. CH4
4. H 2
21
22.
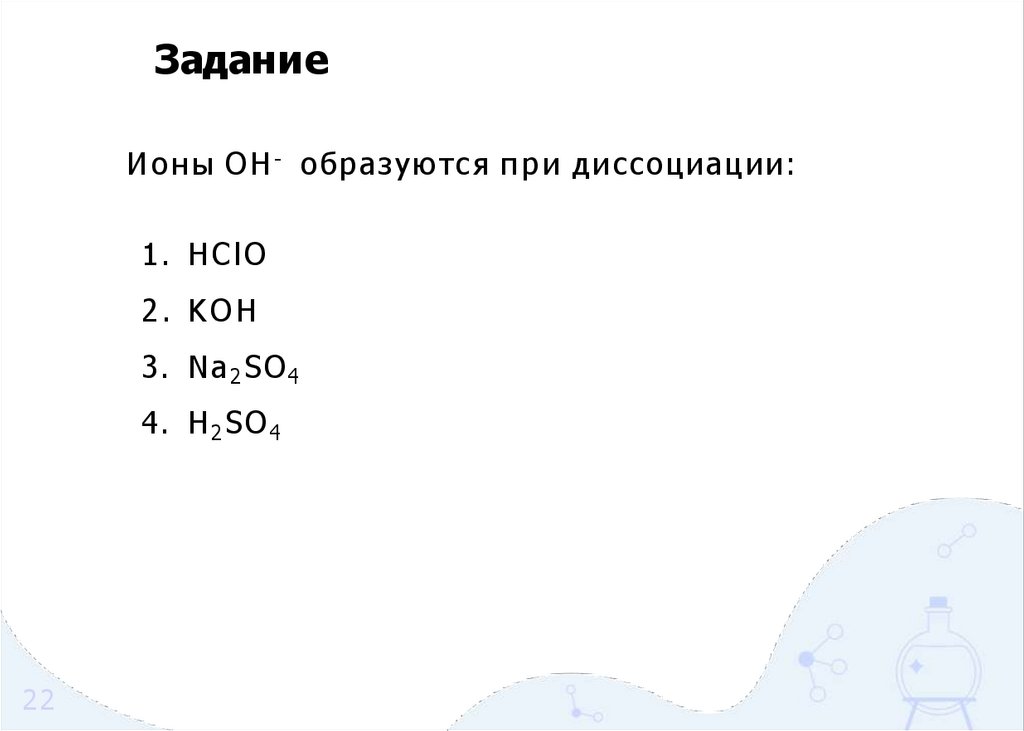
ЗаданиеИ о н ы OH - образуются п р и диссоциации:
1. HClO
2. KOH
3. Na 2 SO 4
4. H 2 SO 4
22
23.
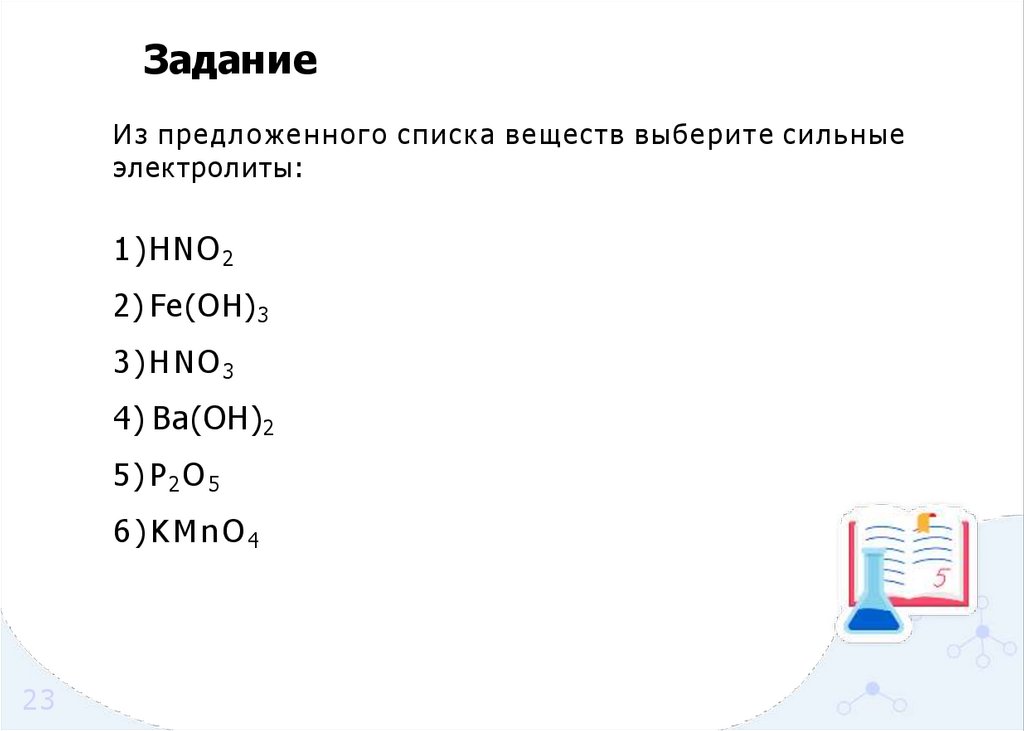
ЗаданиеИ з предложенного списка веществ выберите сильные
электролиты:
1)HNO2
2) Fe(OH) 3
3)HNO3
4) Ba(OH) 2
5) P 2 O 5
6)KMnO4
23
24.
ЗаданиеВ ыберите уравн е н и я электр о ли ти ческой д и с с о ц и ац и и ,
которые записаны верно:
1 . N a N O 3 → N a + +N O 32. 2H g O → 2H g +O 2
3 . B a C O 3 → B a 2+ + C O 324 . C u O → C u 2+ + O 25. H Cl → H + +C l 6.
K 2SO 4 → 2K + + SO 4 2-
7.
AlCl 3 → A l 3+ + 3C l -
8. C H 4 → 4 H + +C 4 -
24
Запомните!
1 . Н е все
вещества
являются
электролитами и
с п о с о бн ы
к д и с с о ц и ац и и
2 . П р и ди с с о ци ац и и
веществ об р азуются
положительные
и отри цательны е и он ы
25.
ЗаданиеП р и д и с с о ц и а ц и и каких электролитов образуется больше
положительных ионов, чем отрицательных:
1)сульфат меди(II)
2) Хлорид алюминия
3) сульфат железа(III)
4) Карбонат натрия
5) фосфат магния
25
26.
ЗаданиеП р и д и с с о ц и а ц и и какого электролита образуется
поровну катионов и анионов:
1 )Гидрок с ид ба рия
2) Сульфат ма гния
3) Карбонат ли тия
4 ) Хлорид калия
5 ) Н и трат алю м и н ия
26
27.
ЗаданиеП р и ди ссо ц и ац и и электролита обр а зовалось в 1,5 раза
больше отрицательных ионов, чем положительных.
Выбер ите соответствующее вещество из предложенного
списка:
1 ) н и трат железа(II)
2) хлорид кальц и я
3) сульфат алюминия
4) хлорид железа(III)
5) фосфат калия
27
28.
ЗаданиеЗапиш и те уравнен и я д и с с о ц и ац и и веществ:
M g S O 4 ……………………………...…………………………...………………………
AlCl 3 ……………………………...…………………………...…………………………
H N O 2 ……………………………...………………………………………………….…
K 3 PO 4 ……………………………...……………………………………………..……
Ba(OH) 2 ……………………………...……………………………………….………
H 2 SO 4 ……………………………...………………………………………….………
28
29.
ОбобщениеЭлектролитическая диссоциа ци я — это п р о ц е с с
распада электролита на и о н ы в растворе и л и
расплаве.
Электролитами являются соли, кислоты, осно ван и я.
Неэлектролитами являются простые вещества,
оксиды, органические вещества.
Свойства растворов электролитов определяются
ионами, обр азую щи ми с я п р и их диссоциации.
Cтупенчато диссоциир ую т многоосновные кислоты
и многокислотные основания, но диссоциаци я
пр еимущественно идёт по п е р в о й ступени
29




















 chemistry
chemistry








