Similar presentations:
Теория электролитической диссоциации
1.
2.
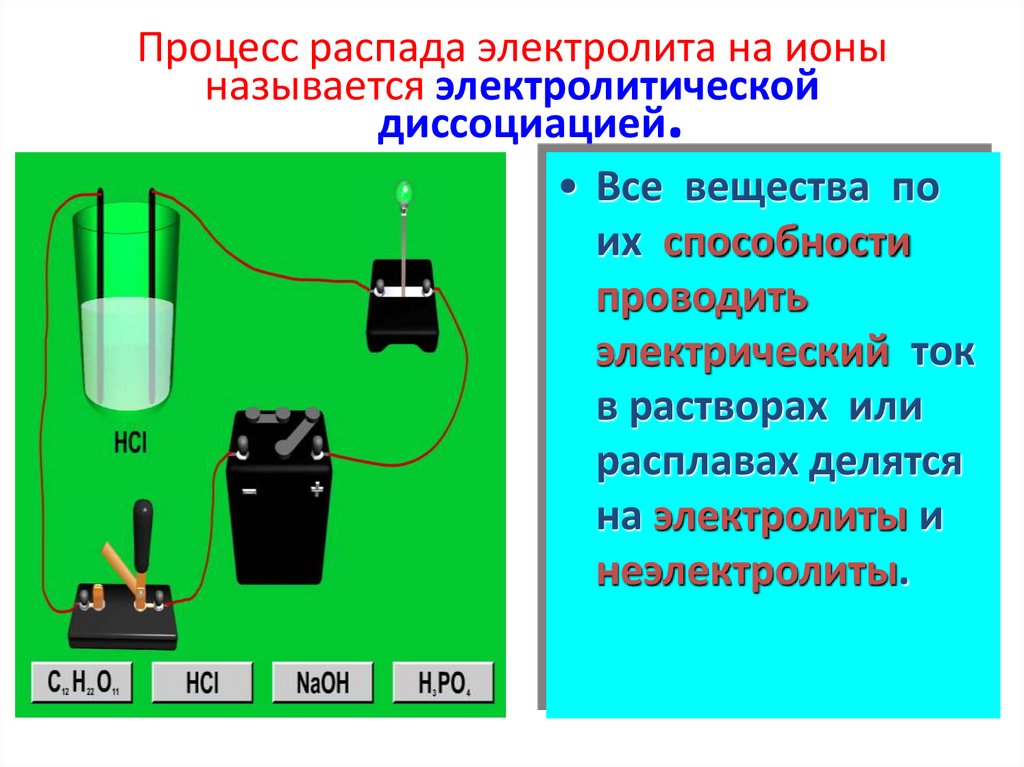
Процесс распада электролита на ионыназывается электролитической
диссоциацией.
• Все вещества по
их способности
проводить
электрический ток
в растворах или
расплавах делятся
на электролиты и
неэлектролиты.
3.
их растворыили расплавы
ПРОВОДЯТ
их растворы
или расплавы
НЕ ПРОВОДЯТ
электрический ток
электрический
ток
Вид химической связи
Ионная или
ковалентная
сильно полярная
Ковалентная
неполярная
или мало полярная
4.
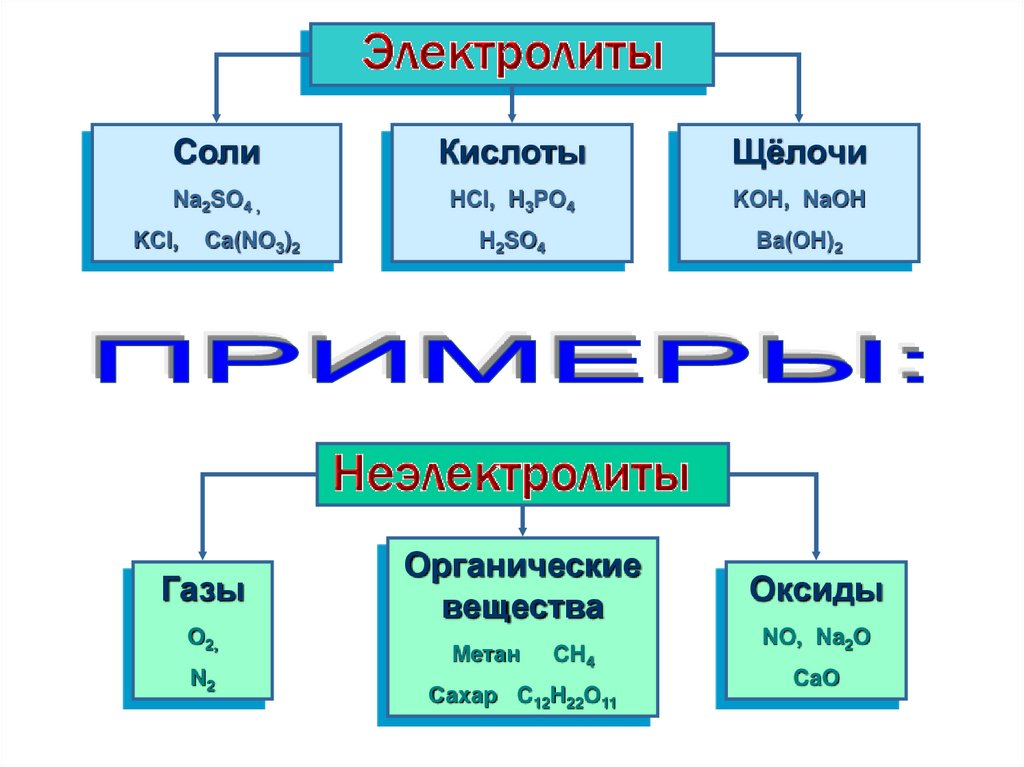
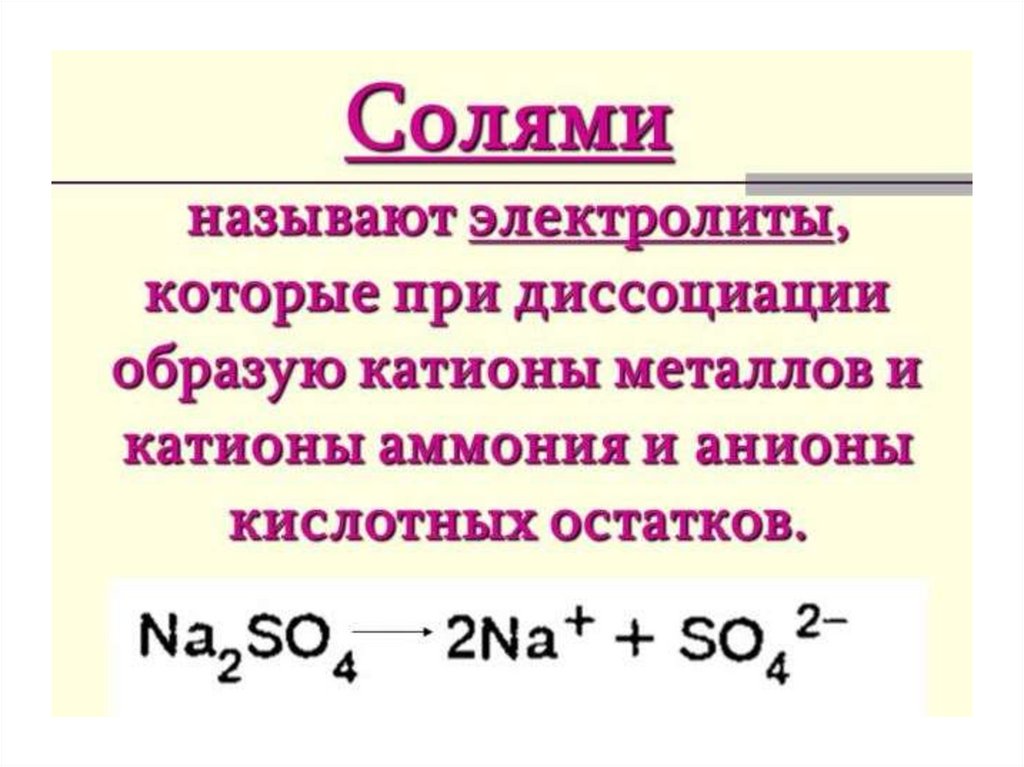
CолиКислоты
Щёлочи
Na2SO4 ,
HCl, H3PO4
KOH, NaOH
H2SO4
Ba(OH)2
KCl,
Ca(NO3)2
Газы
O2,
N2
Органические
вещества
Метан
CH4
Сахар C12H22O11
Оксиды
NO, Na2O
CaO
5.
Электролитическая диссоциацияхимических элементов
Основные положения теории:
1. Электролиты при растворении в воде
распадаются (диссоциируют) на ионы –
положительные и отрицательные.
Ионы находятся в более устойчивых
электронных состояниях, чем атомы. Они
могут состоять из одного атома – это
простые ионы или из нескольких атомов –
сложные ионы.
6.
Электролитическая диссоциацияхимических элементов
Основные положения теории:
2. При действии электрического тока ионы
приобретают направленное движение:
положительно заряженные ионы движутся к
катоду, отрицательно заряженные – к аноду.
Поэтому первые называются катионами, а вторые –
анионами. Направленное движение ионов происходит в
результате притяжения их к противоположено заряженным
электродам.
3. Диссоциация – обратимый процесс: параллельно
с распадом молекул на ионы (диссоциацией)
протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической
диссоциации вместо знака равенства ставят знак
обратимости.
7.
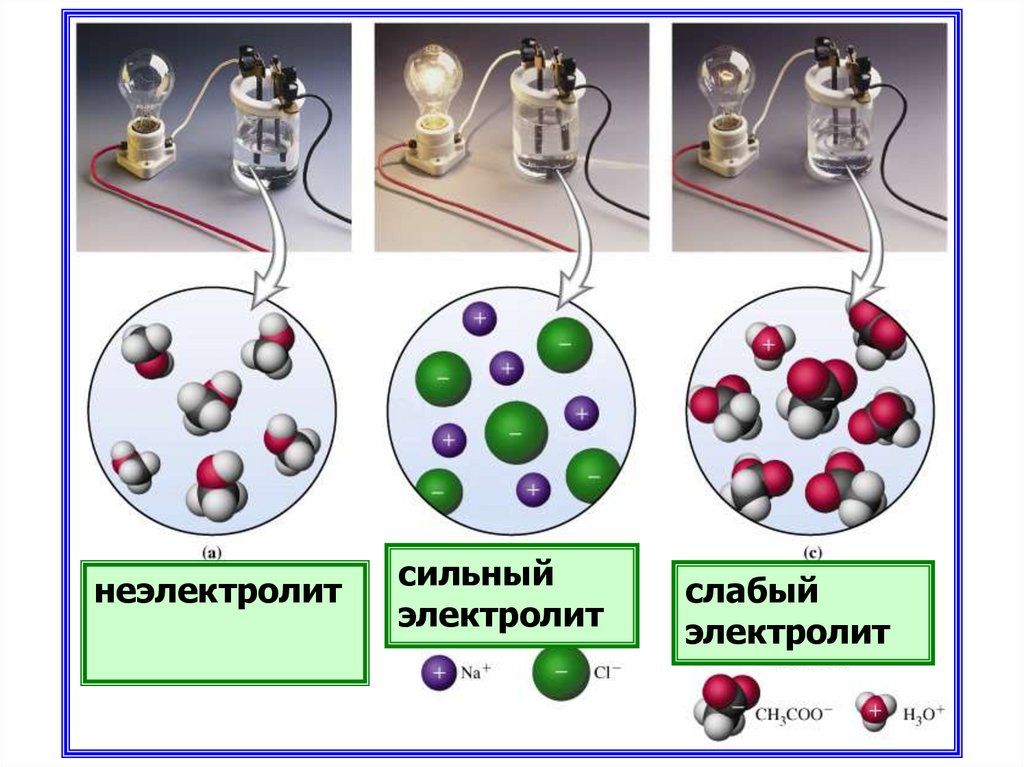
неэлектролитсильный
электролит
слабый
электролит
8.
9.
10.
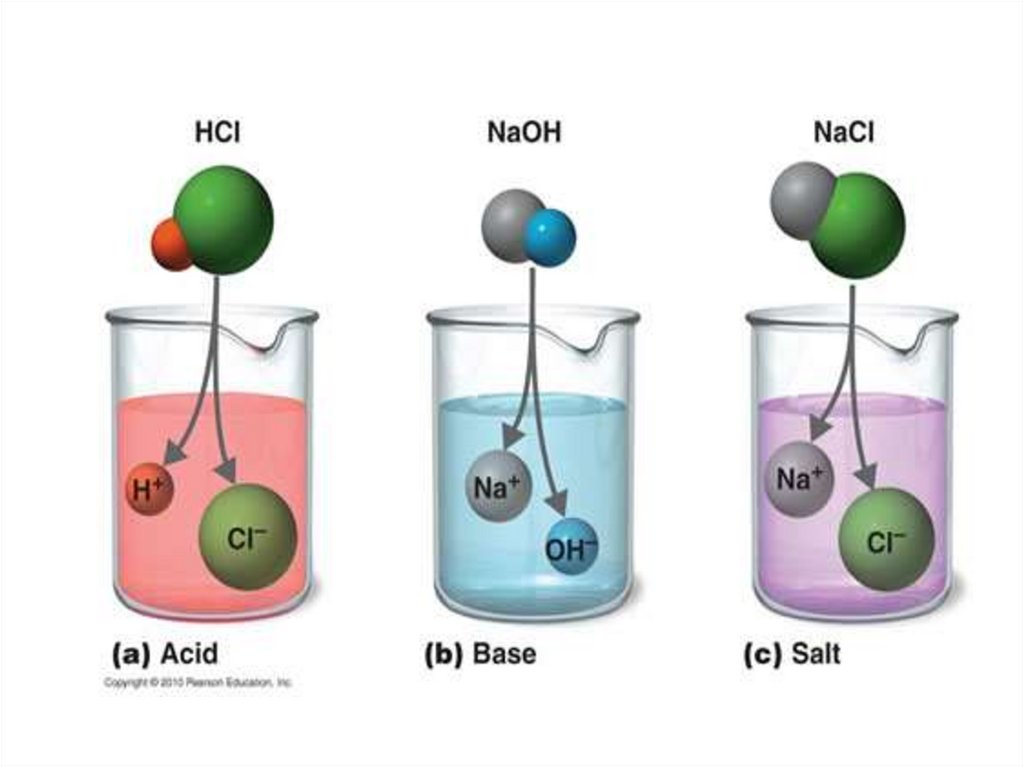
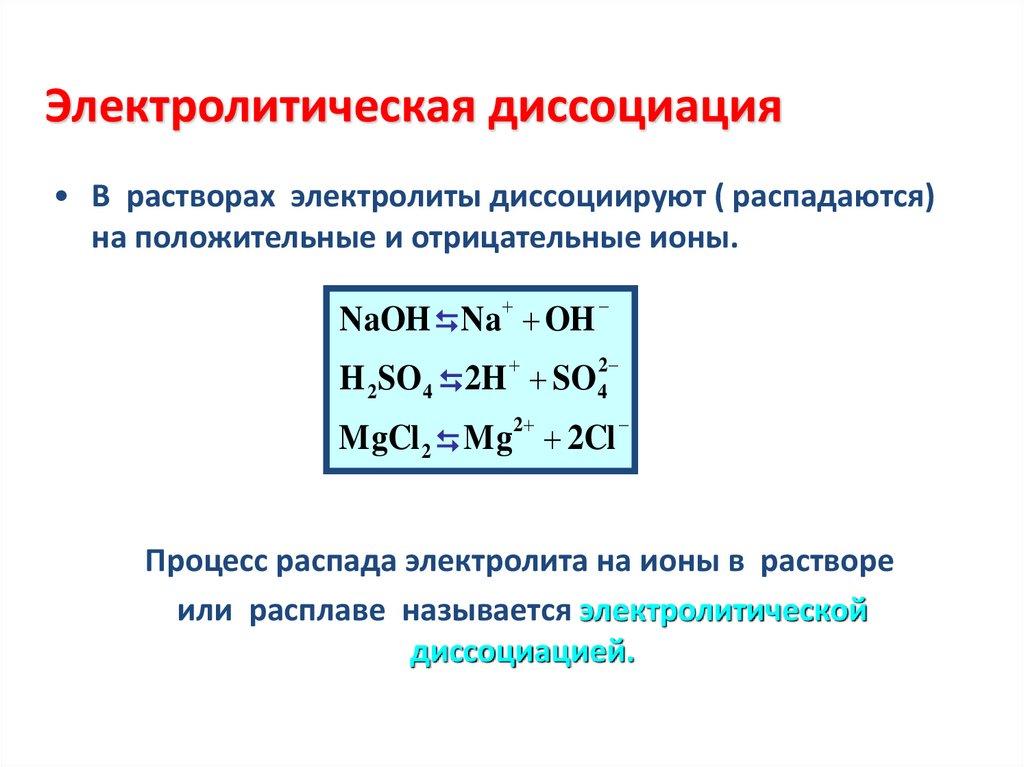
Электролитическая диссоциация• В растворах электролиты диссоциируют ( распадаются)
на положительные и отрицательные ионы.
NaOH Na OH
H 2SO 4 2H SO 42
MgCl 2 Mg2 2Cl
Процесс распада электролита на ионы в растворе
или расплаве называется электролитической
диссоциацией.
11.
Причины распада вещества наионы в расплавах
Нагревание
усиливает колебания
ионов в узлах
кристаллической
решётки кристаллическая
решётка
разрушается.
12.
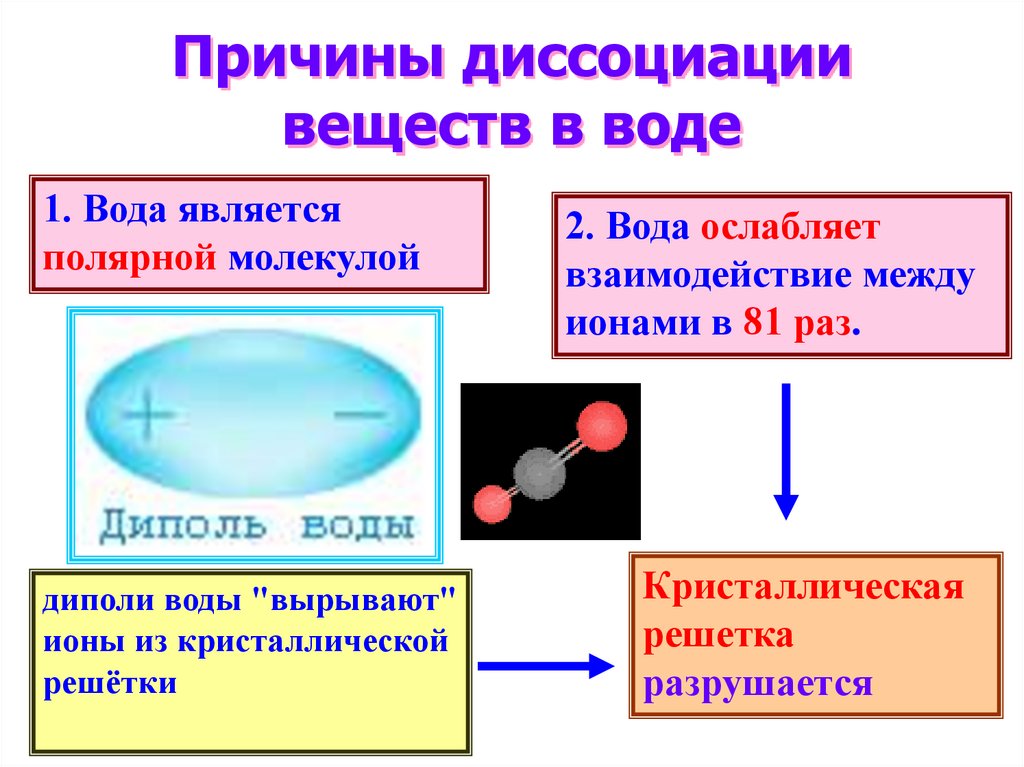
Причины диссоциациивеществ в воде
1. Вода является
полярной молекулой
диполи воды "вырывают"
ионы из кристаллической
решётки
2. Вода ослабляет
взаимодействие между
ионами в 81 раз.
Кристаллическая
решетка
разрушается
13.
Условия протекания реакции ионногообмена
Реакции в растворах электролитов
протекают до конца если:
• Образуется или растворяется осадок;
• Выделяется газ;
• Образуется малодиссоциирующее
вещество (например Н2О)
14.
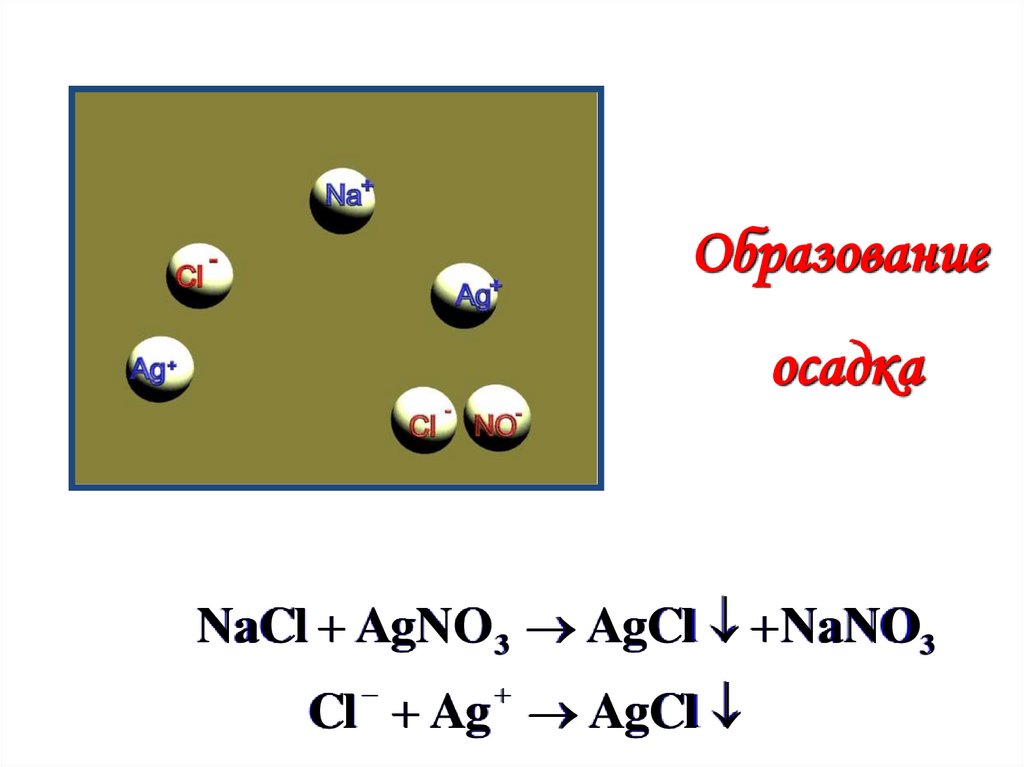
Образованиеосадка
NaCl AgNO 3 AgCl NaNO3
Cl Ag AgCl
15.
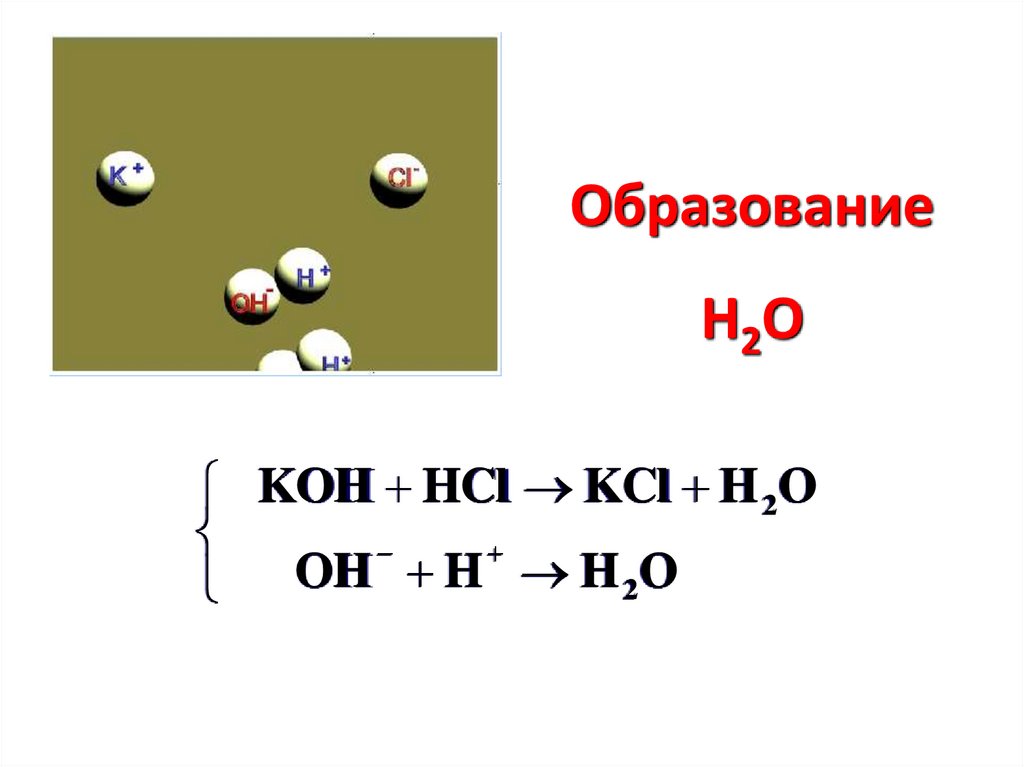
ОбразованиеН 2О
KOH HCl KCl H 2O
OH H H 2O
16.
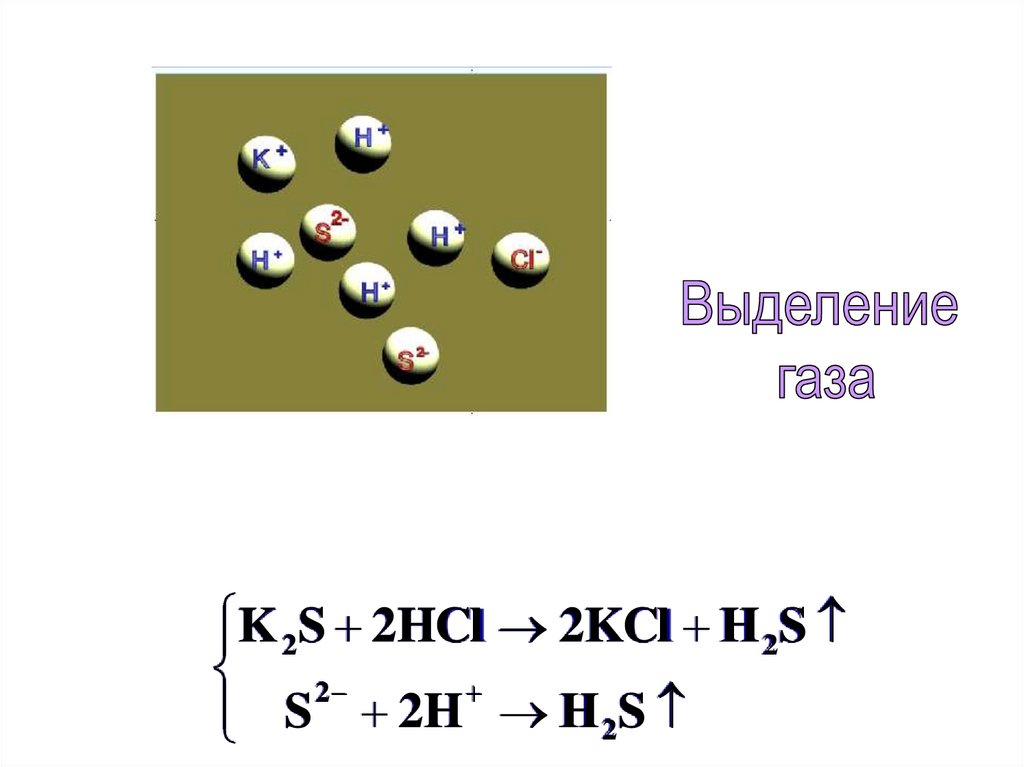
K 2S 2HCl 2KCl H 2S2
S 2H H 2S
17.
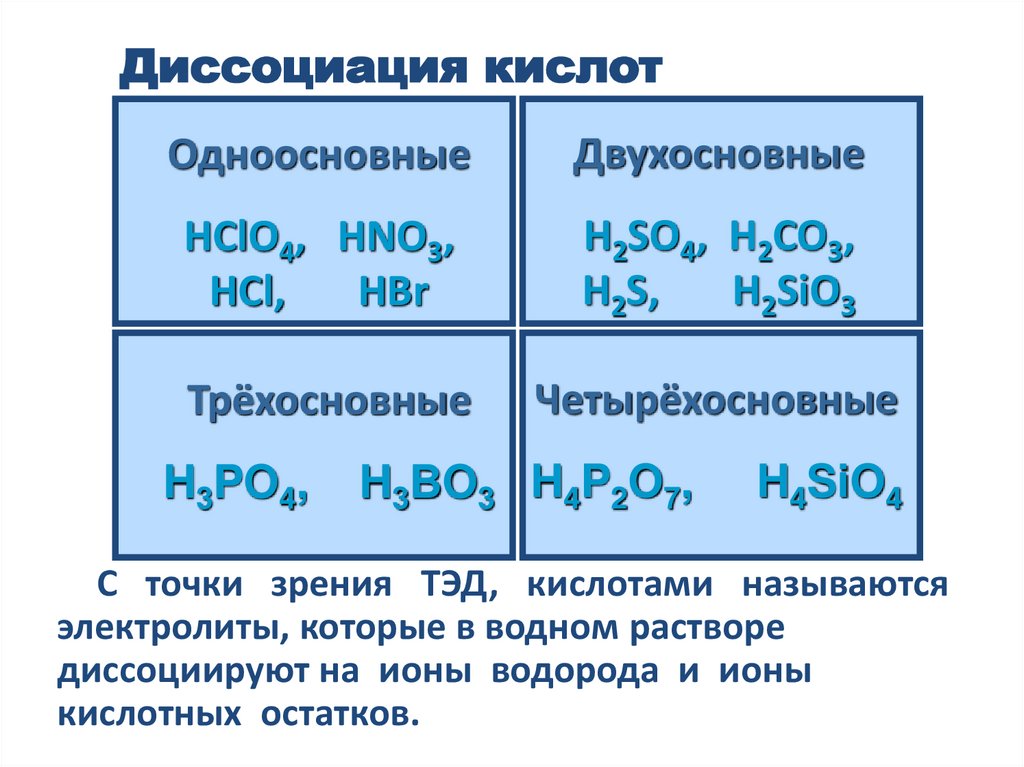
Диссоциация кислотОдноосновные
Двухосновные
HClO4, HNO3,
HCl,
HBr
H2SO4, H2CO3,
H2S,
H2SiO3
Трёхосновные
Четырёхосновные
H3PO4,
H3BO3 H4P2O7,
H4SiO4
С точки зрения ТЭД, кислотами называются
электролиты, которые в водном растворе
диссоциируют на ионы водорода и ионы
кислотных остатков.
18.
Диссоциация многоосновных кислотСильный электролит
+
H2SO4 H + HSO4 1
+
2HSO4 H + SO4 2
1 2
+
2H2SO4 2H + SO4
Электролит средней
силы
+
-
H2SO3 H + HSO3 1
+
2HSO3 H + SO3 2
1>> 2
+
H2SO3 H + HSO3
Многоосновные кислоты диссоциируют
ступенчато. Каждая последующая степень
протекает хуже предыдущей.
19.
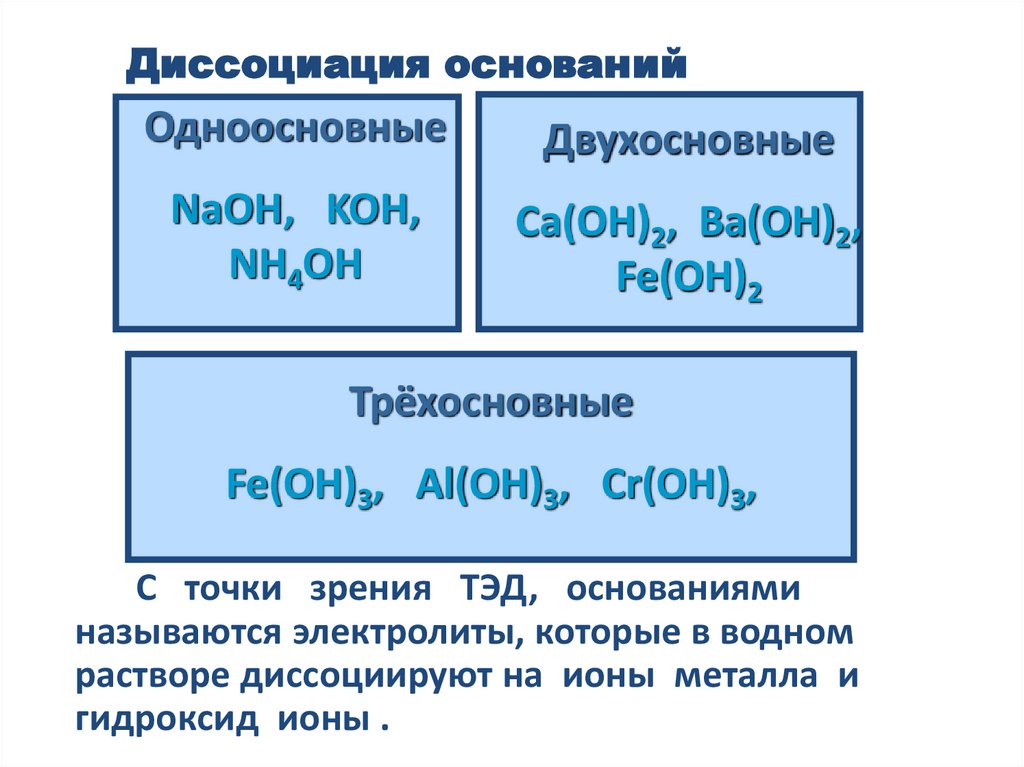
Диссоциация основанийОдноосновные
Двухосновные
NaOH, KOH,
NH4OH
Ca(OH)2, Ba(OH)2,
Fe(OH)2
Трёхосновные
Fe(OH)3, Al(OH)3, Cr(OH)3,
С точки зрения ТЭД, основаниями
называются электролиты, которые в водном
растворе диссоциируют на ионы металла и
гидроксид ионы .
20.
Диссоциация основанийNaOH = Na+ + OHBa(OH)2 = BaOH+ + OH- → Ba2+ + 2OHKOH = K+ + OH-
Основания – это электролиты, которые
диссоциируют на катионы металла и
анионы гидроксогрупп
21.
22.
Составлениеионных уравнений
23.
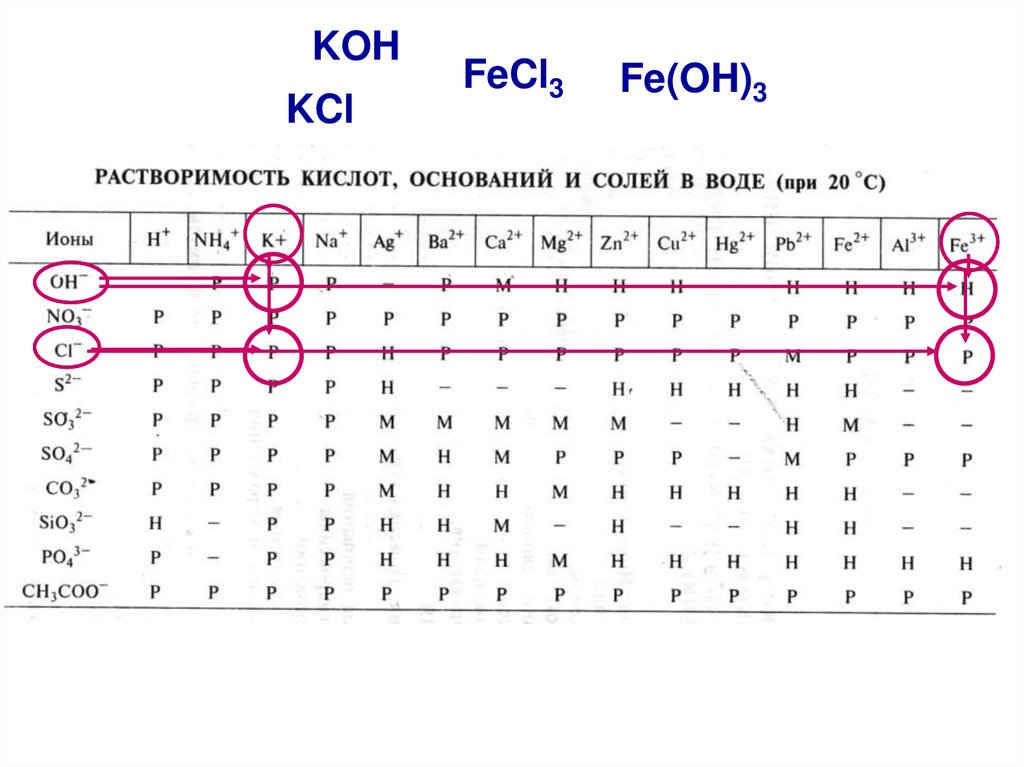
Даны растворы хлорида железа(III) игидроксида калия. Написать
молекулярное и ионные уравнения
реакции между этими растворами.
1. Записать молекулярное уравнение реакции
FeCl3 + 3 KOH = 3 KCl + Fe(OH)3
расставить коэффициенты
24.
2. Подчеркнуть формулы электролитов(формулы кислот, оснований, солей)
FeCl3 + 3 KOH = 3 KCl + Fe(OH)3
Используя таблицу растворимости определить
растворимость электролитов и записать результат
над формулами (Р, М, Н).
25.
KOHKCl
FeCl3
Fe(OH)3
26.
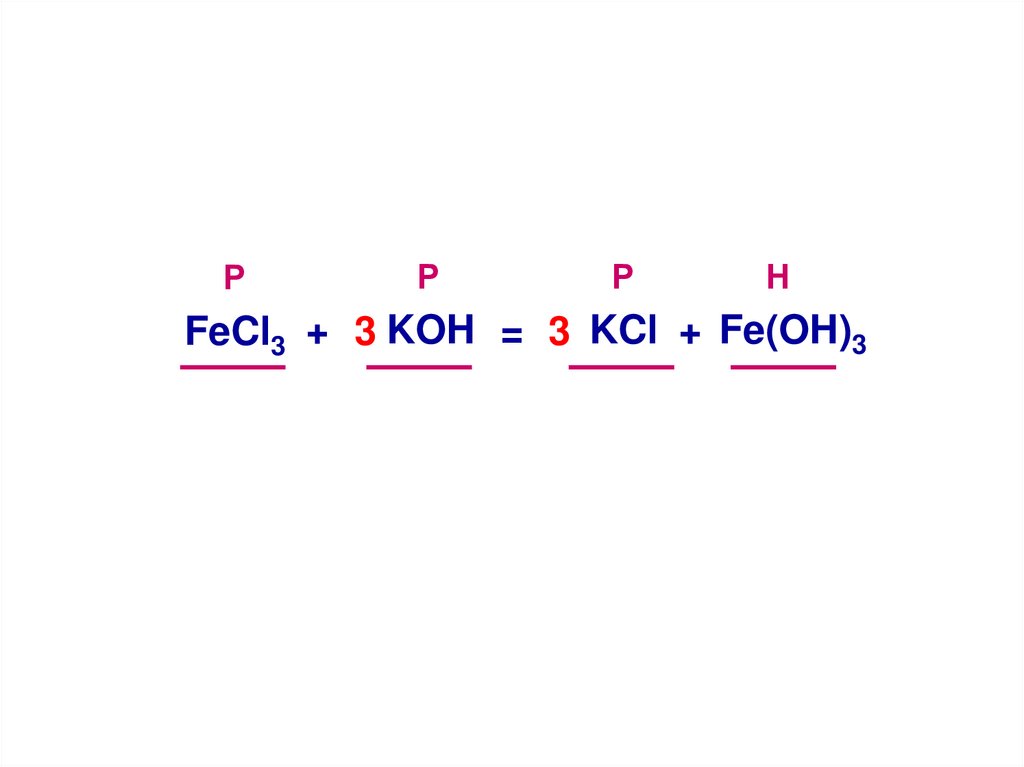
РР
Р
Н
FeCl3 + 3 KOH = 3 KCl + Fe(OH)3
27.
3. Написать полное ионное уравнение реакции.ЗАПОМНИТЬ!!!
В ионных уравнениях формулы электролитов
1) растворимых в воде всегда записываются в диссоциированном
виде;
2) нерастворимых в воде всегда записываются в молекулярном
виде;
3) малорастворимых в воде слева записываются в
диссоциированном виде, а справа – в молекулярном.
Р
Р
Р
Н
FeCl3 + 3 KOH = 3 KCl + Fe(OH)3
Fe3+ +3 Cl- + 3 K+ + 3 OH- = 3 K+ + 3 Cl- + Fe(OH)3
Необходимо учитывать индексы у ионов и коэффициенты в
уравнении реакции.
28.
4. Для составления сокращённого ионного уравнения надо найтиодинаковые ионы справа и слева от знака равенства и
вычеркнуть их.
Fe3+ +3 Cl- + 3 K+ + 3 OH- = 3 K+ + 3 Cl- + Fe(OH)3
5. Записать уравнение без вычёркнутых ионов.
Fe3+ + 3 OH- = Fe(OH)3
29.
Задание:Допишите уравнения реакции. Напишите у
трех уравнений полное и сокращенное
ионное уравнение.
1)Na3PO4+ CaCL2→
2)Al 2(SO4) 3+ KOH →
3)HBr + Ba(OH)2→
4)K2SO4 + HNO3→
5)Fe2(SO4)3+ BaCl2→
6)Na2S + H3PO3→















 chemistry
chemistry








