Similar presentations:
Азот және он қосылыстары
1.
Азот және он қосылыстарыАммиак
Байжан Әсет 1/9/КЕ
2.
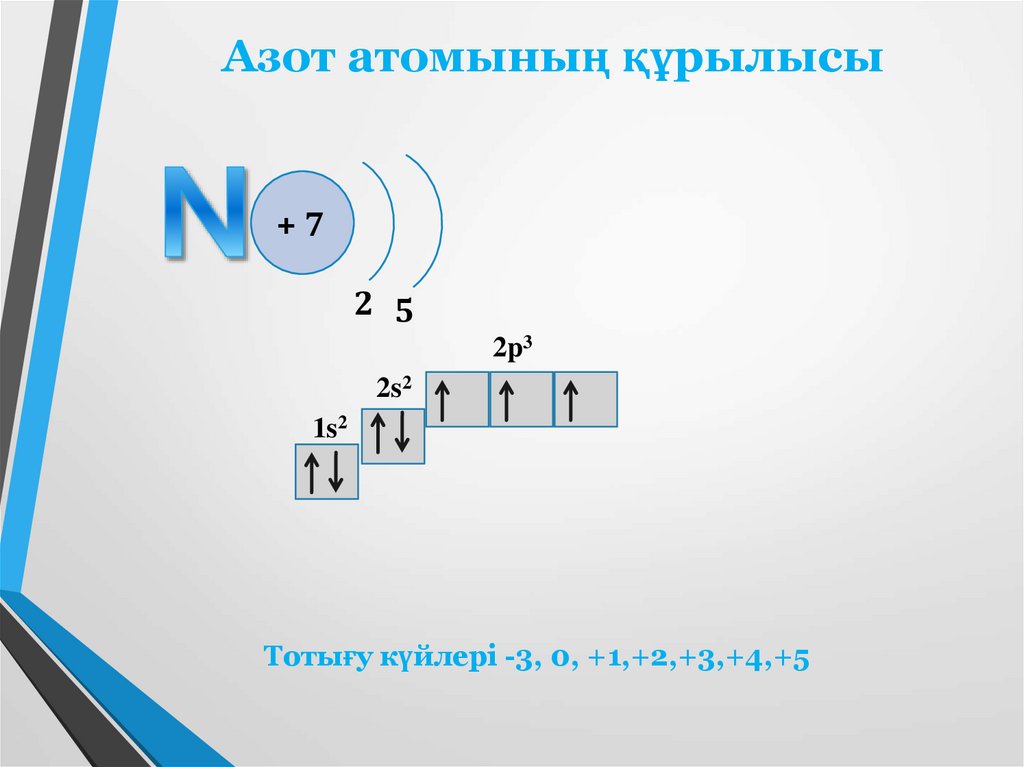
Азот атомының құрылысы+7
2 5
2p3
2s2
1s2
Тотығу күйлері -3, 0, +1,+2,+3,+4,+5
3.
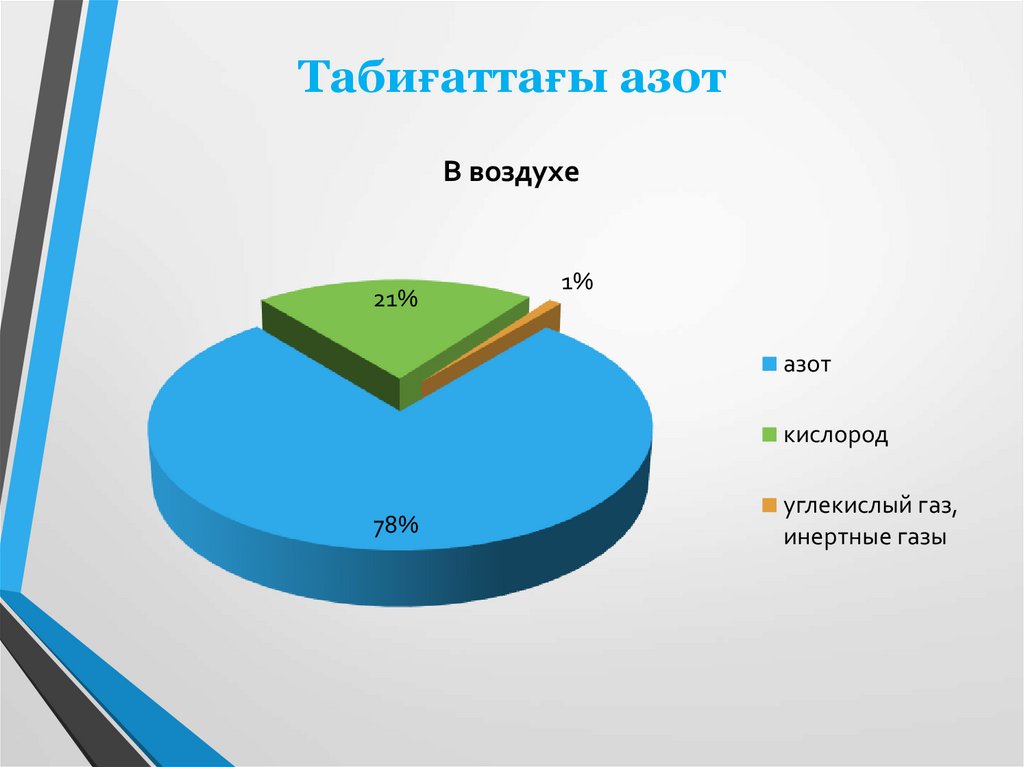
Табиғаттағы азотВ воздухе
21%
1%
азот
кислород
78%
углекислый газ,
инертные газы
4.
Азот қасиеттеріБос күйде азот екі атомды N2 молекулалар
түрінде болады. Бұл молекулаларда екі азот
атомы өте күшті үш коваленттік байланыс
арқылы байланысқан.
N N
N N
Азот – түссіз, иіссіз және дәмсіз газ. Суда
нашар ериді. Сұйық күйде (қайнау
температурасы -195,8 °C) су сияқты түссіз,
қозғалмалы сұйықтық. Сұйық азоттың
тығыздығы 808 кг/м³. −209,86 °C
температурада азот қар тәрізді масса немесе
үлкен қар-ақ кристалдар түрінде қатты күйге
айналады.
5.
Азоттың химиялық қасиеттеріХимиялық тұрғыдан азот күшті коваленттік байланысқа
байланысты өте инертті газ болып табылады.
Металдардың ішінде бос азот қалыпты жағдайда тек
литиймен әрекеттеседі, нитрид түзеді:
6Li + N2 = 2Li3N
Температура жоғарылаған сайын молекулалық азоттың
белсенділігі артады. Азот сутегімен қыздырғанда, жоғары
қысымда және катализатордың қатысуымен
әрекеттескенде аммиак түзіледі:
N2 + 3H2 = 2NH3
Азот оттегімен тек электр доғасында қосылып, азот оксиді
(II) түзеді:
N2 + O2 = 2NO - Q
6.
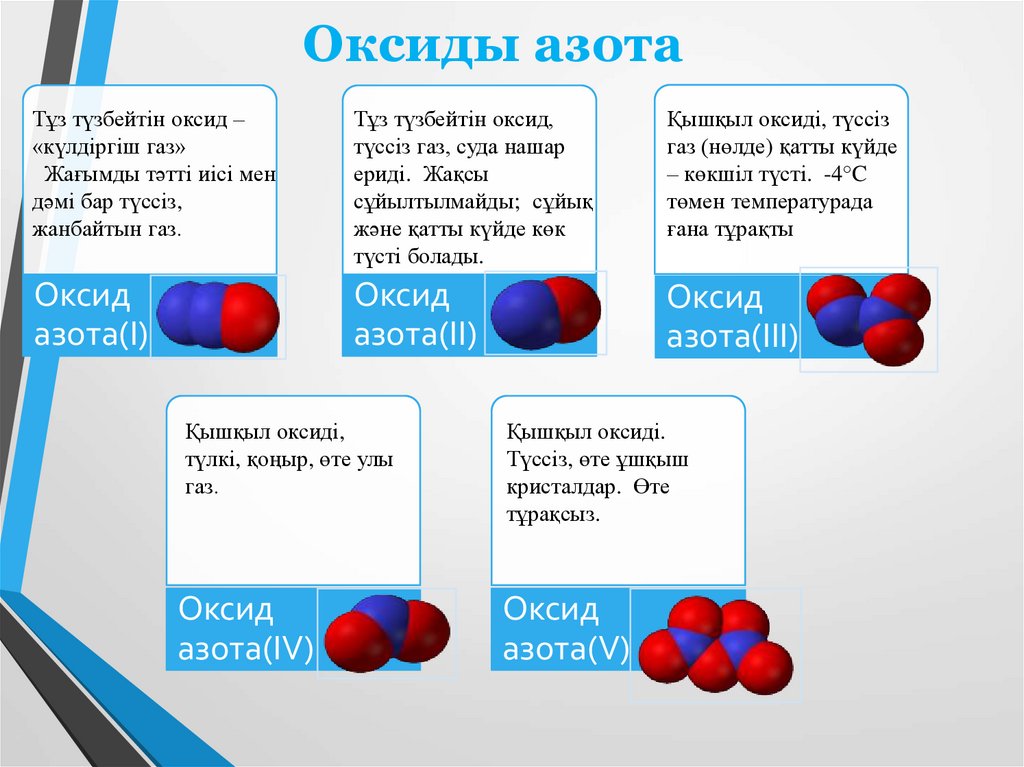
Оксиды азотаТұз түзбейтін оксид –
«күлдіргіш газ»
Жағымды тәтті иісі мен
дәмі бар түссіз,
жанбайтын газ.
Тұз түзбейтін оксид,
түссіз газ, суда нашар
ериді. Жақсы
сұйылтылмайды; сұйық
және қатты күйде көк
түсті болады.
Қышқыл оксиді, түссіз
газ (нөлде) қатты күйде
– көкшіл түсті. -4°C
төмен температурада
ғана тұрақты
Оксид
азота(I)
Оксид
азота(II)
Оксид
азота(III)
Қышқыл оксиді,
түлкі, қоңыр, өте улы
газ.
Қышқыл оксиді.
Түссіз, өте ұшқыш
кристалдар. Өте
тұрақсыз.
Оксид
азота(IV)
Оксид
азота(V)
7.
АммиакN
H
H
H
Аммиак – ауадан екі есе дерлік жеңіл, өткір
иісі бар түссіз газ. Аммиакты ұзақ уақыт
бойы ингаляциялауға болмайды, өйткені
ол улы. Аммиак суда өте жақсы ериді.
Аммиак NH3 молекуласында азот атомы
мен сутегі атомдары арасында үш
ковалентті полярлық байланыс бар.
H N H Или H N H
H
H
8.
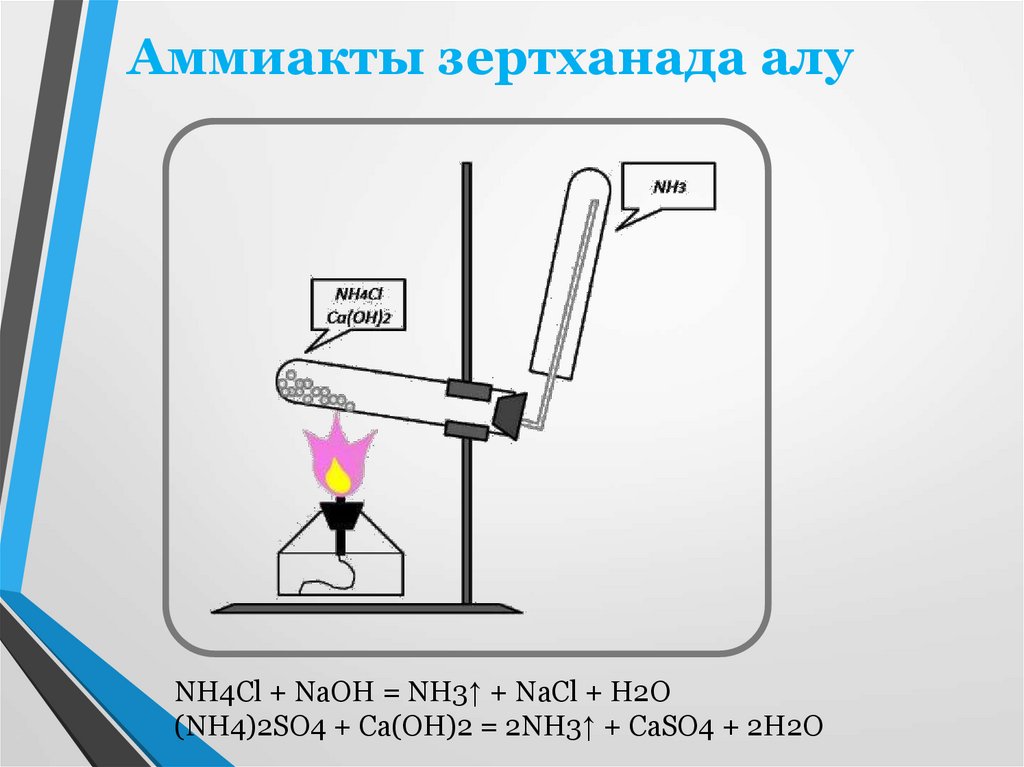
Аммиакты зертханада алуNH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
9.
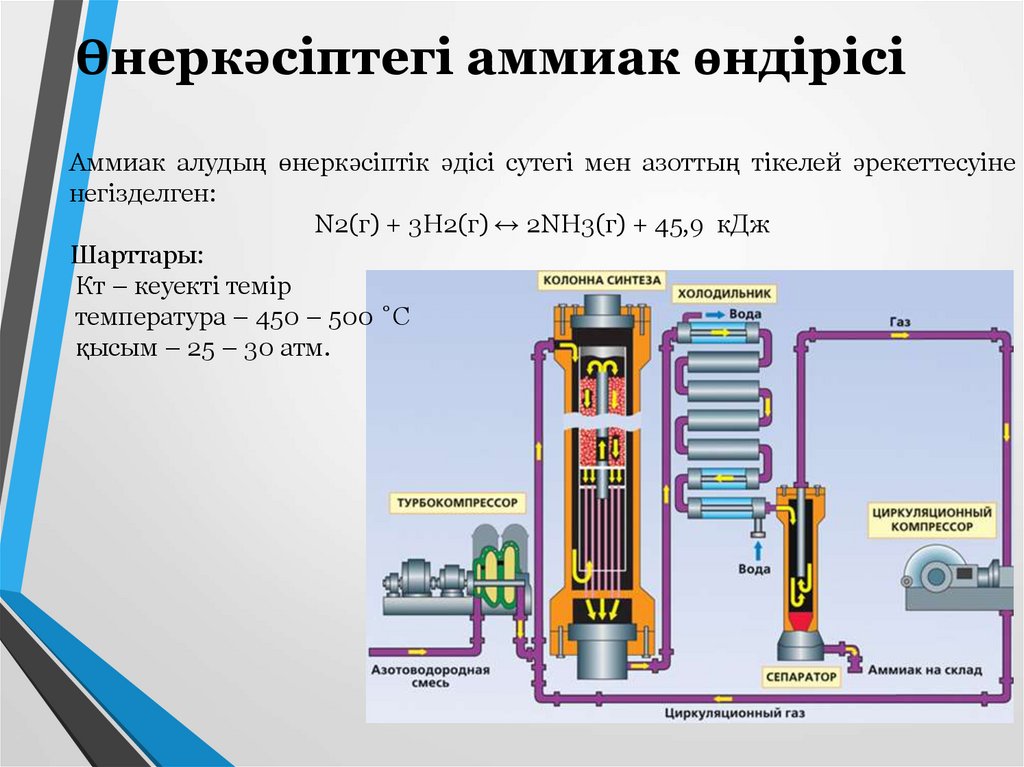
Өнеркәсіптегі аммиак өндірісіАммиак алудың өнеркәсіптік әдісі сутегі мен азоттың тікелей әрекеттесуіне
негізделген:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Шарттары:
Кт – кеуекті темір
температура – 450 – 500 ˚С
қысым – 25 – 30 атм.
10.
Аммиактың химиялық қасиеттері.
NH3-күшті тотықсыздандырғыш болып
табылады.
NH3 + CuO = N2 + Cu + H2O
Аммиактың жануы (қызу кезінде)
4NH3 + 3O2 → 2N2 + 6H20
Аммиактың каталитикалық тотығуы
(катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
11.
Аммиактың сумен жәнеқышқылдармен әрекеттесуі
Қышқылдық-негіздік қасиеттері.
Егер аммиак ерітіндісіне фенолфталеиннің бірнеше
тамшысын қоссаңыз, ол қызыл түске боялады, яғни сілтілі
ортаны көрсетеді:
NH3 + Н20 <-> NН4 + ОНNH3 + HCl = NH4Cl↑
2NH3 + H2SO4 = (NH4)2SO4↓
Бұл
жұпталмаған
электрондардың
ортақтасуы
нәтижесінде
емес,
атомдардың
бірінде
болатын
бос
электрон жұбының арқасында пайда
болатын коваленттік байланыстың
түзілу механизмі донор-акцептор деп
аталады.
12.
Аммиак қолдану13.
Медицинада аммиактың 10% сулы ерітіндісі аммиакдеп аталады.
Аммиактың өткір иісі мұрынның
шырышты қабығындағы ерекше рецепторларды
тітіркендіреді және тыныс алу және тамыр-қозғалыс
орталықтарының стимуляциясына ықпал етеді,
сондықтан есінен тану немесе алкогольмен улану
кезінде зардап шегушіге аммиак буын деммен жұту
үшін береді.
14.
Аммоний тұзы.Қышқылдармен және тұздармен алмасу
реакциясына түседі:
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
(NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
Олар
аммиак түзу үшін сілті ерітінділерімен
әрекеттеседі – аммоний ионына сапалы реакция:
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
Қыздырғанда ыдырайды
NH4Cl → NH3↑ + HCl
15.
NH4H2PO4(NH4)2Cr2O
FeSO4·(NH4)2SO4·6H2O.
16.
ВСЁ











 chemistry
chemistry








