Similar presentations:
Газовые законы
1.
Газовые законы2.
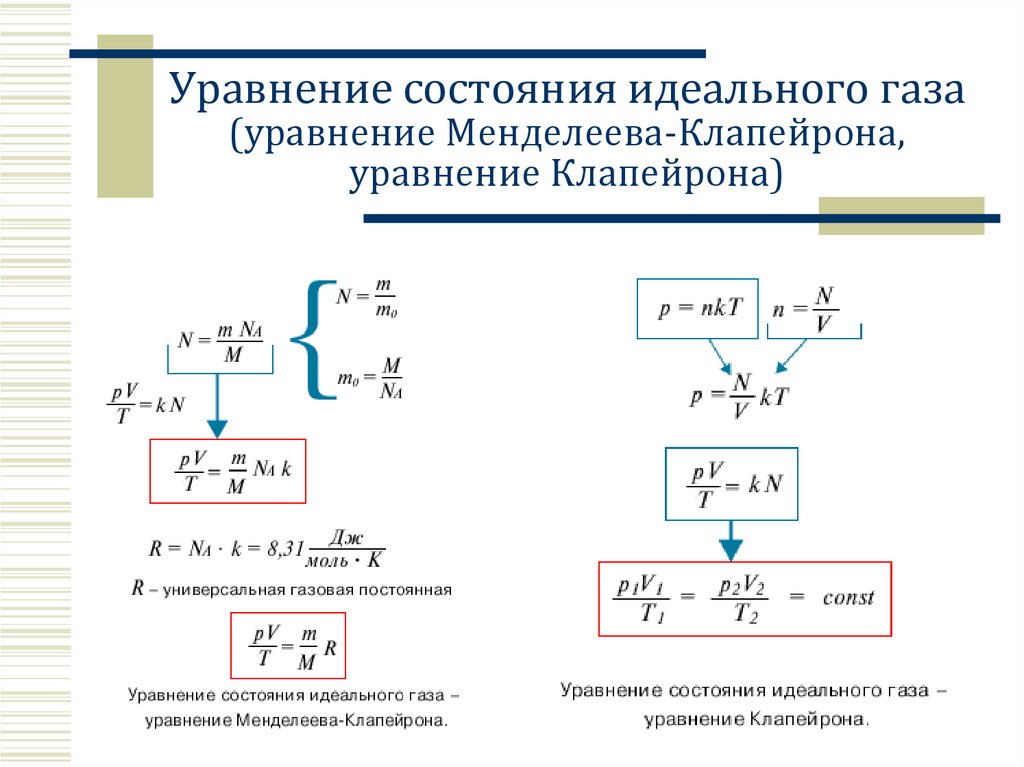
Уравнение состояния идеального газа(уравнение Менделеева-Клапейрона,
уравнение Клапейрона)
3.
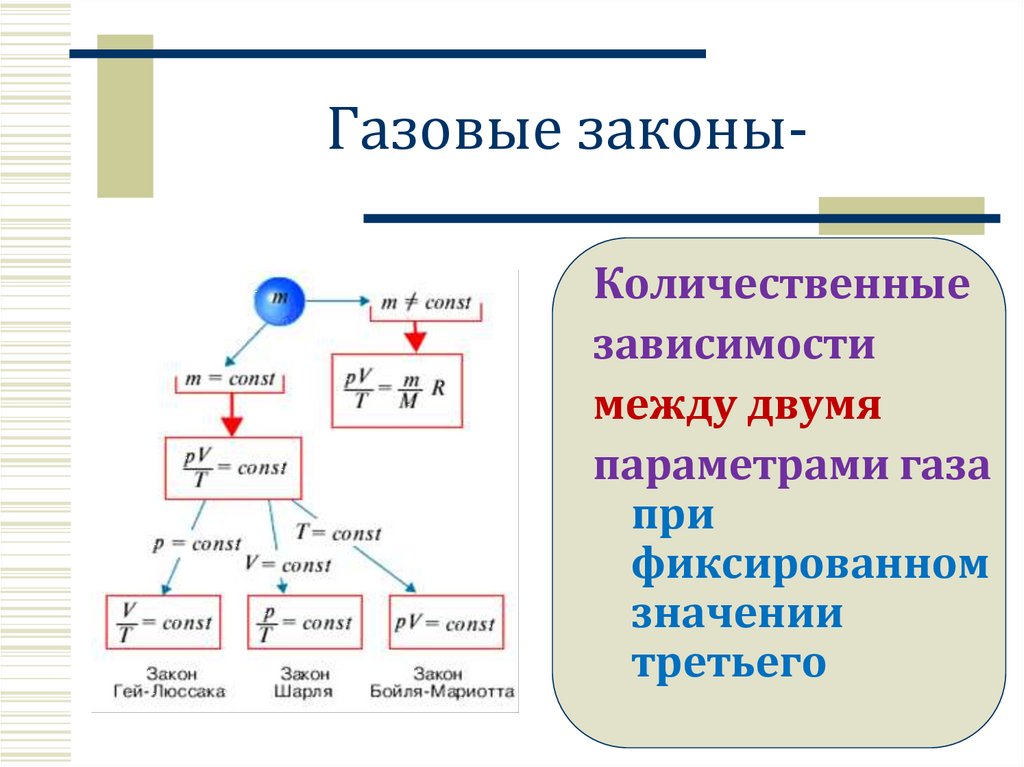
Газовые законыКоличественныезависимости
между двумя
параметрами газа
при
фиксированном
значении
третьего
4.
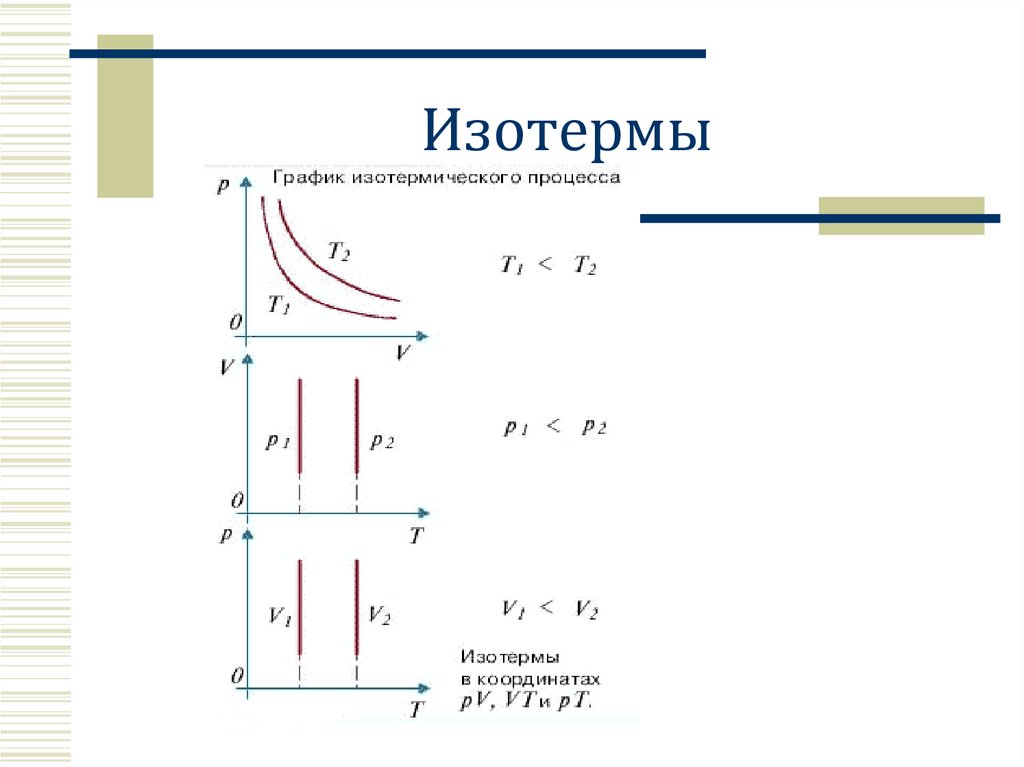
Изотермический процессT=const
В термостате
Закон Бойля – Мариотта.
Для газа данной массы произведение
давления газа на его объем постоянно,
если температура газа не меняется.
pV = const
p↑ , V↓
обратная
пропорциональность
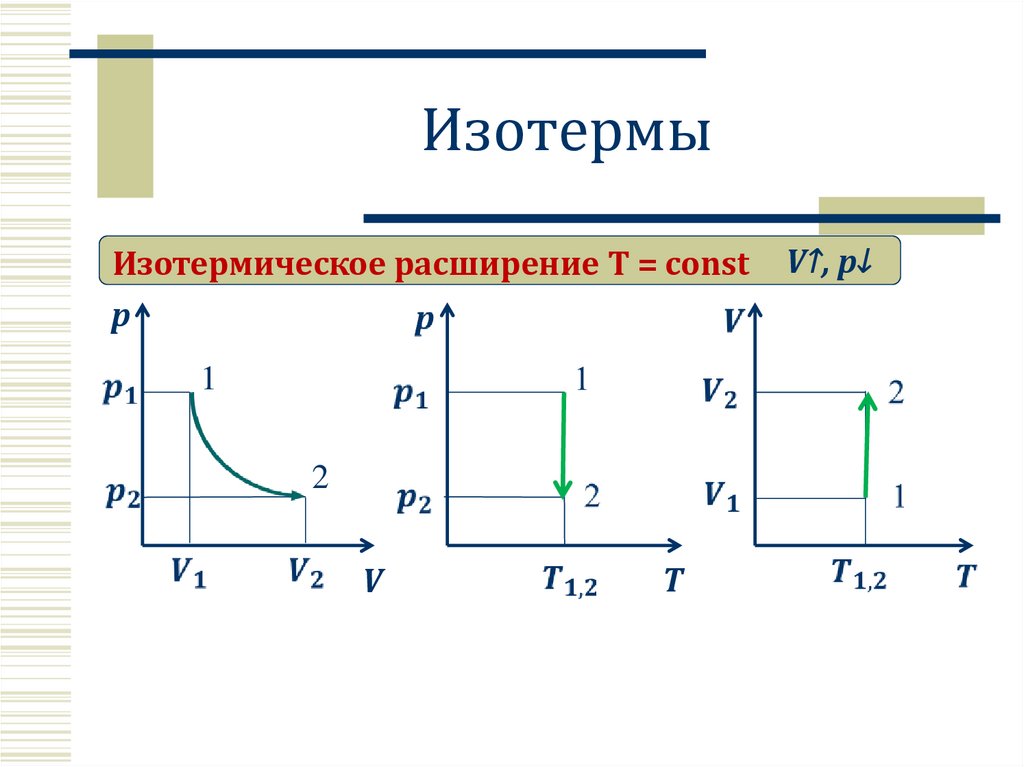
5.
ИзотермыИзотермическое расширение T = const
p
1
2
V
T
V↑, p↓
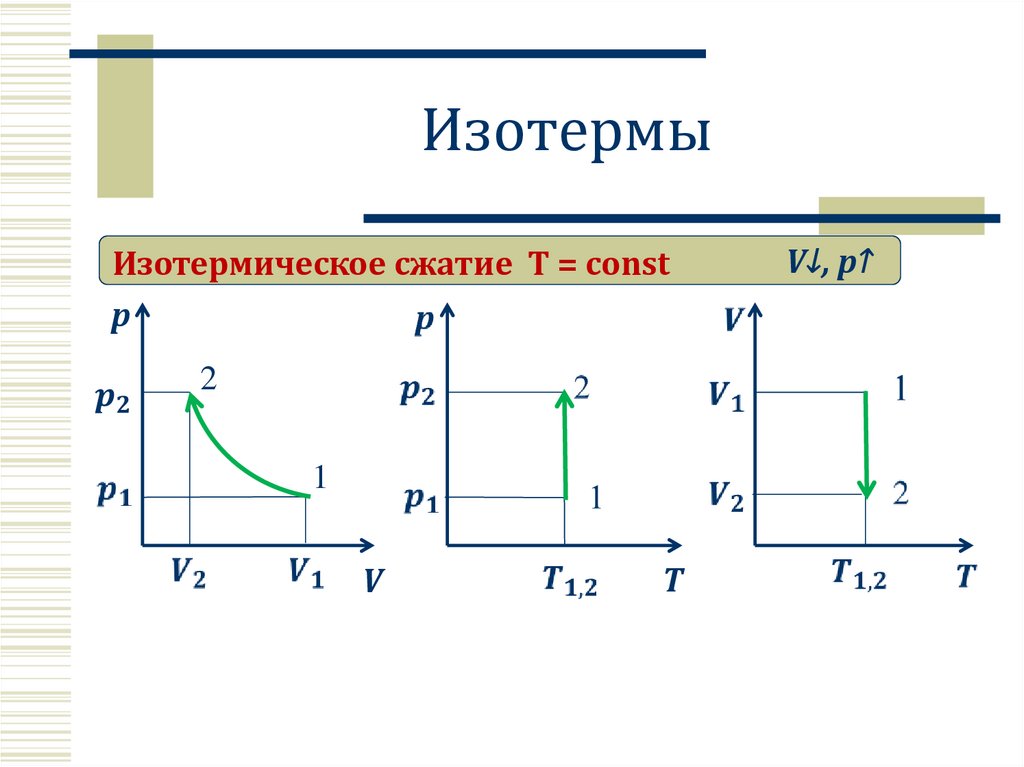
6.
ИзотермыИзотермическое сжатие T = const
p
2
1
V
T
V↓, p↑
7.
Изотермы8.
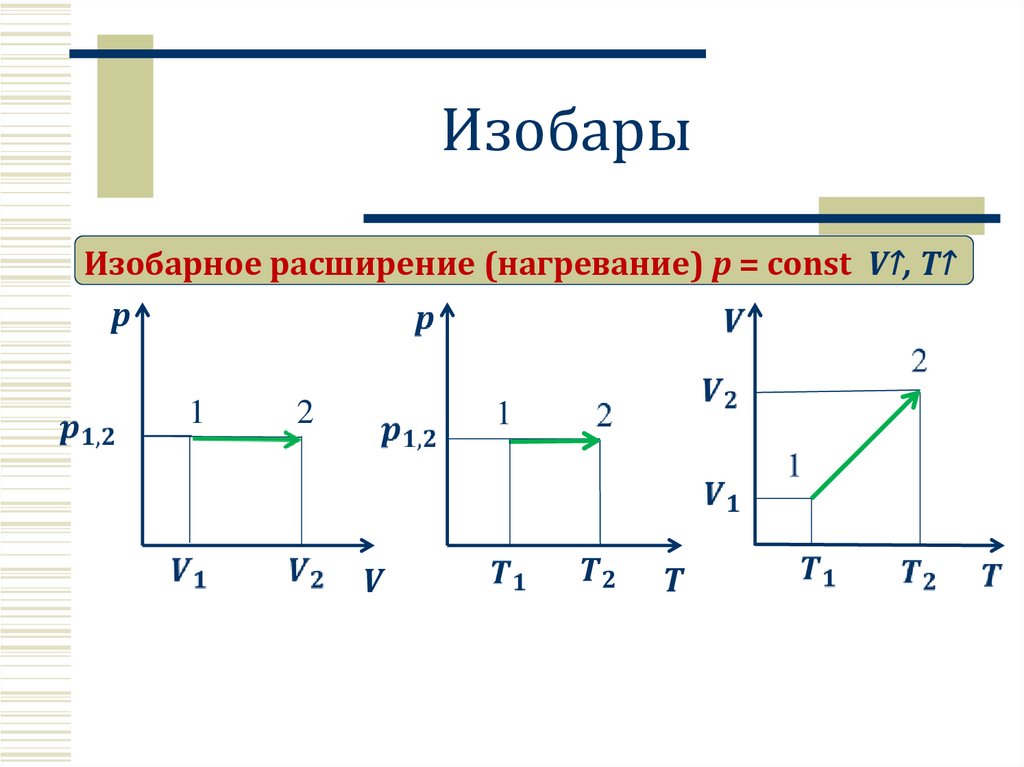
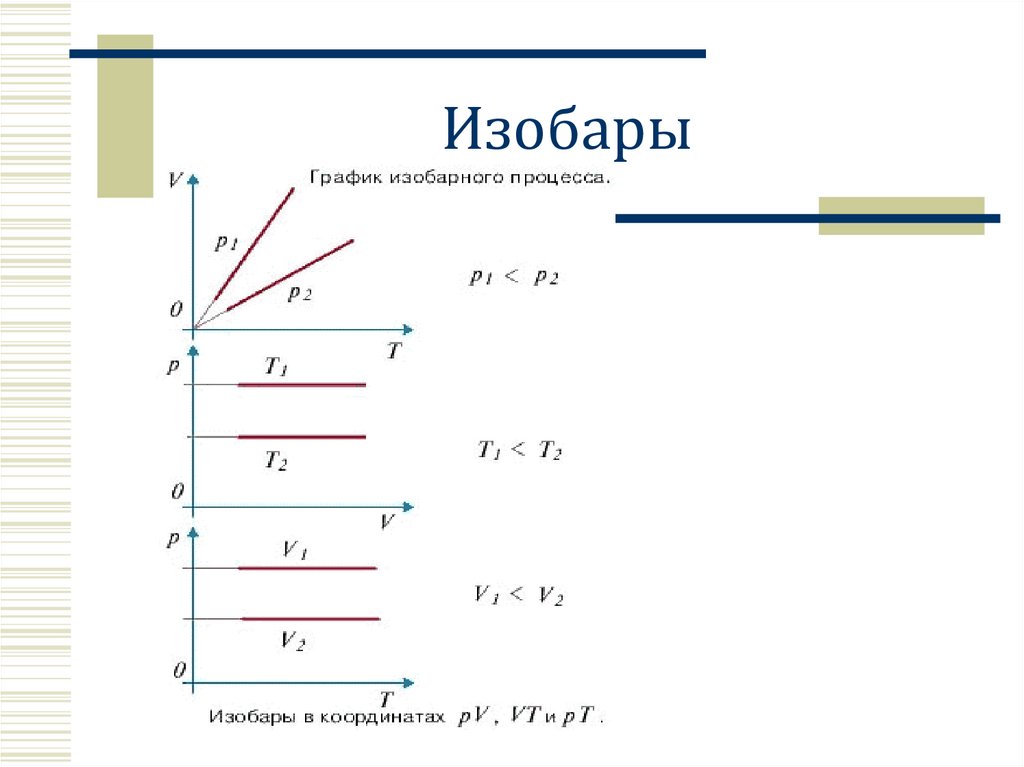
Изобарный процесс p=constВ цилиндре с
подвижным поршнем
Закон Гей – Люссака.
Для газа данной массы отношение
объема газа к температуре постоянно,
если давление газа не меняется.
V↑ , T↑
прямая
пропорциональность
9.
ИзобарыИзобарное расширение (нагревание) p = const V↑, T↑
p
1
2
V
T
10.
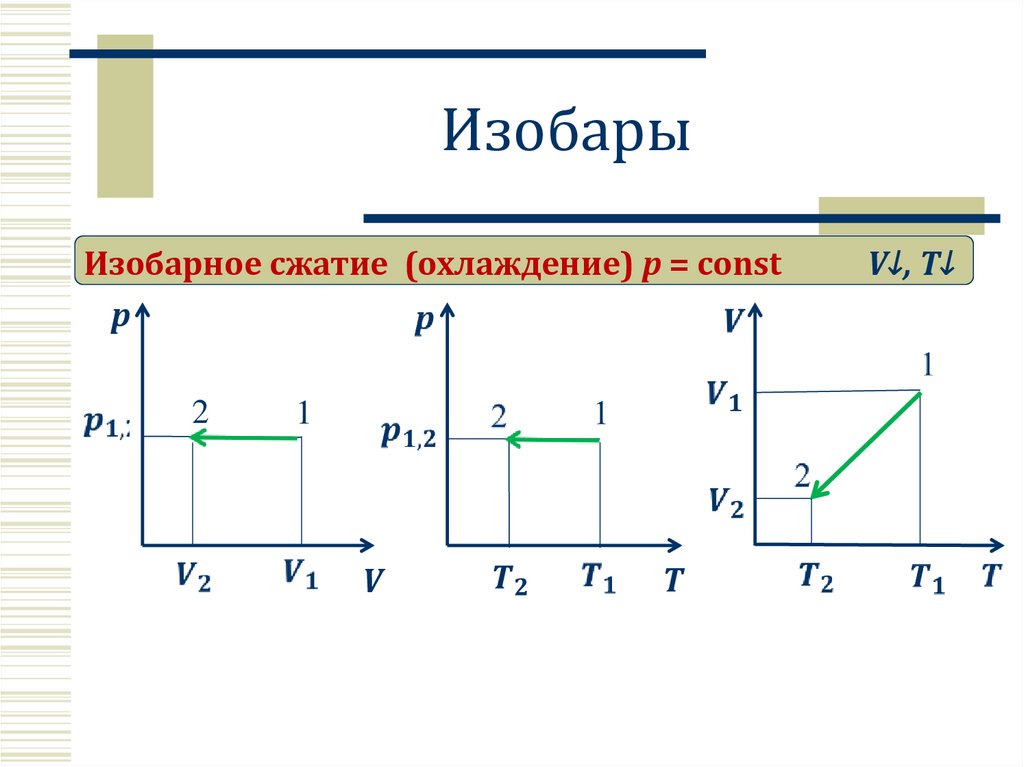
ИзобарыИзобарное сжатие (охлаждение) p = const
p
2
1
V
T
V↓, T↓
11.
Изобары12.
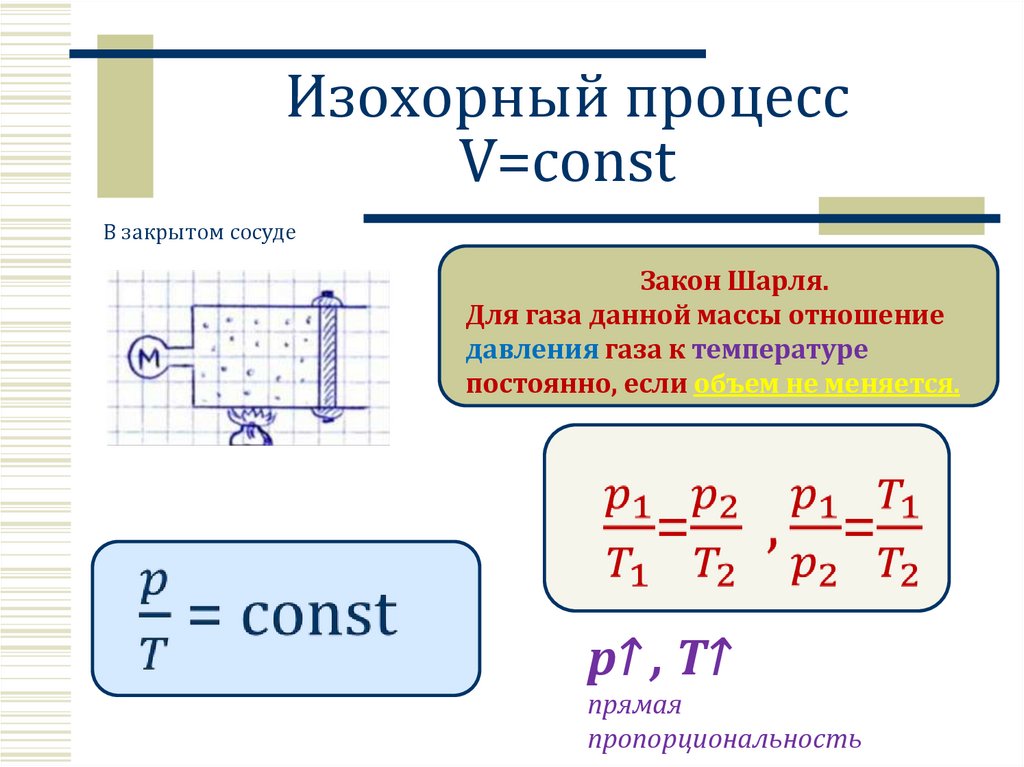
Изохорный процессV=const
В закрытом сосуде
Закон Шарля.
Для газа данной массы отношение
давления газа к температуре
постоянно, если объем не меняется.
p↑ , T↑
прямая
пропорциональность
13.
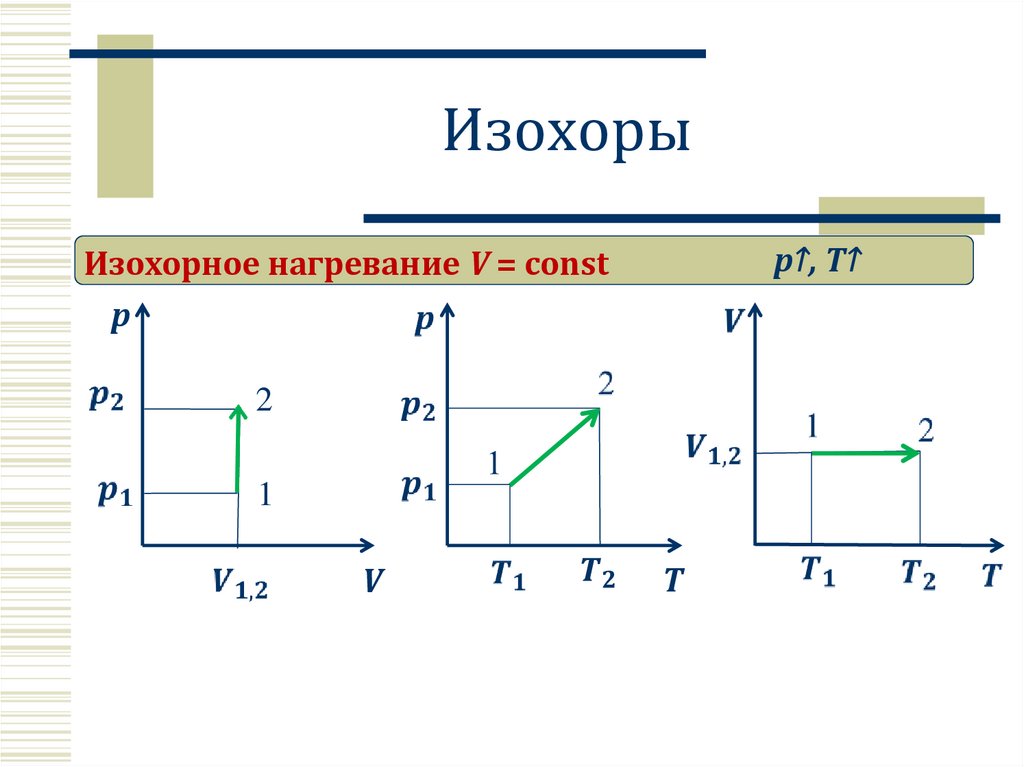
Изохорыp↑, T↑
Изохорное нагревание V = const
p
2
1
V
T
14.
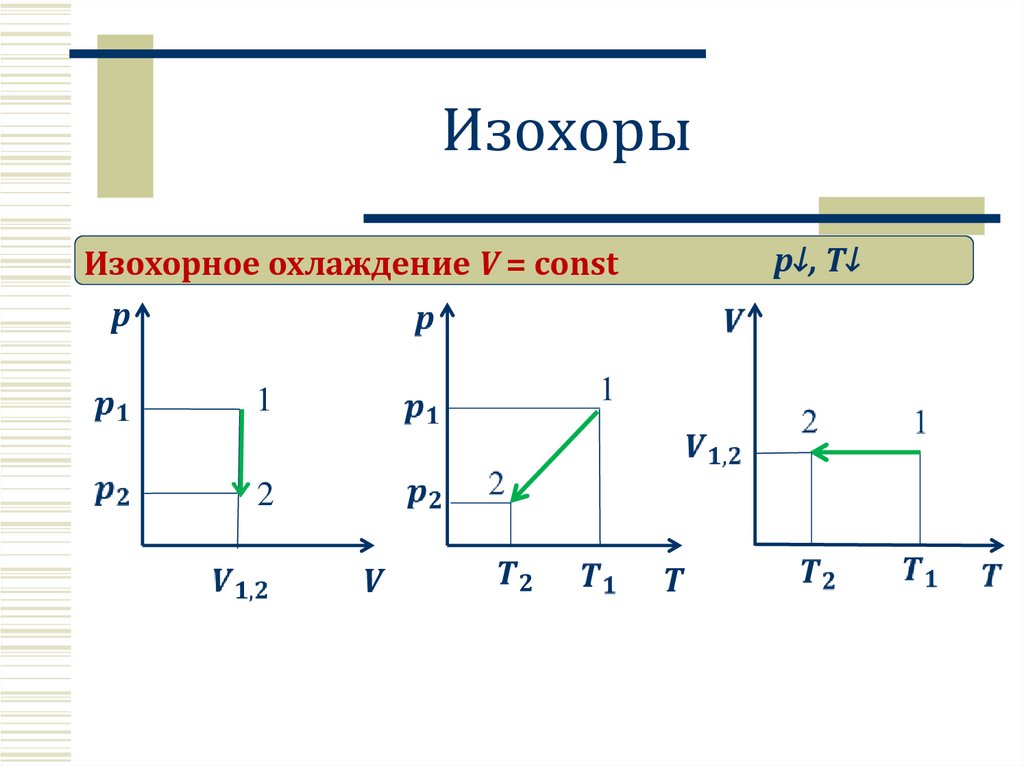
Изохорыp↓, T↓
Изохорное охлаждение V = const
p
1
2
V
T
15.
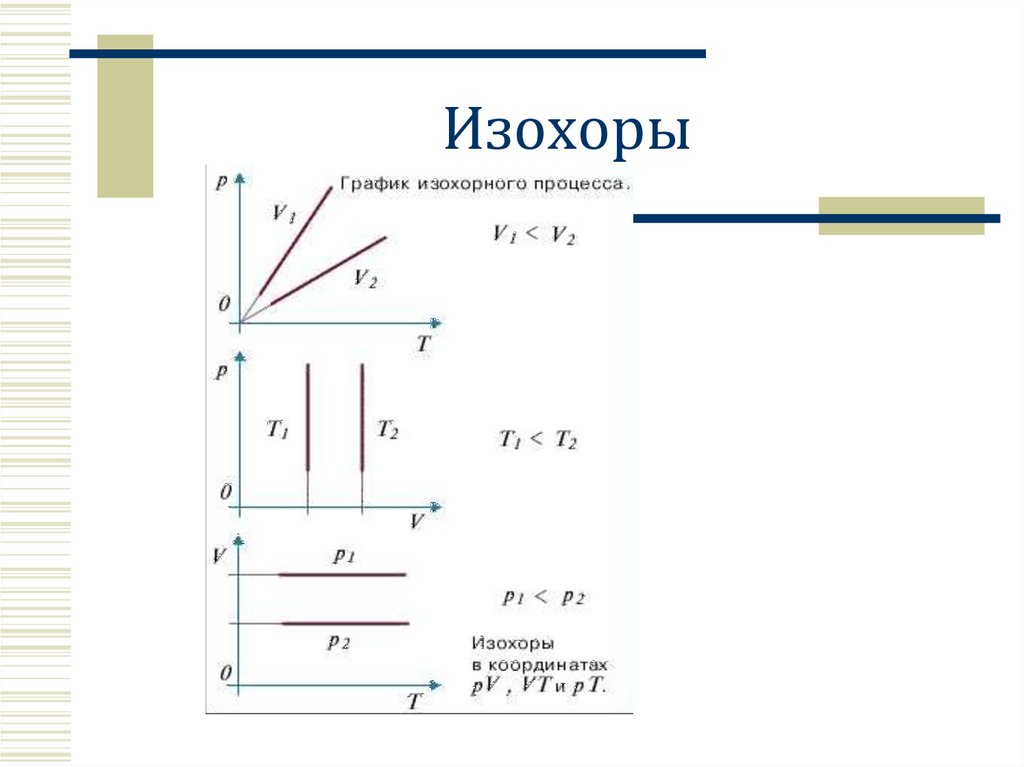
Изохоры16.
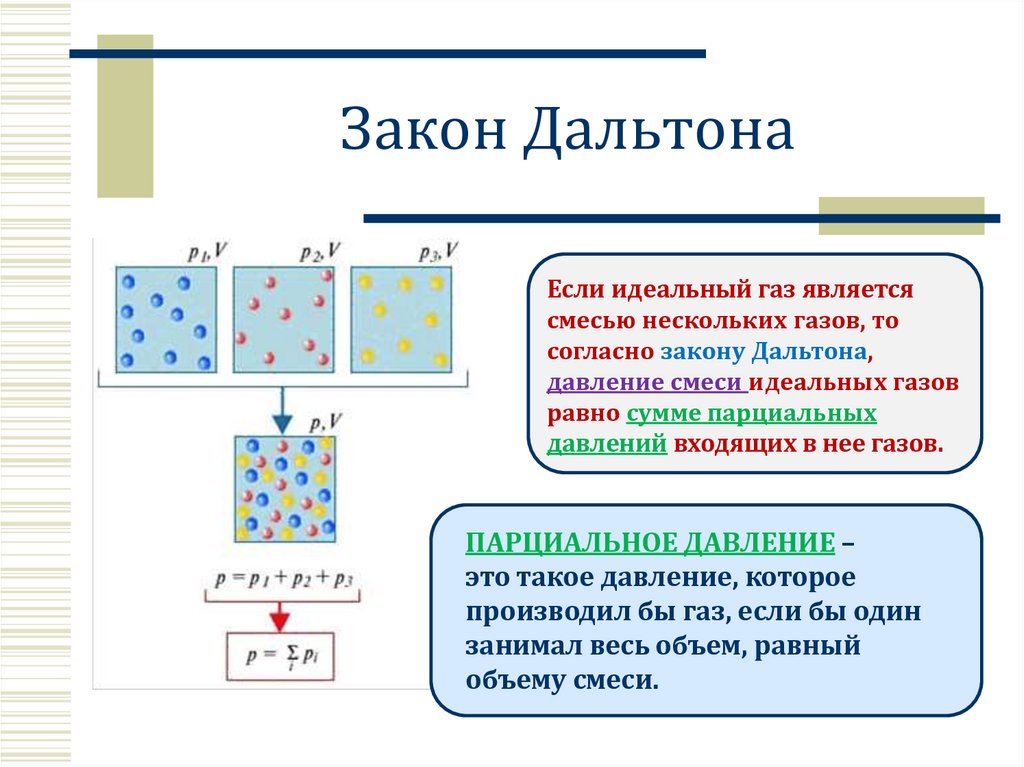
Закон ДальтонаЕсли идеальный газ является
смесью нескольких газов, то
согласно закону Дальтона,
давление смеси идеальных газов
равно сумме парциальных
давлений входящих в нее газов.
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ –
это такое давление, которое
производил бы газ, если бы один
занимал весь объем, равный
объему смеси.
17.
МКТРЕШЕНИЕ ЗАДАЧ.
18.
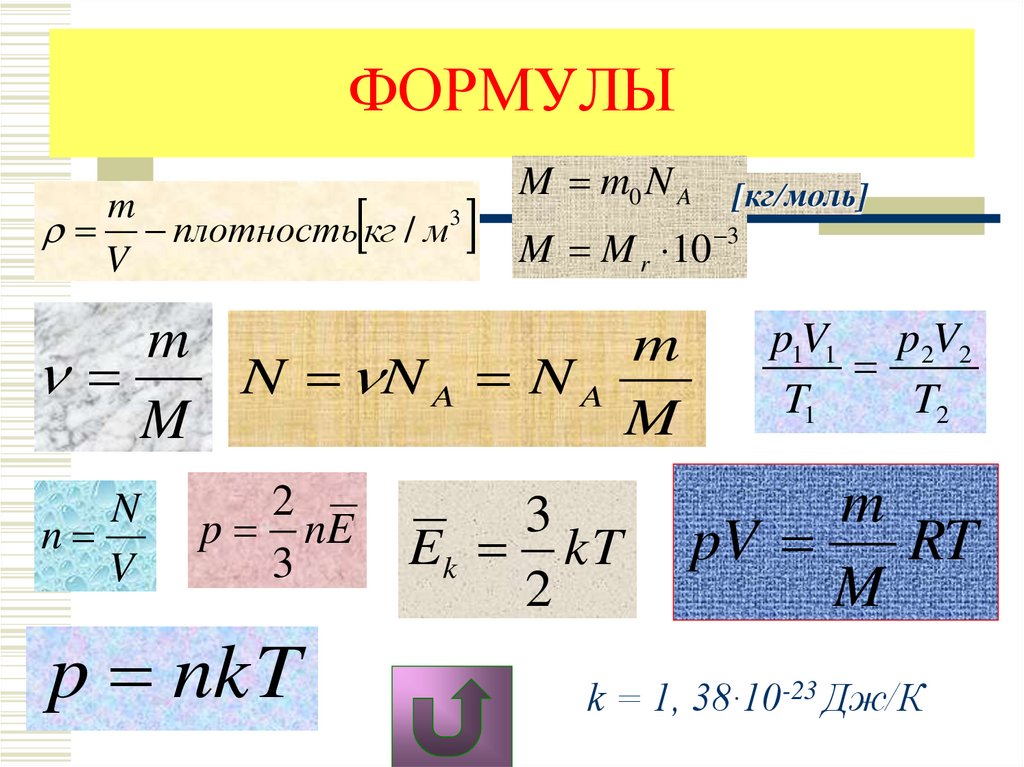
ФОРМУЛЫm
плотность кг / м 3
V
M m0 N A
M M r 10
m
m
N N A N A
M
M
N
n
V
2
p nE
3
p nkT
3
Ek kT
2
[кг/моль]
3
p1V1 p2V2
T1
T2
m
pV
RT
M
k = 1, 38∙10-23 Дж/К
19.
В компрессоре воздух быстро подвергаетсясильному сжатию. Изменяется ли состав и
размеры молекул? промежутки между
молекулами?
20.
Каким способом можно ускорить процессзасолки огурцов? Объясните это явление.
21.
Воспользуйтесь таблицей Менделеева иопределите молярную массу ацетилена
С2H2. Чему равна масса одной молекулы
ацетилена в единицах в единицах СИ?
формулы
22.
Сколько молекул содержится в 10 гуглекислого газа?
формулы
23.
Определите среднюю кинетическуюэнергию поступательного движения
молекулы газа при температуре 1500С.
формулы
24.
В сосуде вместимостью 2 лнаходится кислород при
температуре 270С и давлении
2∙105 Па. Определите массу
кислорода в сосуде.
формулы
25.
Баллон вместимостью 40 л содержиткислород массой 2,6 кг. При какой
температуре возникает опасность взрыва,
если допустимое давление не более 50∙105
Па?
формулы
26.
Объем воздуха в баллоне при температуре170С и давлении 5∙105 Па равен 8 л.
Определите давление воздуха, если объем
его уменьшился в 4 раза, а температура
повысилась до 1270С.
формулы
27.
Газ изотермически сжимают до объема 4 лдо объема 2 л. При этом давление
возрастает на 1,5∙105 Па. Определите
начальное давление газа.
формулы
28.
Газ при температуре 170С занимает объем230 см3. Определите объем этого газа при
температуре 00С. Процесс изобарный.
ФОРМУЛЫ
29.
Какое количество вещества содержится вгазе, если при давлении 200 кПа и
температуре 240К его объем равен 40 л?
№ 489. Каково давление сжатого воздуха,
находящегося в баллоне вместимостью 20 л
при температуре 12 °С, если масса этого
воздуха 2 кг?
В баллоне вместимостью 25 л находится
смесь газов, состоящая из аргона (Аr) массой
20 г и гелия (Не) массой 2 г при температуре
301 К. Найти давление смеси газов на стенки
сосуда.
30.
Газ при давлении 0,2 МПа итемпературе 15 °С имеет объем 5 л.
Чему равен объем газа этой массы при
нормальных условиях?
Газ при давлении 0,2 МПа и
температуре 15 °С имеет объем 5 л.
Чему равен объем газа этой массы при
нормальных условиях?
При температуре 27 °С давление газа в
закрытом сосуде было 75 кПа. Каким
будет давление при температуре -13
°С?
С газом некоторой массы был
произведен замкнутый процесс,
изображенный на рисунке 64.
Объяснить, как изменялся объем газа
при переходах 1—2, 2—3, 3—4, 4—1.
















 physics
physics








