Similar presentations:
Азот как простое вещество. Возможные степени окисления
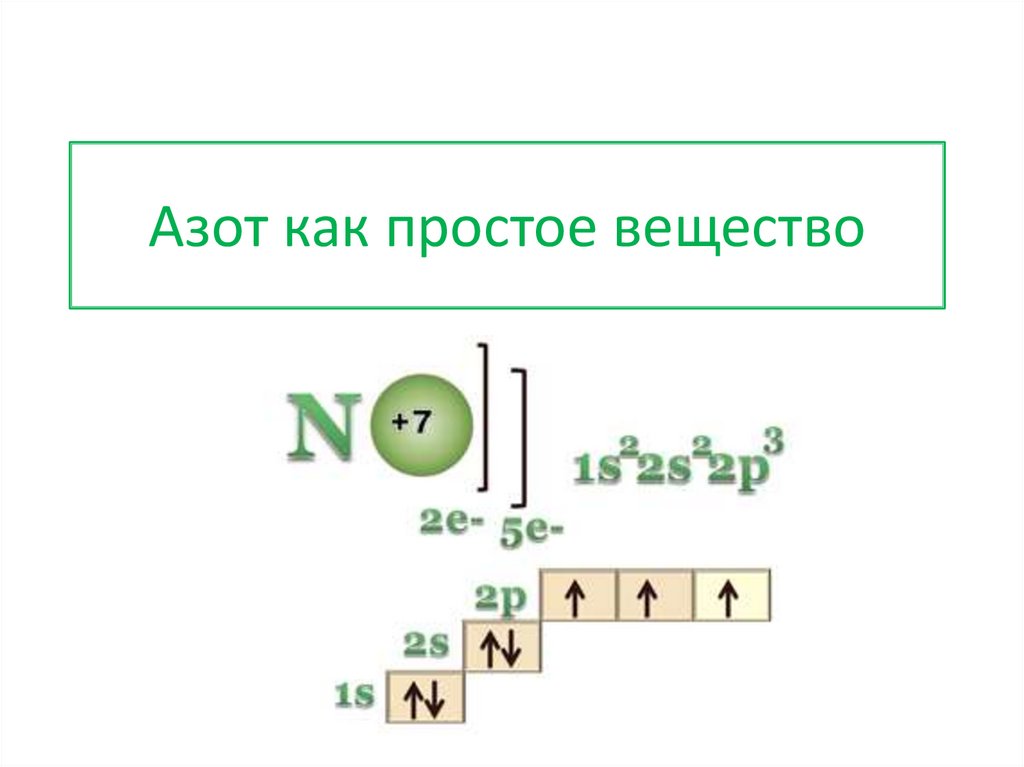
1.
Азот как простое вещество2.
Возможные степени окисления3.
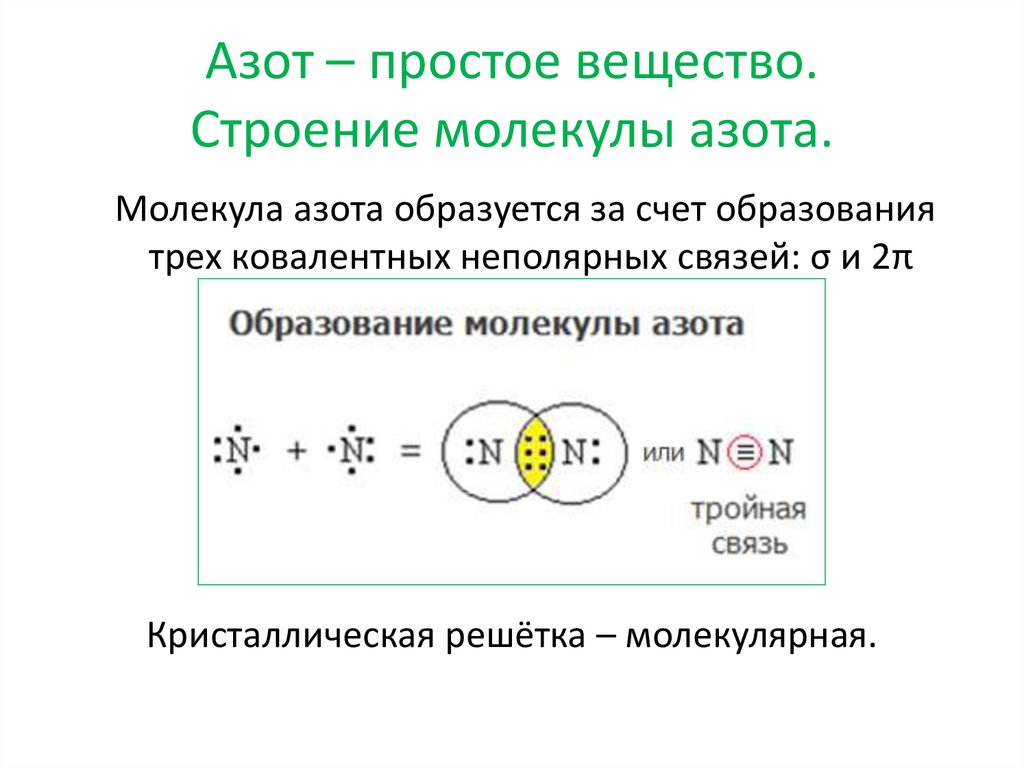
Азот – простое вещество.Строение молекулы азота.
Молекула азота образуется за счет образования
трех ковалентных неполярных связей: σ и 2π
Кристаллическая решётка – молекулярная.
4.
Физические свойства.газ
без цвета и запаха
легче воздуха
малорастворим в воде (2,5 объема N2 в 100
объёмах воды)
• сжижается при -196 оС
• при - 210 оС превращается в снегоподобную
массу.
5.
ПолучениеВ промышленности:
• Азот получают из воздуха путем
охлаждения, сжижения и перегонки
(дистилляции).
В лаборатории
• Термическое разложение
нитритов:
t
NaNO2 + NH4Cl
NaCl + N2 + 2H2O
t
NH4NO2
N2 + 2H2O
• Разложение дихромата аммония
(NH4)2Cr2O7 t N2 + Cr2O3 + 4H2O
! Хранят азот в черных баллонах, имеющих
желтую надпись «азот».
6.
Химические свойстваТройная связь очень прочная, ее энергия
равна 942 кДж/моль, поэтому
молекулярный азот
инертен, т.е. химически малоактивен.
7.
Химические свойства• Азот – восстановитель
2000 оС
N2 + O2
2 NO – Q
Азот не реагирует с серой, углеродом,
фосфором, кремнием и некоторыми
другими неметаллами.
8.
• Азот – окислитель1) С металлами – взаимодействует с
металлами при нагревании (с Li при
комнатной температуре):
t
3Сa + N2
Ca3N2
Некоторые образующиеся нитриды
разлагаются водой:
Са3N2 + 6H2O
3Ca(OH)2 + 2NH3
2) С водородом.
3H2+N2 ↔ 2NH3
Реакция обратима.






 chemistry
chemistry








