Similar presentations:
Азот – простое вещество. Неметаллы
1. НЕМЕТАЛЛЫ
АЗОТ– простое вещество
2. ЦЕЛИ :
Сформировать представлениео строении атома и молекулы
азота.
Рассмотреть физические и
химические свойства азота в
свете ОВР.
Показать значение азота как
биогенного элемента.
3. ПЛАН УРОКА
История открытияНахождение в природе
Строение и свойства атома и молекулы
Физические и химические свойства
Получение и применение
4. ДЕВИЗ УРОКА :
«Нет жизни без азота,ибо он является
непременной составной
частью белков.»
Д.Н.Прянишников
5. ИСТОРИЯ ОТКРЫТИЯ
1772г. К.Шееле и Г.Кавендиш получили азотД.Резерфорд описал получение и свойства
1787г. Лавуазье предложил название азот –
«безжизненный» (а – нет, зоэ – жизнь)
1790г. Ж.Шапталь ввел другое название
нитрогениум, «рождающий селитру»
Многочисленные названия: нечистый газ,
удушливый газ, септон, испорченный воздух,
огорюченный воздух, селитрород, гнилотвор,
смертельный газ, нитроген и др.
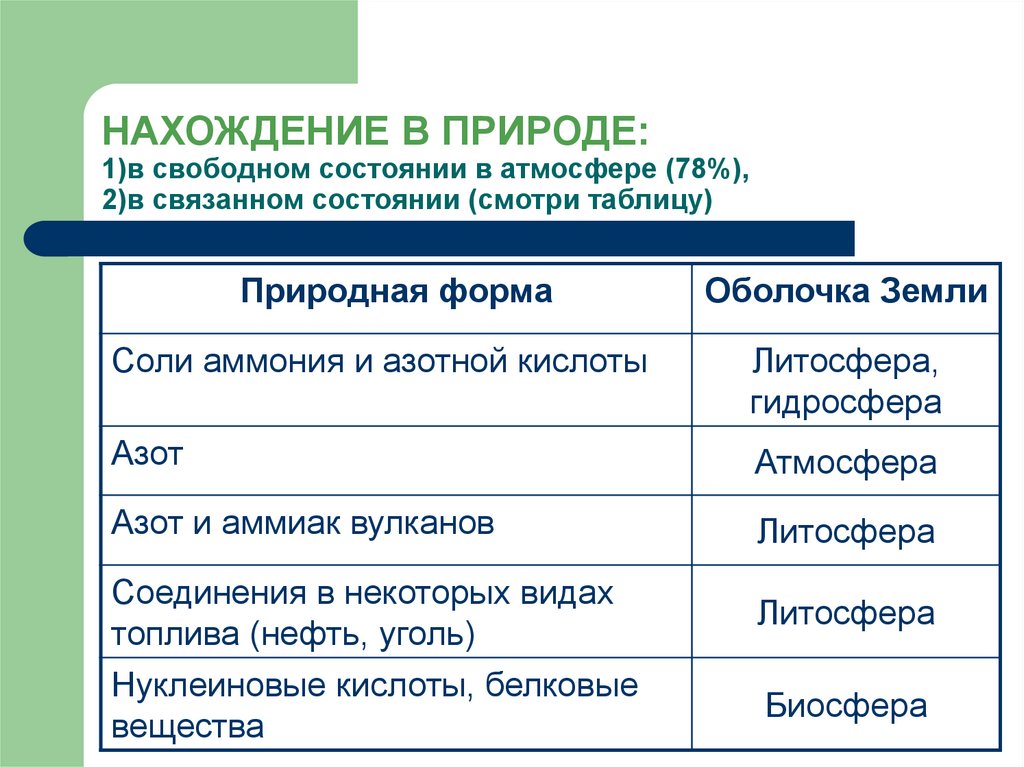
6. НАХОЖДЕНИЕ В ПРИРОДЕ: 1)в свободном состоянии в атмосфере (78%), 2)в связанном состоянии (смотри таблицу)
Природная формаОболочка Земли
Соли аммония и азотной кислоты
Литосфера,
гидросфера
Азот
Атмосфера
Азот и аммиак вулканов
Литосфера
Соединения в некоторых видах
топлива (нефть, уголь)
Литосфера
Нуклеиновые кислоты, белковые
вещества
Биосфера
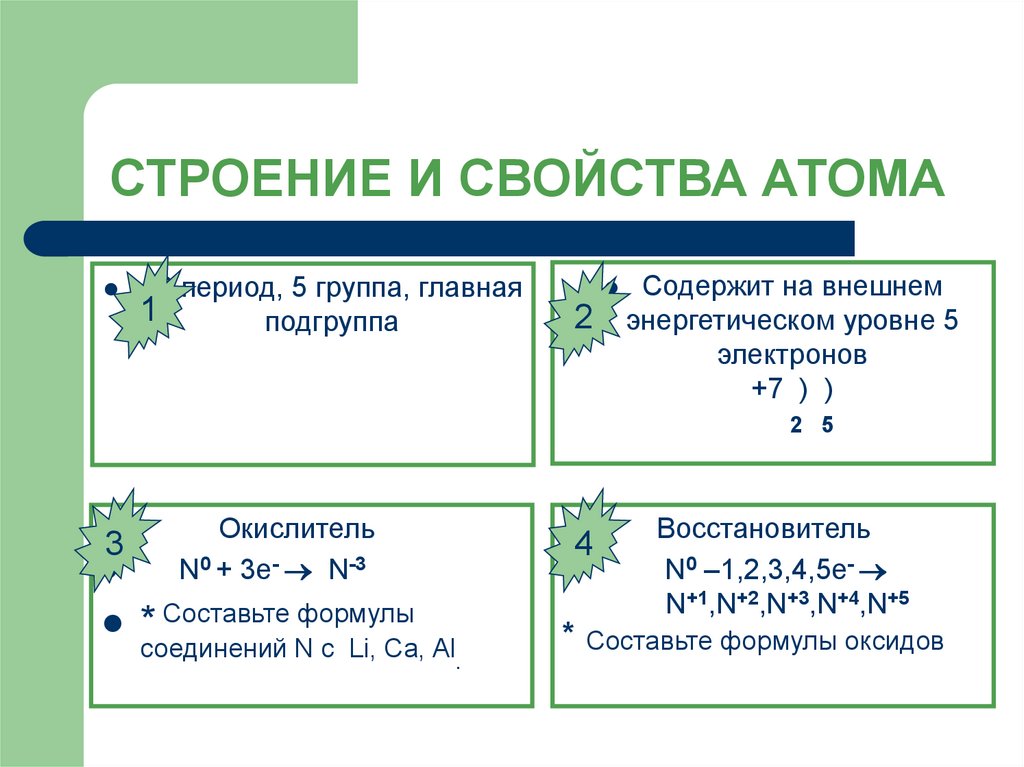
7. СТРОЕНИЕ И СВОЙСТВА АТОМА
2 период, 5 группа, главная1
подгруппа
2
Содержит на внешнем
энергетическом уровне 5
электронов
+7 ) )
2 5
3
Окислитель
N0 + 3e- N-3
* Составьте формулы
соединений N с Li, Са, Al.
4
Восстановитель
N0 –1,2,3,4,5e-
N+1,N+2,N+3,N+4,N+5
* Составьте формулы оксидов
8. Проверь себя !
Li3N, Ca3N2, AlN.N2O, NO, N2O3, NO2, N2O5.
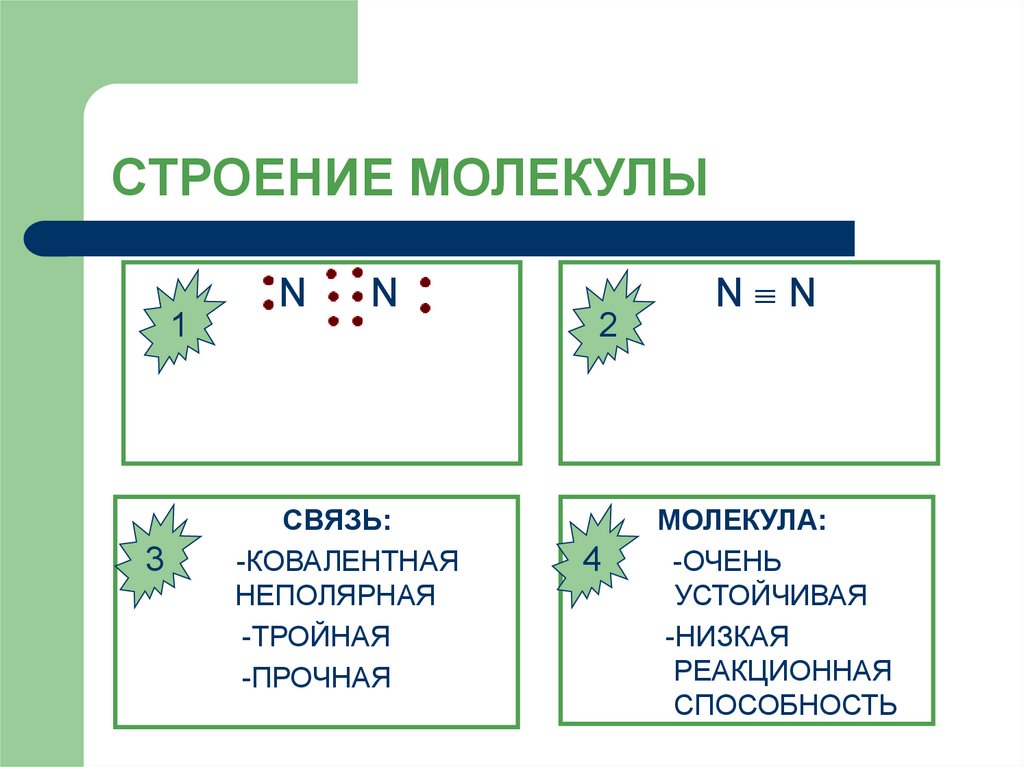
9. СТРОЕНИЕ МОЛЕКУЛЫ
13
N
N
СВЯЗЬ:
-КОВАЛЕНТНАЯ
НЕПОЛЯРНАЯ
-ТРОЙНАЯ
-ПРОЧНАЯ
2
4
N N
МОЛЕКУЛА:
-ОЧЕНЬ
УСТОЙЧИВАЯ
-НИЗКАЯ
РЕАКЦИОННАЯ
СПОСОБНОСТЬ
10. ФИЗИЧЕСКИЕ СВОЙСТВА.
Газ без цвета, запаха и вкусаПлохо растворим в воде
Немного легче воздуха
В обычных условиях пассивен
Tºпл.= -210ºС
Tºкип.= -196ºС
11. ХИМИЧЕСКИЕ СВОЙСТВА Задание: дать полную характеристику реакциям.
ОкислительныеN20
2N-3
При нагревании с
другими
металлами(Ca, Al, Fe)
При комнатной tº
только с Li
*При высокой tº, р, kat
(Fe, оксиды Al, K) с H2
Восстановительные
N20
2N+2
*При
tº электрической
дуги (3000 - 4000ºС) с
О2
12. ПРОВЕРЬ СЕБЯ !
N2+3H2Обратимая
Соединения
Экзотермическая
Гомогенная
Каталитическая
2NH3 +Q
N2+O2
Обратимая
Соединения
Эндотермическая
Гомогенная
Некаталитическая
2NO
–Q
13. ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ
ПрименениеПолучение аммиака
Создание инертной атмосферы
Создание низких температур
Насыщение поверхности стали
для повышения прочности
Получение
В промышленности – из жидкого
воздуха
В лаборатории – разложением
неустойчивых соединений азота
14. Вопросы для самоконтроля выпиши в две строчки ответы ,соотнося их к O2 илиN2
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
Газ без цвета , вкуса и запаха
Молекула двухатомна
Содержание в воздухе 78 %
В лаборатории получают разложением KMnO4 и
H2O2
В промышленности – из жидкого воздуха
Химически малоактивен
Взаимодействует почти со всеми простыми
веществами
С ним связаны процессы дыхания и фотосинтеза
Является составной частью белков
Участвует в круговороте веществ в природе
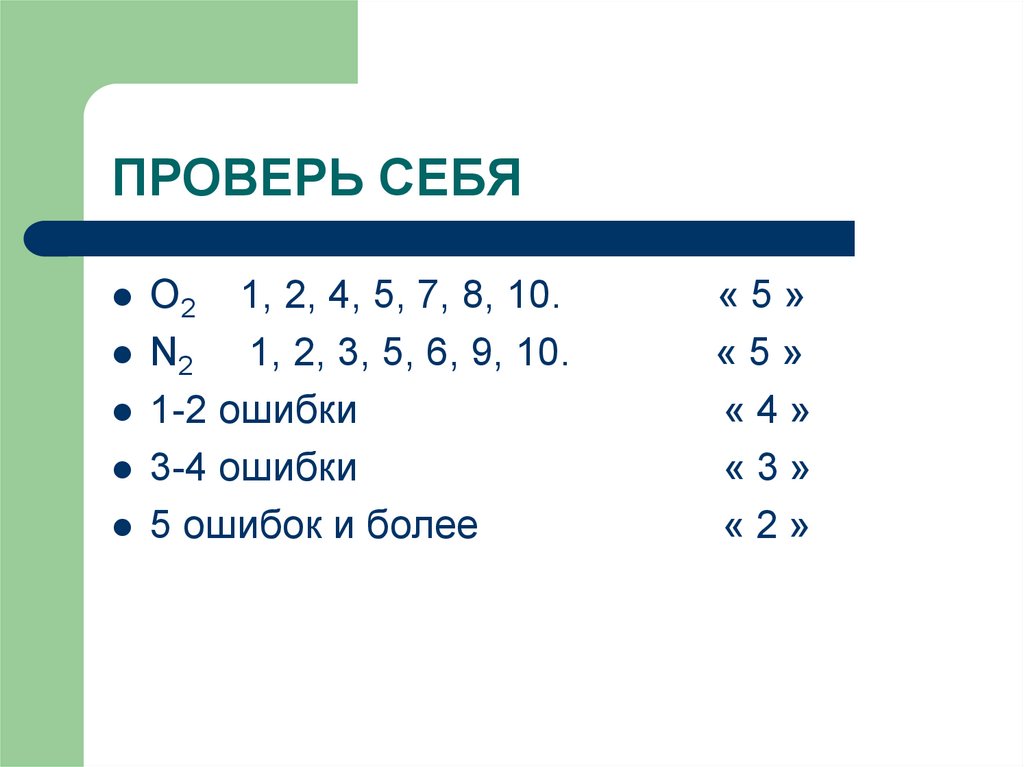
15. ПРОВЕРЬ СЕБЯ
O2 1, 2, 4, 5, 7, 8, 10.N2 1, 2, 3, 5, 6, 9, 10.
1-2 ошибки
3-4 ошибки
5 ошибок и более
«5»
«5»
«4»
«3»
«2»
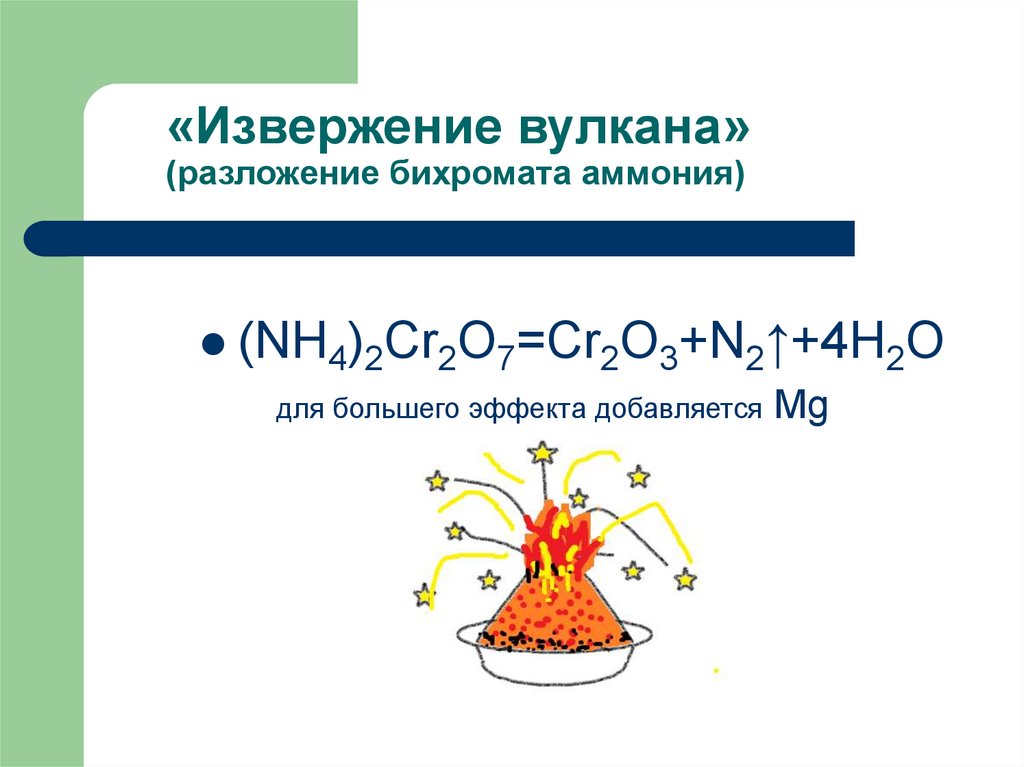
16. «Извержение вулкана» (разложение бихромата аммония)
(NH4)2Cr2O7=Cr2O3+N2↑+4H2Oдля большего эффекта добавляется
Mg
17. Домашнее задание
Параграф №24Выполнить задания 2,3,4* на стр. 146
Составить рассказ на тему: «Путешествие
азота в природе»











 chemistry
chemistry








