Similar presentations:
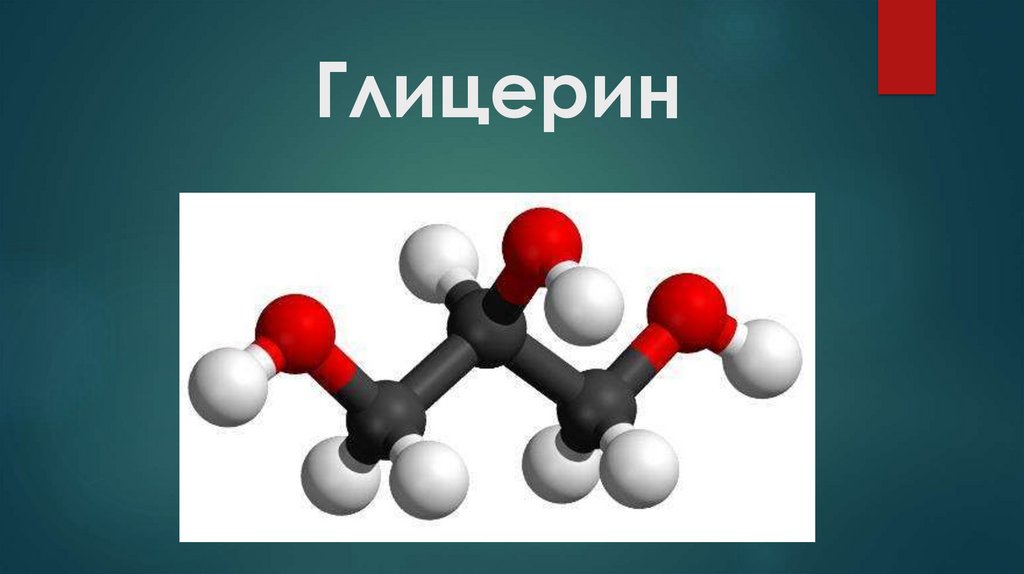
Глицерин. Строение молекулы глицерина
1.
Глицерин2.
Глицерин – это бесцветная, вязкая,сиропообразная жидкость, сладкая на
вкус. Не ядовит. Глицерин не имеет
запаха.
Его температуры плавления и кипения
равны 18 oС и 290 oС соответственно.
Глицерин гигроскопичен, хорошо
смешивается с водой и этанолом.
Абсолютно чистый безводный глицерин
затвердевает при +18oС, но получить
его в твердом виде чрезвычайно
сложно.
3.
Строение молекулы глицерина4.
Получение глицеринаСтарейший способ производства глицерина –
гидролиз жиров и масел:
5.
Внастоящее время глицерин получают
синтетическим путем из пропилена,
образующегося при крекинге нефти.
При этом используют разные пути
превращения пропилена в глицерин.
Наиболее перспективный способ –
окисление пропилена кислородом
воздуха в присутствии катализатора и
при высокой температуре (kat = Cu, t0 =
370). Процесс идет в несколько стадий.
6.
Глицериншироко распространен в живой
природе. Он играет важную роль в
процессах обмена в организмах
животных, входит в состав большинства
липидов – жиров и других веществ,
содержащихся в животных и растительных
тканях и выполняющих в живых организмах
важнейшие функции.
Глицерин
является компонентом многих
пищевых продуктов, кремов и
косметических средств
7.
Химические свойства глицеринаГлицерин является представителем трехатомных спиртов,
для которых, как для гидроксилсодержащих соединений
характерны те же реакции, что и для одноатомных
спиртов.
Глицерин реагирует с активными металлами (калием,
натрием и др.), замещающими водород во всех
гидроксильных группах, вступают в реакции с
галогеноводородами (HCl, HBr и др.), в реакции
дегидратации, образуя различные эфиры.
8.
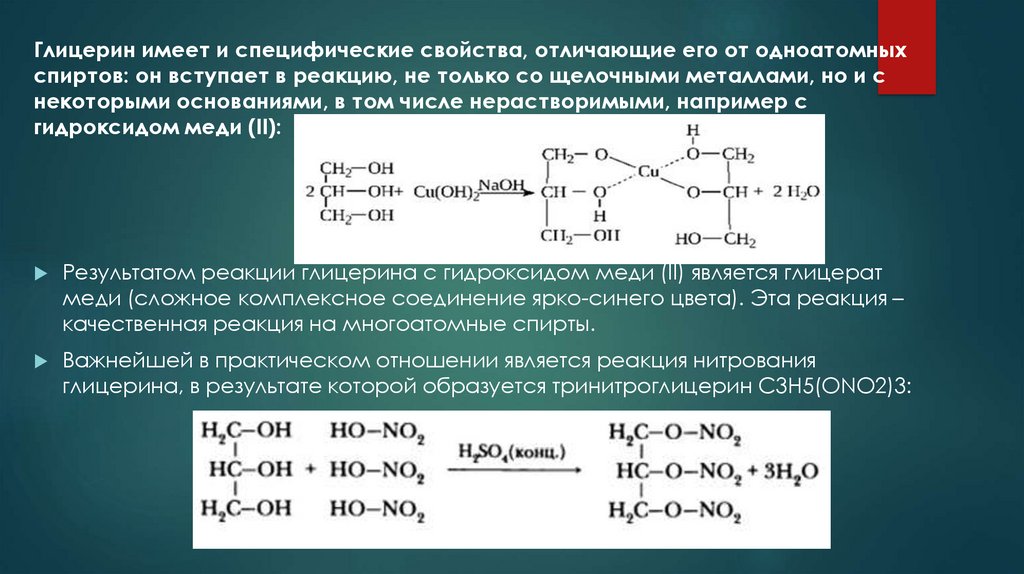
Глицерин имеет и специфические свойства, отличающие его от одноатомныхспиртов: он вступает в реакцию, не только со щелочными металлами, но и с
некоторыми основаниями, в том числе нерастворимыми, например с
гидроксидом меди (II):
Результатом реакции глицерина с гидроксидом меди (II) является глицерат
меди (сложное комплексное соединение ярко-синего цвета). Эта реакция –
качественная реакция на многоатомные спирты.
Важнейшей в практическом отношении является реакция нитрования
глицерина, в результате которой образуется тринитроглицерин C3H5(ONO2)3:
9.
ЭтиленгликольЭтиленгликоль (этан-1,2-диол ) – сложное
кислородсодержащее органическое
соединение, двухатомный спирт. С2Н6О2
10.
Этиленгликоль имеет слегка сладковатыйвкус, не имеет запаха, в очищенном
состоянии выглядит, как немного маслянистая
бесцветная прозрачная жидкость.
Этиленгликоль реагирует с различными
щелочными и щелочно-земельными
металлами:
11.
Качественной реакцией являетсявзаимодействие спирта со
свежеосажденным Cu(OH)_2. Наблюдается
растворение осадка и окрашивание
раствора в насыщенно синий цвет — в
результате образования гликолята меди (II).
12.
Применение; Этиленгликоль в основном используется в составе
антифризов (50 \%), а также в качестве сырья при
производстве сложных полиэфиров, таких как
полиэтилентерефталат (ПЭТ) (40 \%).
В автомобильной отрасли этиленгликоль находит
применение и в качестве отличного теплоносителя. Кроме
того, он используется в следующих сферах:
органический синтез: химические свойства гликоля
позволяют с его помощью использовать спирт в виде
эффективного растворителя, работающего при
повышенных температурах, а также в качестве основной
составляющей специальной авиационной жидкости,
уменьшающей явление обводнения горючих смесей для
летательных аппаратов
13.
растворениекрасящих соединений;
изготовление
нитрогликоля – мощного
взрывчатого вещества на основе
описываемого нами соединения;
газодобывающая
промышленность:
гликоль не позволяет формироваться
гидрату метана на трубах, кроме того,
он поглощает излишнюю влагу на
трубопроводах.











 chemistry
chemistry








