Similar presentations:
Валентные возможности атомов. Степень окисления. 11 класс
1. Валентные возможности атомов. Степень окисления
11 классВалентные
возможности атомов.
Степень окисления
2. Валентность -
Валентность • это число химических связей, котороеданный атом образует с другими
атомами.
• Электроны, принимающие участие в образовании
химических связей называют валентными
• Валентные электроны располагаются на внешнем
уровне (для главных подгрупп) + предвнешнем dподуровне (для побочных подгрупп)
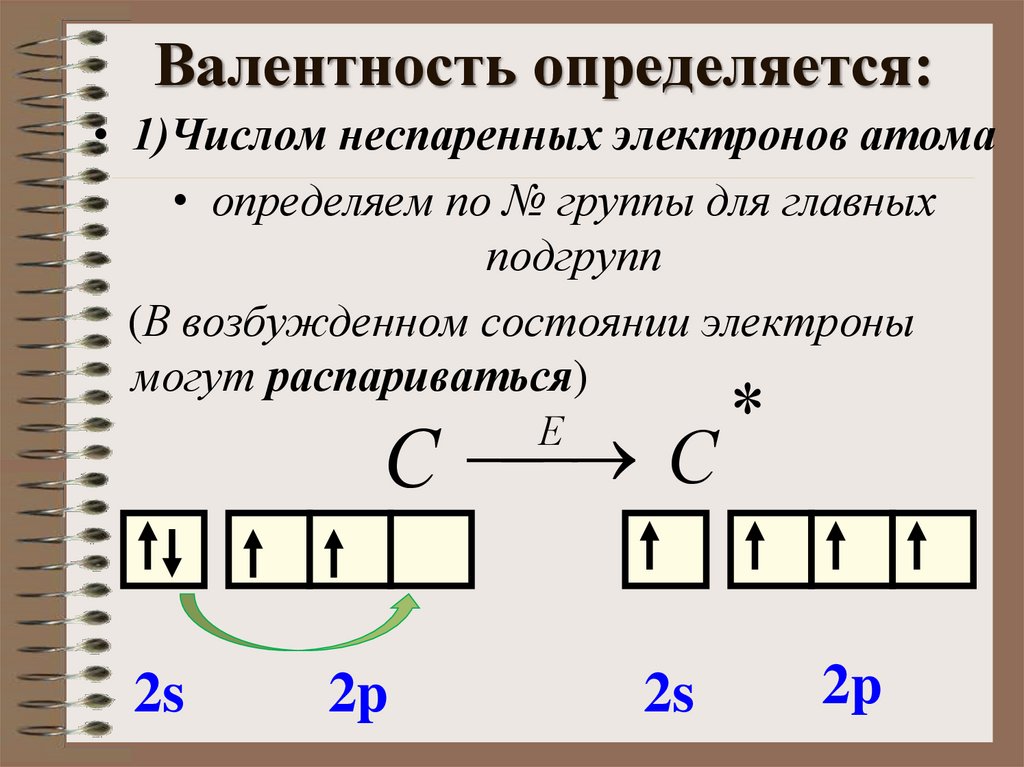
3. Валентность определяется:
• 1)Числом неспаренных электронов атома• определяем по № группы для главных
подгрупп
(В возбужденном состоянии электроны
могут распариваться)
С С
Е
2s
2p
2s
2p
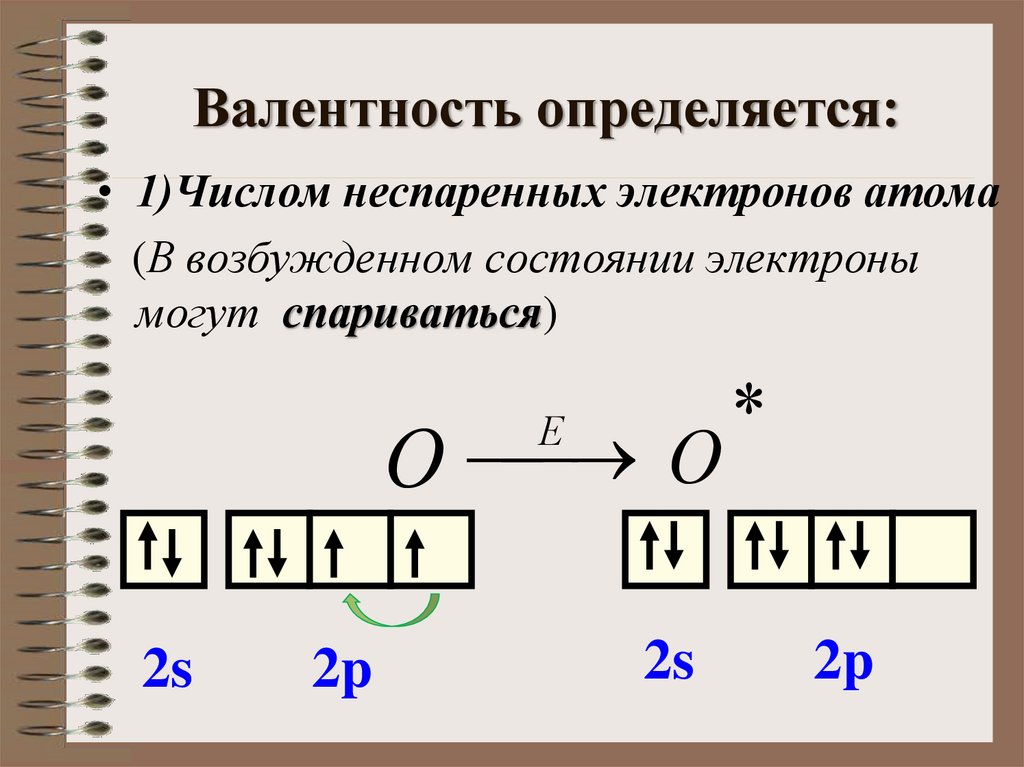
4. Валентность определяется:
• 1)Числом неспаренных электронов атома(В возбужденном состоянии электроны
могут спариваться)
О О
Е
2s
2p
2s
2p
5. Валентность определяется:
• 2)Числом пустых орбиталей• 3) наличием неподеленных электронных
пар
Механизм образования
связи
Обменный
Донорноакцепторный
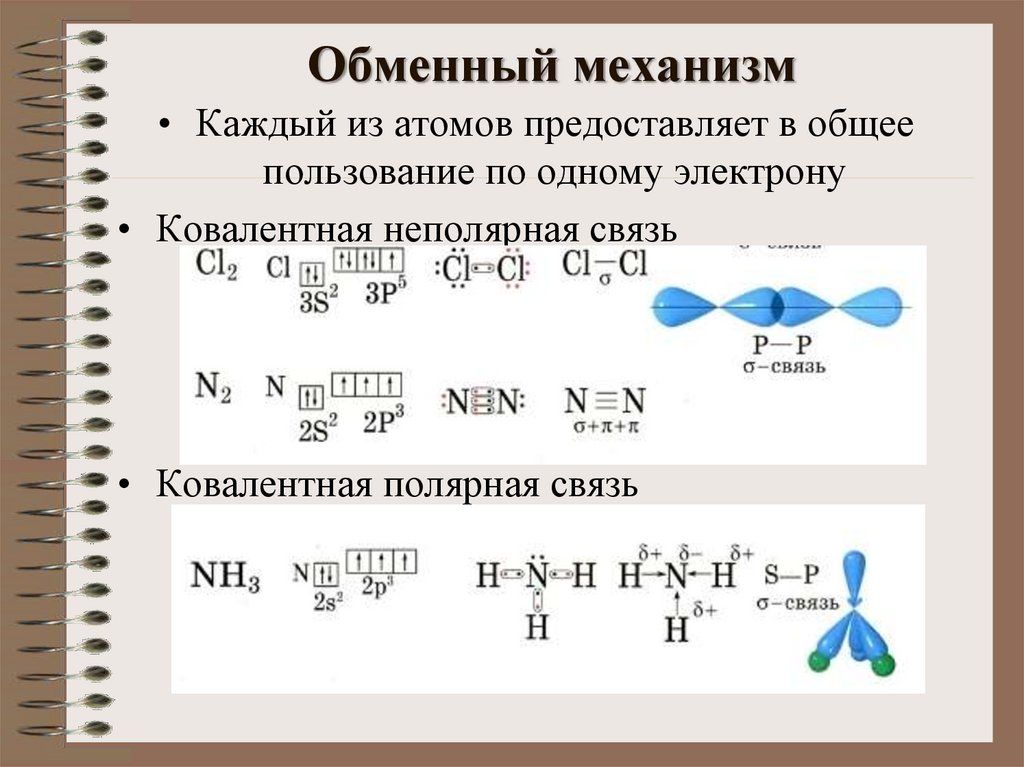
6. Обменный механизм
• Каждый из атомов предоставляет в общеепользование по одному электрону
• Ковалентная неполярная связь
• Ковалентная полярная связь
7. Донорно-акцепторный механизм
• Образование связи происходит за счетпары электронов атома-донора и
вакантной орбитали атома-акцептора
• Образование 4-й ковалентная связь IV
+
в ионе аммония
NH4
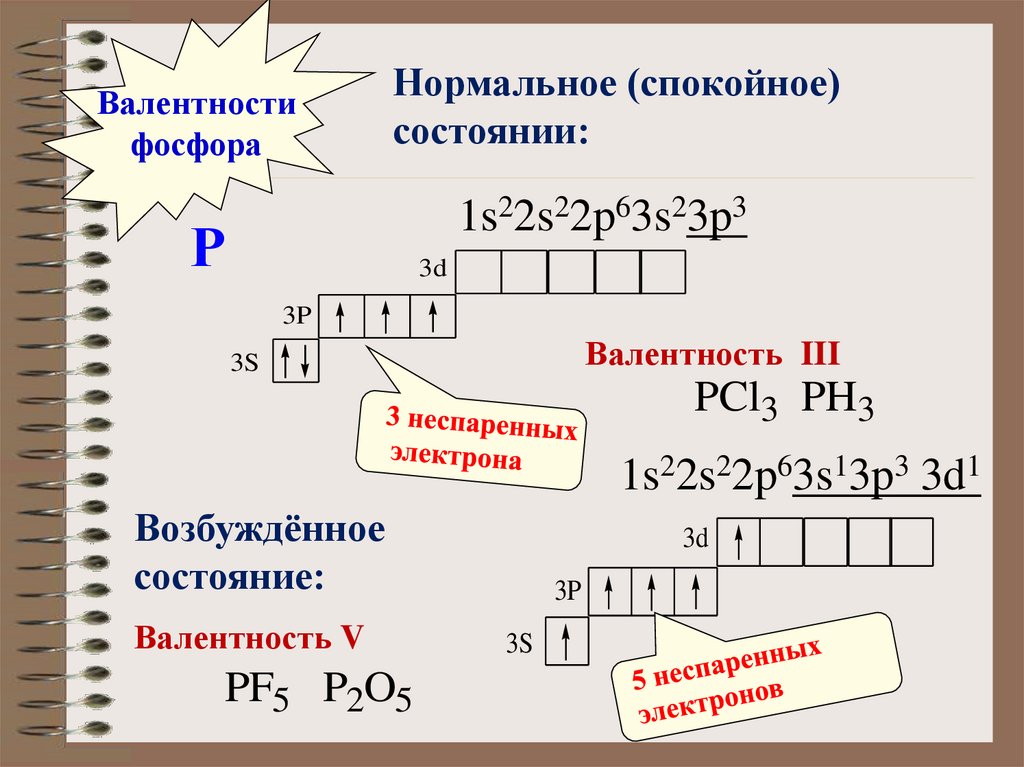
8.
Валентностифосфора
Нормальное (спокойное)
состоянии:
1s22s22p63s23p3
Р
3d
3P
Валентность III
3S
PCl3 PH3
1s22s22p63s13p3 3d1
Возбуждённое
состояние:
Валентность V
PF5 P2O5
3d
3P
3S
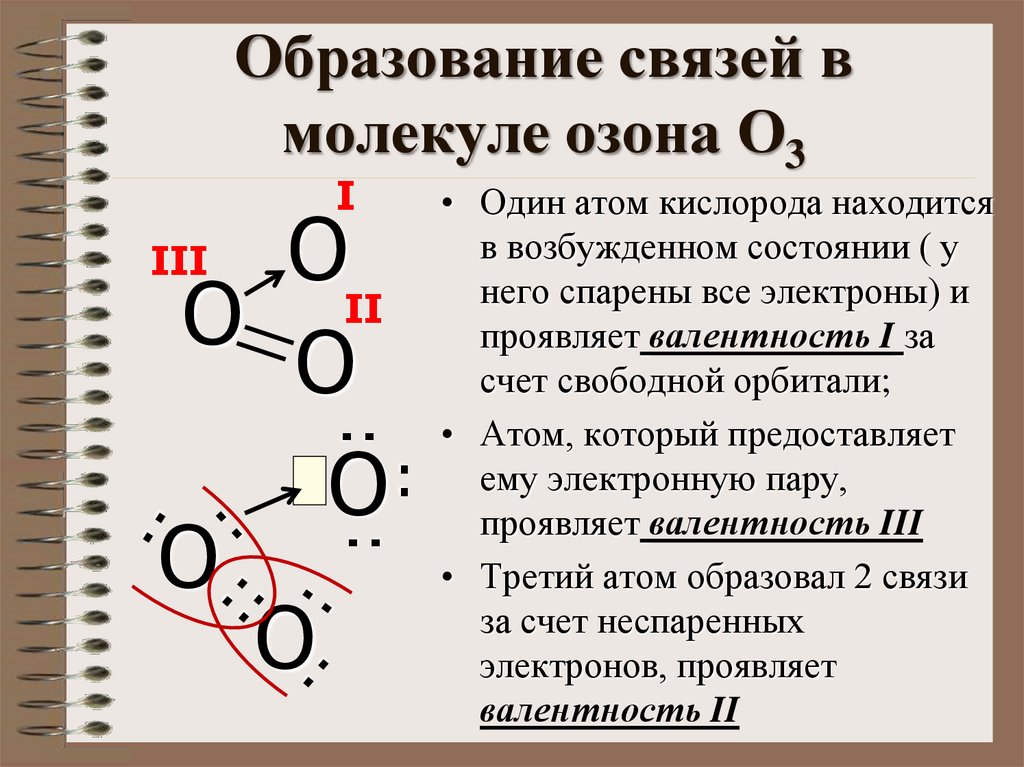
9. Образование связей в молекуле озона О3
IО
II
О
О
О
О
О
III
:
:
:
• Один атом кислорода находится
в возбужденном состоянии ( у
него спарены все электроны) и
проявляет валентность I за
счет свободной орбитали;
• Атом, который предоставляет
ему электронную пару,
проявляет валентность III
• Третий атом образовал 2 связи
за счет неспаренных
электронов, проявляет
валентность II
10. Степень окисления
• - это условный заряд, который быприобрел атом, если бы все связи в
веществе были ионными
• - это условный заряд, равный числу
частично или полностью, «отданных»
или «присоединенных» электронов от
одного атома к другому
11. Степень окисления
• 1)Численно С.О. совпадает свалентностью, если в веществе нет:
• а) Неполярных связей
• б)Донорно-акцепторных связей
• 2) Низшая С.О. неМе определяется :
8-№ группы
• 3)Высшая С.О. определяется:
по № группы
• 4) Сумма всех С.О. х.э. = 0
• 5) С.О. х.э. в простых в-вах = 0
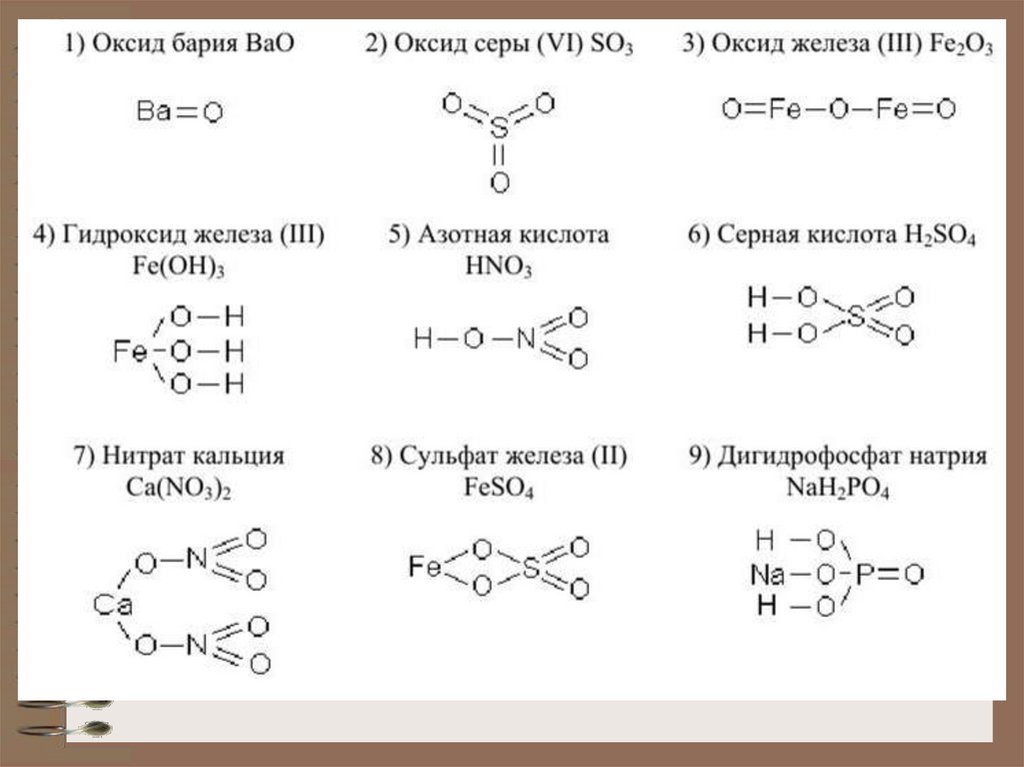
12. Определите валентность и С.О. атомов х.э., Составьте структурные формулы веществ:
PCl3H2SO4
NH4+
Zn(OH)2
N2
C2H6
Cl2O5
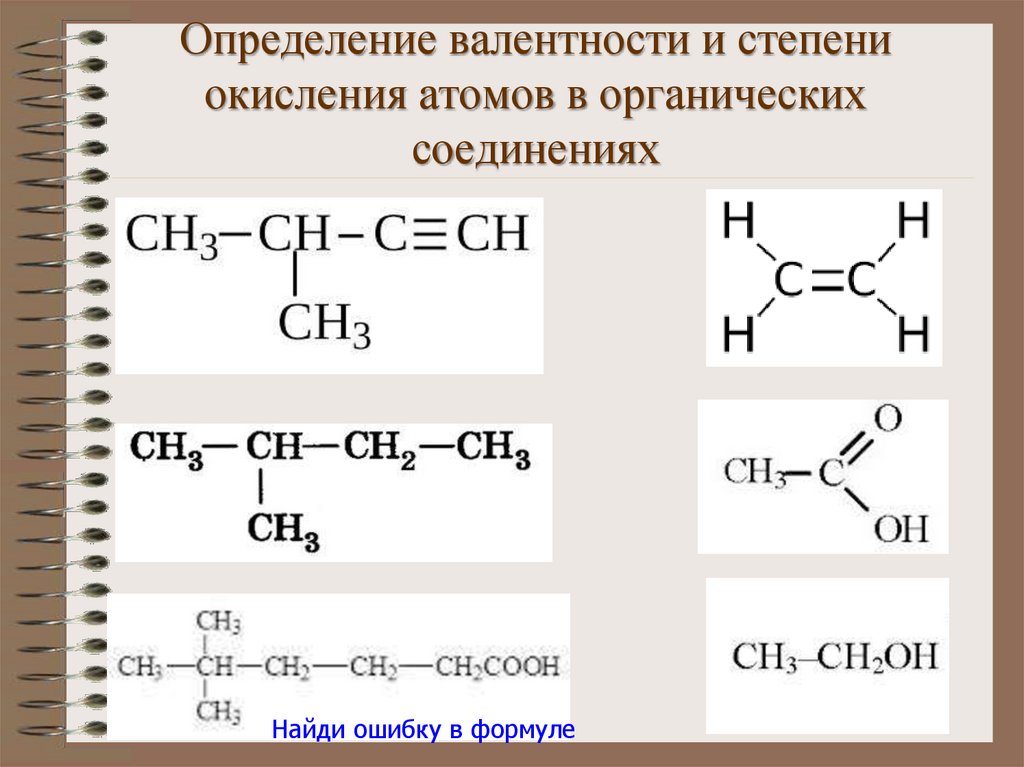
13. Определение валентности и степени окисления атомов в органических соединениях
Найди ошибку в формуле14.
1. Какими тремя факторами определяются валентные возможностиатомов химических элементов?
Валентные возможности атомов химических элементов определяются:
а) числом неспаренных электронов
б) наличием свободных орбиталей
в) наличием неподеленных пар электронов.
2. Почему максимальная валентность атомов элементов второго
периода не может быть больше четырех?
Максимальная валентность атомов элементов второго периода не может
превышать четырех, т.к. они не могут иметь более четырех неспаренных
электронов, при этом у них не остается ни одной свободной орбитали и
неподеленных пар электронов.
3. Укажите валентность и степень окисления атомов азота в ионе
аммония NH4+.
15.
4. Вспомните, чем отличаются понятия валентности и степениокисления. Что между ними общего?
Валентность — способность атома, иона или радикала образовывать
устойчивые химические связи с определенным количеством других частиц.
Степень окисления — условный заряд, который можно приписать атому,
исходя из предположения, что вся частица состоит из простых ионов.
Оба эти понятия имеют численное значение и характеризуют связи в частицах.
Часто валентность числено совпадает со
степенью окисления, но при этом значения
степени окисления всегда имеют еще и знак
заряда ("+" или "-")
5. Определите валентность и степень окисления атомов углерода в
веществах с формулами С2Н6, С2Н4, С2Н2.
Валентность атомов углерода во всех этих соединениях равна IV.
16.
6. Определите валентность и степень окисления атомов в веществах сформулами N2, NF3, NH3, Н2O2, OF2, O2F2.
17.
18.
19.
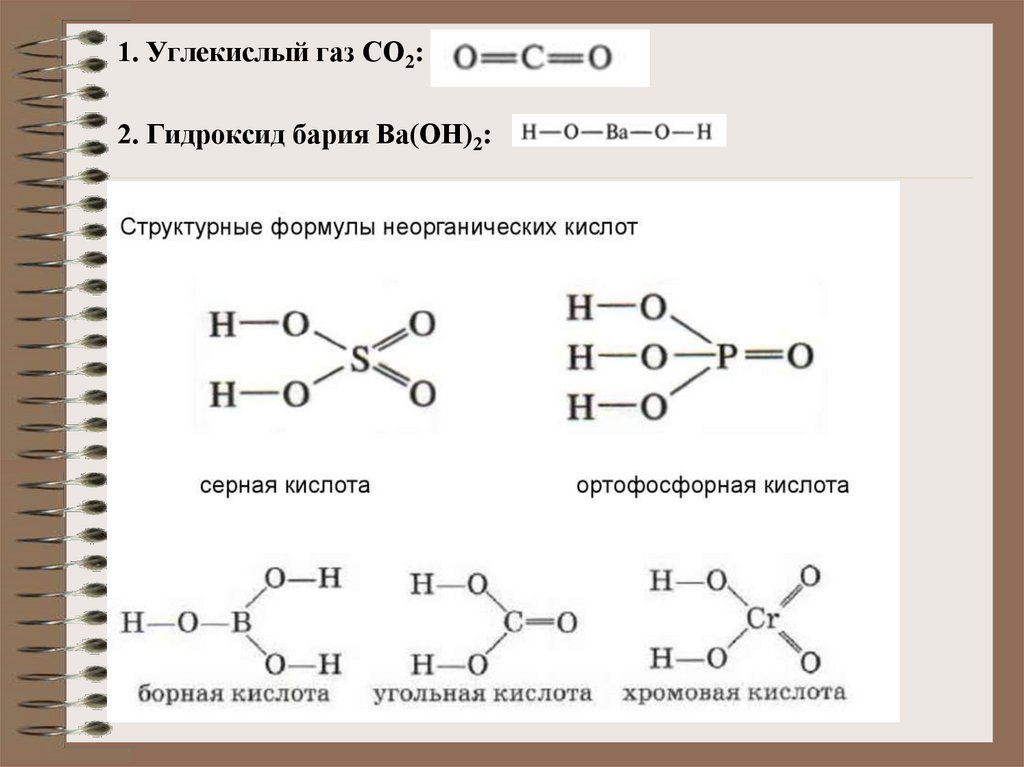
Составим теперь структурную формулу серной кислоты - H2SO4.По имеющимся данным можно составить пять "правильных"
структурных формул:
Чтобы выбрать из них действительно правильную, нам придется
вспомнить, что серная кислота - гидроксид, а из этого следует, что
все атомы водорода в ее молекуле связаны с атомами кислорода.
Отсюда правильная структурная формула серной кислоты:
20.
1. Углекислый газ СО2:2. Гидроксид бария Ва(ОН)2:
21.
22. Домашнее задание
•§4№ 12, стр.70, № 1-4 стр. 71














 chemistry
chemistry








