Similar presentations:
Ферменты. Доказательства белковой природы ферментов
1.
ФЕРМЕНТЫSvetlana Protopop
doctor în științe medicale,
conferențiar universitar
2.
Рекомендованная литература1. Северин Е.С. Биохимия. Учебник для
вузов, 2004, 2011
2. Тюкавкина Н.А. Биоорганическая химия,
2009
4. https://themedicalbiochemistrypage.org/
5. Лекционный материал
3.
• Фермент – от лат. «fermentum» – закваска(1877 год).
• Энзим – «еn zyme» – в дрожжах.
• Ферменты – биологические катализаторы
белковой природы.
4.
Доказательства белковой природыферментов
• При гидролизе распадаются на
аминокислоты.
• Подвергаются денатурации.
• Амфотерность.
• Электтрофоретическая подвижность.
• Имеют большую молекулярную массу.
• Неспособность к диализу.
• Получение ферментов в чистом виде.
5.
Методы изучения структурыферментов:
• Рентгеноструктурный анализ.
• Ядерно-магнитный резонанс (ЯМР).
• Электронно-парамагнитный резонанс (ЭПР).
6.
Сходства ферментов инебиологических катализаторов
• Катализируют только энергетически
возможные реакции.
• Не изменяют направления реакции.
• Не изменяют равновесия реакции.
• Не расходуются в процессе реакции.
7.
Ферменты снижают энергетическийбарьер химической реакции
8.
Отличительные свойства ферментовот небиологических катализаторов
• Скорость ферментативных реакций выше,
чем реакций, катализируемых небелковыми
катализаторами.
• Высокая специфичность действия.
• Катализируют реакции в «мягких» условиях.
• Активность ферментов регулируется.
9.
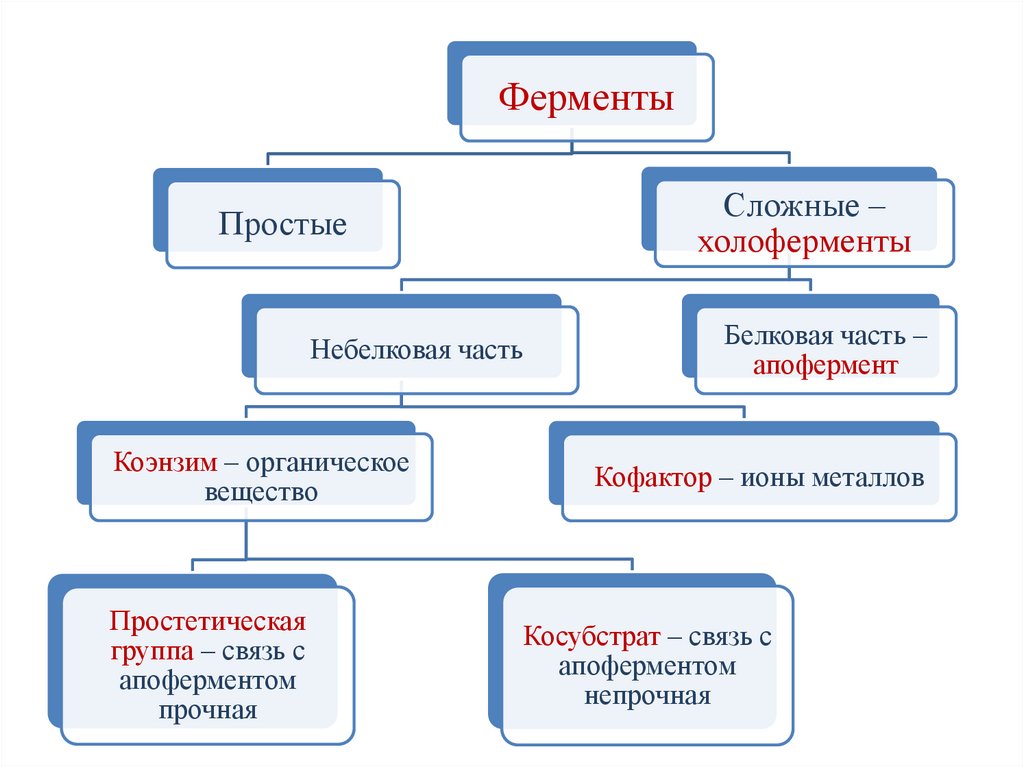
ФерментыСложные –
холоферменты
Простые
Небелковая часть
Коэнзим – органическое
вещество
Простетическая
группа – связь с
апоферментом
прочная
Белковая часть –
апофермент
Кофактор – ионы металлов
Косубстрат – связь с
апоферментом
непрочная
10.
Активный центр фермента• участок фермента, обеспечивающий
связывание субстрата и прямое участие в
акте катализа.
• Активный центр является
«пространственной структурой», т.е.
образуется при упаковке полипептидной
цепи в третичную структуру.
11.
Активный центр фермента• Активные центры простых ферментов состоят
из радикалов аминокислот:
• Ser, Thr, Tyr (–OH)
• Asp, Glu (–COO-)
• Lys (–NH3+)
• His (имидазолил)
• Cys (–SH)
• У сложных ферментов в состав активного
центра входят и коферменты.
12.
Активный центр ферментаВ активном центре условно различают:
• каталитический центр – непосредственно
вступает в химическое взаимодействие с
субстратом.
• связывающий центр (контактная
(≪якорная≫) площадка – обеспечивает
связывание субстрата.
13.
Аллостерический центр фермента• Другой центр, отличный от активного
центра.
• Является регуляторным центром фермента.
• К аллостерическим центрам
присоединяются аллостерические
модуляторы (активаторы и ингибиторы).
14.
Роль металлов вферментативных реакциях
15.
1. Присоединение субстрата вактивном центре фермента
Стабилизация молекулы субстрата
(субстратом для киназ является Mg2+-ATP)
– Е- S-Ме
Стабилизация активного центра фермента
(служат «мостиком» между ферментом и
субстратом – металлоферменты – Mg2+ в
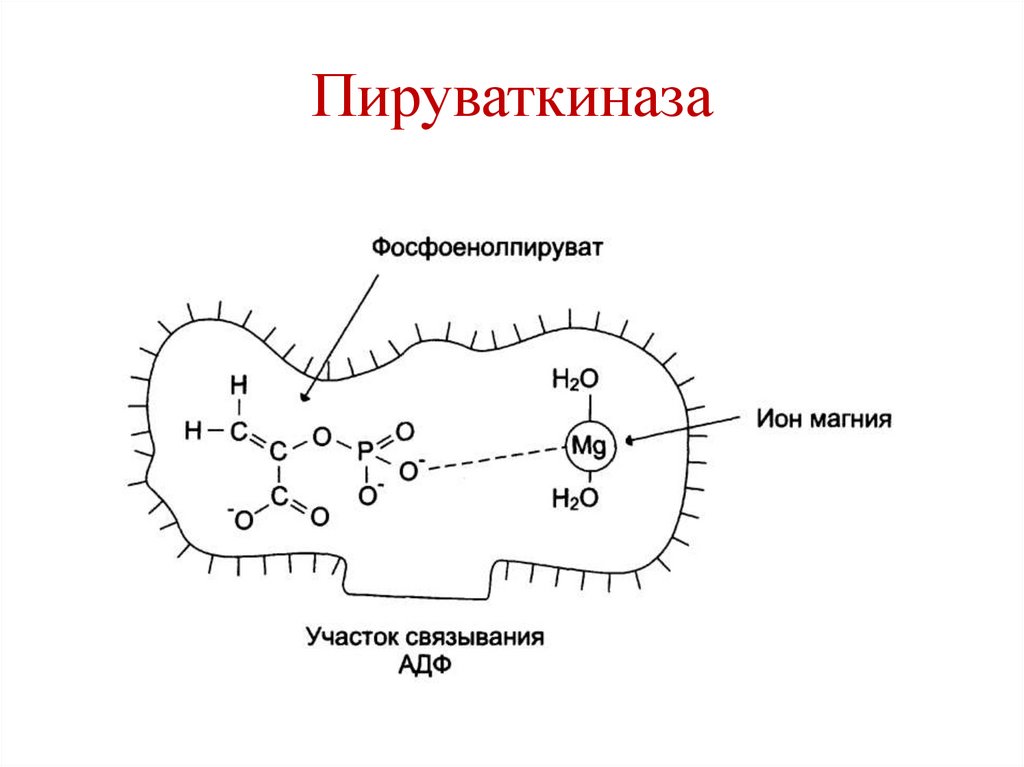
пируваткиназе) – Е-Ме-S
16.
Гексокиназа17.
Пируваткиназа18.
2. Стабилизация конформациифермента
К+ – стабилизация третичной структуры
пируваткиназы.
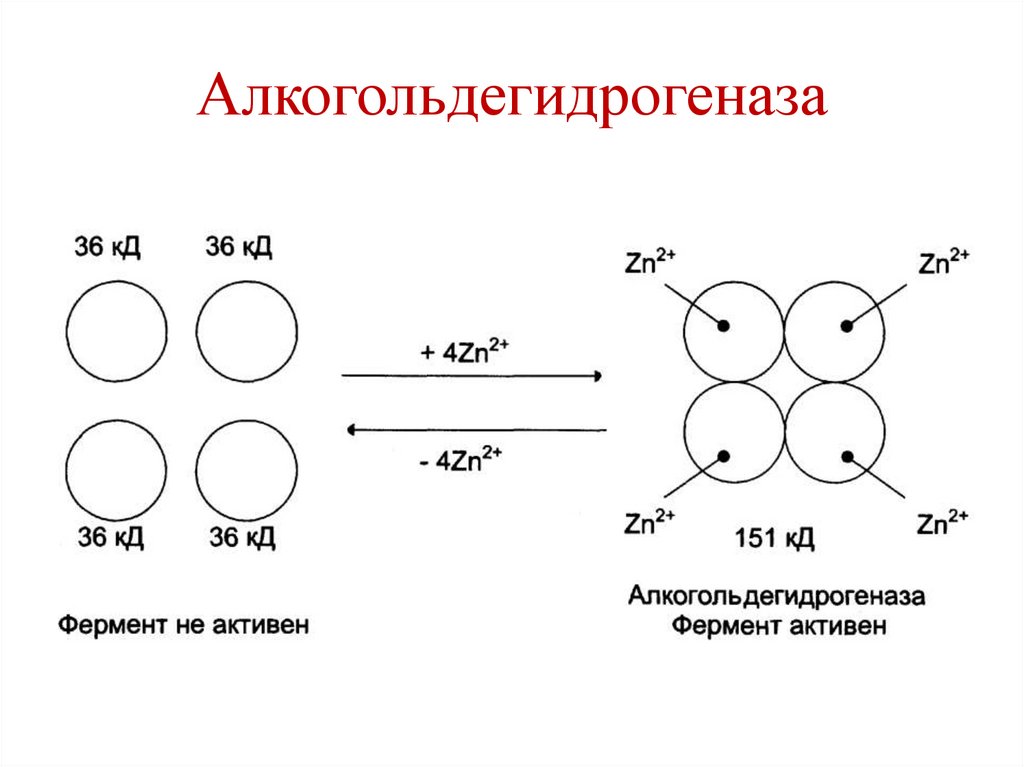
Zn2+ – стабилизация четвертичной
структуры алкогольдегидрогеназы.
19.
Алкогольдегидрогеназа20.
3. Непосредственно участвуют вферментативном катализе
Электрофильный катализ (карбоангидраза
– Zn2+).
Окислительно-восстановительные реакции
(цитохромы – железо).
21.
КарбоангидразаЦитохромы
22.
4. Регуляция активностиферментов
Са2+ является активатором протеинкиназы
С, кальций-кальмодулинзависимых
ферментов.
23.
Коферменты (коэнзимы)Витамины – биотин, витамин С
Производные витаминов – тиаминпирофосфат, пиридоксаль-фосфат
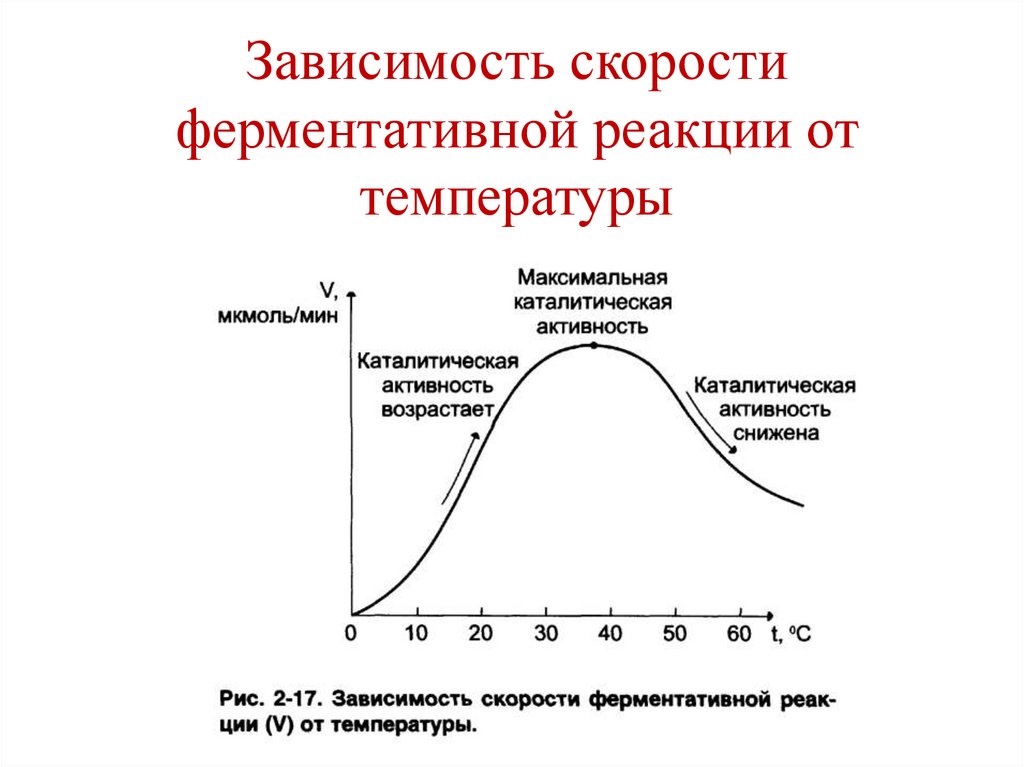
Нуклеотиды – FAD, NAD+
Порфирины – гем
Пептиды – глутатион
24.
Роль витаминов в качествекоферментов
• Витамин В1 (тиамин)
• Витамин В2 (рибофлавин)
• Витамин РР (витамин В3)
• Витамин В6
• Пантотеновая кислота (витамин В5)
• Биотин (витамин Н)
• Фолиевая кислота (витамин Вс, витамин В9)
• Аскорбиновая кислота (витамин С)
25.
Витамин В1 (тиамин)NH2
N
H3C
CH2
N
Пиримидиновое кольцо
N
S
CH3
CH2
CH2OH
Тиазоловое кольцо
26.
Кофермент витамина В1:тиаминпирофосфат (ТРР)
NH2
N
H3C
CH2
N
N
S
CH3
CH2
CH2
O
O
P
OH
O
O
P OH
OH
27.
Метаболическая роль ТРР:• Реакции окислительного
декарбоксилирования альфа-кетокислот
(пируват, альфа-кетоглутарат, альфакетобутират);
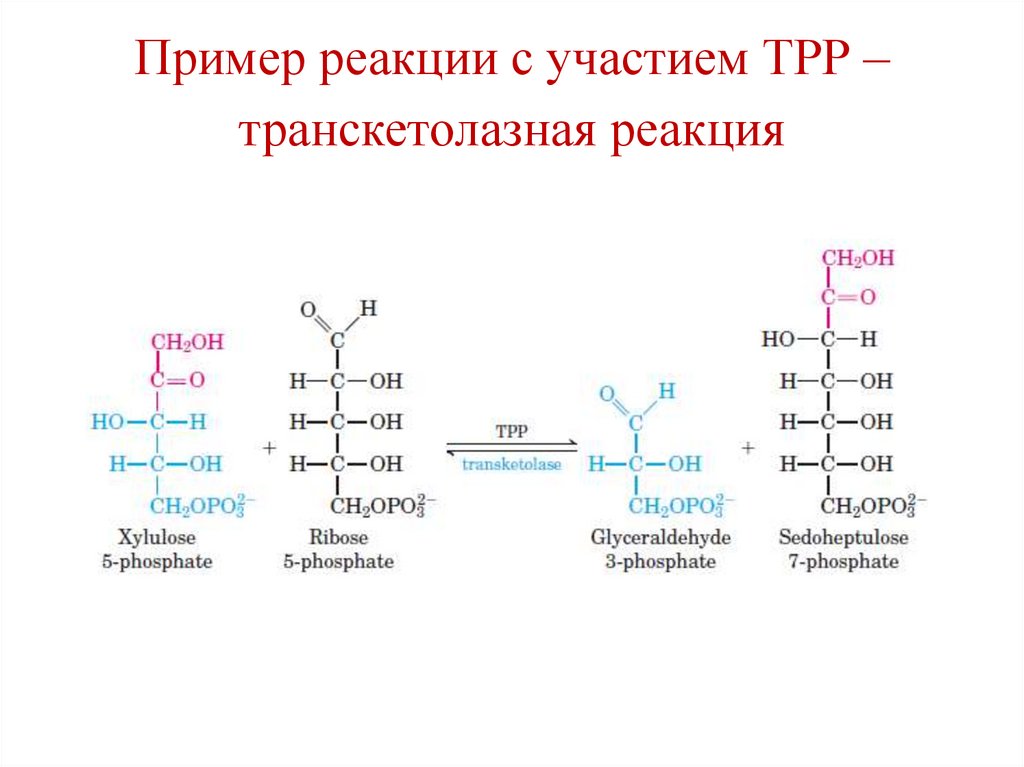
• Транскетолазные реакции (реакции
второго этапа пентозофосфатного пути
окисления глюкозы).
28.
Пример реакции с участием ТРР – реакциядекарбоксилирования пирувата
O
CH3 C COOH
O
CH3 C
H
+ CO2
29.
Механизм реакции декарбоксилированияпирувата с участием ТРР
30.
Пример реакции с участием ТРР –транскетолазная реакция
31.
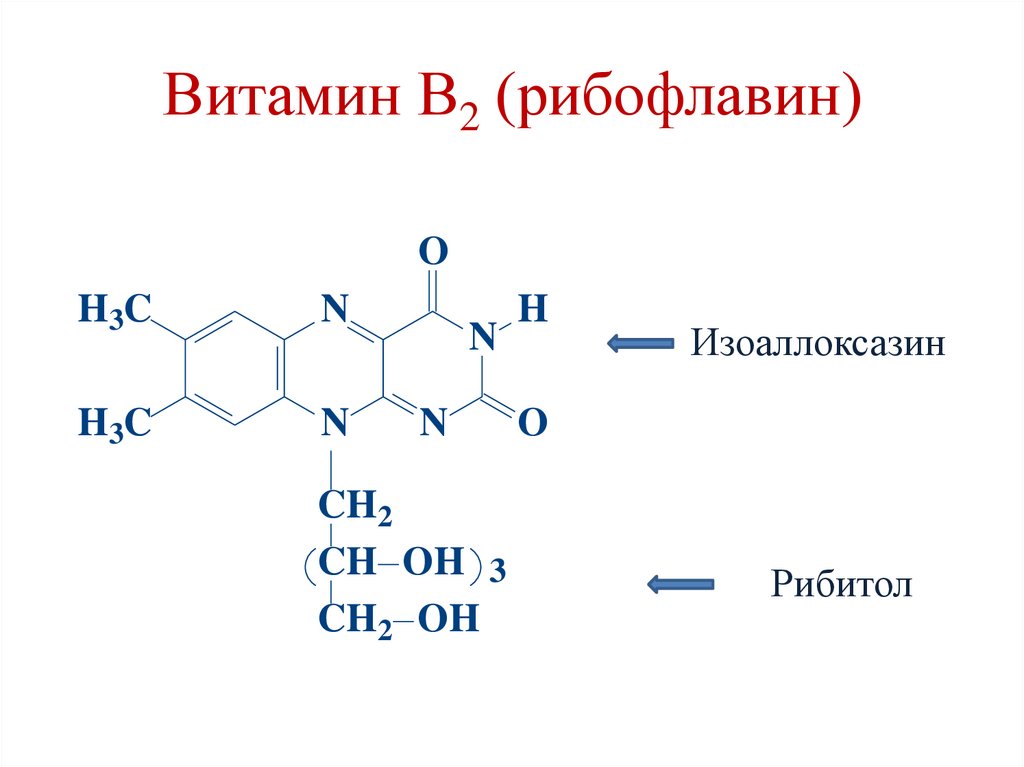
Витамин В2 (рибофлавин)O
H3C
N
H3C
N
N
N
CH2
CH OH 3
CH2 OH
H
Изоаллоксазин
O
Рибитол
32.
Кофермент витамина В2:FMN (флавин мононуклеотид)
O
H3C
N
H3C
N
N
N
CH2
CH OH 3
CH2
O
HO
P
OH
O
H
O
33.
OH3C
N
H3C
N
N
H
O
CH2
CH OH 3
CH2
Кофермент
витамина В2:
FAD (флавин аденин
динуклеотид)
N
O
HO
P
O
O
HO
P
O
NH2
O
N
CH2
OH
O
N
OH
N
N
34.
Метаболическая роль FMN и FAD:окислительно-восстановительные реакции
O
H3C
N
N
SH2 +
H3C
N
N
H
+2H+, +2e-
O
H3C
H
N
H3C
N
N
H
N
S +
O
-2H+, -2e-
R
R
FAD (FMN)
окисленная форма
O
FADH2 (FMNH2)
восстановленная форма
Фермент – дегидрогеназа
SH2 + FAD
H
S + FADH2
35.
Пример реакции с участием FADCOOH
COOH
CH2
CH
FAD
CH2
HC
COOH
COOH
Сукцинат
Фумарат
FADH2
Фермент – сукцинатдегидрогеназа
36.
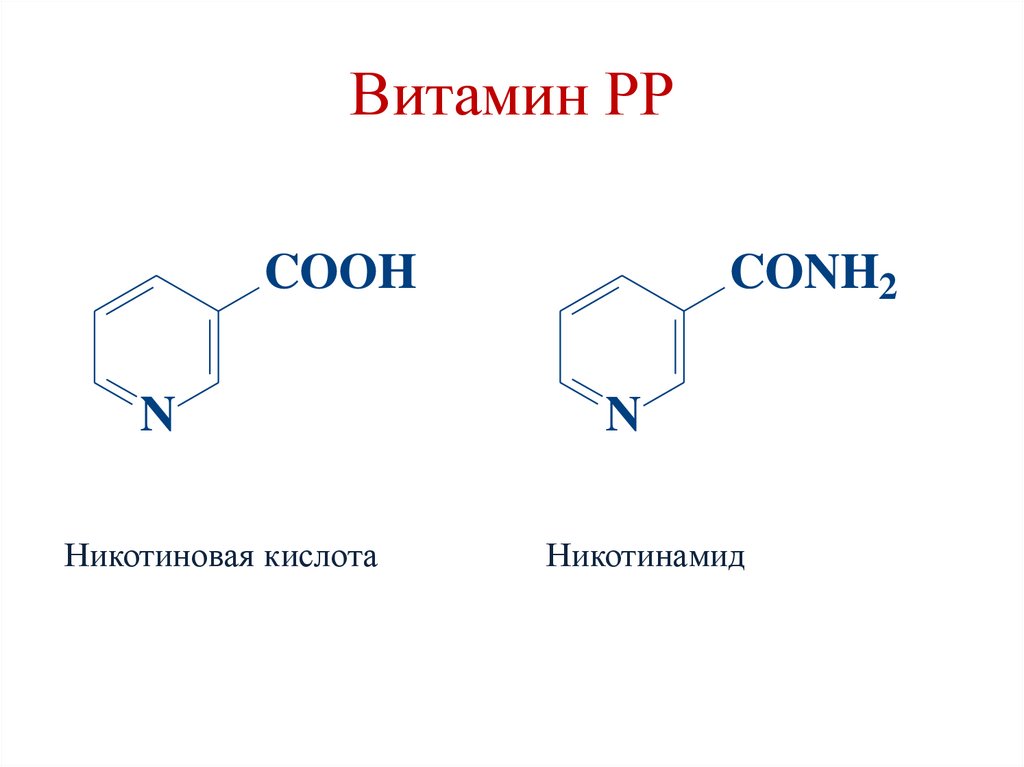
Витамин РРCONH2
COOH
N
Никотиновая кислота
N
Никотинамид
37.
Кофермент витамина РР:NAD+ (никотинамид аденин динуклеотид)
H
CONH2
CH2
O
HO
P
O
O
N
O
HO
P
O
O
OH
OH
NH2
CH2
N
O
OH
N
OH
N
N
38.
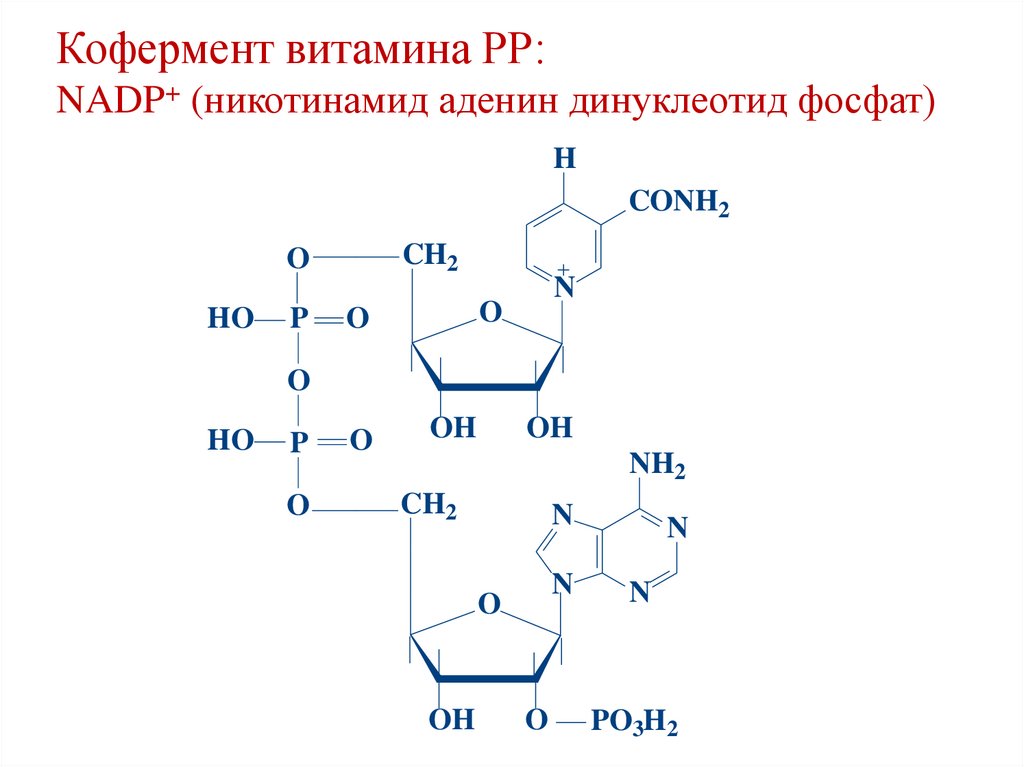
Кофермент витамина РР:NADP+ (никотинамид аденин динуклеотид фосфат)
H
CONH2
CH2
O
HO
P
N
O
O
O
HO
P
O
O
OH
OH
NH2
CH2
N
N
O
OH
O
N
N
PO3H2
39.
Метаболическая роль NAD+ и NADP+:окислительно-восстановительные реакции
H
CONH2
SH2 +
H
H
CONH2
+2H+, +2e-
+ H+
S +
N
N
-2H+, -2e-
R
R
NAD+ (NADP+)
окисленная форма
NADH+H+ (NADPH+H+)
восстановленная форма
Фермент – дегидрогеназа
SH2 + NAD+
S + NADH+H+
Фермент – редуктаза
S + NADPH+H+
SH2 + NADP+
40.
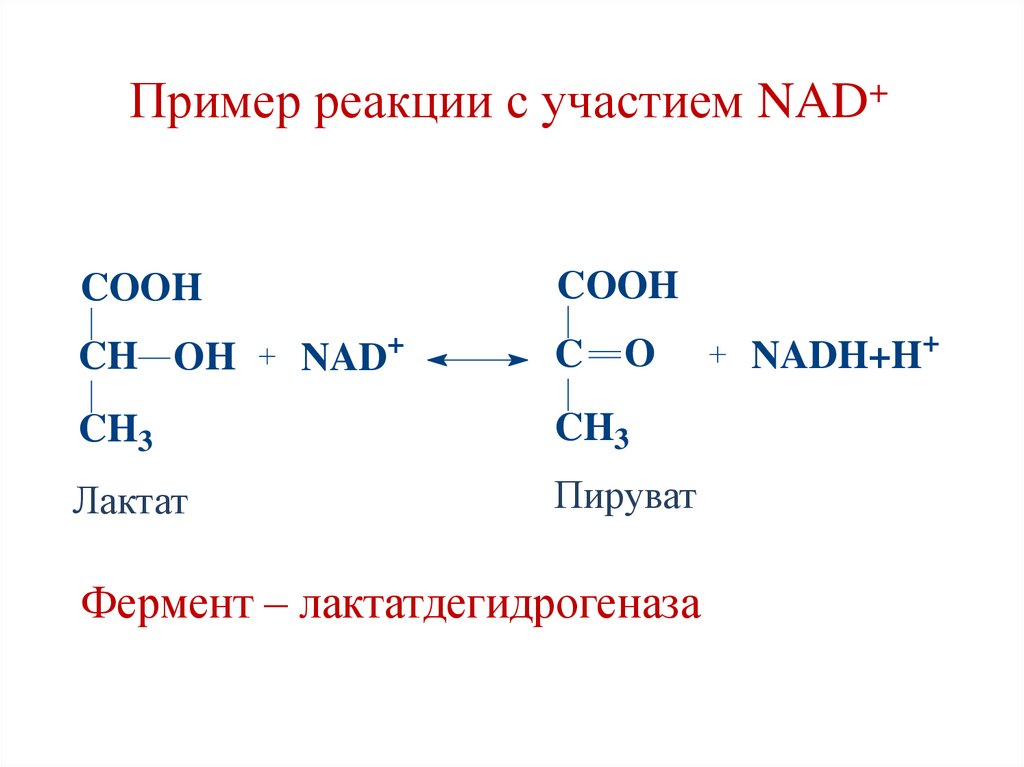
Пример реакции с участием NAD+COOH
COOH
CH OH
+
NAD
C
O
CH3
CH3
Лактат
Пируват
Фермент – лактатдегидрогеназа
NADH+H+
41.
Витамин В6HO
CH2OH
CH2OH
HO
H3C
N
H3C
Пиридоксин
(Пиридоксол)
COH
CH2OH
N
Пиридоксаль
HO
CH2NH2
CH2OH
H3C
N
Пиридоксамин
42.
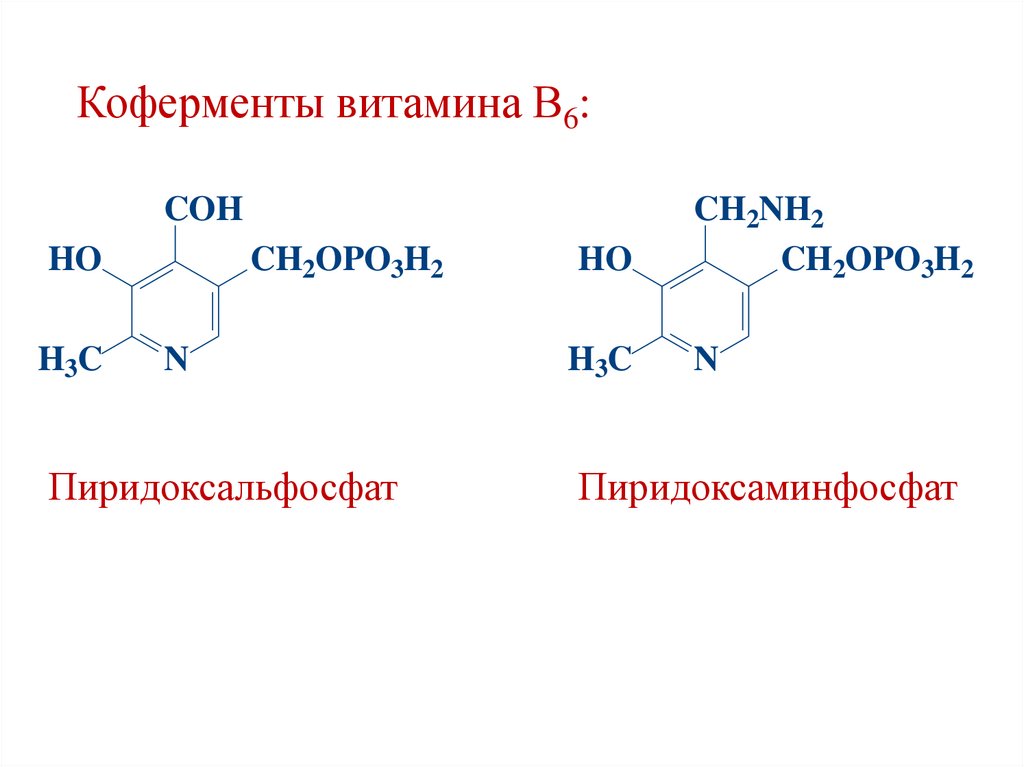
Коферменты витамина В6:COH
HO
H3C
CH2OPO3H2
N
Пиридоксальфосфат
HO
CH2NH2
CH2OPO3H2
H3C
N
Пиридоксаминфосфат
43.
Метаболическая роль:• Трансаминирование аминокислот;
• Дезаминирование аминокислот;
• Декарбоксилирование аминокислот;
• Транссульфурирование аминокислот.
44.
Пример реакции с участием пиридоксальфосфата– трансаминирование аминокислот
COOH
COOH
CH NH2 + C O
CH3
CH2
CH2
COOH
Аланин
α-кетоглутарат
COOH
C O
+
CH3
Пируват
COOH
CH NH2
CH2
CH2
COOH
Глутаминовая
кислота
Фермент – аланинаминотрансфераза
45.
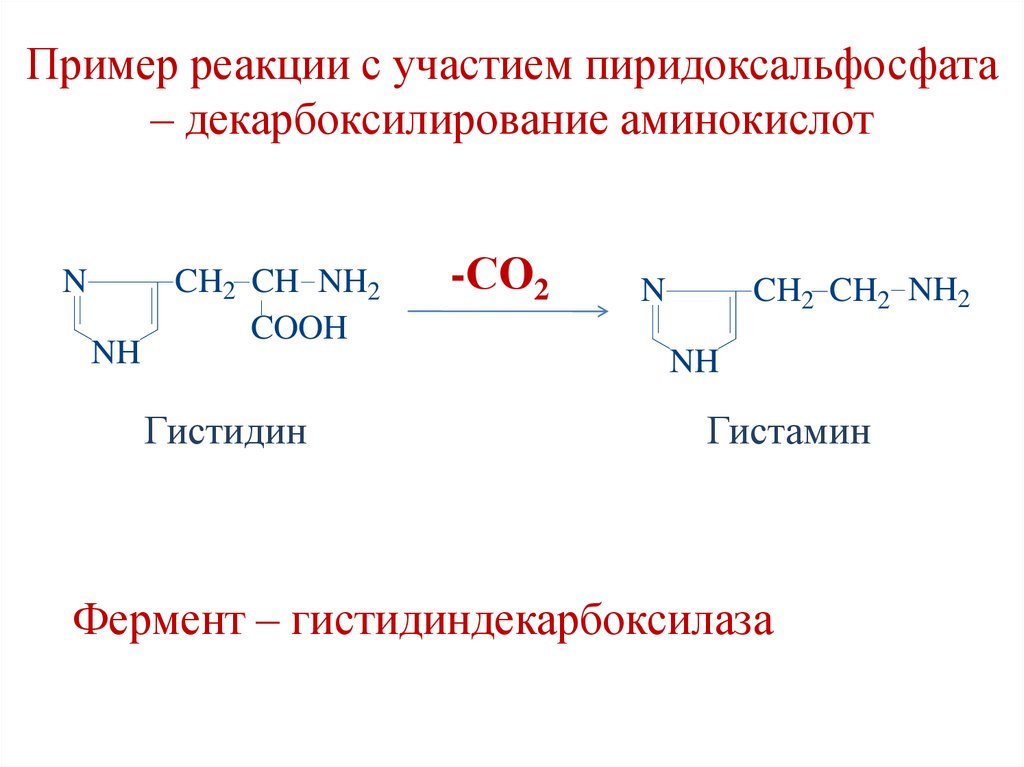
Пример реакции с участием пиридоксальфосфата– декарбоксилирование аминокислот
N
NH
CH2 CH NH2
COOH
-СО2
CH2 CH2 NH2
N
NH
Гистидин
Гистамин
Фермент – гистидиндекарбоксилаза
46.
Пантотеновая кислота (витамин В5)H3C
HO CH2
C CH C NH CH2
CH2
H3C OH O
2.4-дигидрокси-3,3-диметилмасляная кислота
β-аланин
COOH
47.
Кофермент пантотеновой кислоты:4-фосфопантотеин
H3C
O
O-
P O CH2
O-
C CH C NH CH2
CH2
CO NH CH2
CH2
SH
H3C OH O
Пантотеновая кислота
Тиоэтиламин
Метаболическая роль:
Фосфопантотеин является коферментом
пальмитатсинтазы.
48.
Кофермент пантотеновой кислоты:Коэнзим А (СоА-SH)
NH2
N
N
N
N
CH2
O
OH
O
H3C
O
O
P O
P O CH2
O-
O-
C CH C NH CH2
CH2
CO NH CH2
CH2
SH
H3C OH O
OPO32-
Пантотеновая кислота
Тиоэтиламин
Метаболическая роль:
Коэнзим А участвует в активации жирных
кислот и переносе ацильных радикалов.
49.
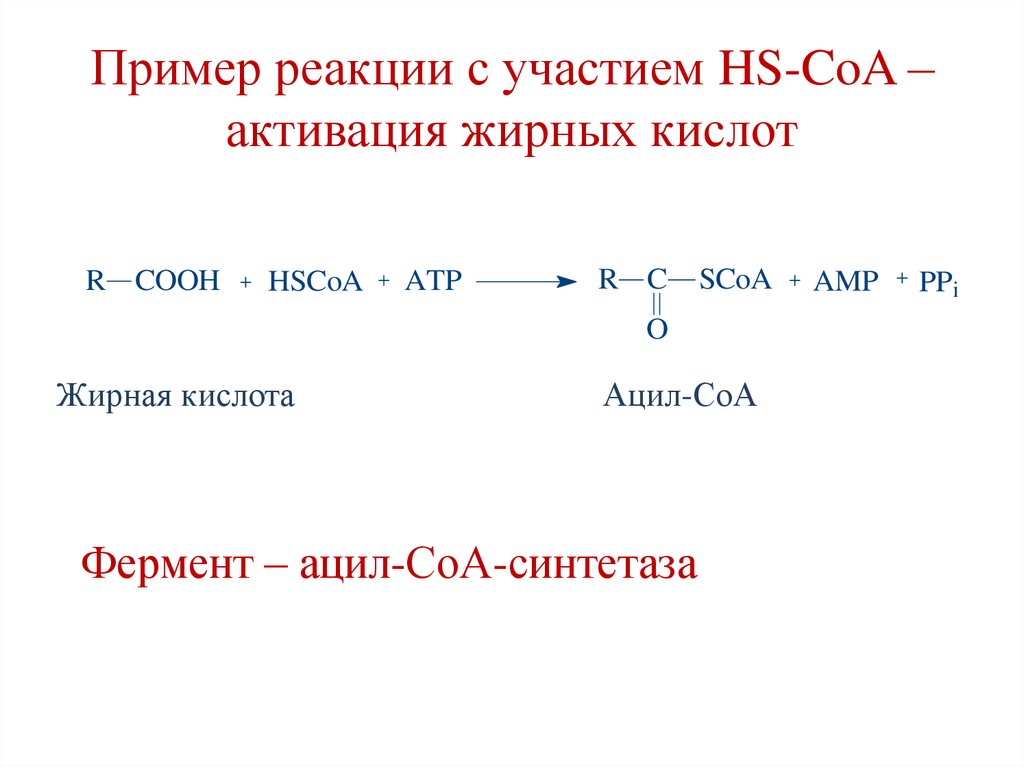
Пример реакции с участием HS-CoA –активация жирных кислот
R COOH
HSCoA
ATP
R C
SCoA
O
Жирная кислота
Ацил-СоА
Фермент – ацил-СоА-синтетаза
AMP
PPi
50.
Пример реакции с участием HS-CoA –ацилтрансферазная реакция
O
CH2 O C R
O
CH O C R
+
CH2 OH
Диацилглицерол
R CO SCoA
Ацил-СоА
O
CH2 O C R
O
CH O C R
O
CH2 O C R
+
HSCoA
Триацилглицерол
Фермент – диацилглицерол-ацил-СоА-трансфераза
51.
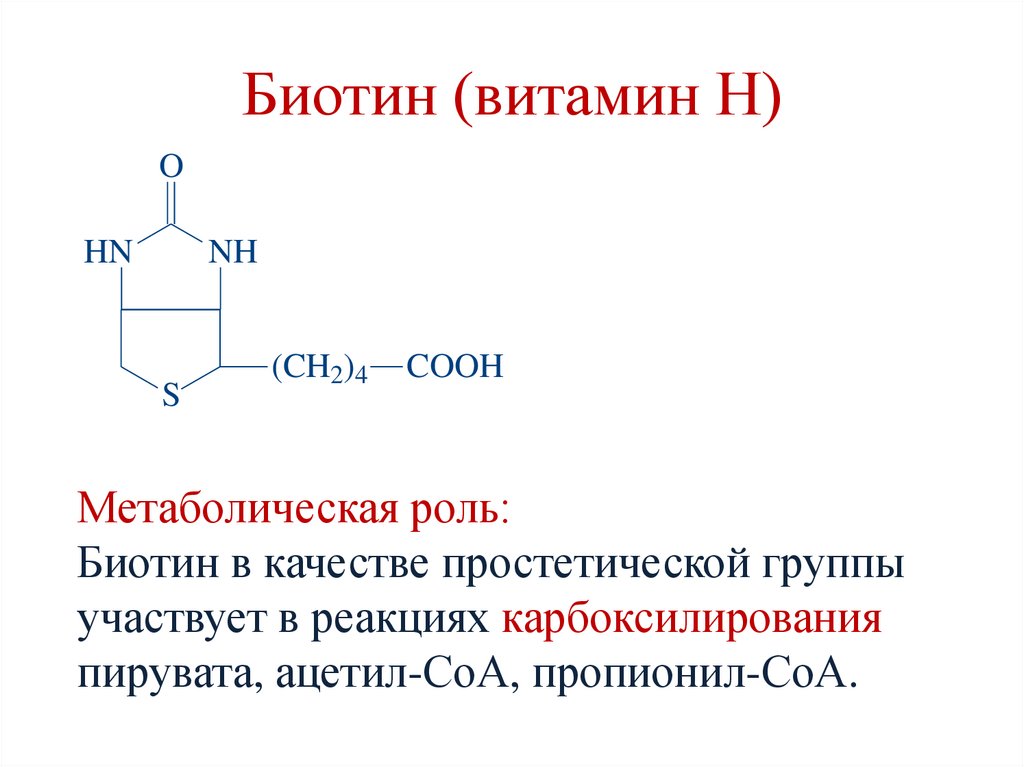
Биотин (витамин Н)O
HN
NH
S
(CH2)4
COOH
Метаболическая роль:
Биотин в качестве простетической группы
участвует в реакциях карбоксилирования
пирувата, ацетил-СоА, пропионил-СоА.
52.
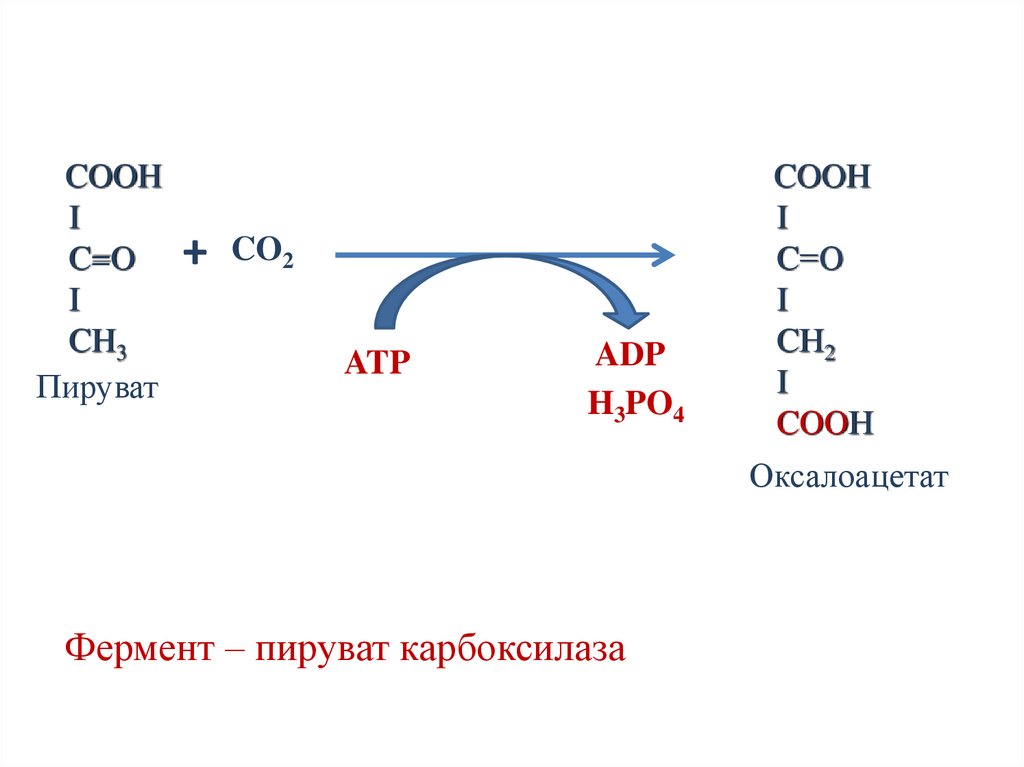
Пример реакции с участиембиотина
COOH
C
O
CH3
Пируват
COOH
CO2
ATP
C
O
ADP
CH2
COOH
Оксалоацетат
Фермент – пируваткарбоксилаза
H3PO4
53.
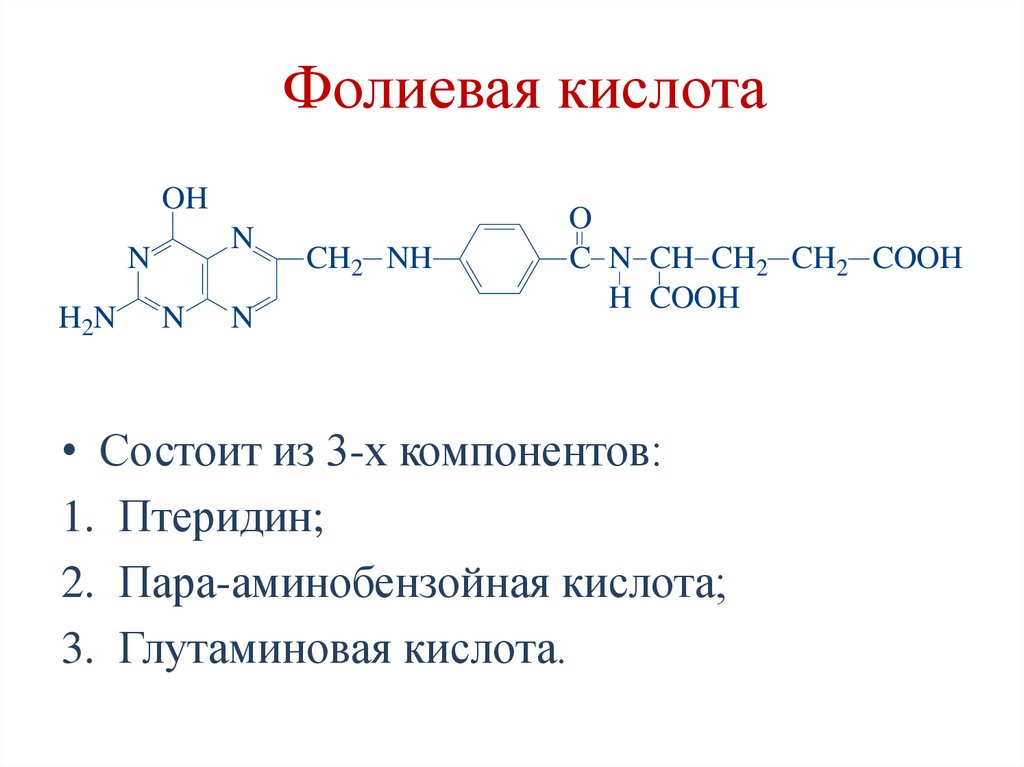
Фолиевая кислотаOH
N
N
H2N
N
N
CH2 NH
O
C N CH CH2 CH2 COOH
H COOH
• Состоит из 3-х компонентов:
1. Птеридин;
2. Пара-аминобензойная кислота;
3. Глутаминовая кислота.
54.
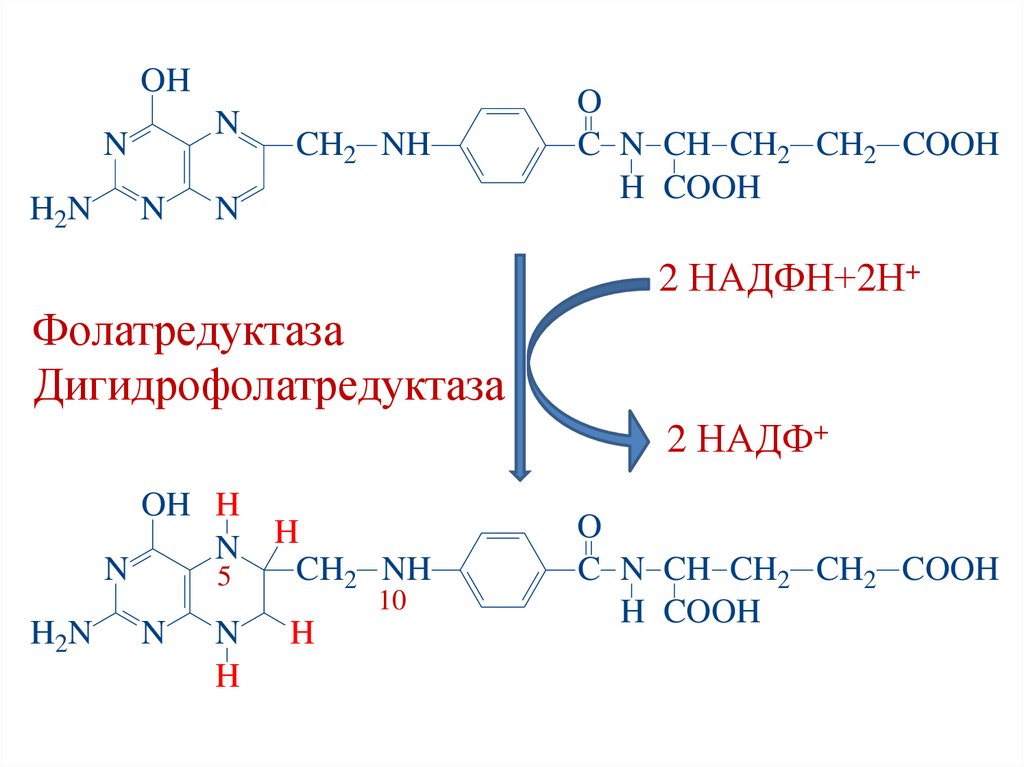
Кофермент фолиевой кислоты:Тетрагидрофолиевая кислота (ТГФК)
• Образуется из фолиевой кислоты в ходе 2-х
реакций восстановления (в печени) под действием
ферментов:
1. Фолатредуктаза;
2. Дигидрофолатредуктаза.
3. Кофермент – НАДФН.
ФК
1
НАДФН+Н+
ДГФК
2
НАДФ+ НАДФН+Н+
ТГФК
НАДФ+
55.
OHN
N
H2N
N
CH2 NH
N
O
C N CH CH2 CH2 COOH
H COOH
2 НАДФН+2Н+
Фолатредуктаза
Дигидрофолатредуктаза
2 НАДФ+
OH H
N H
N
CH2 NH
5
10
H2N
N
N
H
H
O
C N CH CH2 CH2 COOH
H COOH
56.
Метаболическая роль ТГФКявляется переносчиком одноуглеродных
фрагментов :
–СН3 (метил);
– СОН
(формил);
–СН2– (метилен); – СН=NH (формимино).
–СН= (метенил);
В качестве донора или акцептора
вышеуказанных групп, ТГФК участвует в
обмене аминокислот и нуклеотидов.
Одноуглеродные фрагменты связываются к
N5 и/или N10 ТГФК.
57.
Производные ТГФКOH H
N H
N
CH2 NH
5
10
H2N
N
N
H
H
CH2
N
5
CH2 N
10
N5,N10-CH2-THF
O
C N CH CH2 CH2 COOH
H COOH
CH3
N
5
CH2
H
N
10
N5-CH3-THF
58.
Пример реакции с участием ТГФКCH2 OH
CH NH2
COOH
CH2 NH2
H
O
2
COOH +
Gly
Ser
THF
N5,N10-CH2-THF
Фермент – серин гидроксиметил трансфераза
59.
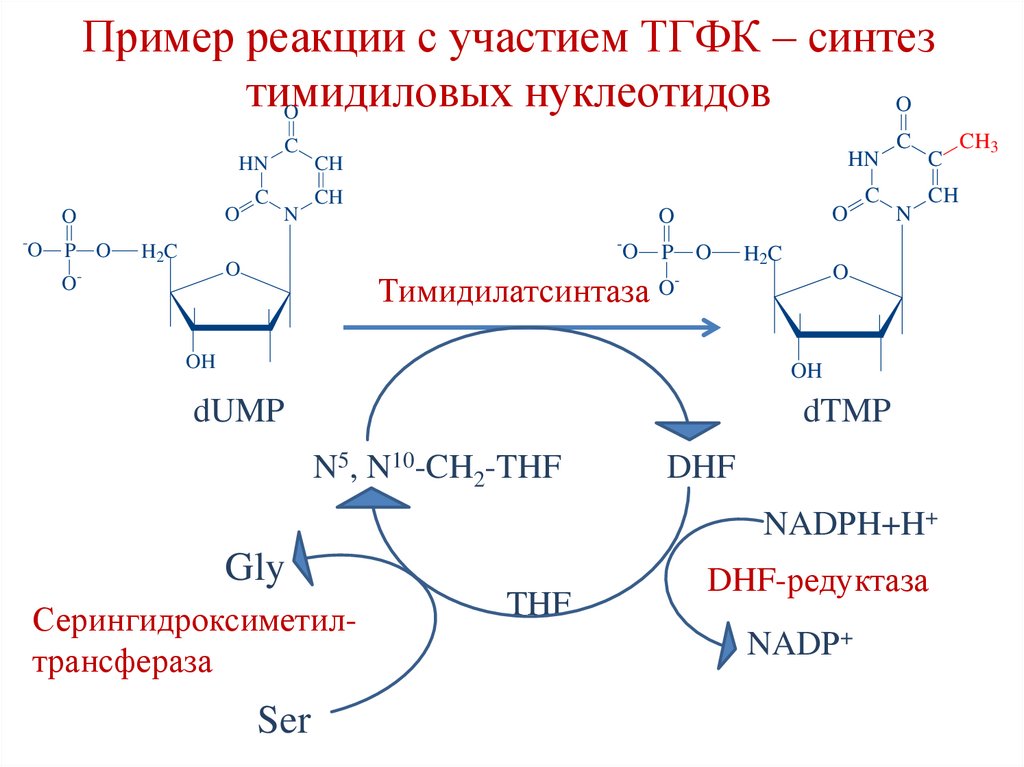
Пример реакции с участием ТГФК – синтезтимидиловых
нуклеотидов
O
O
C
HN
O
O
-
O
P O
C
N
CH
HN
CH
C
-
H 2C
O
O-
O
O
O
P O
H 2C
N
C
CH
O
Тимидилатсинтаза O-
OH
OH
dUMP
dTMP
N5, N10-CH2-THF
C
DHF
NADРH+H+
Gly
Серингидроксиметилтрансфераза
Ser
THF
DHF-редуктаза
NADР+
CH3
60.
Аскорбиновая кислота (витамин С)O
C
HO
C
HO
C O
HC
HO
CH
CH2 OH
Аскорбиновая кислота
O
C
- 2Н
O C
+ 2Н
O C O
HC
HO
CH
CH2 OH
Дегидроаскорбиновая кислота
61.
Витамин С:Метаболическая роль:
Реакции восстановления:
• Fe3+ → Fe2+ (при всасывании железа);
• Метгемоглобин → гемоглобин;
Реакции гидроксилирования:
• Пpолин → гидроксипролин;
• Лизин → гидроксилизин.
62.
Пример реакции с участиемвитамина С – реакция гидроксилирования пролина
OH
O
COOH
C N
CH2
H
C N
O
Радикал Pro в составе
полипептидной цепи
коллагена
O2
O
COOH
C N
CH2
H
CH2
C O
COOH
C N
O
Радикал 4-Hyp
Фермент – пролилгидроксилаза
Participarea vitaminei?????
CH2
COOH
CO2
63.
Витамин К (антигеморрагический);нафтохиноны
• Производные хинонов с боковыми
изопреноидными цепями.
• Витамин K1 (филлохинон) – растительный.
• Витамин К2 (менахинон) – в растениях и в
организме животных.
• За открытие антигеморрагического
действия витамина К Э. Дойзи и X. Дам
удостоены Нобелевской премии в 1943 г.
64.
Витамин К (антигеморрагический);нафтохиноны
65.
Метаболическая роль витамина К• Витамин К является коферментом карбоксилазы
глутаминовой кислоты из состава
Са2+-связывающих белков (Gla-белки):
• Кальмодулин;
• Кальций-переносящий белок энтероцитов
(кальбиндин);
• Коллаген;
• Факторы свертывания крови (II, VII, IX, X);
• Са2+-АТФ-аза.
В ходе карбоксилирования образуется γкарбоксиглутаминовая кислота (Gla).
66.
Метаболическая роль витамина КРеакция карбоксилирования глутаминовой кислоты
в составе Са2+-связывающих белков (Gla-белки):
COO-
COO-
CH2
CH COO
O
CH2
H
C
CH
N
N
H
C
O
+ CO2
O
CH2
H
C
CH
N
N
H
C
O
67.
Биологическая роль витамина К68.
69.
Антивитамины Кдикумарол
салициловая
кислота
варфарин
Конкурентные ингибиторы тромбообразования.
Являются непрямыми антикоагулянтами.
Используют для лечения болезней, характеризующихся
повышенной свертываемостью крови (коронарные
тромбозы, тромбофлебиты).
70.
Гиповитаминоз К• Встречается редко (пища богата витамином К и он
синтезируется кишечной микрофлорой).
• Развивается обычно при нарушении процесса
всасывания жиров в кишечнике.
• Самопроизвольные паренхиматозные и
капиллярные кровотечения (носовые кровотечения,
внутренние кровоизлияния).
• Поражения сосудов (включая хирургические
операции) могут привести к обильным
кровотечениям.
• У детей грудного возраста часто возникают
обильные подкожные кровотечения и
кровоизлияния (геморрагический диатез),
являющийся следствием недостаточности
свертывания крови у матери.
71.
Классификация и номенклатураферментов
Рабочее название:
• Название субстрата + суффикс «аза»
(уреаза, липаза, нуклеаза) или
• название химического превращения
субстрата + «аза» (лактатдегидрогеназа,
пируваткарбоксилаза).
Систематическая номенклатура:
• учитывает тип катализируемой реакции.
72.
Классификация ферментовВ зависимости от типа химической реакции –
7 классов ферментов:
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы (синтетазы)
7. Транслоказы
73.
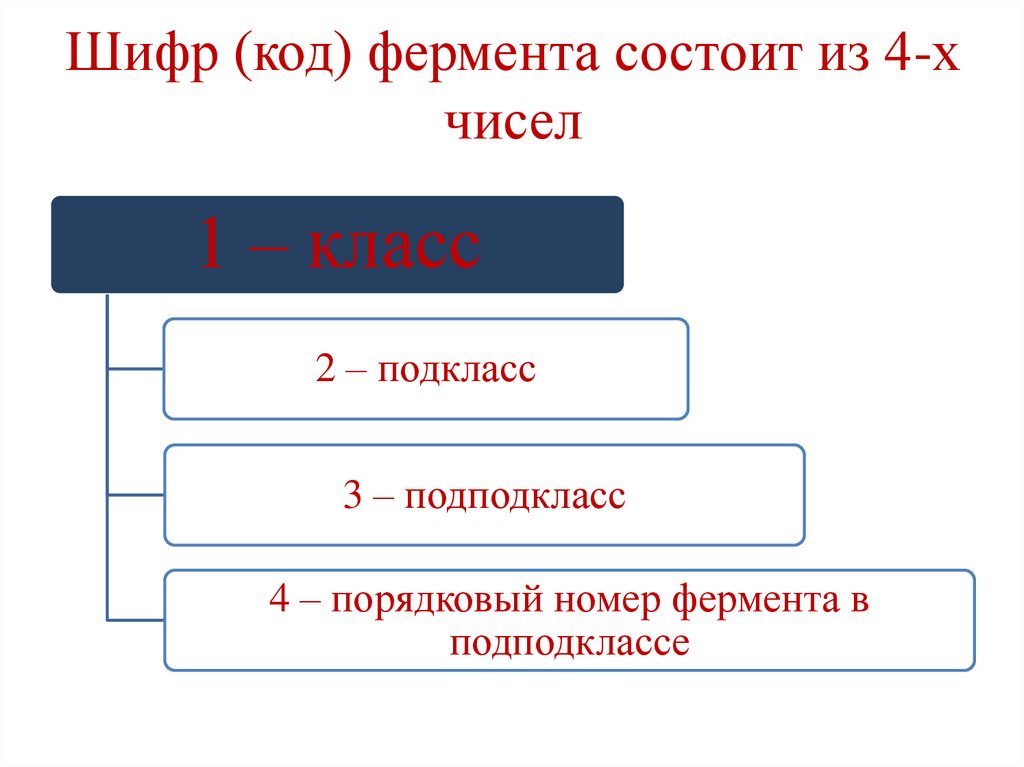
Шифр (код) фермента состоит из 4-хчисел
1 – класс
2 – подкласс
3 – подподкласс
4 – порядковый номер фермента в
подподклассе
74.
1. Оксидоредуктазы• катализируют окислительновосстановительные реакции.
• 23 подкласса (в зависимости от химической
природы донора или акцептора электронов).
Систематическое название – донор:акцептороксидоредуктаза.
Рабочее название –
субстрат-подкласс оксидоредуктаз.
75.
ОксидоредуктазыПримеры:
• Дегидрогеназы AH2 + B → A + BH2
• Редуктазы
A + BH2 → AH2 + B
• Оксидазы
AH2 + ½O2 → A + H2O
AH2 + O2 → A + H2O2
• Монооксигеназы (гидроксилазы)
AH + O2 + BH2 → A-OH + B + H2O
76.
COOHI
CH-OH
I
CH2
I
CООН
NAD+
NADH+H+
Малат
Фермент – малат дегидрогеназа
COOH
I
C=O
I
CH2
I
CООН
Оксалоацетат
77.
2. Трансферазы• Катализируют перенос функциональных
групп от одного субстрата-донора к
другому субстрату-акцептору.
• 9 подклассов (в зависимости от
транспортируемой группы).
Систематическое название – донор:акцептортранспортируемая группа-трансфераза.
Рабочее название –
донор (или акцептор)-транспортируемая
группа-трансфераза.
78.
ТрансферазыОбщая схема реакции, катализируемой
трансферазами:
А-Х + В ↔ А + В-Х
Примеры:
• Аминотрансферазы
• Ацилтрансферазы
• Метилтрансферазы
• Киназы (фосфотрансферазы)
79.
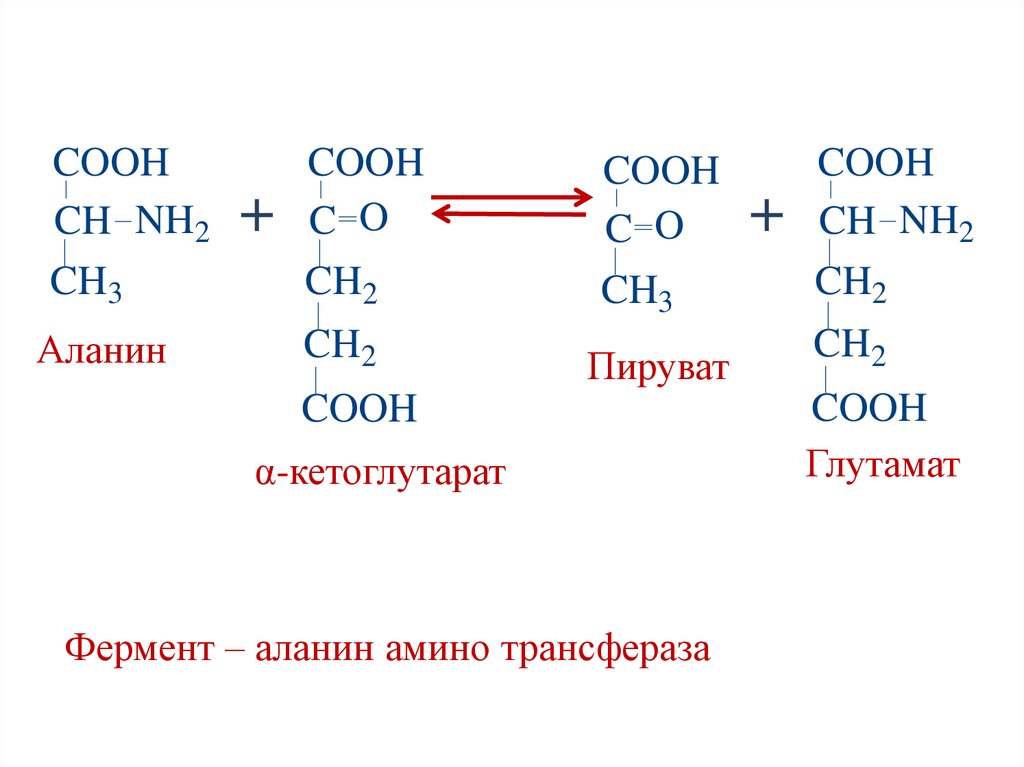
COOHCH NH2
CH3
Аланин
+
COOH
C O
CH2
CH2
CH3
COOH
CH NH2
CH2
Пируват
CH2
COOH
C O
COOH
α-кетоглутарат
Фермент – аланин амино трансфераза
+
COOH
Глутамат
80.
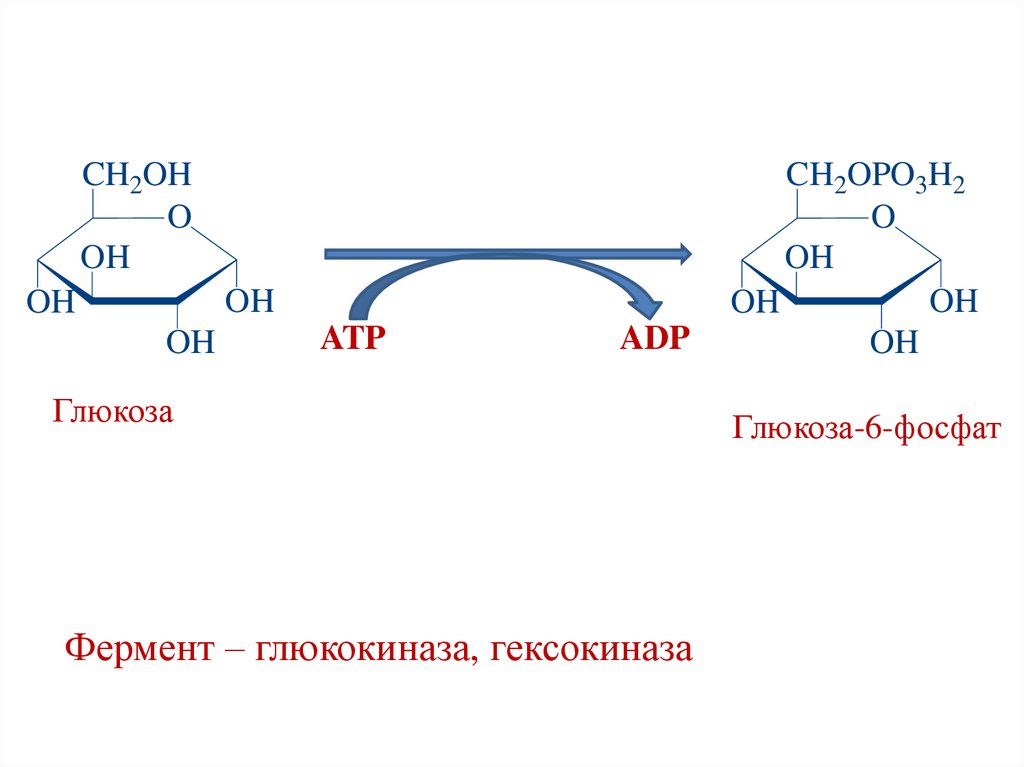
CH2OHO
OH
OH
OH
OH
ATP
ADP
Глюкоза
Фермент – глюкокиназа, гексокиназа
CH2OPO3H2
O
OH
OH
OH
OH
Глюкоза-6-фосфат
81.
3. Гидролазы• Катализируют реакции гидролиза
(расщепление ковалентных связей с
присоединением воды по месту разрыва).
• 13 подклассов (в зависимости от
расщепленной химической связи или
химического соединения).
• название – субстрат-гидролаза или
субстрат-аза.
82.
ГидролазыОбщая схема реакции, катализируемой
гидролазами:
А-В +НОН →А-ОН + Н-В
Примеры:
• Протеазы
• Эстеразы
• Гликозидазы
• Фосфатазы
83.
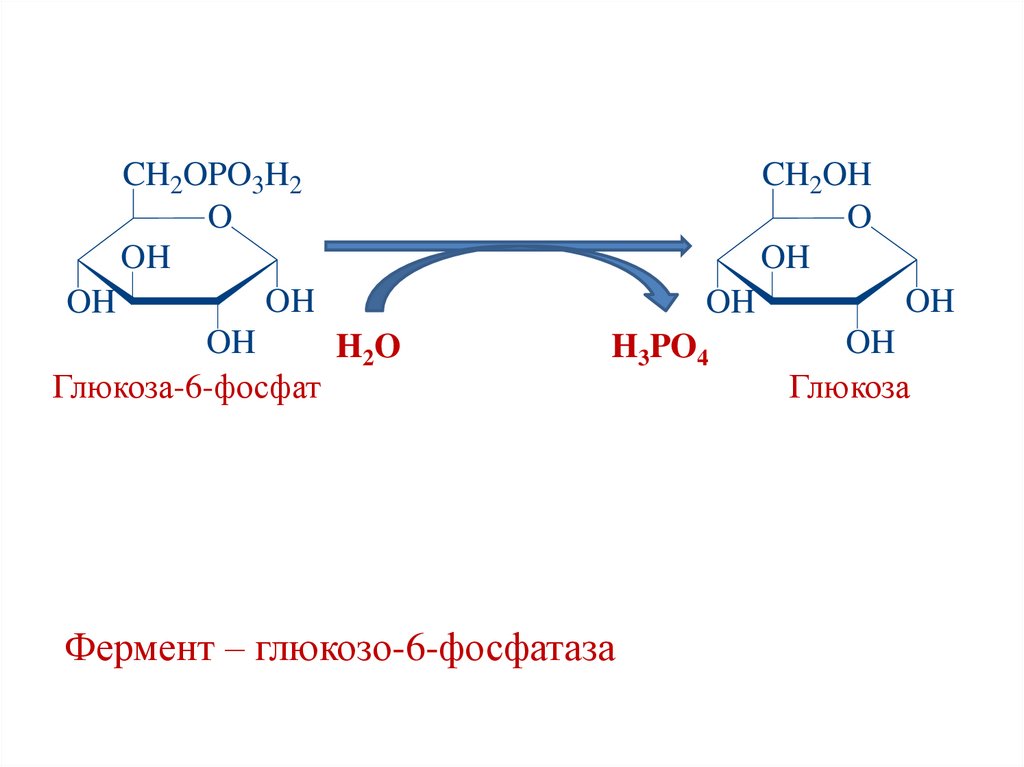
CH2OPO3H2O
OH
OH
OH
OH
H2 O
Глюкоза-6-фосфат
CH2OH
O
OH
OH
H3PO4
Фермент – глюкозо-6-фосфатаза
OH
OH
Глюкоза
84.
4. Лиазы• Катализируют реакции негидролитического
расщепления ковалентных связей (с
отщеплением СО2, Н2О, NН3) или
присоединение химических групп.
• 7 подклассов (в зависимости от
расщепленной химической связи)
• название – субстрат-отщепляемая или
присоединяемая группа-аза.
85.
ЛиазыОбщая схема реакции, катализируемой
лиазами:
А → В + С или А + В → С
• Декарбоксилазы
• Дегидратазы
• Гидратазы
• Альдолазы
86.
COOHI
CH
II
HC
I
CООН
Фумарат
+ H2O
COOH
I
CH-OH
I
CH2
I
CООН
Малат
Фермент – фумарат гидратаза (фумараза)
87.
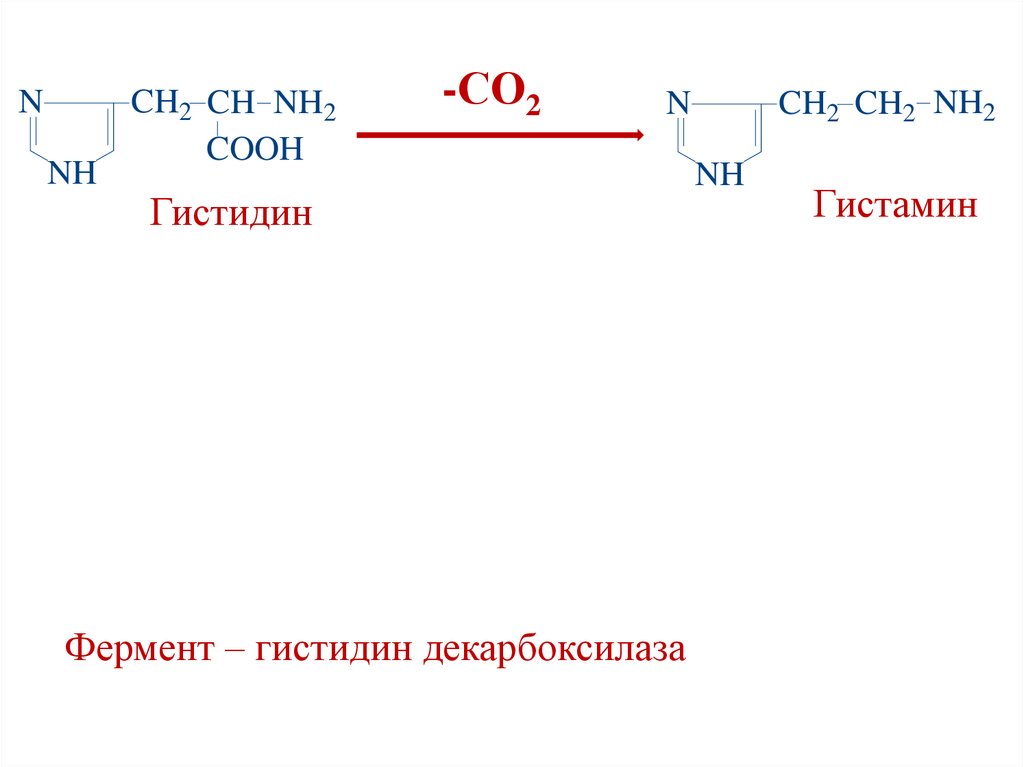
NNH
CH2 CH NH2
COOH
-СО2
CH2 CH2 NH2
N
Гистидин
Фермент – гистидин декарбоксилаза
NH
Гистамин
88.
5. Изомеразы• Катализируют реакции
внутримолекулярного превращения
• 6 подклассов (в зависимости от типа
реакции изомеризации).
• название – субстрат-тип изомеризации-аза.
89.
ИзомеразыОбщая схема реакции, катализируемой
изомеразами:
А 1 ↔ А2
Примеры:
• Цис-транс изомеразы
• Эпимеразы
• Рацемазы
• Мутазы
90.
CH2OPO3H2O
OH
OH
OH
OH
Глюкоза-6-фосфат
Фермент – глюкозо фосфат мутаза
(фосфоглюкомутаза)
CH2OH
O
OH
OPO3H2
OH
OH
Глюкоза-1-фосфат
91.
6. Лигазы (синтетазы)• Катализируют реакции присоединения 2-х
молекул с образованием ковалентной связи
за счет энергии гидролиза АТР.
• 6 подклассов (в зависимости от типа
образуемой химической связи)
• Систематическое название – субстратсубстрат-лигаза.
• Рабочее название – продукт реакциисинтетаза.
92.
Лигазы (синтетазы)Общая схема реакции, катализируемой
трансферазами:
А + В + АТР → С + ADP + Pi
Примеры:
• Глутамин-синтетаза
• Пируват-карбоксилаза
93.
COOHI
C=O + CO2
I
CH3
Пируват
ATP
ADP
H3PO4
COOH
I
C=О
I
CН2
I
CООН
Оксалоацетат
Фермент – пируват карбоксилаза
94.
7. ТранслоказыПереносят ионы или молекулы через мембраны.
6 подклассов (в зависимости от переносимых
ионов или молекул).
Подклассы:
• Транслоказы протонов (Н+-АТР-аза)
• Транслоказы неорганических катионов ((Na+/K+ATP-аза)
• Транслоказы неорганических анионов
• Транслоказы аминокислот и пептидов
• Транслоказы углеводов и их производных
• Транслоказы других молекул
95.
ATP + H20 + Na+[side1] + K+[side2] →ADP + Pi + Na+ [side2] + K+ [side1]
Фермент – Na +,K + -ATP-aza
96.
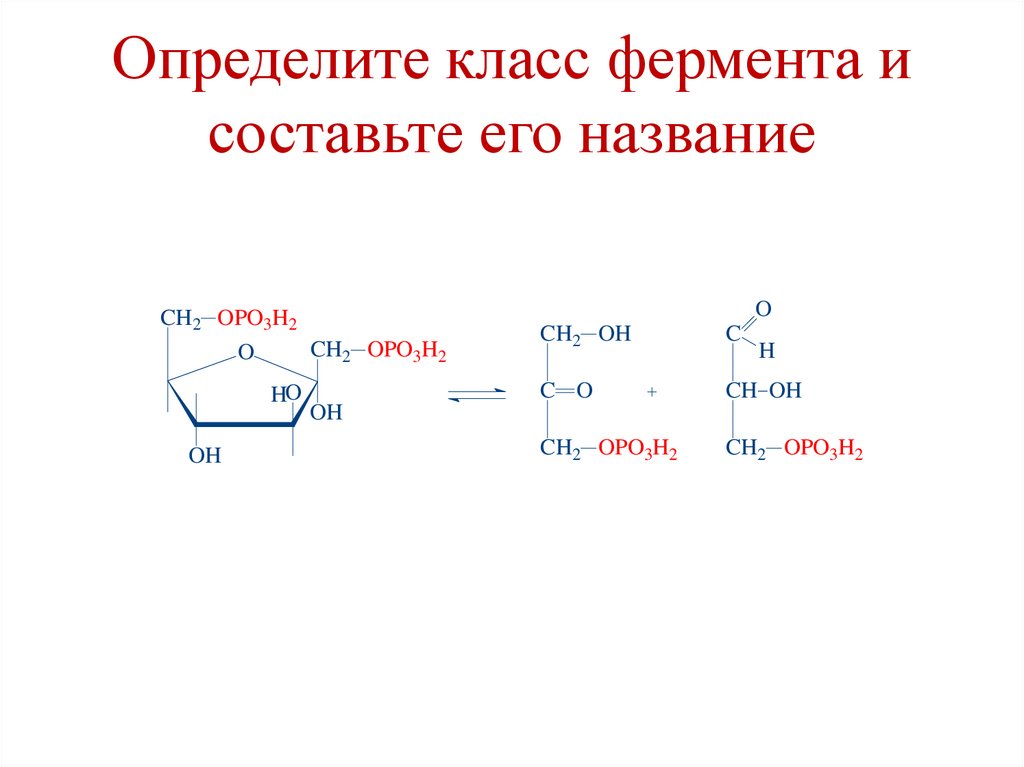
Определите класс фермента исоставьте его название
O
CH2 OPO3H2
CH2 OPO3H2
O
HO
OH
CH2 OH
C
C O
CH OH
CH2 OPO3H2
CH2 OPO3H2
H
OH
97.
Определите класс фермента исоставьте его название
C H 2 C H C O O H + O 2 + N A D PH + H +
NH2
HO
C H 2 C H C O O H + H 2O + N A D P +
NH2
98.
Определите класс фермента исоставьте его название
SH
CH2
+ N5-CH3-THF
CH2
CH NH2
COOH
CH3
S
CH2
+
CH2
CH NH2
COOH
THF
99.
Определите класс фермента исоставьте его название
CH2 OPO3H2
O
OH
CH2 OPO3H2
HO
OH
HO
OH
CH2OH
O
OH
OH
100.
Определите класс фермента исоставьте его название
COOH
CH NH2 + NH3 +ATP
CH2
CH2
COOH
COOH
CH NH2 + ADP + H3PO4
CH2
CH2
CONH2
101.
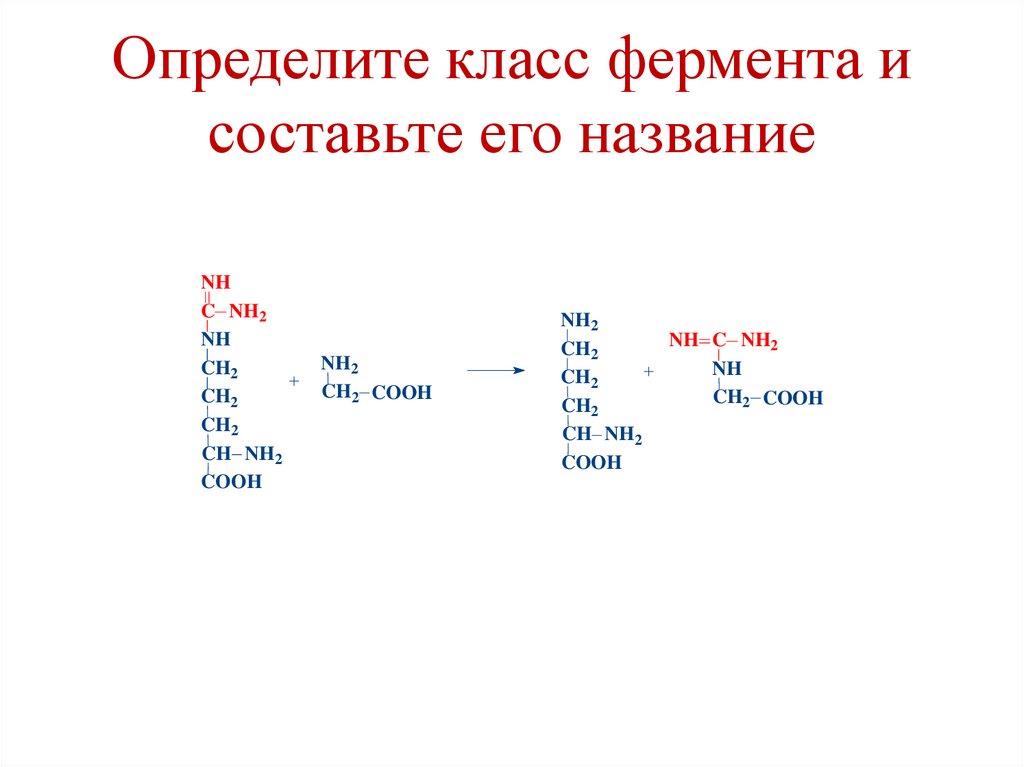
Определите класс фермента исоставьте его название
NH
C NH2
NH
CH2
CH2
CH2
CH NH2
COOH
NH2
CH2 COOH
NH2
CH2
CH2
CH2
CH NH2
COOH
NH C NH2
NH
CH2 COOH
102.
Определите класс фермента исоставьте его название
COOH
CH NH2 + H2O
CH2
CH2
CONH2
COOH
CH NH2 + NH3
CH2
CH2
COOH
103.
Определите класс фермента исоставьте его название
COOH
CH NH2 + NAD+ + H2O
CH2
CH2
COOH
COOH
C O + NADH+H+ + NH3
CH2
CH2
COOH
104.
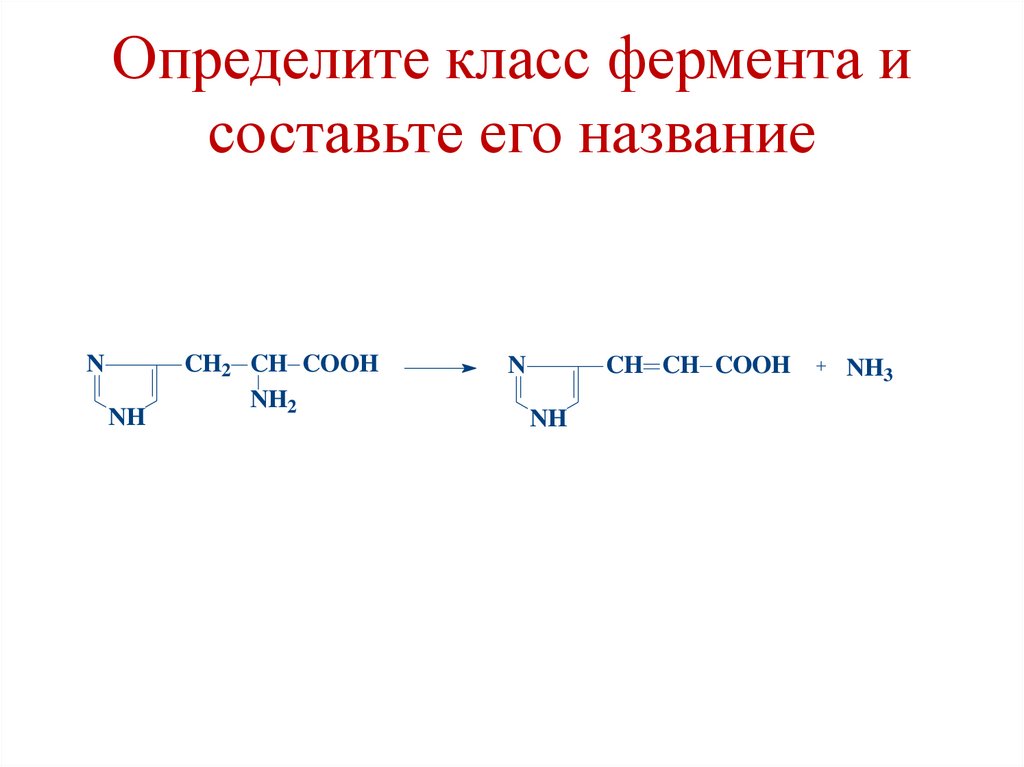
Определите класс фермента исоставьте его название
N
NH
CH2 CH COOH
NH2
N
CH CH COOH
NH
NH3
105.
Специфичность ферментов• Свойство ферментов катализировать
превращение одного или нескольких
определенных субстратов.
• Типы:
1.Стереоспецифичность.
2.Абсолютная субстратная специфичность.
3.Относительная (групповая) субстратная
специфичность.
106.
Стереоспецифичность• Фермент обладает специфичностью только к
одному из стереоизомеров субстрата.
Примеры:
1. Гексокиназа – специфичность к D-сахарам.
2. Оксидазы L-аминокислот – специфичность
к L-аминокислотам.
3. Фумараза – специфичность к трансизомеру.
4. Амилаза – специфичность к αгликозидным связям.
107.
Стереоспецифичность108.
Стереоспецифичность• Фермент катализирует превращение субстрата
только в один изомер продукта реакции.
Пример – сукцинатдегидрогеназа превращает
сукцинат в фумаровую кислоту, не образует
малеиновую кислоту.
COOH
COOH
CH2
CH
FAD
CH2
HC
COOH
COOH
FADH2
109.
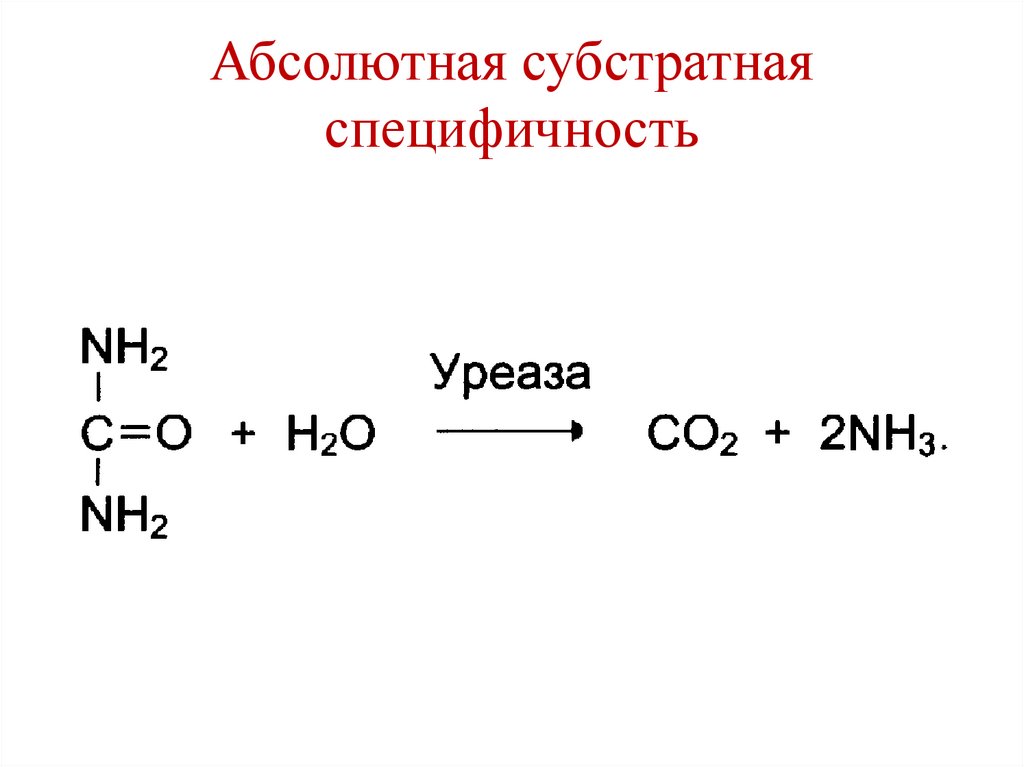
Абсолютная субстратнаяспецифичность
• Фермент катализирует превращение только
одного субстрата.
• Примеры:
1. Аргиназа
2. Уреаза
3. Карбоангидраза
110.
Абсолютная субстратнаяспецифичность
111.
Абсолютная субстратнаяспецифичность
112.
Групповая субстратнаяспецифичность
• Фермент катализирует однотипные реакции
с группой структурно похожих субстратов.
• Пример:
1. Панкреатическая липаза.
2. Протеолитические ферменты.
3. Алкогольдегидрогеназа.
113.
Активный центр фермента• участок фермента, обеспечивающий
связывание субстрата и прямое участие в
акте катализа.
• Активный центр является
«пространственной структурой», т.е.
образуется при упаковке полипептидной
цепи в третичную структуру.
114.
Активный центр фермента• Активные центры простых ферментов состоят
из радикалов аминокислот:
• Ser, Thr, Tyr (–OH)
• Asp, Glu (–COO-)
• Lys (–NH3+)
• His (имидазолил)
• Cys (–SH)
• У сложных ферментов в состав активного
центра входят и коферменты.
115.
Активный центр ферментаВ активном центре условно различают:
• каталитический центр – непосредственно
вступает в химическое взаимодействие с
субстратом.
• связывающий центр (контактная
(≪якорная≫) площадка – обеспечивает
связывание субстрата.
116.
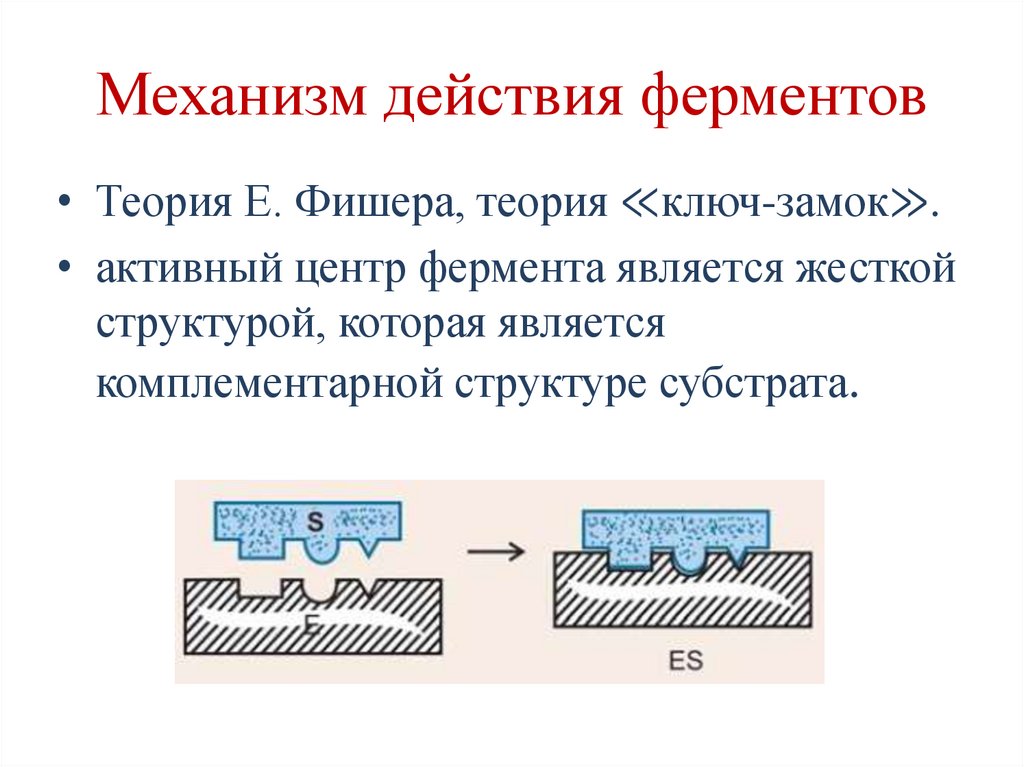
Механизм действия ферментов• Теория Е. Фишера, теория ≪ключ-замок≫.
• активный центр фермента является жесткой
структурой, которая является
комплементарной структуре субстрата.
117.
Механизм действия ферментов• Теория Д. Кошленда, теория
≪индуцированного соответствия≫.
• Активный центр является гибкой структурой.
Субстрат индуцирует конформационные
изменения молекулы фермента таким образом,
что активный центр принимает необходимую
для связывания субстрата пространственную
ориентацию.
118.
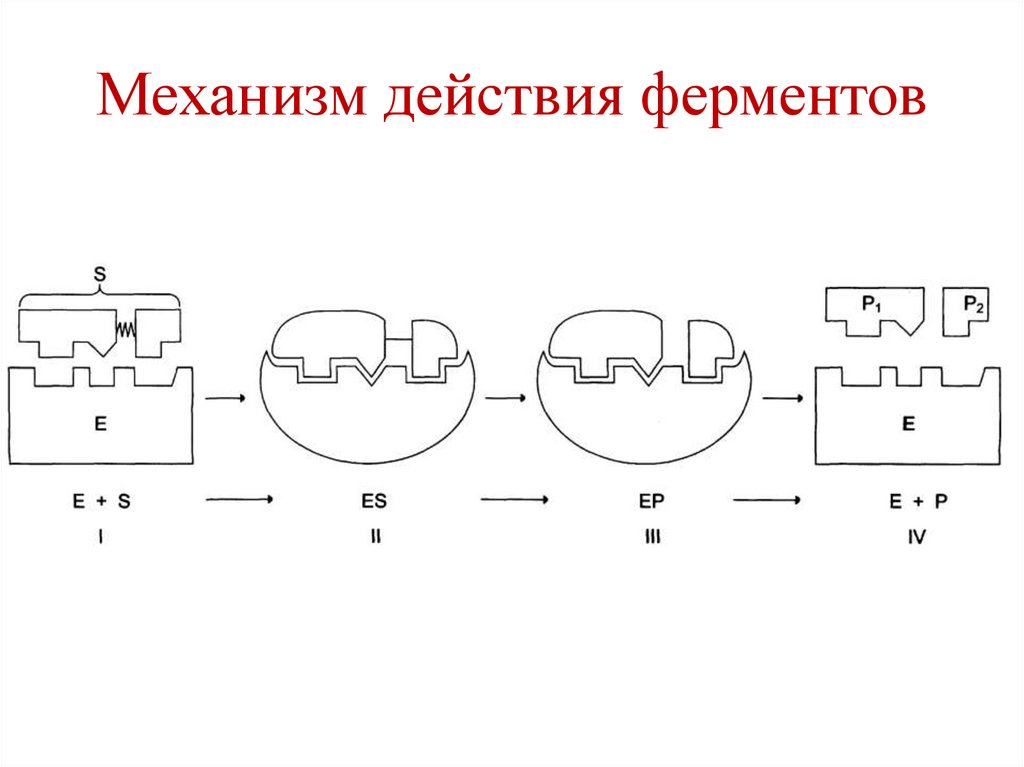
Механизм действия ферментоваа
• I этап – сближение и ориентация субстрата
относительно активного центра фермента и
образование фермент-субстратного
комплекса (ES) в результате
«индуцированного соответствия».
119.
Механизм действия ферментов• II этап – преобразование субстрата в
продукт реакции с образованием
нестабильного комплекса фермент-продукт
(ЕР).
• III этап – распад комплекса ЕР с
высвобождением продукта реакции из
активного цента фермента.
120.
Механизм действия ферментов121.
Молекулярные механизмыферментативного катализа
• Эффект сближения и ориентации реагентов.
• Эффект деформации субстрата.
• Кислотно-основной катализ (пример –
алкогольдегидрогеназа).
• Ковалентный катализ (пример –
«сериновые» протеиназы).
122.
Механизм кислотно-основного катализана примере алкогольдегидрогеназы
123.
Принципы определения активностиферментов
E
↓ S →P ↑
Измерение уменьшения концентрации
субстрата за единицу времени.
Измерение увеличения концентрации
конечного продукта за единицу времени.
124.
Единицы измерения активностиферментов
• Международная единица (МЕ) –
количество фермента, которое превращает 1
мкмоль субстрата за 1 минуту.
• Катал (кат) – количество фермента, которое
превращает 1 моль субстрата за 1 секунду.
125.
Кинетика ферментативных реакций• раздел энзимологии, изучающий
зависимость скорости ферментативной
реакции от химической природы
реагирующих веществ, а также от факторов
внешней среды.
126.
Скорость ферментативной реакции(активность фермента)
• Является мерой каталитической активности
фермента и определяется изменением
концентрации субстрата (уменьшение) или
продукта (увеличение) за единицу времени.
127.
Скорость ферментативной реакциизависит от:
• Концентрации субстрата
• Концентрации фермента
• Температуры
• рН среды
128.
Зависимость скоростиферментативной реакции от
концентрации субстрата
• На начальном этапе скорость реакции
прямо пропорциональна времени и имеет
линейную зависимость.
• С течением времени скорость реакции
уменьшается.
129.
Зависимость скоростиферментативной реакции от
концентрации субстрата
130.
Уравнение каталитической реакции1 – константа скорости образования ES комплекса
-1 – константа скорости распада ES комплекса
2 – константа скорости образования продукта
131.
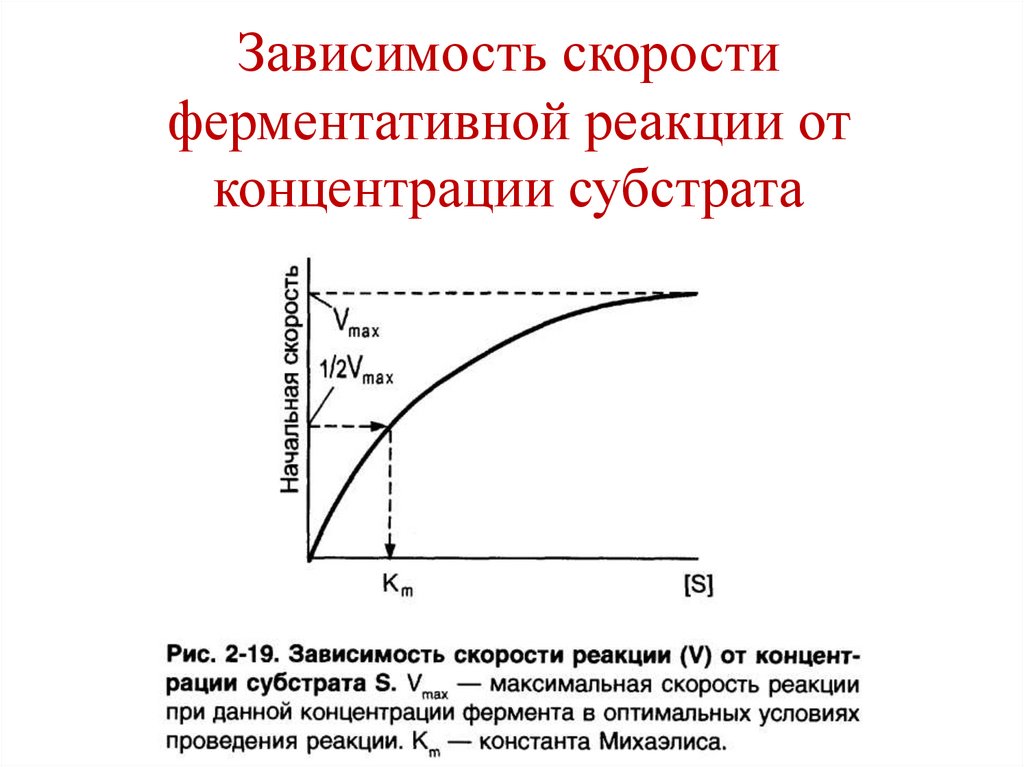
Константа Михаэлиса, Кm( -1+ 2)/ 1
Уравнение Михаэлиса-Ментен –
зависимость скорости ферментативной
реакции от концентрации субстрата
132.
Константа Михаэлиса, Кmравна концентрации субстрата, при которой
скорость ферментативной реакции
составляет половину от максимальной
скорости.
133.
Vmax и Кm – кинетическиехарактеристики эффективности
фермента
• Vmax – характеризует каталитическую
активность фермента.
• Кm – характеризует сродство фермента к
субстрату.
• Чем меньше Кm, тем больше сродство
фермента к субстрату и наоборот.
134.
135.
Зависимость скоростиферментативной реакции от
концентрации фермента
136.
Зависимость скоростиферментативной реакции от
температуры
137.
Зависимость скоростиферментативной реакции от рН
среды
138.
Проферменты (зимогены)• Некоторые ферменты синтезируются в виде
неактивных предшественников –
проферменты (зимогены).
• Механизм активации – частичный
протеолиз.
• Необратимый механизм.
139.
Примеры ферментов, которыеактивируются частичным протеолизом
Профермент (зимоген)
Пепсиноген
Трипсиноген
Прокарбоксипептидаза
Протромбин
Активный фермент
Пепсин
Трипсин
Карбоксипептидаза
Тромбин
140.
Ингибирование ферментовснижение каталитической активности в
присутствии определенных веществ –
ингибиторов.
Типы:
• Обратимое и необратимое.
• Специфическое и неспецифическое.
• По механизму:
• Конкурентное, неконкурентное.
141.
Конкурентное ингибированиеферментов
• Ингибитор является структурным аналогом
субстрата.
• Ингибитор связывается в активном центре
фермента, препятствуя связыванию
субстрата.
• Образуются комплексы ES и EI.
• Обратимый процесс – снимается
увеличением концентрации субстрата.
• Vmax не меняется, Кm увеличивается.
142.
Конкурентное ингибированиеферментов
Пример – сукцинатдегидрогеназа;
Ингибитор – малонат.
143.
Лекарственные препараты какконкурентные ингибиторы
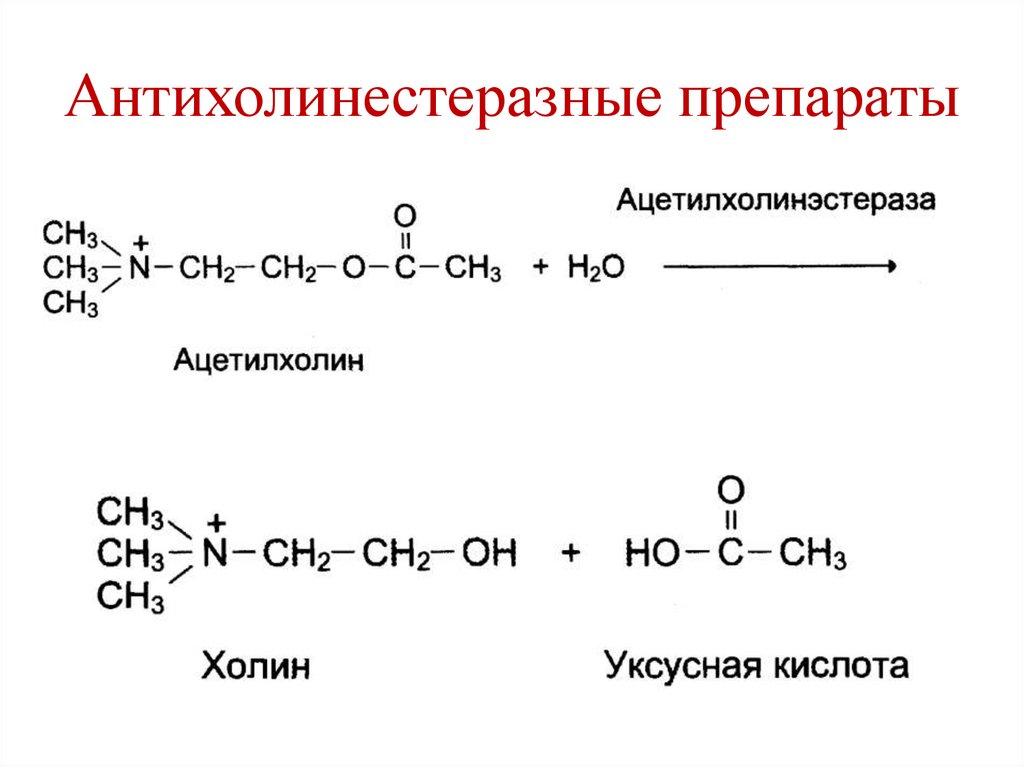
• Антихолинэстеразные препараты – прозерин
– лечение мышечных дистрофий.
• Сульфаниламидные препараты – лечение
инфекционных заболеваний.
• Аналоги нуклеотидов – лечение
онкологических заболеваний.
• Аллопуринол – лечение подагры.
144.
Антихолинестеразные препараты145.
Механизм антибактериального действиясульфаниламидных препаратов
• Сульфаниламидные препараты похожи по
строению на парааминобензойную кислоту.
146.
Механизм антибактериального действиясульфаниламидных препаратов
Подавляют синтез фолиевой кислоты:
• Конкурентно ингибируют бактериальные
ферменты синтеза фолата.
• ТГФК участвует в синтезе нуклеотидов.
• В результате нарушается синтез
нуклеиновых кислот, что вызывает
прекращение размножения бактерий.
147.
Лечение подагрыO
Ксантиноксидаза
N
HN
N
H
N
Гипоксантин
O
O
О2 Н2О
N
HN
N
H
Н2О2
Ксантин
HN
O
N
N
О2 Н2О
Ксантиноксидаза
O
N
H
Аллопуринол – структурный
аналог гипоксантина!
N
H
H
N
HN
O
Н2О2
O
N
H
N
H
Мочевая кислота
148.
Лечение подагрыМеханизм действия аллопуринола:
• Конкурентно ингибирует ксантиноксидазу,
останавливая катаболизм пуриновых
нуклеотидов на стадии гипоксантина,
растворимость которого в 10 раз выше
мочевой кислоты.
149.
Неконкурентное ингибированиеферментов
• Ингибитор не является структурным аналогом
субстрата.
• Ингибитор связывается в участке, отличном от
активного центра.
• Образуется тройной комплекс ESI.
• Ингибитор препятствует преобразованию
субстрата.
• Происходит снижение Vmax , Кm не меняется.
150.
Неконкурентное ингибированиеферментов
151.
Неконкурентное ингибированиеферментов
152.
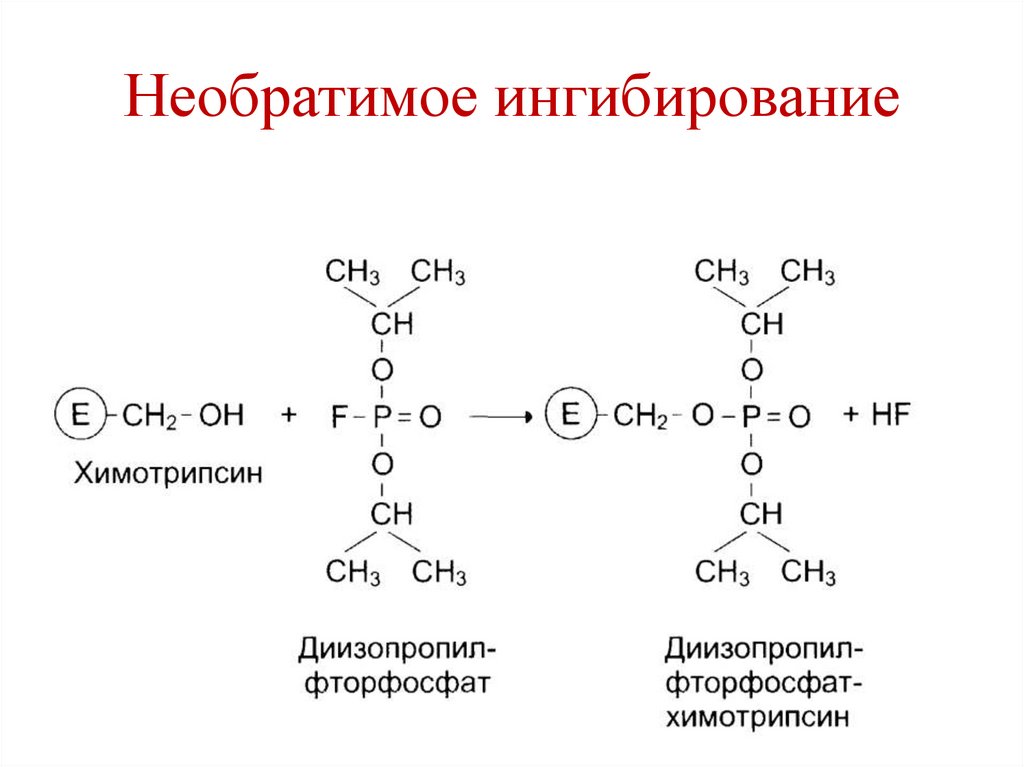
Необратимое ингибирование• Специфическое – ингибитор блокирует
определенную химическую группу в
активном центре фермента.
• Пример – диизопропилфторфосфат (ДФФ)
связывается с остатком серина из активного
центра «сериновых» протеиназ (трипсин,
химотрипсин, тромбин, холинэстераза).
• Нейро-паралитический яд, инсектицид.
153.
Необратимое ингибирование154.
Необратимое ингибирование• Неспецифическое – ингибитор реагирует с
любыми определенными свободными
группами ферментов.
• Пример – ацетат йода, р-хлормеркурибензоат
вступают в реакцию с любыми SН-группами
остатков цистеина белков.
155.
Необратимое ингибирование156.
Необратимые ингибиторы каклекарственные препараты
• Аспирин (противовоспалительный
нестероидный препарат) – ингибирует
циклооксигеназу, фермент, катализирующий
синтез простагландинов из арахидоновой
кислоты.
157.
158.
Регуляция скорости ферментативнойреакции
• Регуляция количества фермента (регуляция
скорости синтеза и распада ферментов).
• Регуляция доступностью субстратов и
кофакторов, необходимых для реакции.
• Регуляция активности фермента.
159.
Регуляция активности фермента• Ковалентная регуляция.
• Аллостерическая регуляция.
160.
Ковалентная регуляцияактивности фермента
- фосфорилирование/дефосфорилирование;
- метилирование/деметилирование;
- ацетилирование/деацетилирование;
- аденилирование/деаденилирование;
- ацилирование/деацилирование
(пальмитоил-; миристоил-);
- пренилирование (фарнезил-):
- АДФ-рибозилирование;
- сульфатирование.
161.
Фосфорилирование/дефосфорилирование
Протеинкиназа
ATP
ADP
E-OH
E-OPO3H2
Дефосфорилированный
фермент
H3PO4
Фосфорилированный
фермент
H2O
Фосфопротеинфосфатаза
162.
ФосфорилированиедефосфорилированиеПримеры:
• Фермент гликогенфосфорилаза
(регуляторный фермент распада гликогена)
активен в фосфоформе.
• Фермент гликогенсинтаза (регуляторный
фермент синтеза гликогена) активен в
дефосфоформе.
163.
Аллостерические ферменты• Являются олигомерными белками.
• Имеют аллостерический центр,
пространственно удаленный от активного
центра.
• В аллостерических центрах
присоединяются нековалентно
аллостерические регуляторы.
• Обратимый процесс.
• Обладают кооперативностью.
164.
Аллостерические ферменты• Имеют S-образную кривую зависимости
скорости реакции от концентрации субстрата.
165.
Аллостерическое ингибирование166.
Аллостерическая активация167.
Изоферменты• Множественные формы ферментов,
катализирующие одну и ту же реакцию, но
отличающиеся по химической структуре,
физико-химическим и кинетическим
свойствам.
• Являются олигомерными ферментами.
• Состоят из 2-х или более разного типа
протомеров.
168.
Изоферменты• Пример:
• Лактатдегидрогеназа (ЛДГ)
• Реакция, катализируемая ЛДГ:
COOH
COOH
CH OH
NAD+
C
O
CH3
CH3
Лактат
Пируват
NADH+H+
169.
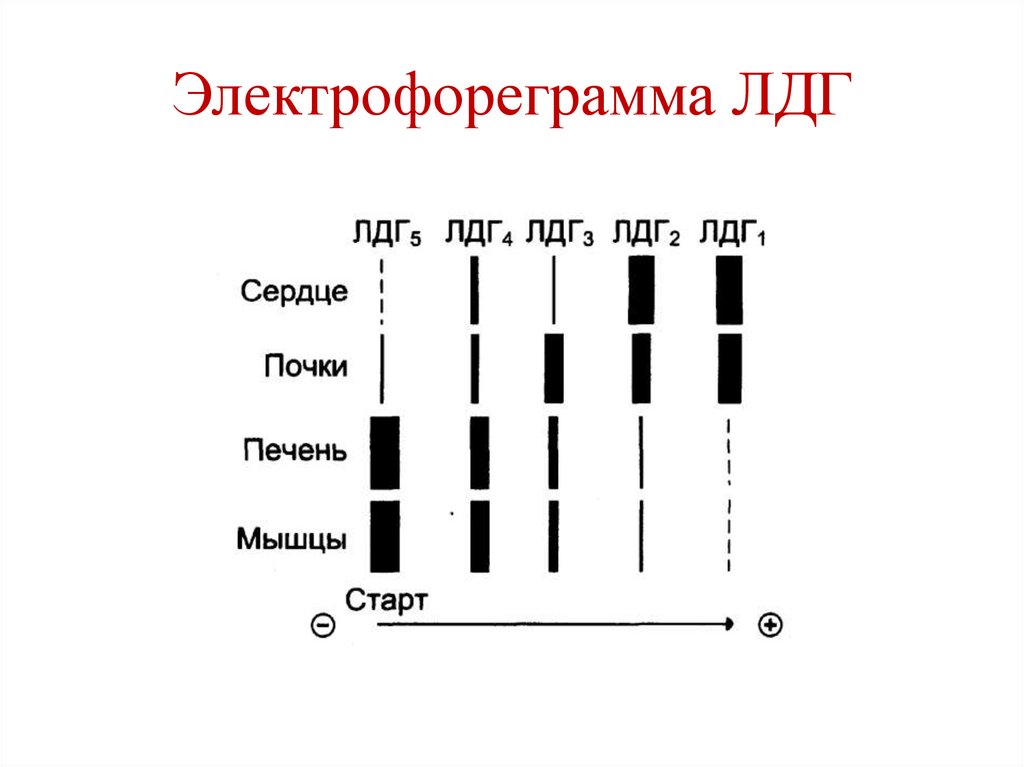
Изоферменты ЛДГ• ЛДГ состоит из 4-х субъединиц 2-х типов:
• М (от англ. muscle)
• Н (от англ. heart)
• 5 изоформ ЛДГ:
• ЛДГ1 – НННН (сердце, почки)
• ЛДГ2 – НННМ (сердце, почки)
• ЛДГ3 – ННММ (почки)
• ЛДГ4 – НМММ (печень, мышцы)
• ЛДГ5 – ММММ (печень, мышцы)
170.
Электрофореграмма ЛДГ171.
Изоферменты• Пример:
• Креатинфосфокиназа (СРК)
• Реакция, катализируемая СРК:
Креатин
Креатин-фосфат
172.
Изоферменты СРК• СРК состоит из 2-х субъединиц 2-х типов:
• М (от англ. muscle)
• В (от англ. brain)
• 3 изоформы СРК:
• ММ – мышцы
• ВВ – мозг
• МВ – сердце
173.
Организация ферментов в клеткеПолиферментные комплексы:
• Функциональные – гликолиз.
• Структурные – пируват дегидрогеназный
комплекс.
• Смешанные – цикл Кребса.
174.
Организация ферментов в клеткеКомпартментализация:
• Строгая локализация определенных
ферментов в различных органеллах.
Примеры:
• Ферменты гликолиза – цитоплазма.
• Цикл Кребса – митохондрии.
• Дыхательная цепь – внутренняя
митохондриальная мембрана.
• Ферменты синтеза ДНК и РНК – ядро.
175.
Регуляция метаболизма в клеткеПринцип отрицательной обратной связи –
ретроингибирование
176.
Регуляция метаболизма в клеткеАктивация ключевых ферментов
заключительных реакций
метаболического пути.
177.
Энзимодиагностика• Постановка диагноза на основе
определения активности ферментов в
биологических жидкостях.
Основы энзимодиагностики:
• Повреждение тканей сопровождается
поступлением ферментов из тканей в
биологические жидкости.
• Органоспецифичность – ряд ферментов
имеет преимущественную или абсолютную
локализацию в определенных органах.
178.
Органоспецифические ферменты• Примеры:
• Кардиоспецифические ферменты:
ЛДГ1 и ЛДГ2
АСТ
креатинкиназа МВ
• Гепатоспецифические ферменты:
ЛДГ4 и ЛДГ5
АЛТ, АСТ и др.
179.
Энзимотерапия• Использование ферментов в качестве
терапевтических средств.
• Заместительная терапия: панкреатические
ферменты используют при недостаточности
секреции поджелудочной железы (фестал,
мезим, панкреатин).
• Использование ферментов в комплексной
терапии: протеолитические ферменты
(трипсин, химотрипсин) используют для
очистки гнойных ран
180.
Использование ферментов влабораторной практике
• Примеры:
• Глюкооксидаза используется для
определения концентрации глюкозы в
крови.
• Уреаза используется для определения
концентрации мочевины в крови.
181.
Афиннаяхроматография
• Это специфичный метод
выделения
индивидуальных
ферментов, основанный
на избирательном
взаимодействии с
лигандами (субстратом
или коферментом),
прикрепленными к
твердому носителю.
182.
Афинная хроматография• Через колонку, заполненную
иммобилизованным лигандом, пропускают
раствор, содержащий смесь белков. К
лиганду присоединяется только фермент,
специфично взаимодействующий с ним.
Фермент, адсорбированный на колонке,
можно снять, промыв ее раствором с
измененным значением рН или
детергентом, разрывающие связи между
ферментом и лигандом.






















































































































































 biology
biology








