Similar presentations:
Молекулярная физика
1.
МОЛЕКУЛЯРНАЯФИЗИКА
2.
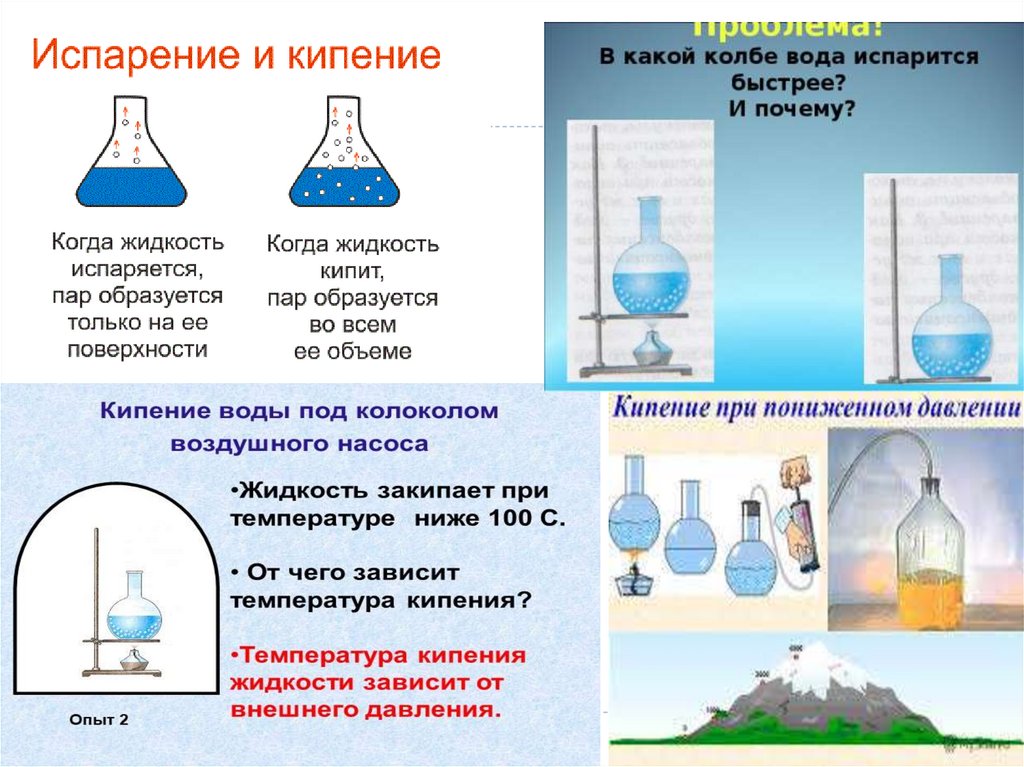
Молекулярная физика –это раздел физики, изучающий внутреннее
строение тел, а также тепловые процессы,
происходящие внутри вещества.
Идея о том, что все тела состоят из
мельчайших частиц – атомов, и, что тепло
представляет собой внутреннее движение и
энергию этих атомов, высказывались еще
античными философами.
3.
4.
5.
6.
7.
8.
9.
10.
ГЛАВЫ11.
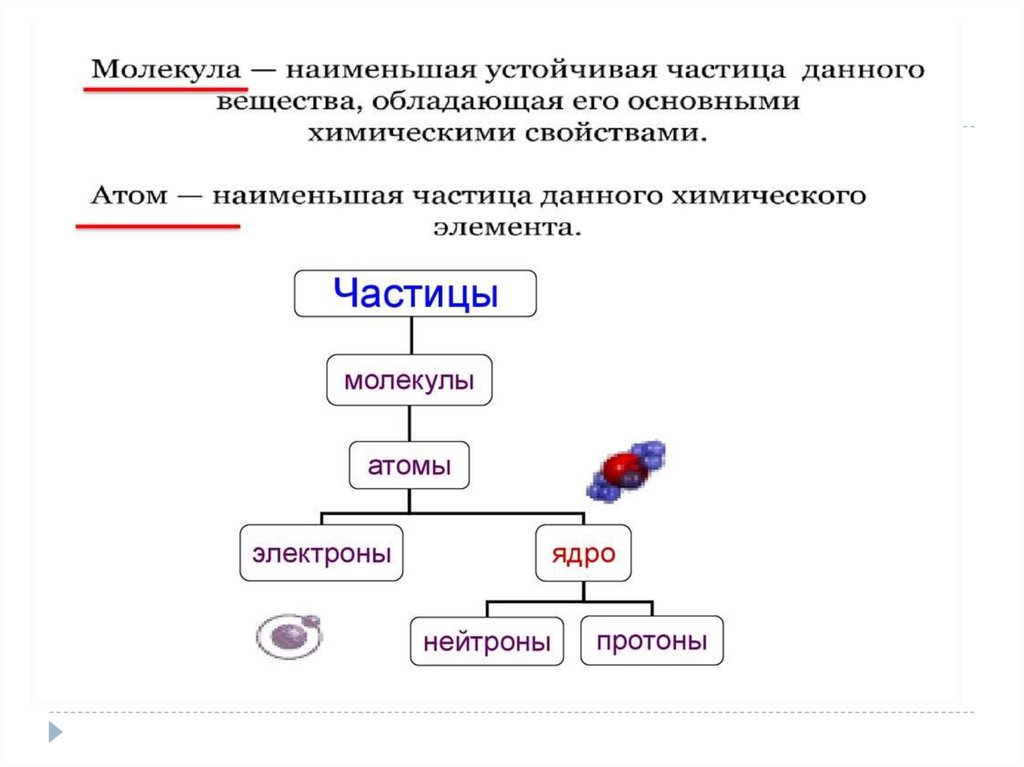
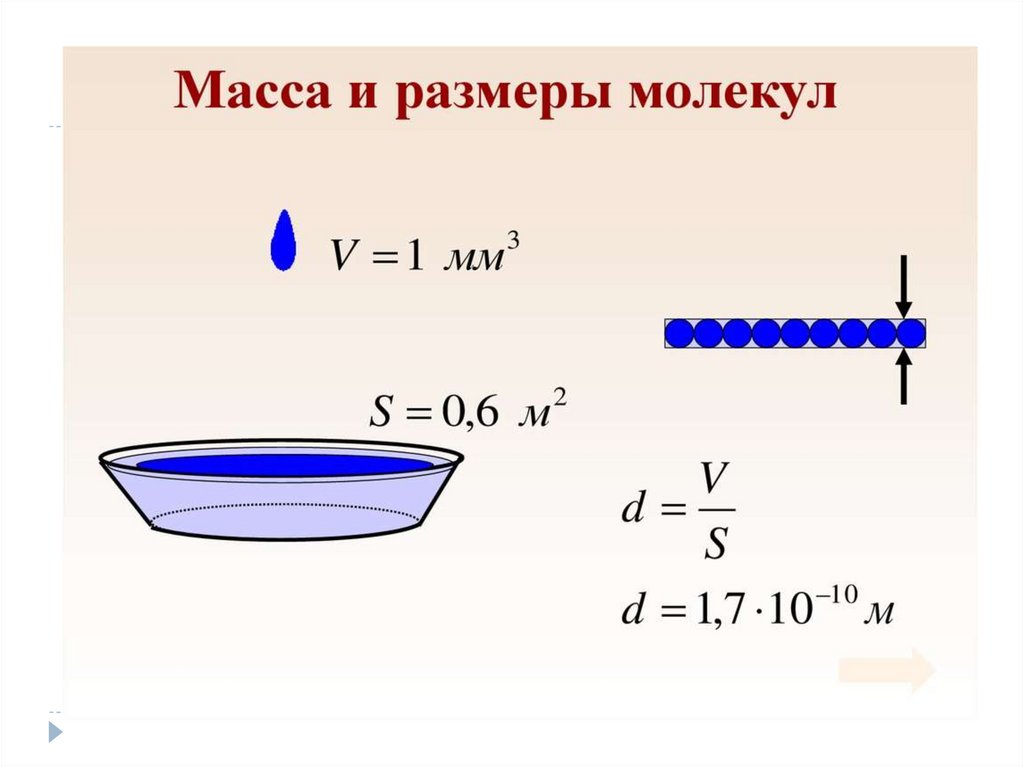
1)Положение МКТ :Все тела (вещества)
состоят из частиц
(молекул, атомов, ионов)
между которыми есть
промежутки.
Опытные обоснования:
- крошение вещества;
-испарение жидкости;
-смешивание веществ;
диффузия;
-фотография туннельного
микроскопа.
12.
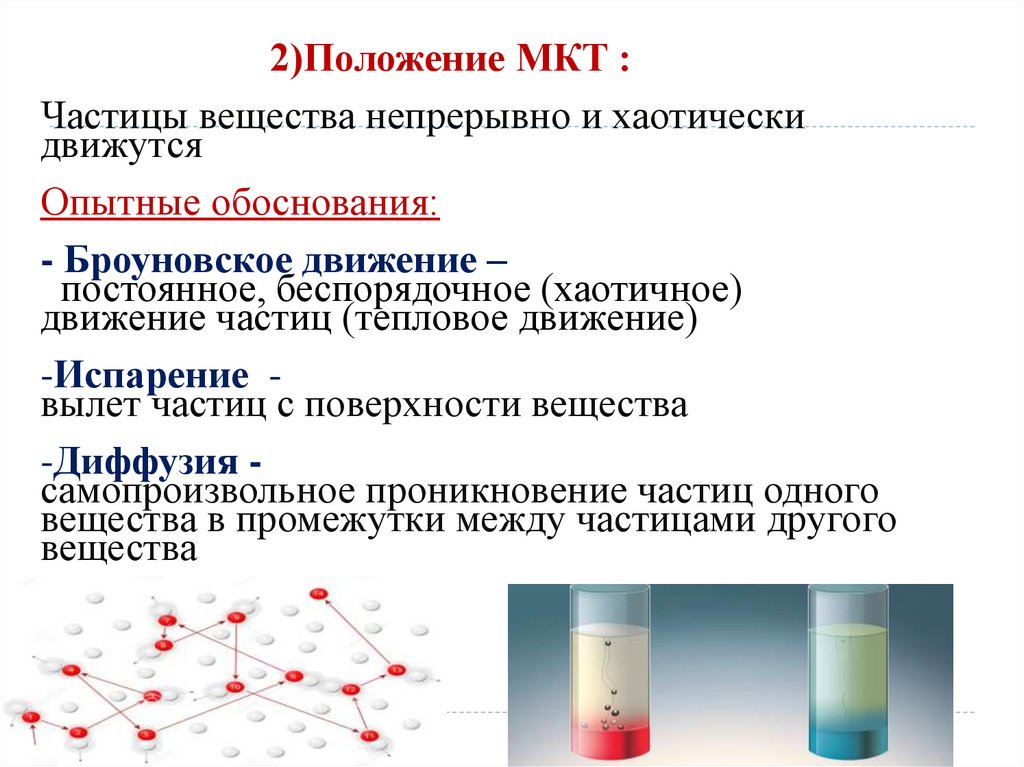
2)Положение МКТ :Частицы вещества непрерывно и хаотически
движутся
Опытные обоснования:
- Броуновское движение –
постоянное, беспорядочное (хаотичное)
движение частиц (тепловое движение)
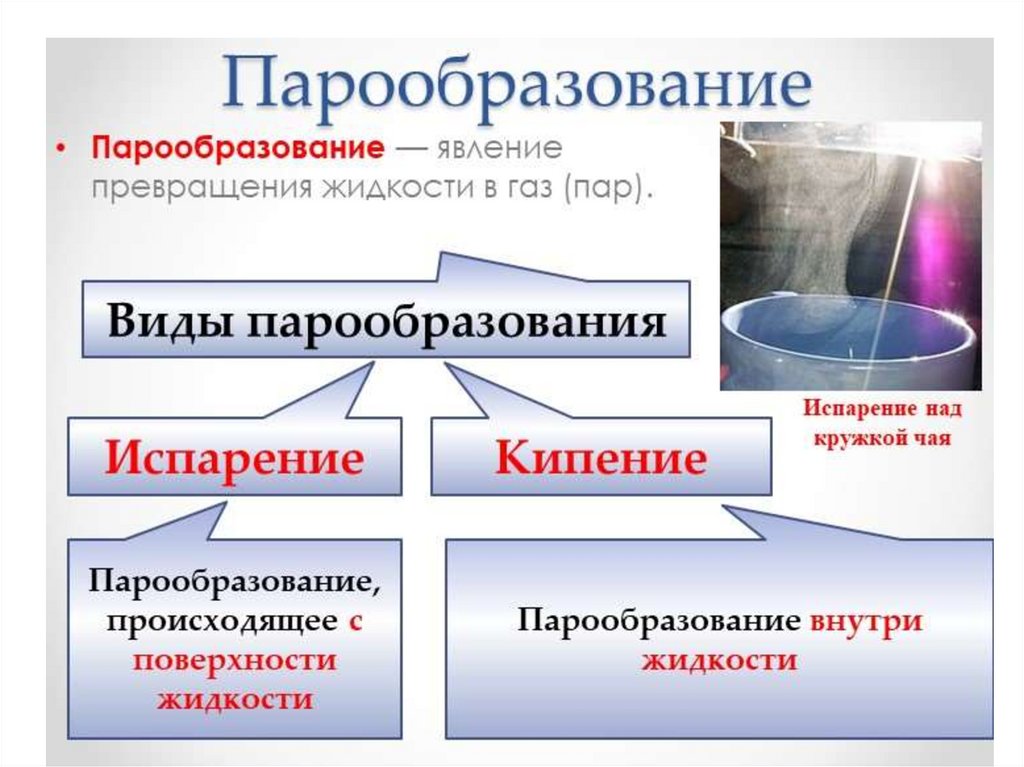
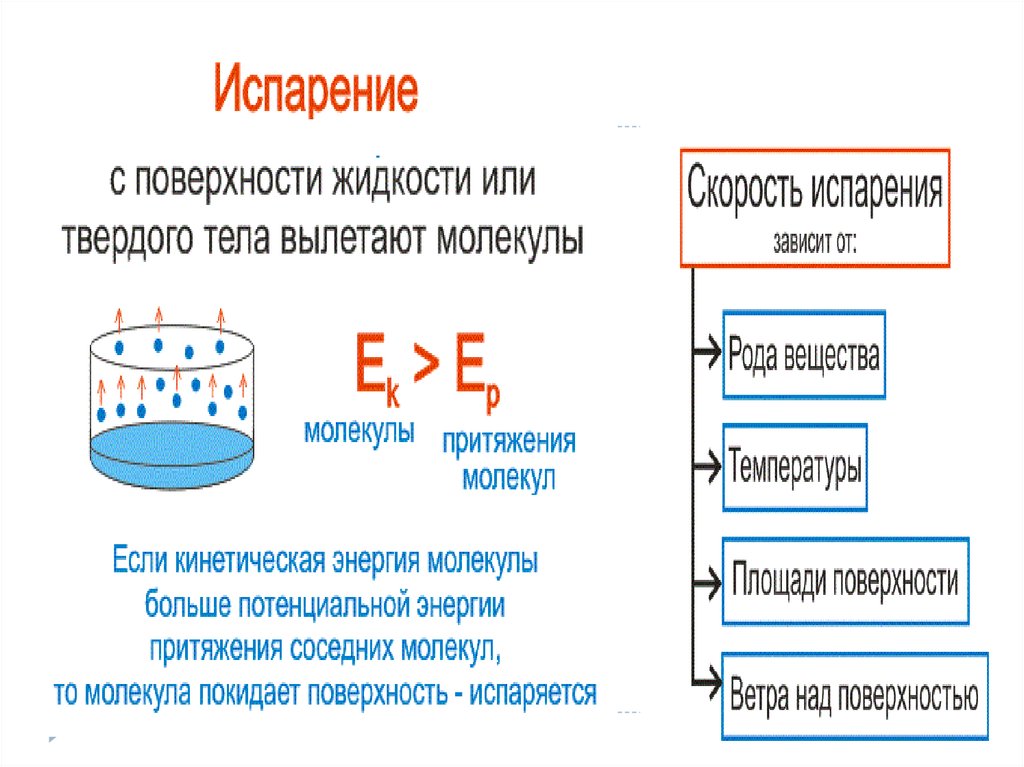
-Испарение вылет частиц с поверхности вещества
-Диффузия самопроизвольное проникновение частиц одного
вещества в промежутки между частицами другого
вещества
13.
14.
15.
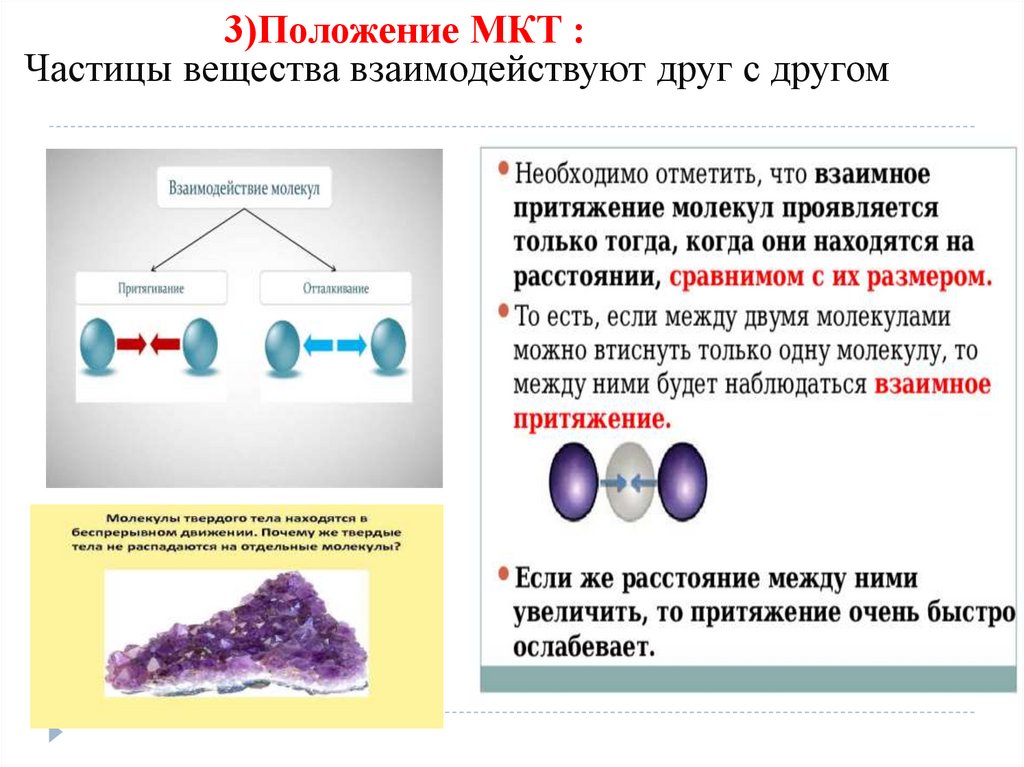
3)Положение МКТ :Частицы вещества взаимодействуют друг с другом
16.
МОЛЕКУЛЯРНАЯ ФИЗИКАизучает физические свойства тел в различных
агрегатных состояниях на основе их молекулярного
строения.
17.
18.
19.
20.
21.
22.
23.
24.
25.
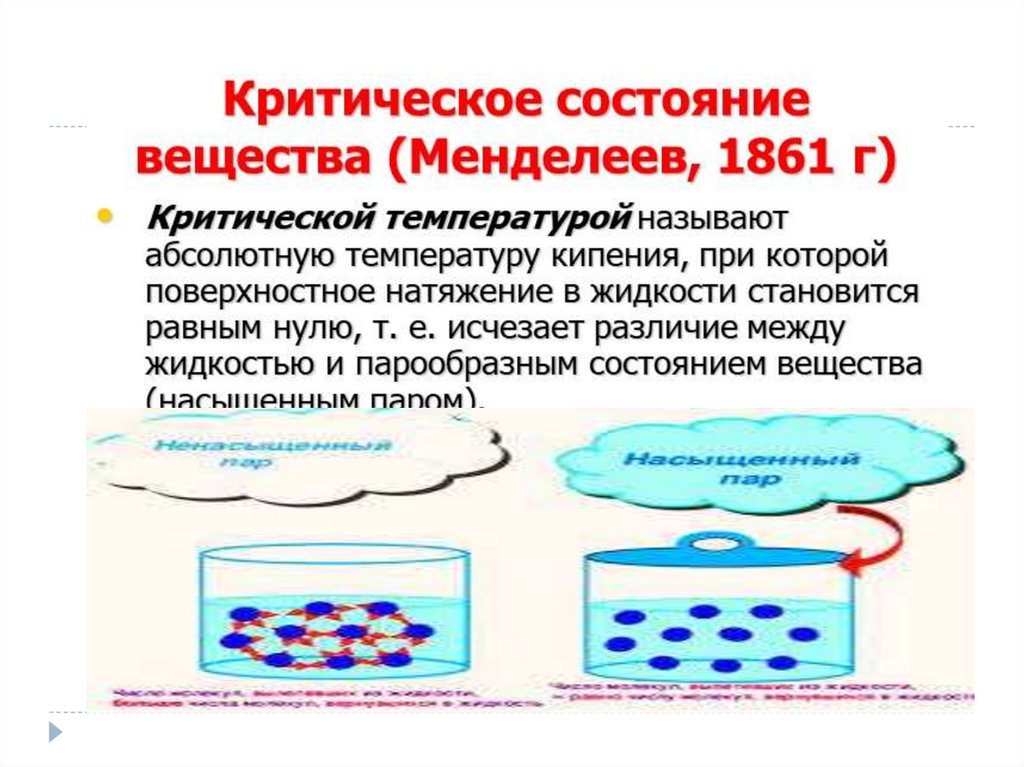
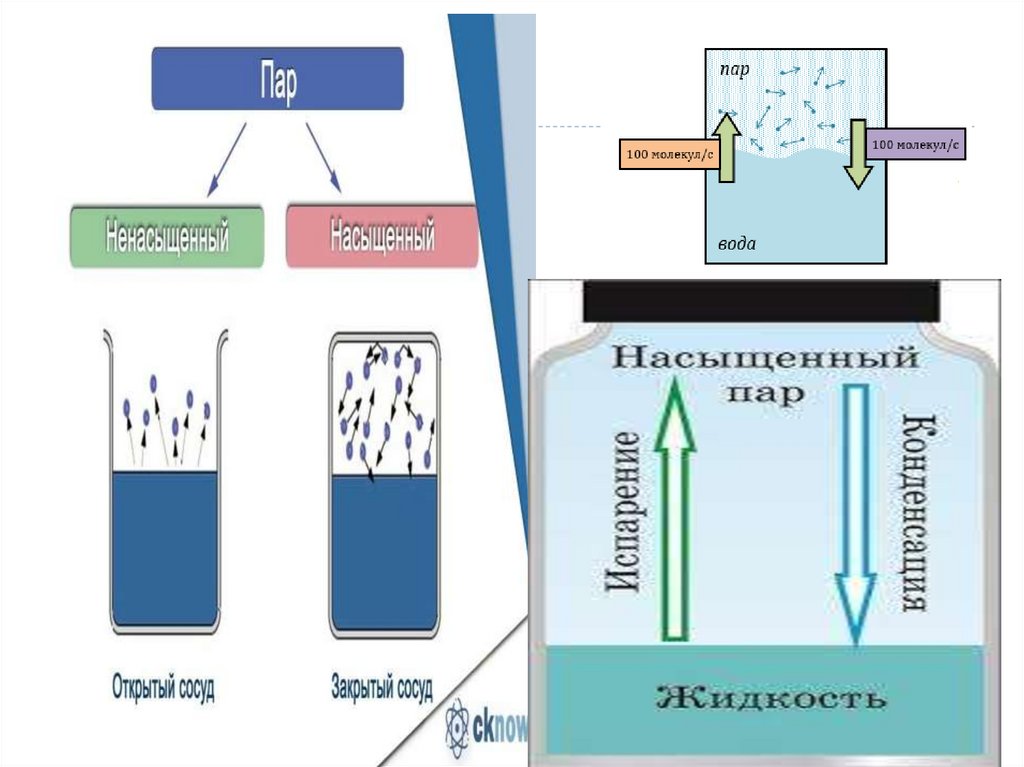
Насыщенный пар-это пар, в которомколичество испарившихся молекул =
количеству конденсирующихся молекул за
единицу времени
26.
27.
28.
29.
30.
С явлением поверхностного натяженияжидкости мы сталкиваемся каждый день:
капли воды стремятся принять форму,
близкую к шарообразной (а в невесомости
они совсем шарообразные);
струя воды из-под крана стремится к
цилиндрической форме;
булавка не тонет на поверхности воды в
стакане;
многие насекомые могут скользить по
поверхности воды(водомерки)
31.
32.
33.
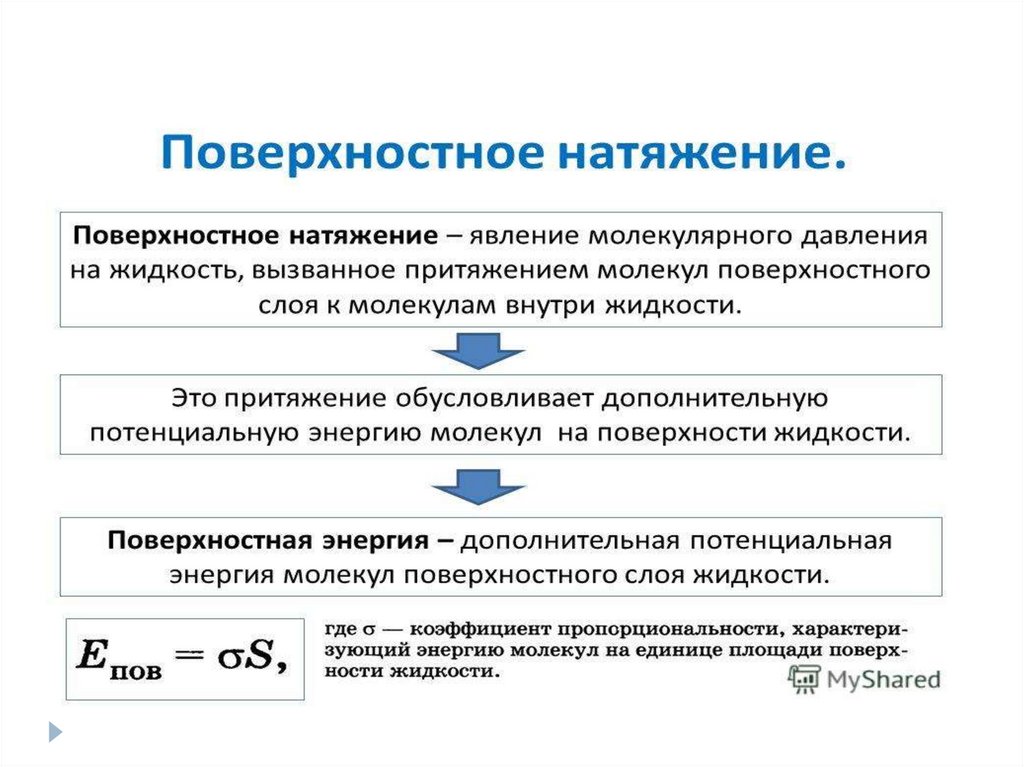
Коэффициент поверхностного натяжения σσ = Е/S
Е — поверхностная энергия жидкости [Дж]
S — площадь свободной поверхности [м2]
σ — коэффициент поверхностного натяжения [Н/м]
Коэффициент поверхностного натяжения σ
жидкости зависит:
-от природы жидкости;
-температуры жидкости;
-свойств газа, который граничит с данной жидкостью;
-наличия поверхностно-активных веществ (например, мыло
или стиральный порошок), которые уменьшают
поверхностное натяжение.
34.
l — длина контура, ограничивающего поверхностьжидкости [м]
σ — коэффициент поверхностного натяжения [Н/м]
35.
36.
37.
38.
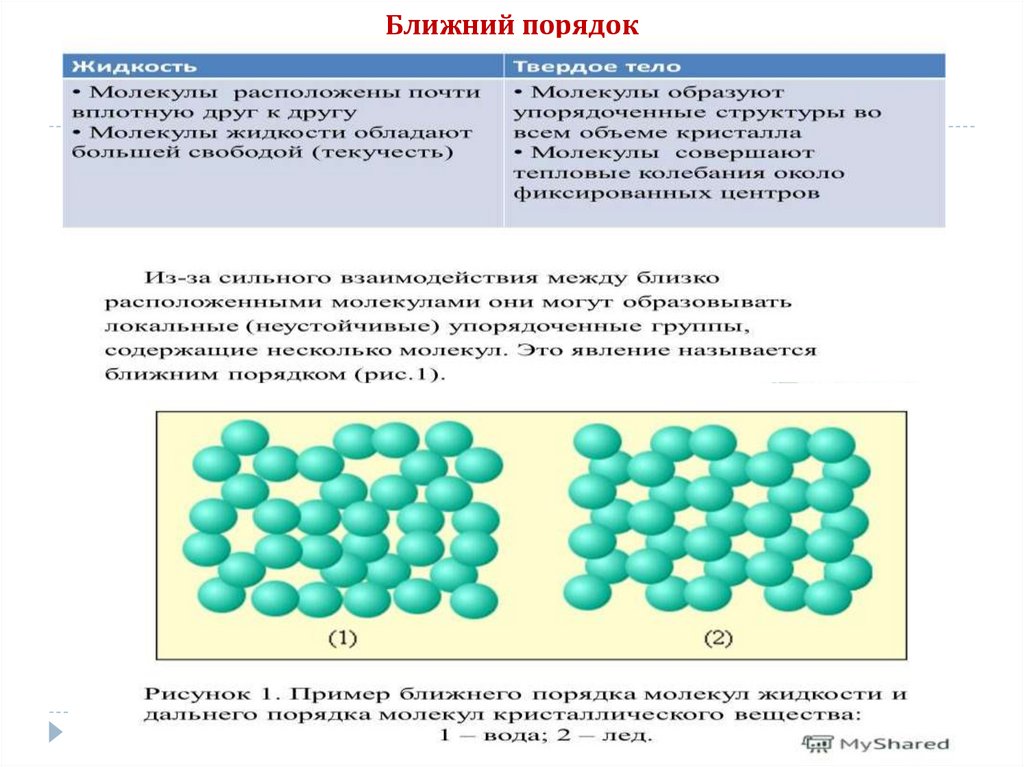
Ближний порядок39.
40.
41.
42.
43.
Выводы:Поверхностное натяжение – это явление, при котором жидкость
стремиться приобрести форму с наименьшей возможной площадью
поверхности.
Примеры поверхностного натяжения в природе:
-жидкость приобретает форму капли
-капля принимает шарообразную форму
-водомерка удерживается на поверхности воды
Коэффициент поверхностного натяжения – коэффициент, равный
энергии(работе), которую необходимо совершить для образования
поверхности жидкости площадью S при постоянной температуре.
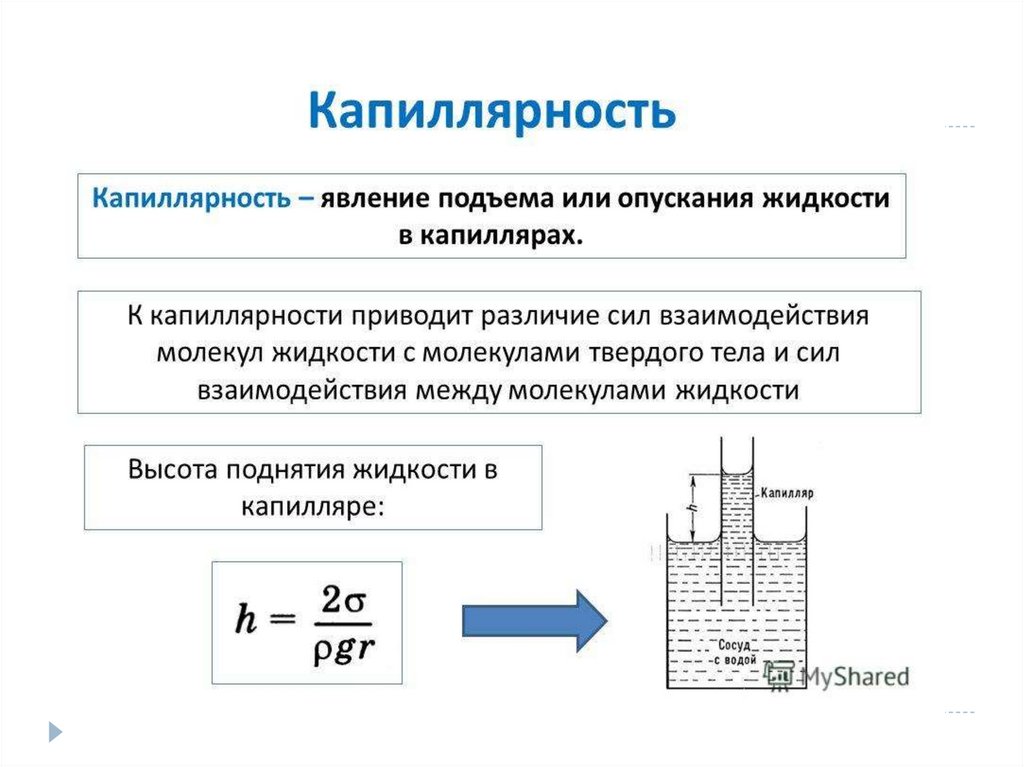
Капиллярные явления – подъем или опускание жидкости в
капиллярах (трубках малого диаметра).
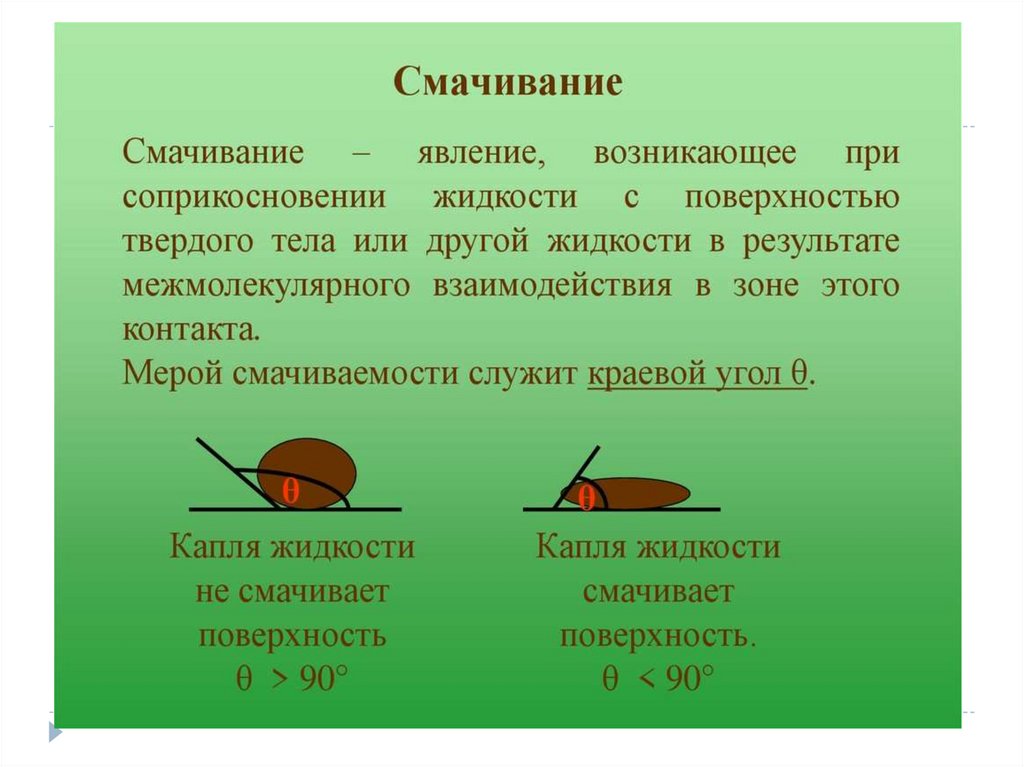
Смачивание – это искривление поверхности жидкости вблизи твердого
тела. Возникает из-за взаимодействия молекул жидкости с молекулами
твердого тела.
Количественная характеристика этого явления – угол смачивания.
44.
45.
46.
47.
48.
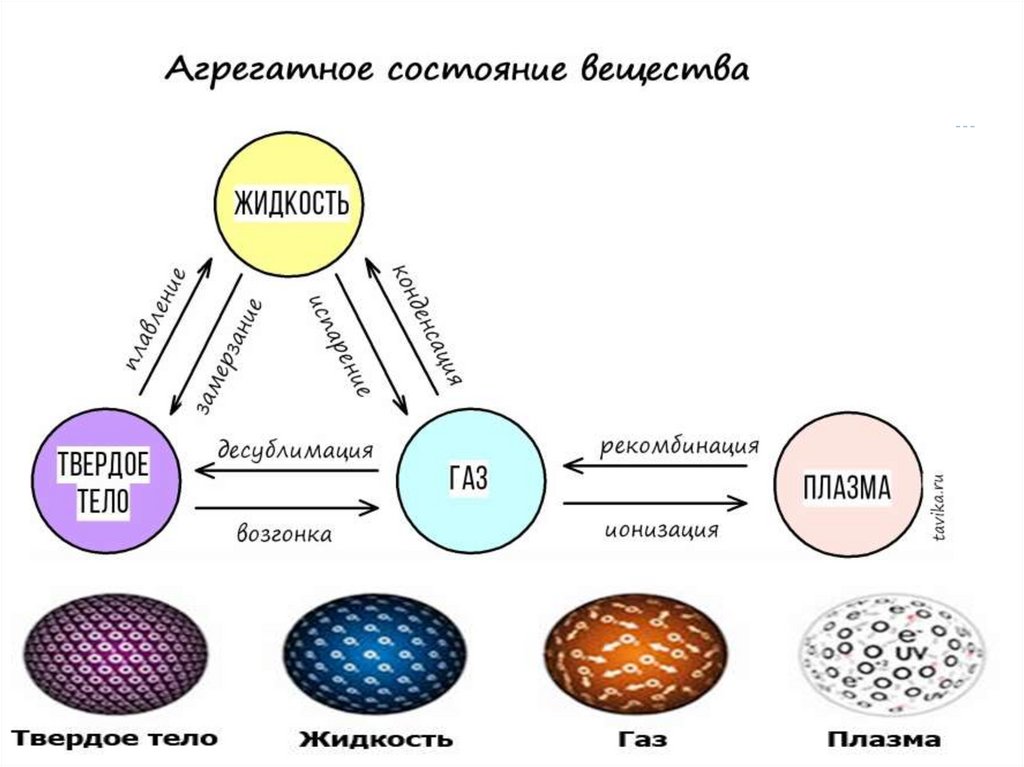
Агрегатные состояния веществаАгрегатные
состояния
Твердое
Жидкое
Газы
Форма
Объём
Расположени
е молекул
Притяжение
молекул
Свойства
49.
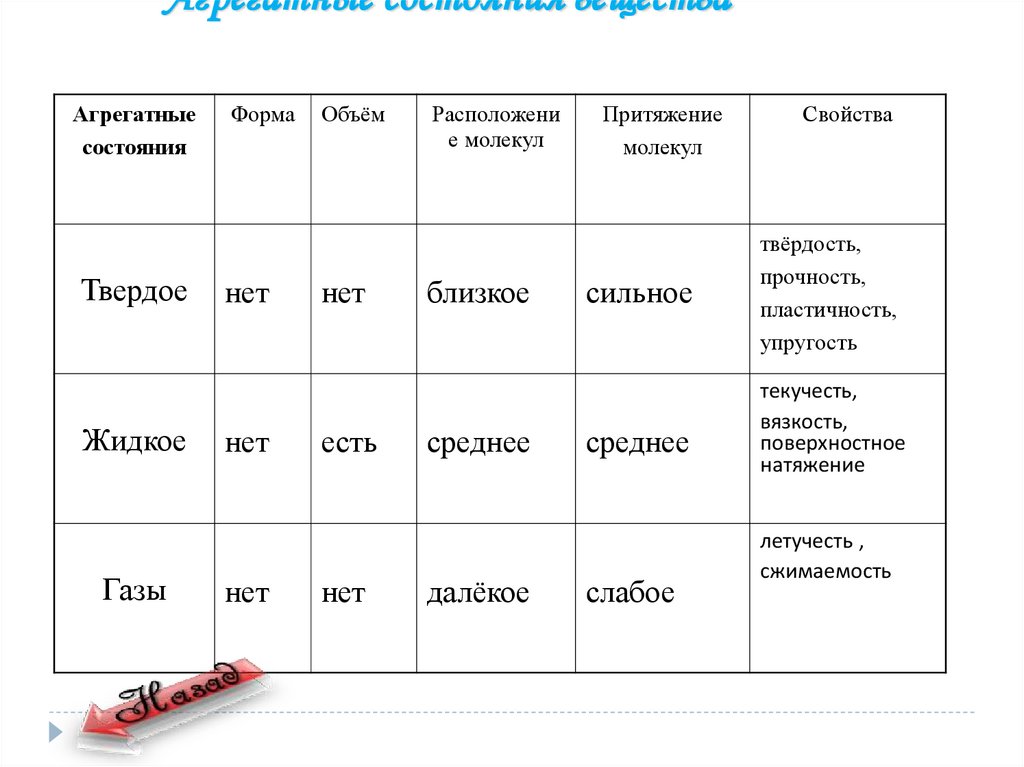
Агрегатные состояния веществаАгрегатные
состояния
Твердое
Жидкое
Газы
Форма
нет
нет
нет
Объём
нет
есть
нет
Расположени
е молекул
близкое
среднее
далёкое
Притяжение
молекул
сильное
среднее
слабое
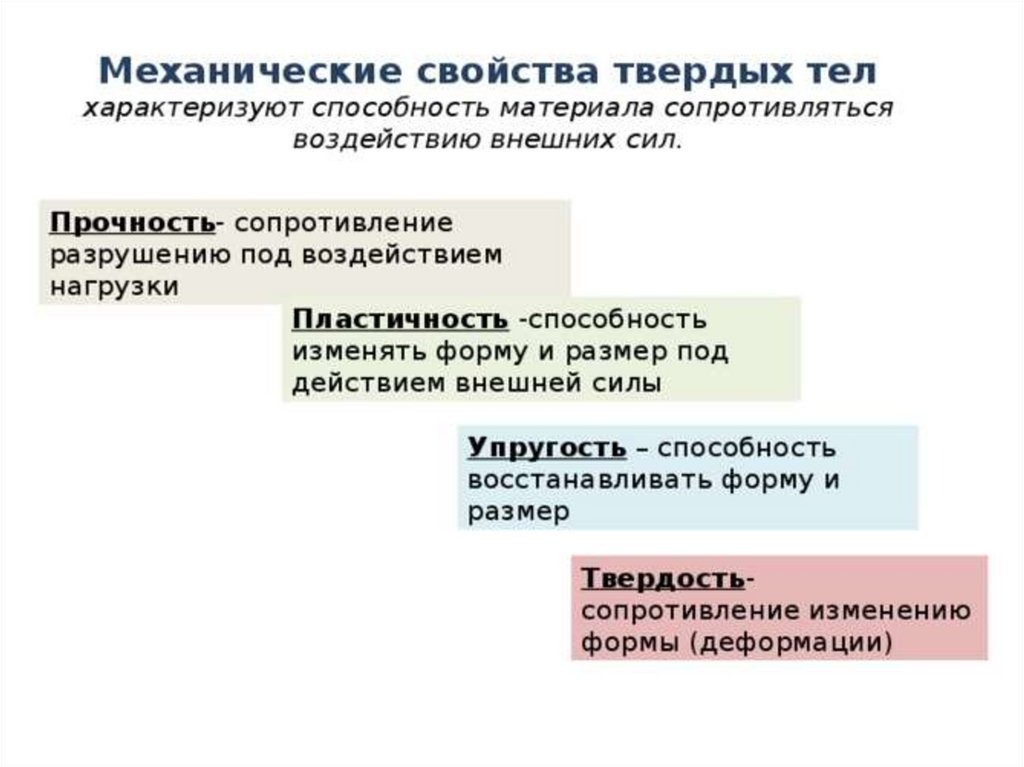
Свойства
твёрдость,
прочность,
пластичность,
упругость
текучесть,
вязкость,
поверхностное
натяжение
летучесть ,
сжимаемость
50.
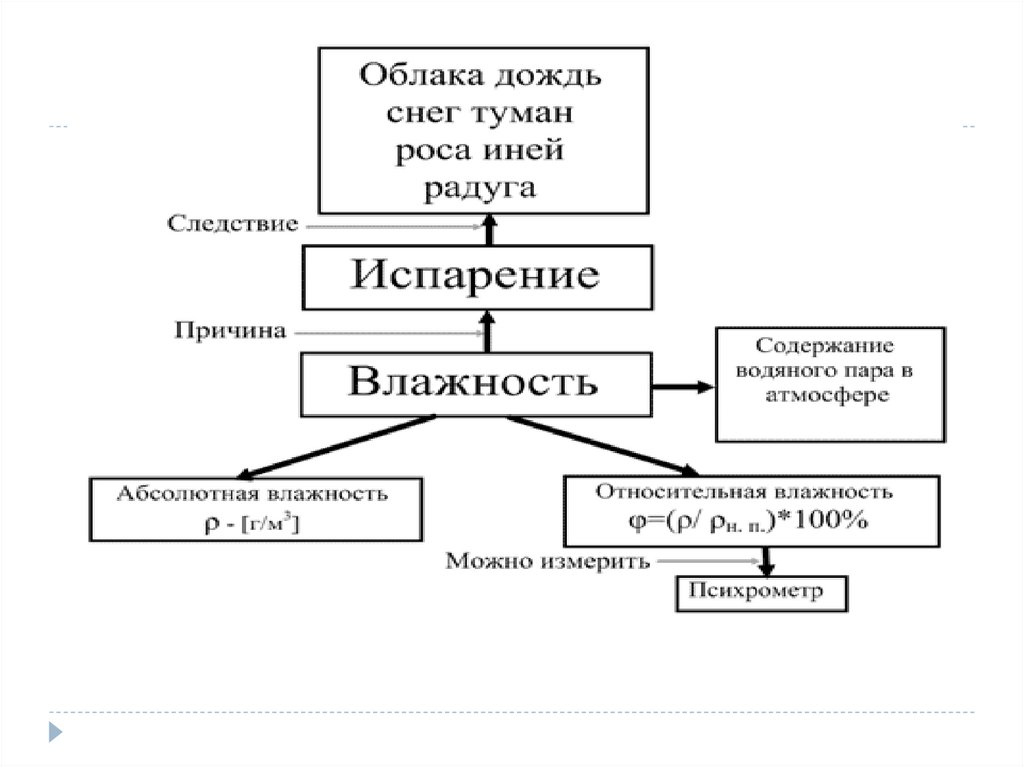
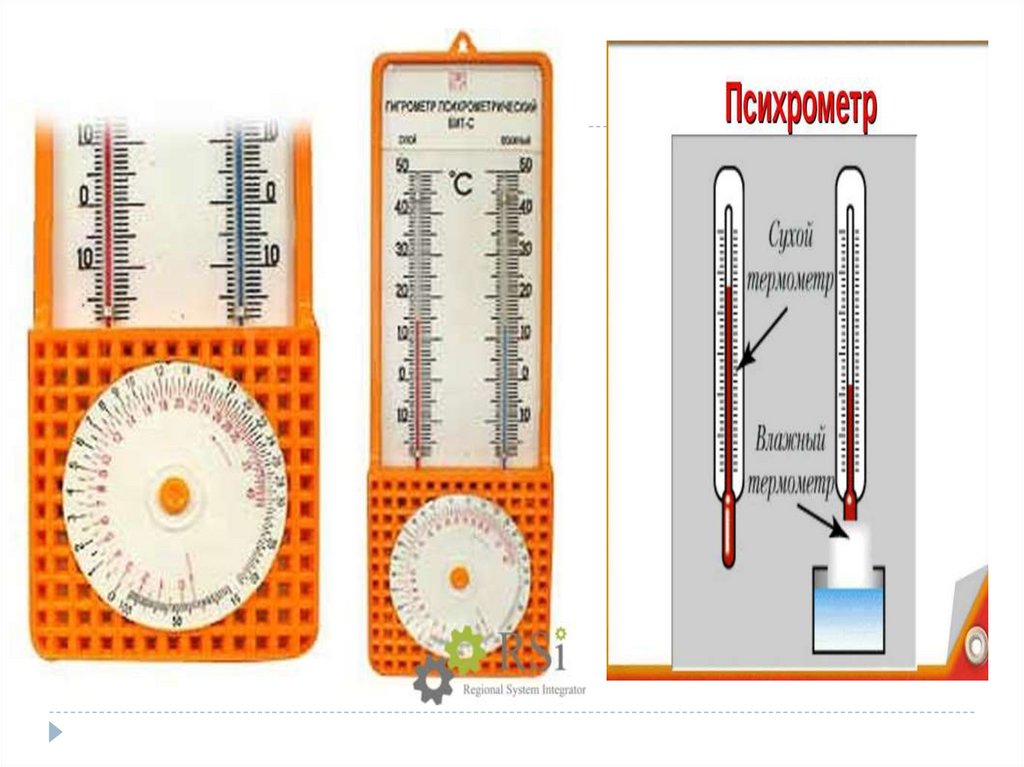
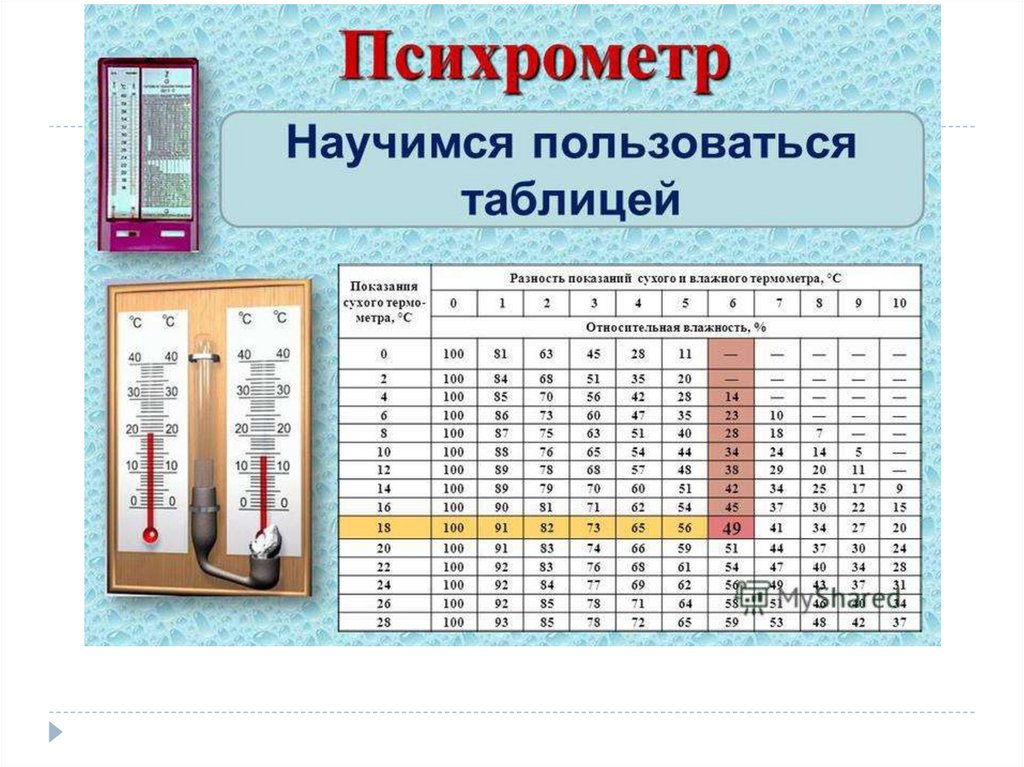
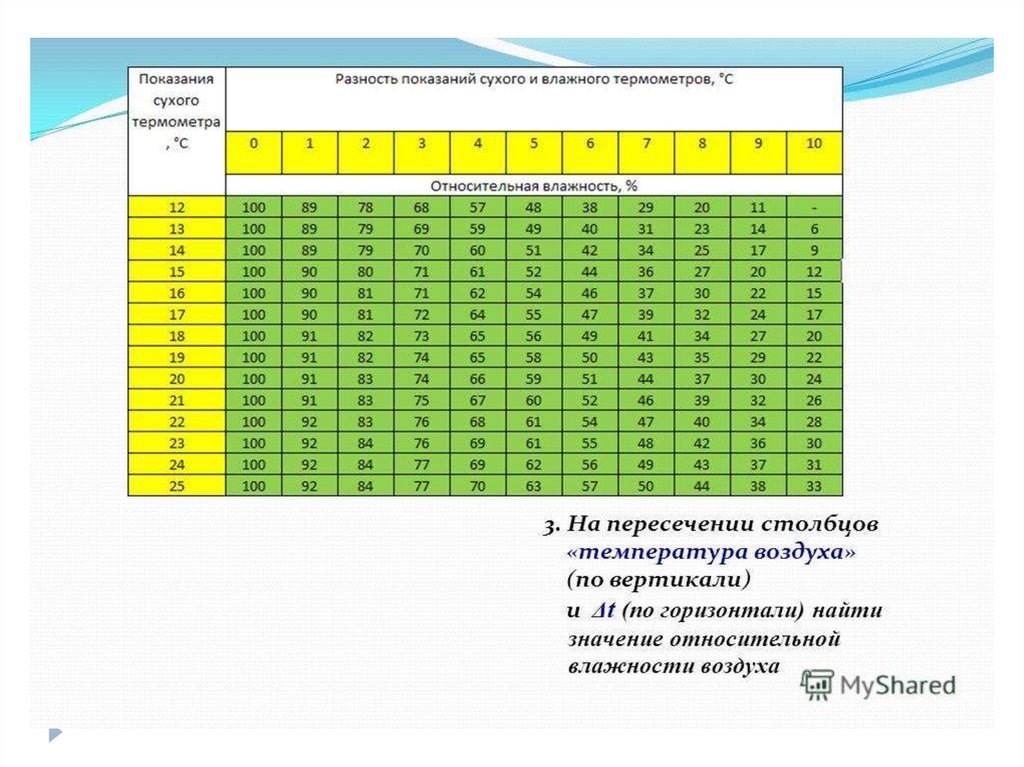
Влажность –наличие водяных паров в воздухе.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
ТЕМПЕРАТУРАмера нагретости тела81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
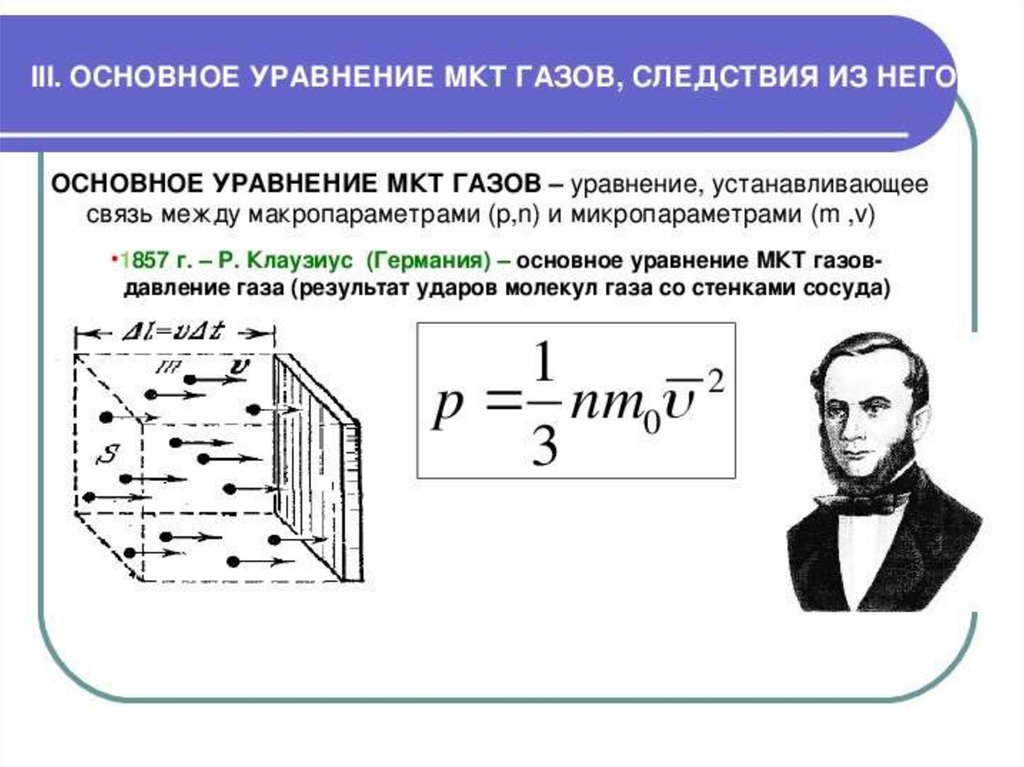
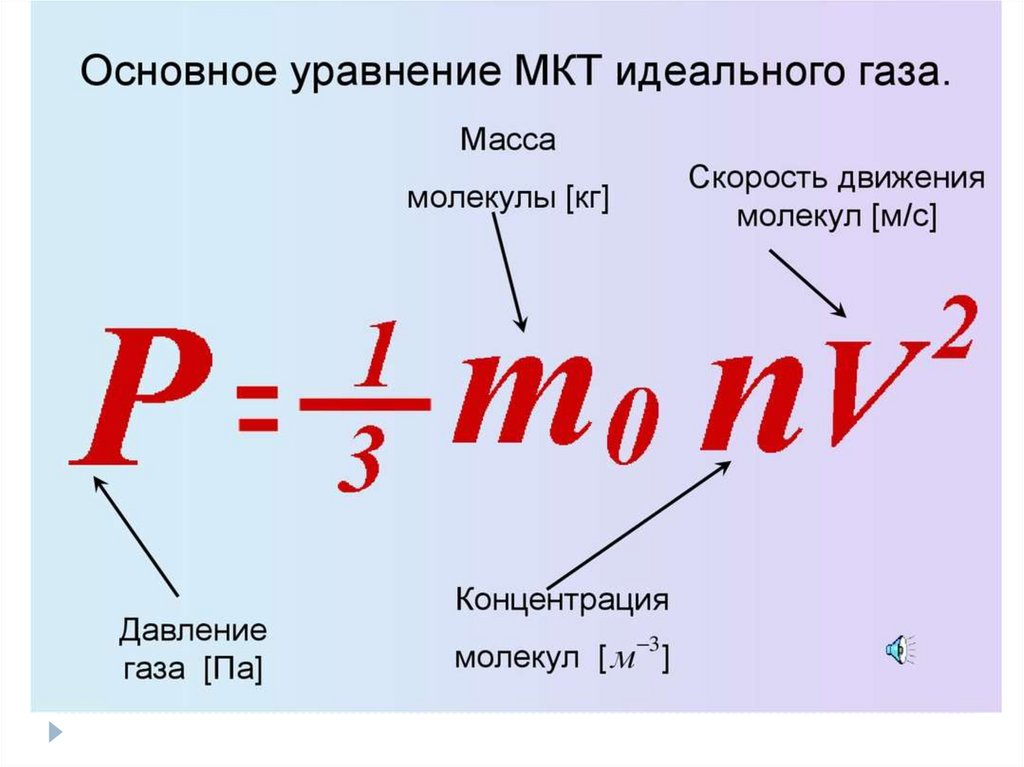
ИДЕАЛЬНЫЙ ГАЗ92.
93.
94.
95.
96.
97.
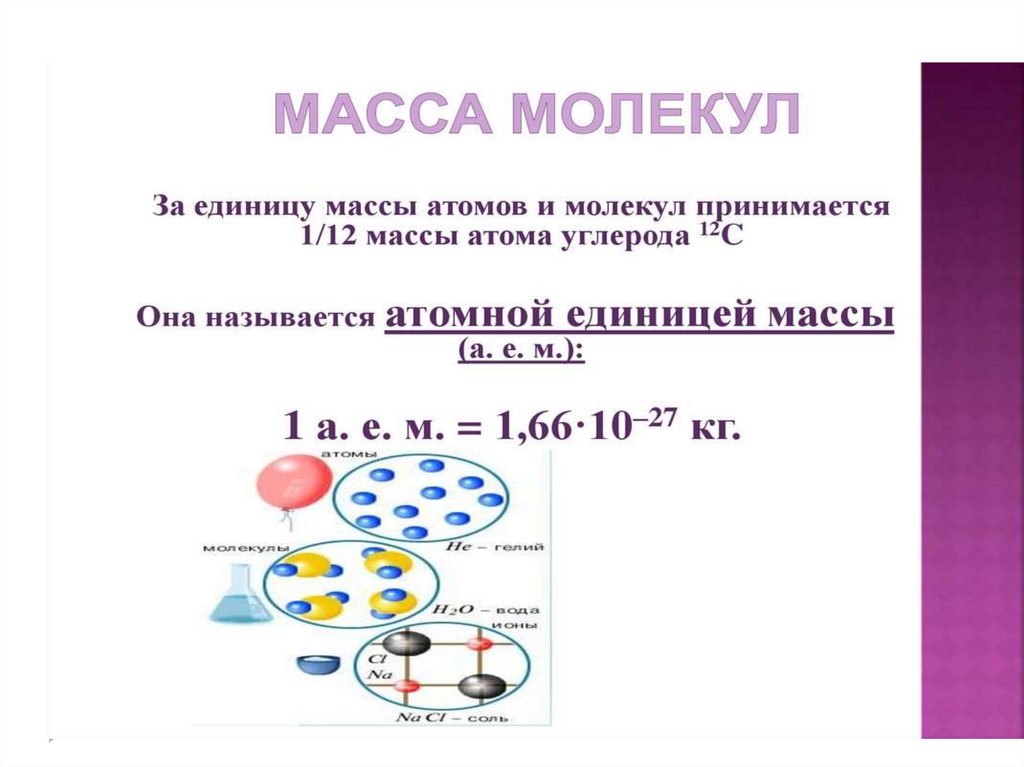
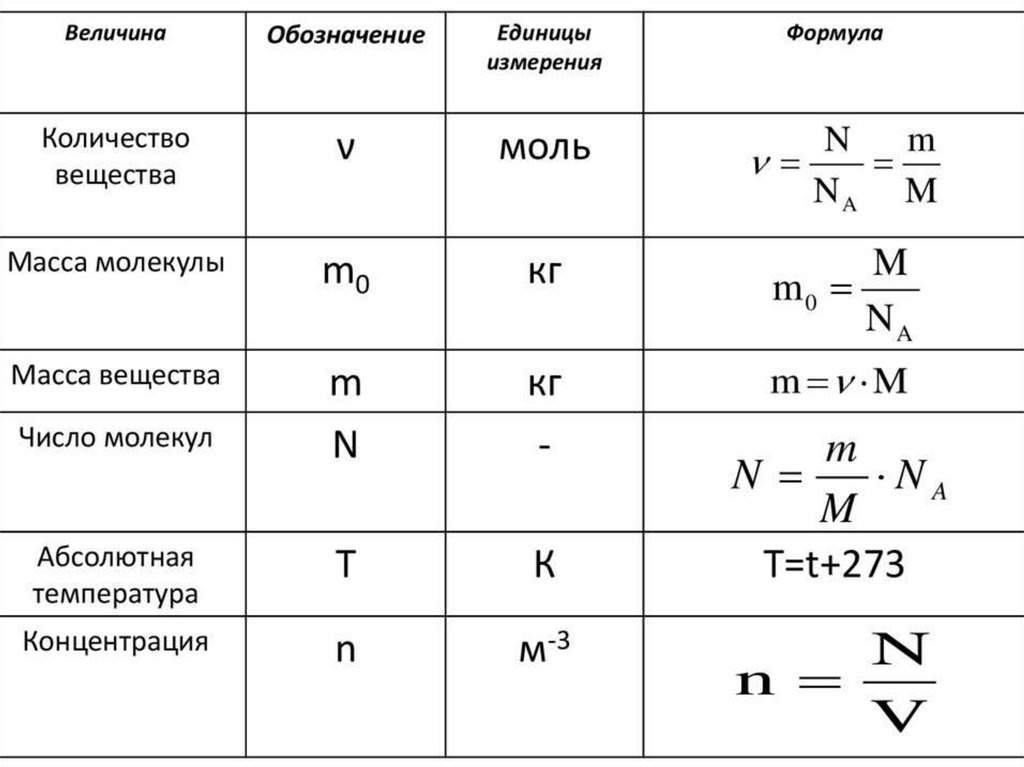
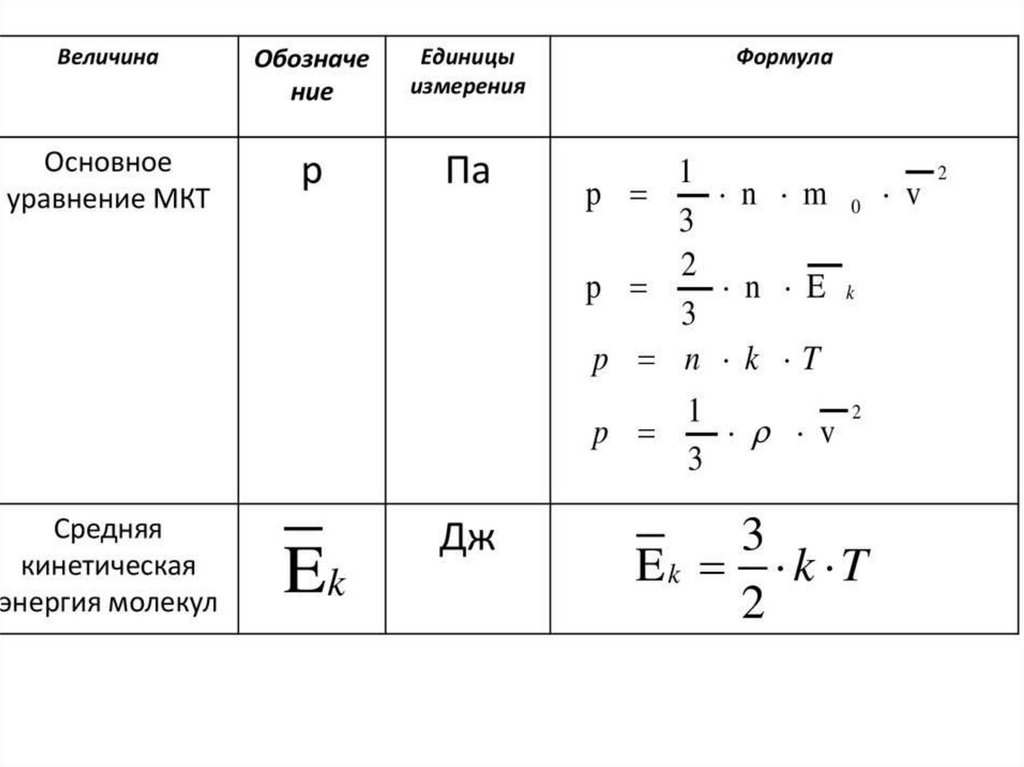
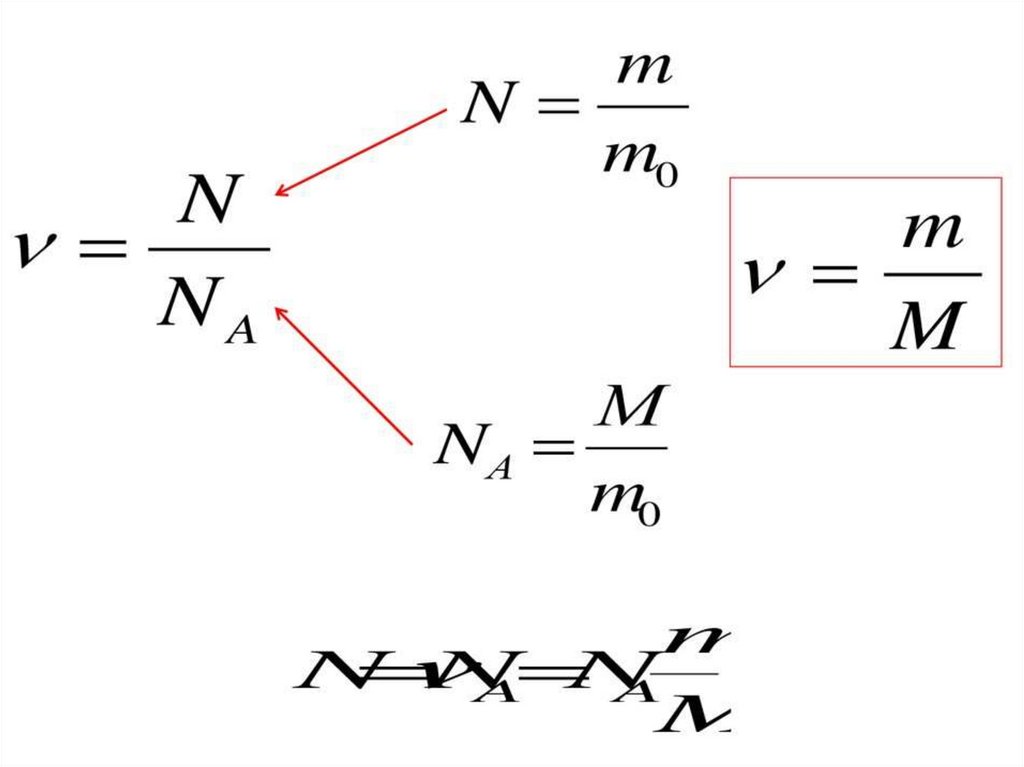
Величины МКТЧисло Авогадро –
число атомов в 12
граммах углерода.
Nа = 6,02 * 10²³ мольֿ¹
Количества вещества –
это количество
вещества, в котором
содержится столько же
частиц, сколько атомов
в 12 граммах углерода.
V=N/ Nа
V- количество вещества
N- число частиц
Молярной
массой М
называется
величина, равная
отношению массы
вещества m к
количеству
вещества ν (ню)
М = m/V
98.
99.
100.
101.
102.
103.
104.
105.
106.
107.
108.
109.
110.
111.
112.
113.
114.
115.
116.
117.
118.
119.
120.
121.
122.
123.
124.
125.
126.
127.
128.
129.
130.
131.
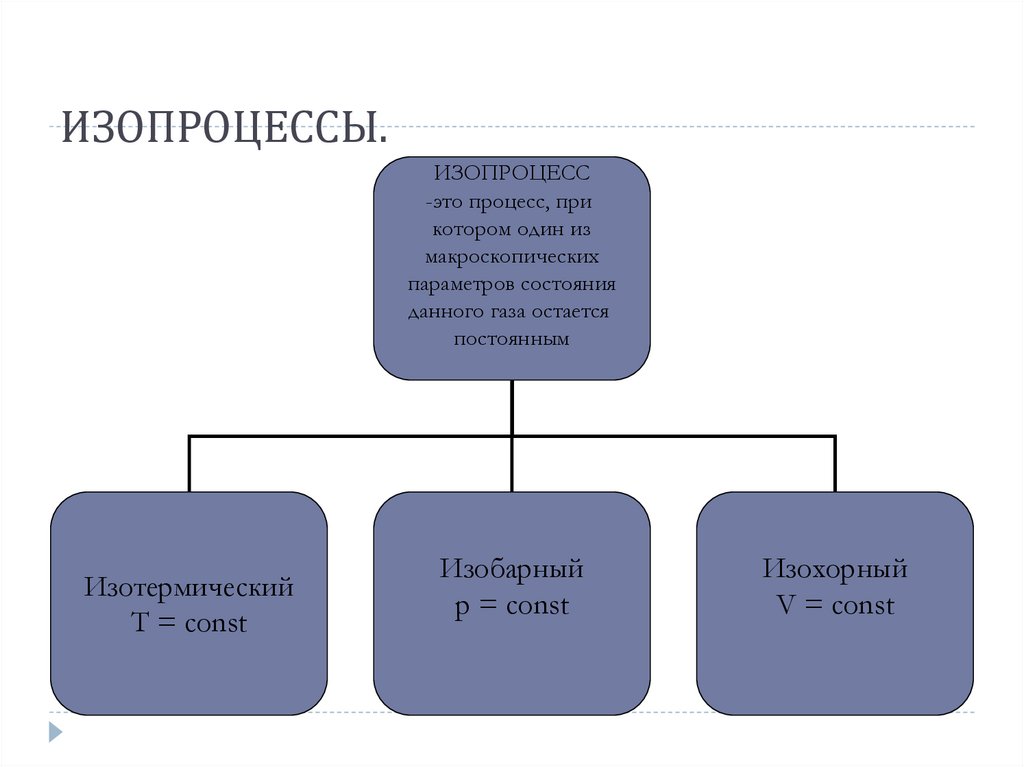
ИЗОПРОЦЕССЫ.ИЗОПРОЦЕСС
-это процесс, при
котором один из
макроскопических
параметров состояния
данного газа остается
постоянным
Изотермический
Т = const
Изобарный
p = const
Изохорный
V = const
132.
ТЕРМОДИНАМИКА (от термо... и динамика), раздел физики, изучающий наиболееобщие свойства макроскопических систем, находящихся в состоянии
термодинамического равновесия, и процессы перехода между этими состояниями.
(Неравновесные процессы изучает термодинамика неравновесных процессов.)
Термодинамика строится на основе фундаментальных принципов — начал
термодинамики, которые являются обобщением многочисленных
наблюдений и результатов экспериментов
Термодинамика возникла в 1-й пол. 19 в. в связи с развитием теории
тепловых машин (С. Карно) и установлением закона сохранения энергии (Ю.
Р. Майер, Дж. Джоуль, Г. Гельмгольц).
Основные этапы развития термодинамики связаны с именами Р. Клаузиуса и
У. Томсона (формулировки второго начала термодинамики), Дж. Гиббса
(метод термодинамических потенциалов), В. Нернста (третье начало
термодинамики) и др.
Различают химическую термодинамику, техническую термодинамику и
термодинамику различных физических явлений.
133.
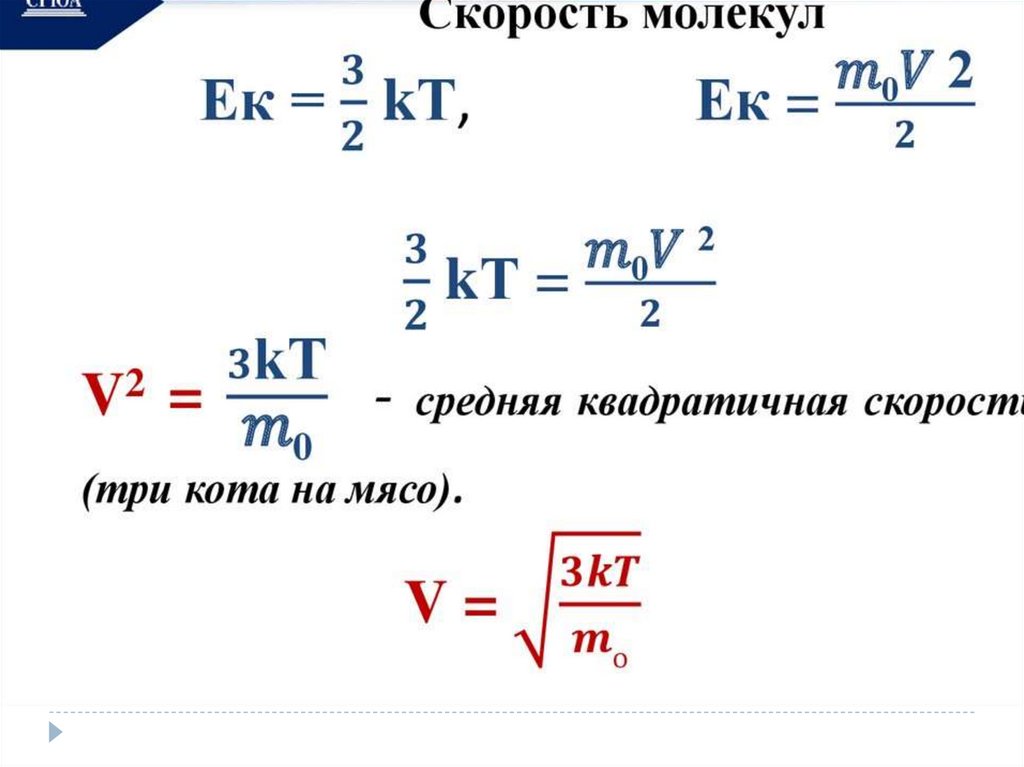
Термодинамика.Внутренняя энергия тела – сумма кинетической
энергии хаотического теплового движения частиц
(атомов или молекул) тела и потенциальной энергии
их взаимодействия.
U- внутренняя энергия
[U] – Дж
U=Ек + Ер (1)
U=3/2 m/M RT (2)
U=3/2 pV (3)
134.
АДИАБАТНЫЙ ПРОЦЕСС (адиабатическийпроцесс), термодинамический процесс, при
котором система не получает теплоты извне
и не отдает ее. Быстропротекающие
процессы (напр., распространение звука)
могут приближенно рассматриваться как
адиабатный процесс и при отсутствии
теплоизолирующей оболочки.


























































































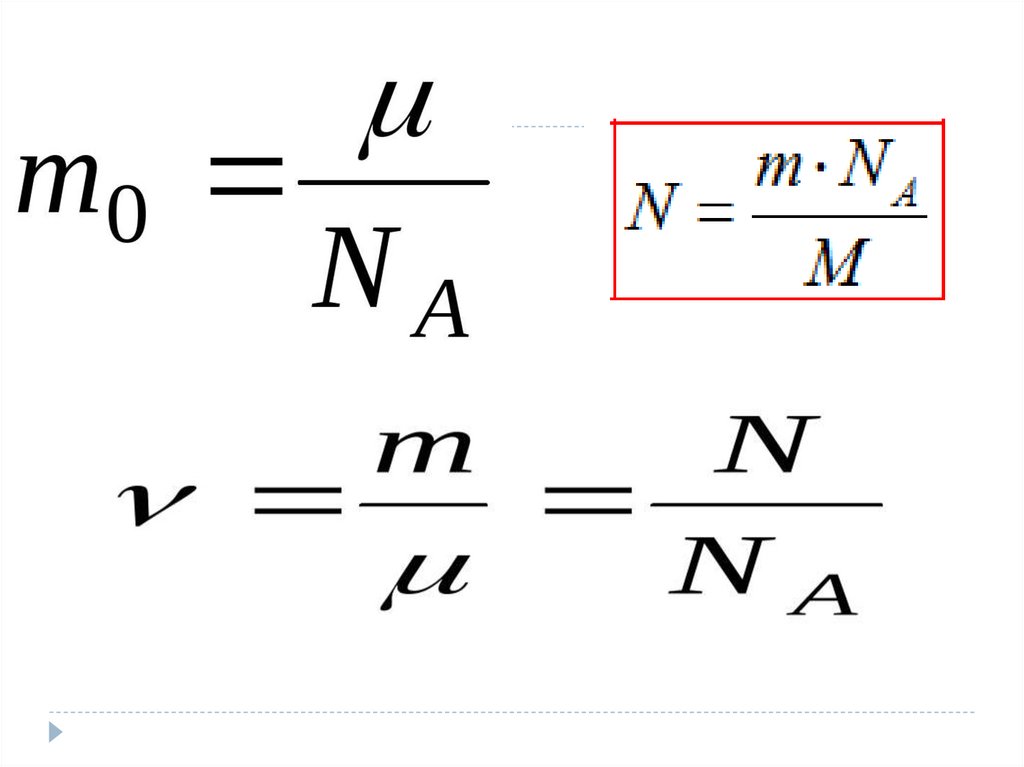



 physics
physics








