Similar presentations:
Молекулярная физика
1.
МОЛЕКУЛЯРНАЯФИЗИКА
2.
Молекулярная физика –это раздел физики, изучающий внутреннее
строение тел, а также тепловые процессы,
происходящие внутри вещества.
Идея о том, что все тела состоят из
мельчайших частиц – атомов, и, что тепло
представляет собой внутреннее движение и
энергию этих атомов, высказывались еще
античными философами.
3.
4.
5.
6.
7.
8.
9.
10.
ГЛАВЫ11.
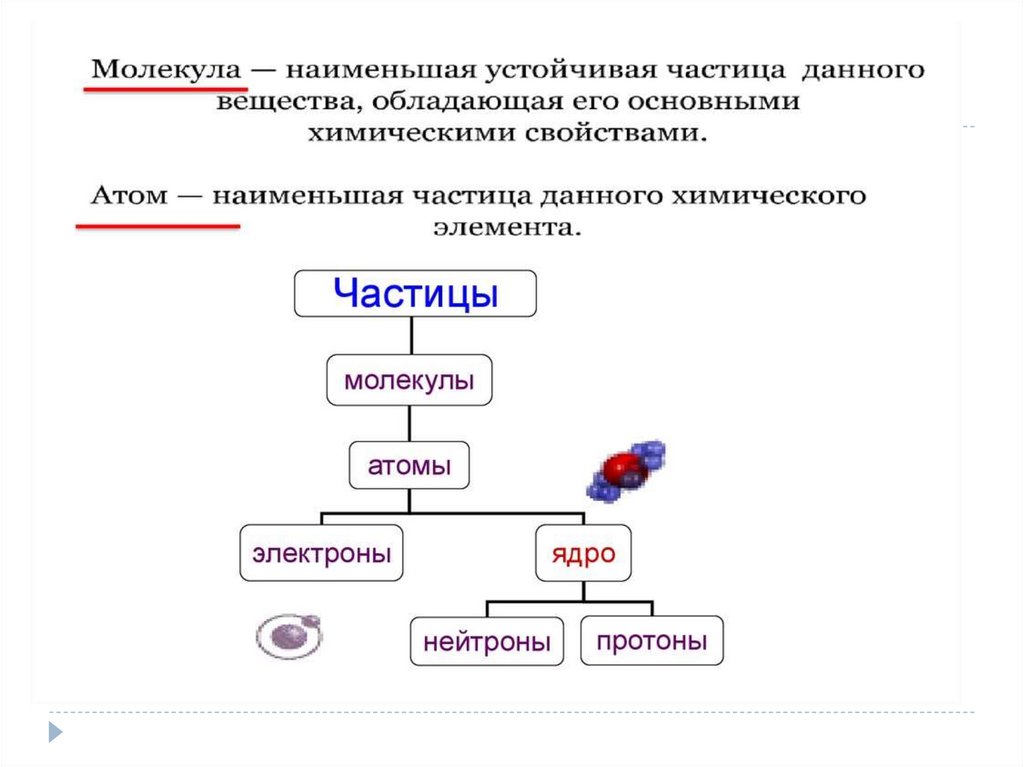
1)Положение МКТ :Все тела (вещества)
состоят из частиц
(молекул, атомов, ионов)
между которыми есть
промежутки.
Опытные обоснования:
- крошение вещества;
-испарение жидкости;
-смешивание веществ;
диффузия;
-фотография туннельного
микроскопа.
12.
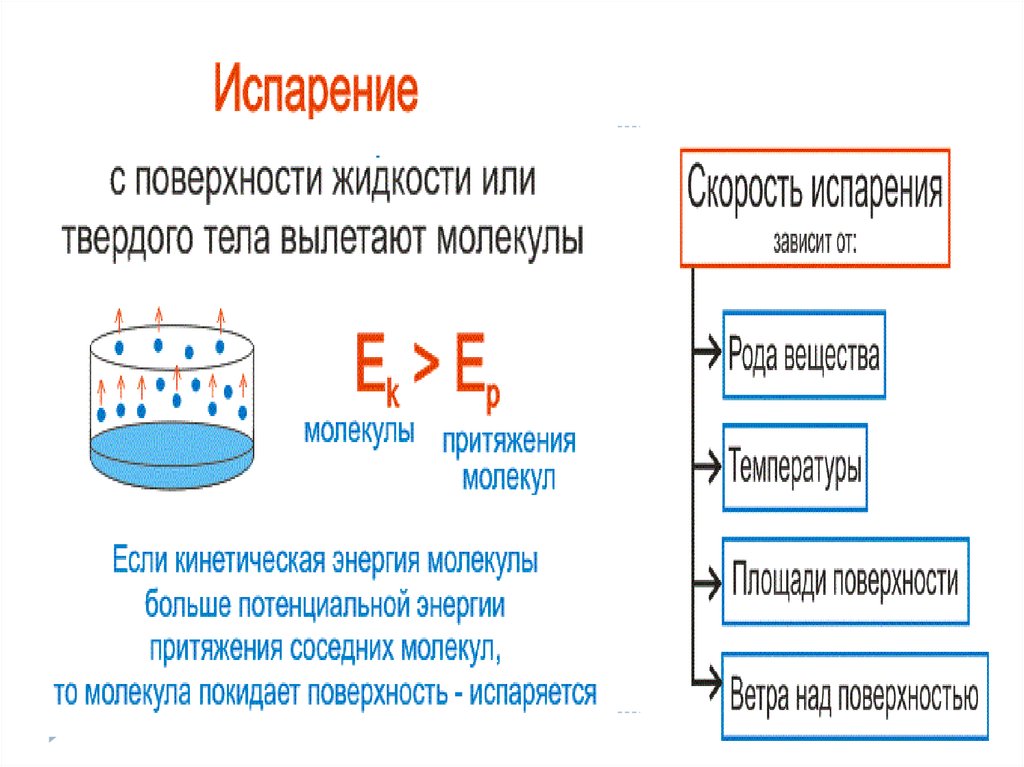
2)Положение МКТ :Частицы вещества непрерывно и хаотически
движутся
Опытные обоснования:
- Броуновское движение –
постоянное, беспорядочное (хаотичное)
движение частиц (тепловое движение)
-Испарение вылет частиц с поверхности вещества
-Диффузия самопроизвольное проникновение частиц одного
вещества в промежутки между частицами другого
вещества
13.
14.
15.
3)Положение МКТ :Частицы вещества взаимодействуют друг с другом
16.
МОЛЕКУЛЯРНАЯ ФИЗИКАизучает физические свойства тел в различных
агрегатных состояниях на основе их молекулярного
строения.
17.
18.
19.
20.
21.
22.
23.
24.
25.
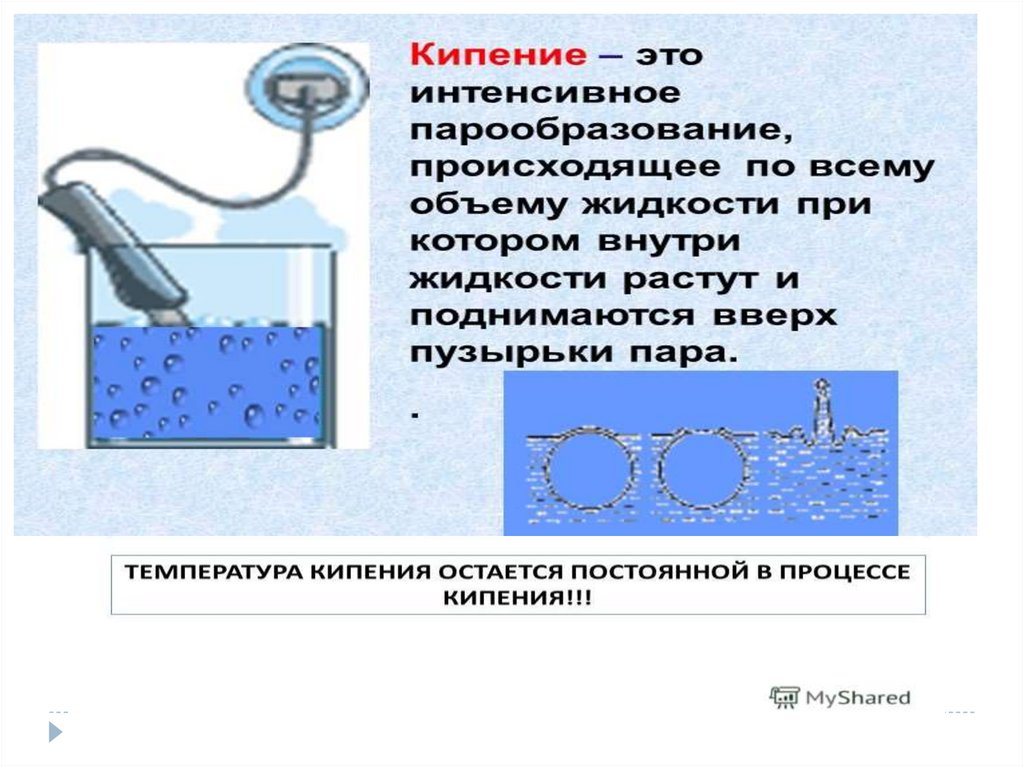
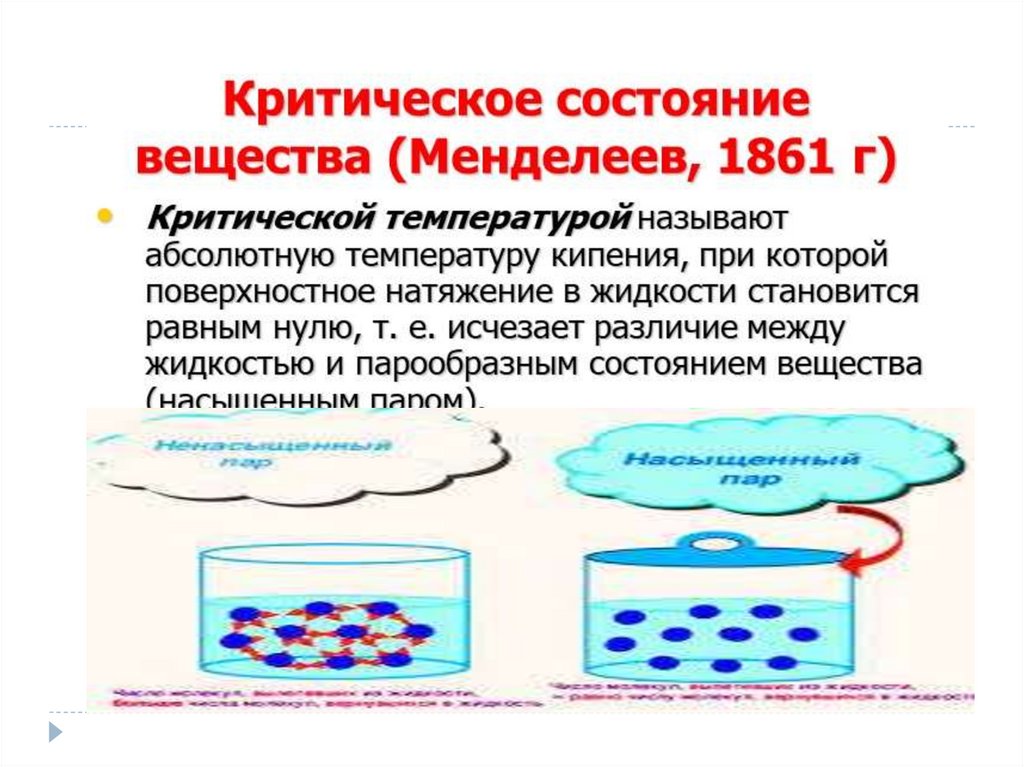
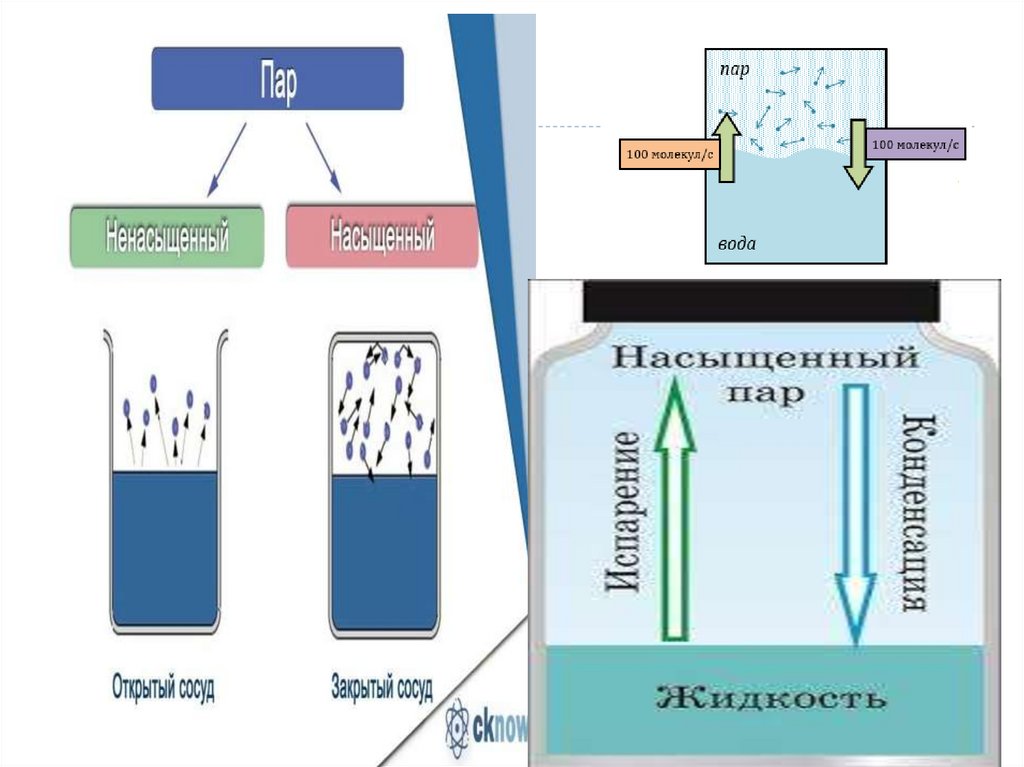
Насыщенный пар-это пар, в которомколичество испарившихся молекул =
количеству конденсирующихся молекул за
единицу времени
26.
27.
28.
29.
30.
С явлением поверхностного натяженияжидкости мы сталкиваемся каждый день:
капли воды стремятся принять форму,
близкую к шарообразной (а в невесомости
они совсем шарообразные);
струя воды из-под крана стремится к
цилиндрической форме;
булавка не тонет на поверхности воды в
стакане;
многие насекомые могут скользить по
поверхности воды(водомерки)
31.
32.
33.
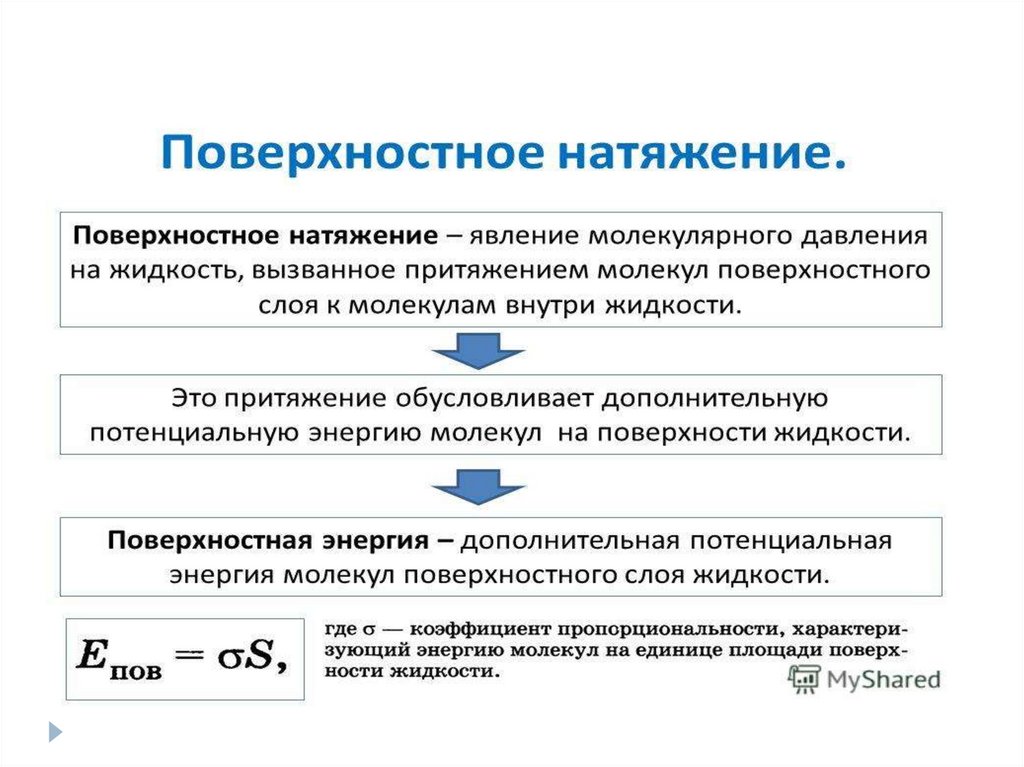
Коэффициент поверхностного натяжения σσ = Е/S
Е — поверхностная энергия жидкости [Дж]
S — площадь свободной поверхности [м2]
σ — коэффициент поверхностного натяжения [Н/м]
Коэффициент поверхностного натяжения σ
жидкости зависит:
-от природы жидкости;
-температуры жидкости;
-свойств газа, который граничит с данной жидкостью;
-наличия поверхностно-активных веществ (например, мыло
или стиральный порошок), которые уменьшают
поверхностное натяжение.
34.
l — длина контура, ограничивающего поверхностьжидкости [м]
σ — коэффициент поверхностного натяжения [Н/м]
35.
36.
37.
38.
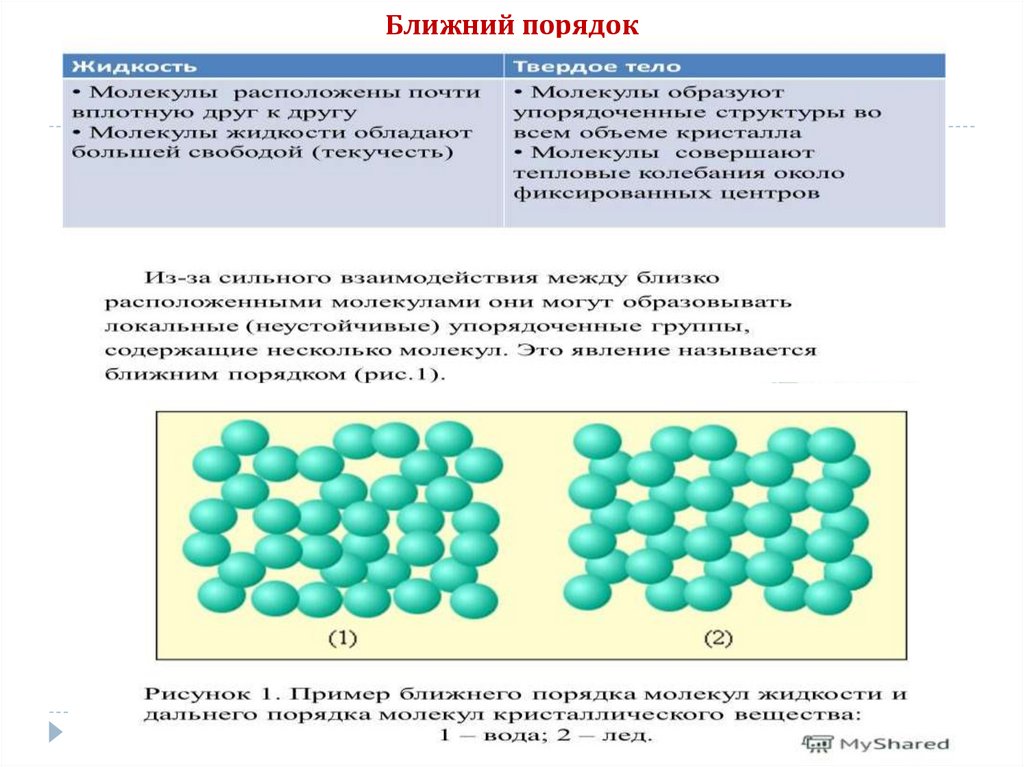
Ближний порядок39.
40.
41.
42.
43.
Выводы:Поверхностное натяжение – это явление, при котором жидкость
стремиться приобрести форму с наименьшей возможной площадью
поверхности.
Примеры поверхностного натяжения в природе:
-жидкость приобретает форму капли
-капля принимает шарообразную форму
-водомерка удерживается на поверхности воды
Коэффициент поверхностного натяжения – коэффициент, равный
энергии(работе), которую необходимо совершить для образования
поверхности жидкости площадью S при постоянной температуре.
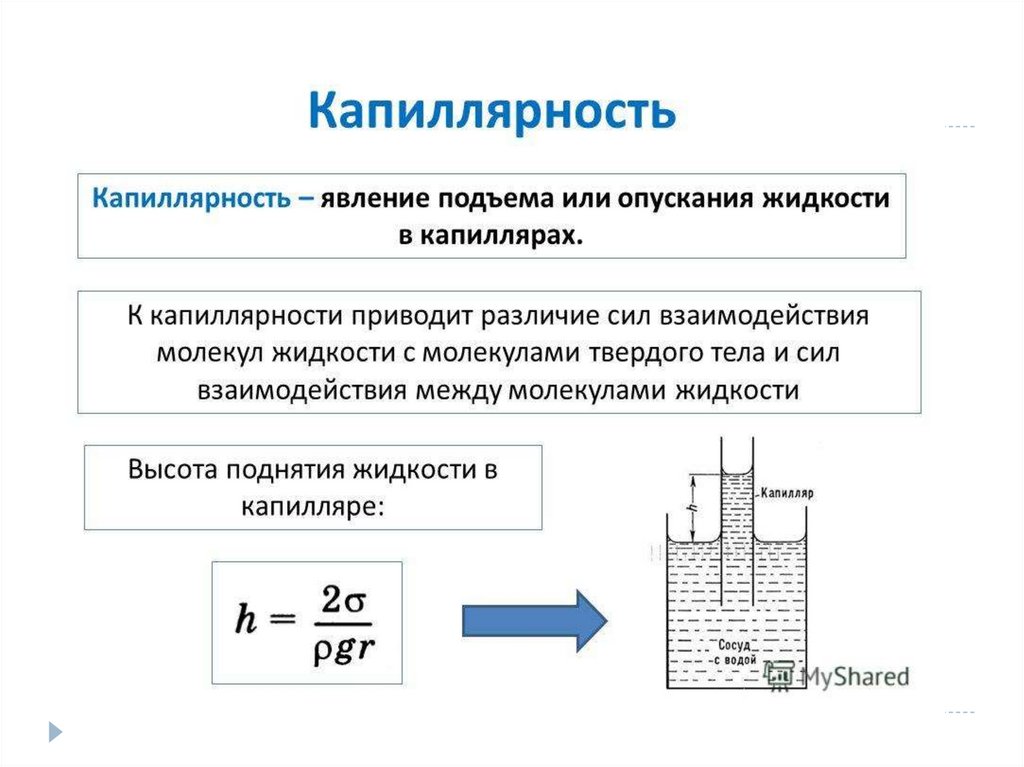
Капиллярные явления – подъем или опускание жидкости в
капиллярах (трубках малого диаметра).
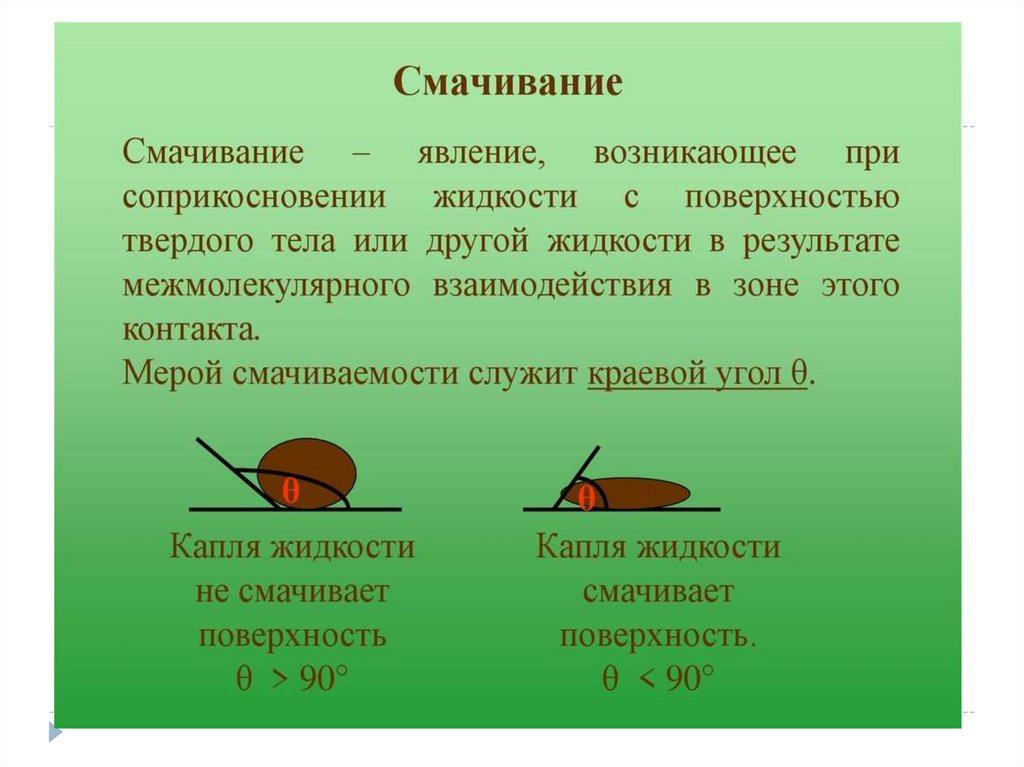
Смачивание – это искривление поверхности жидкости вблизи твердого
тела. Возникает из-за взаимодействия молекул жидкости с молекулами
твердого тела.
Количественная характеристика этого явления – угол смачивания.
44.
45.
46.
47.
48.
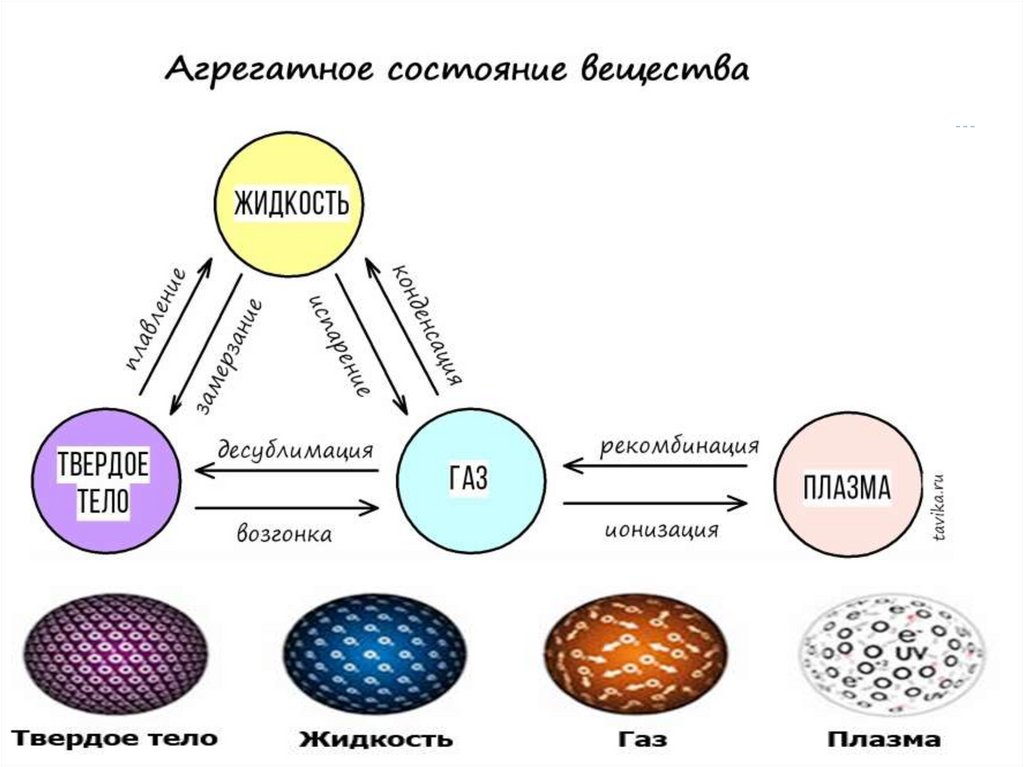
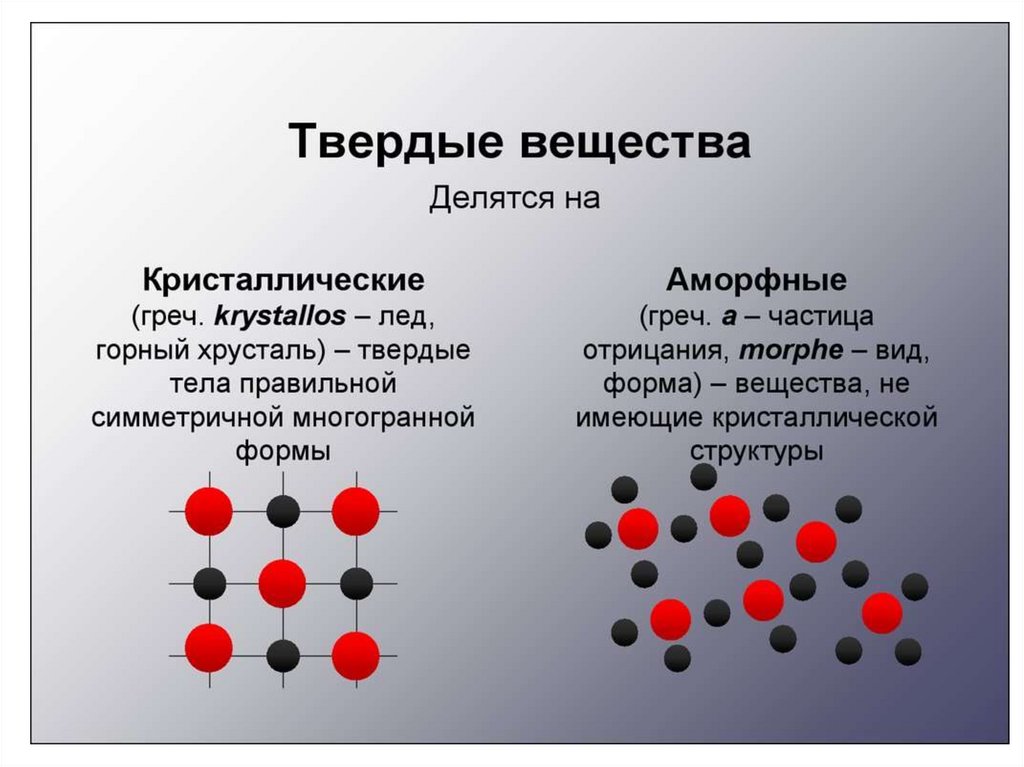
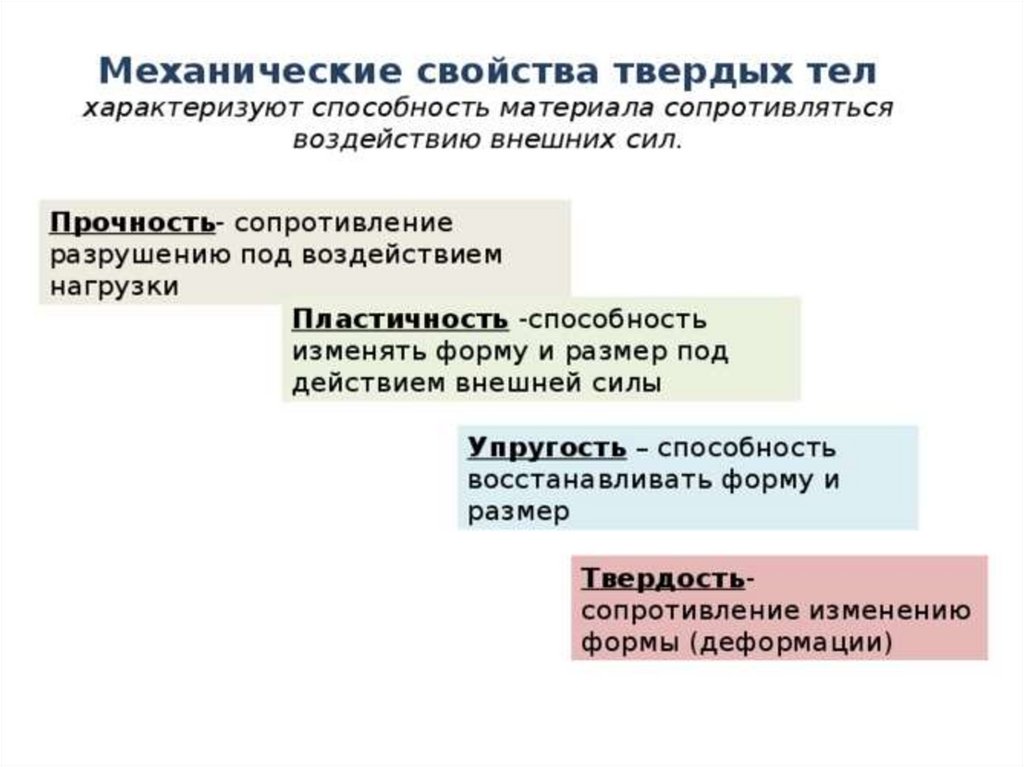
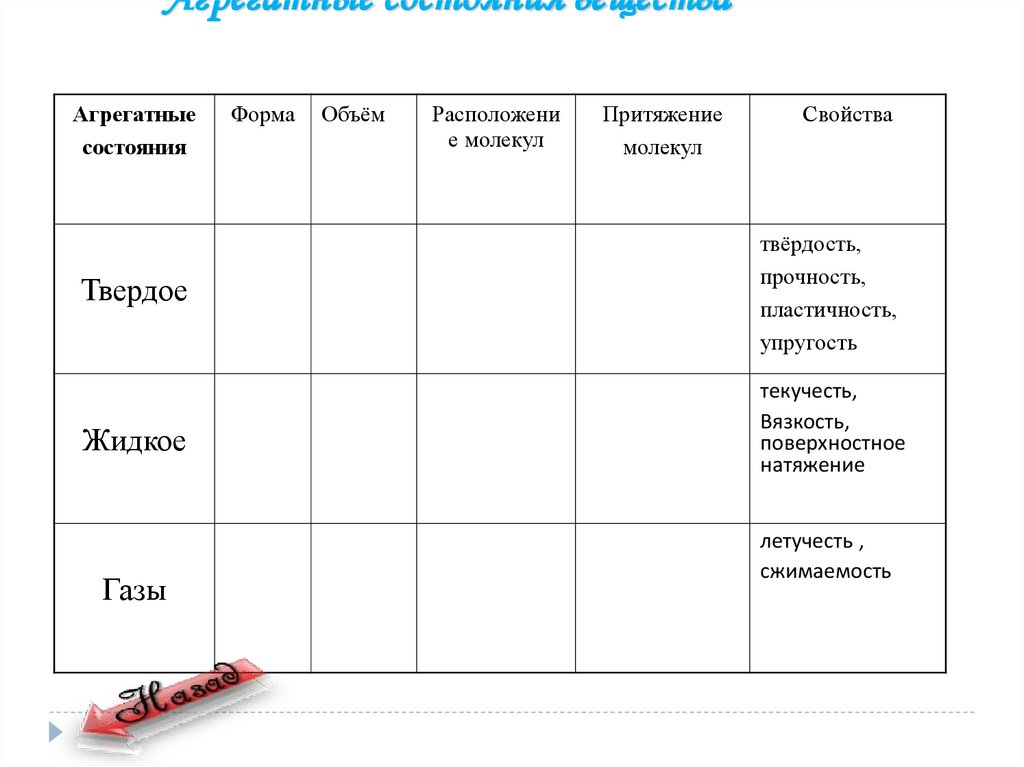
Агрегатные состояния веществаАгрегатные
состояния
Форма
Объём
Расположени
е молекул
Притяжение
молекул
Свойства
Твердое
твёрдость,
прочность,
пластичность,
упругость
Жидкое
текучесть,
Вязкость,
поверхностное
натяжение
Газы
летучесть ,
сжимаемость
49.
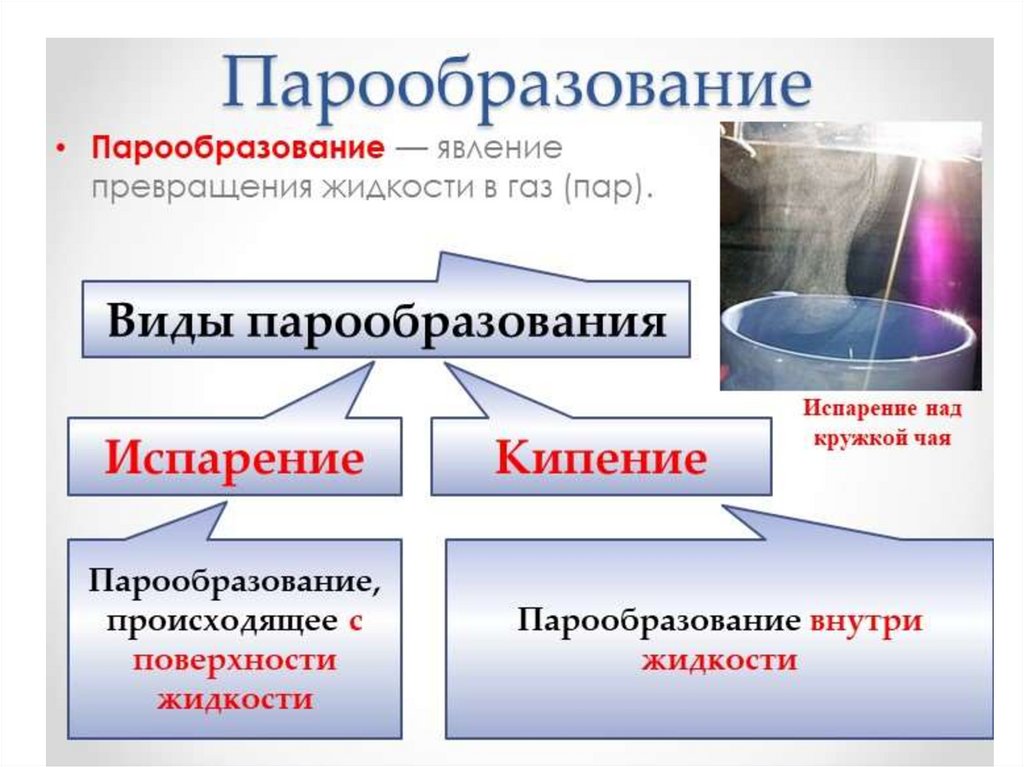
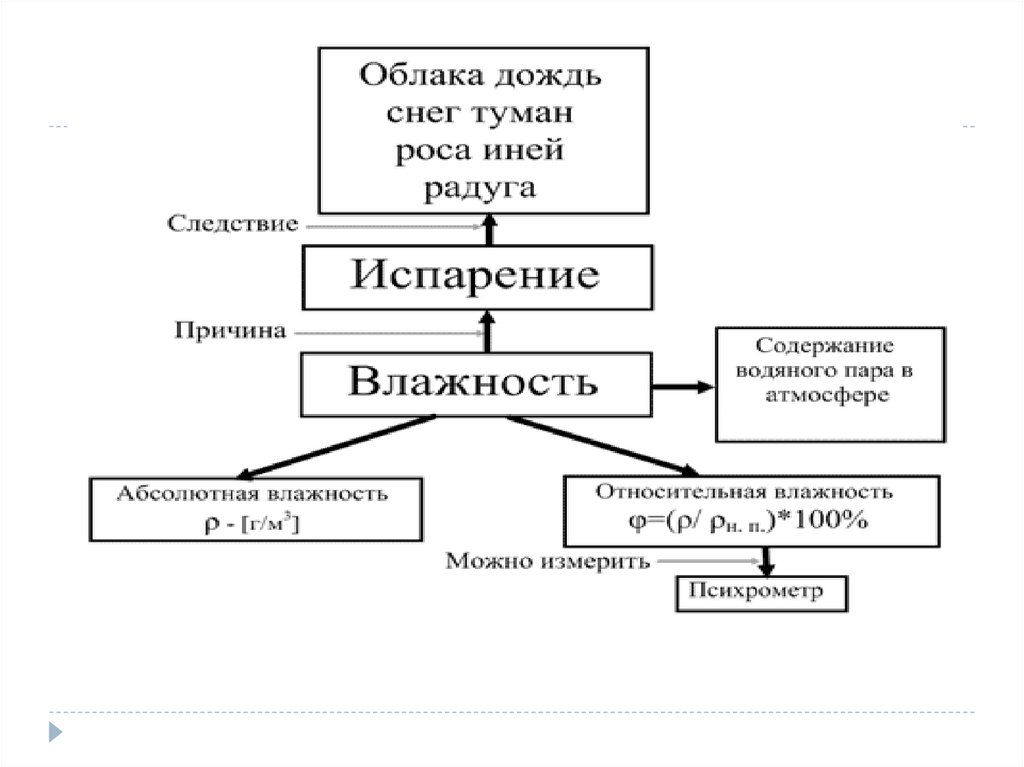
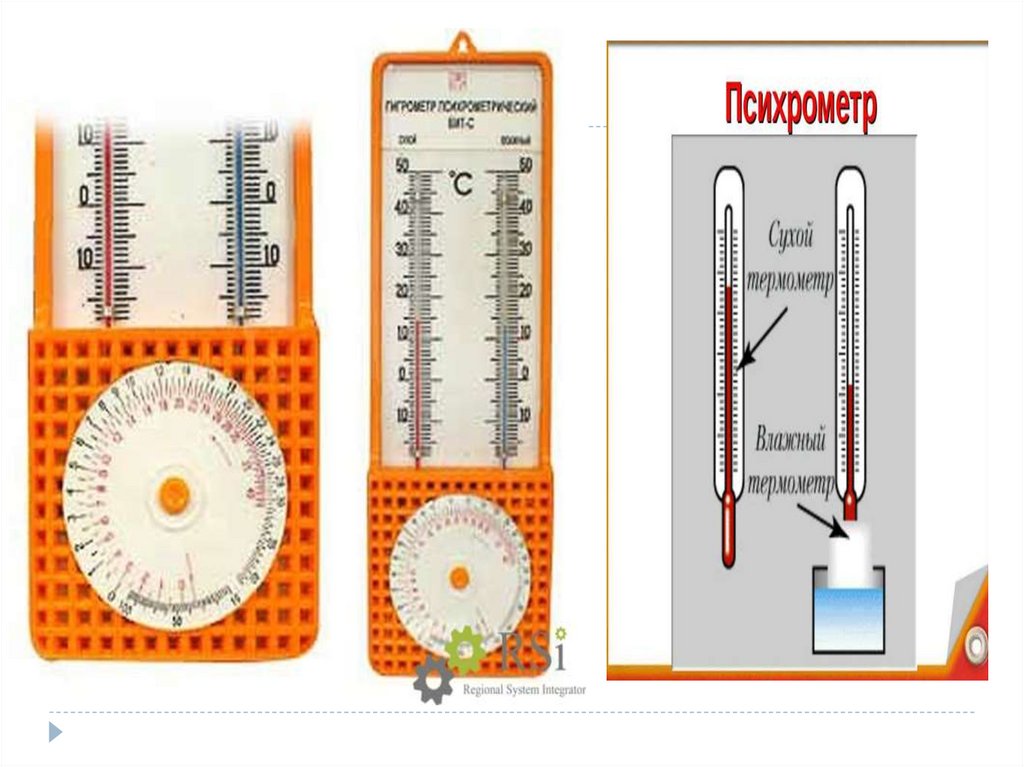
Влажность –наличие водяных паров в воздухе.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
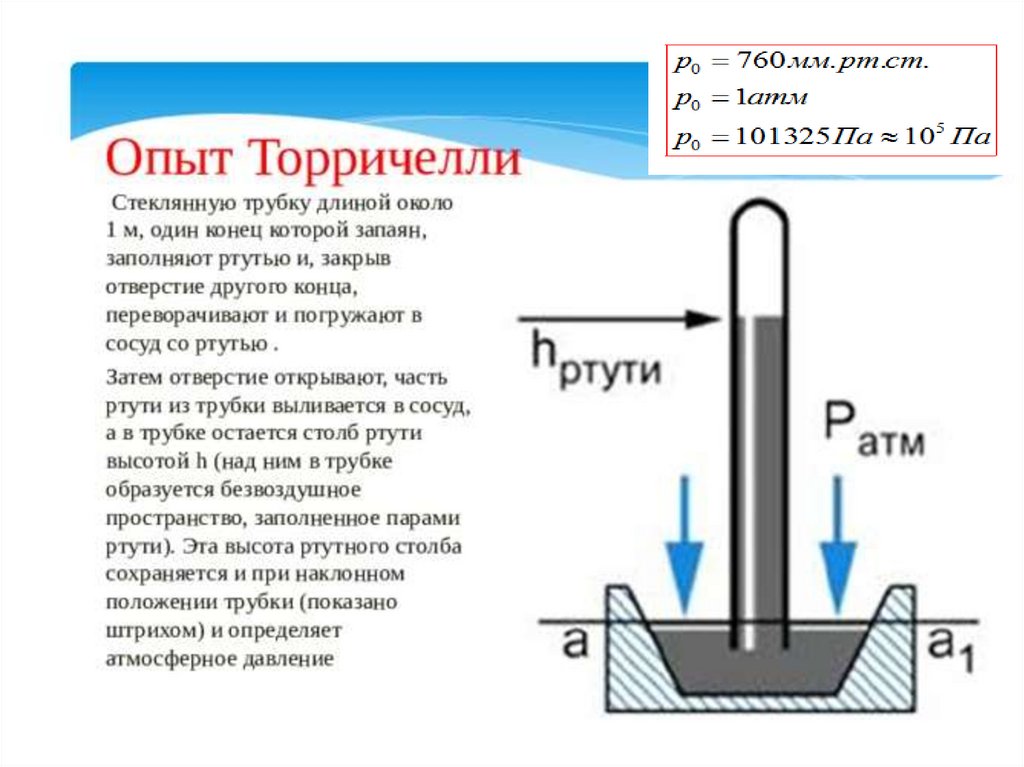
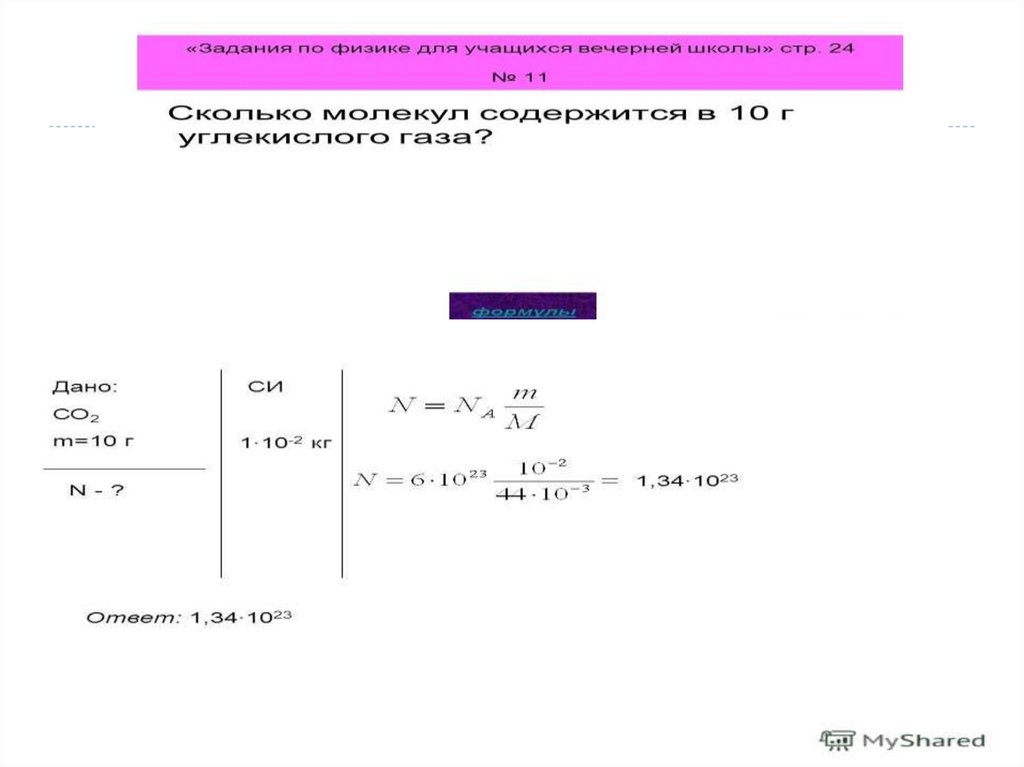
ЗАДАЧИ1)Давление паров воды в воздухе при температуре 10 °С
равно 900 Па. Найдите относительную влажность
воздуха.
2) В воздухе с относительной влажностью 60% давление
водяного пара равно 960 Па. Чему равно давление
насыщенного водяного пара при этой же температура?
3)
Найти относительную влажность
воздуха при температуре=40°C,если в одном
кубическом метре воздуха содержится 3,2 грамма
воды. Плотность насыщенного пара по таблице
4)Влажность воздуха
http://kornev-school.ru/f8_air_humidity.html
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
ИДЕАЛЬНЫЙ ГАЗ82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
ТЕМПЕРАТУРА93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
105.
106.
107.
108.
109.
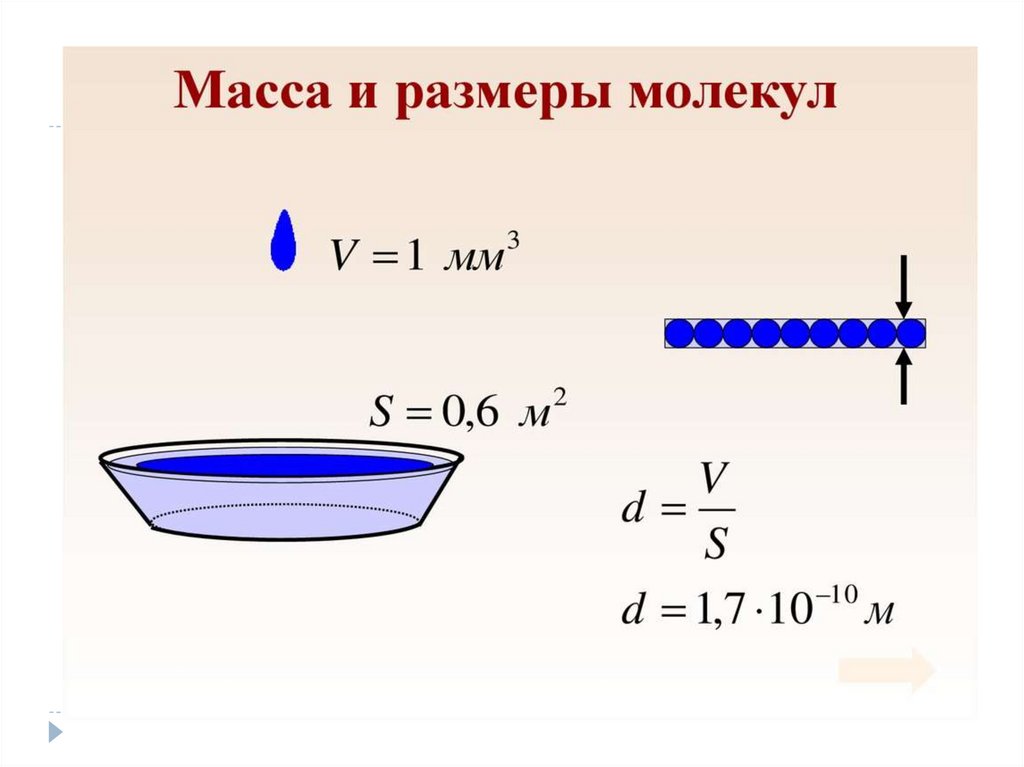
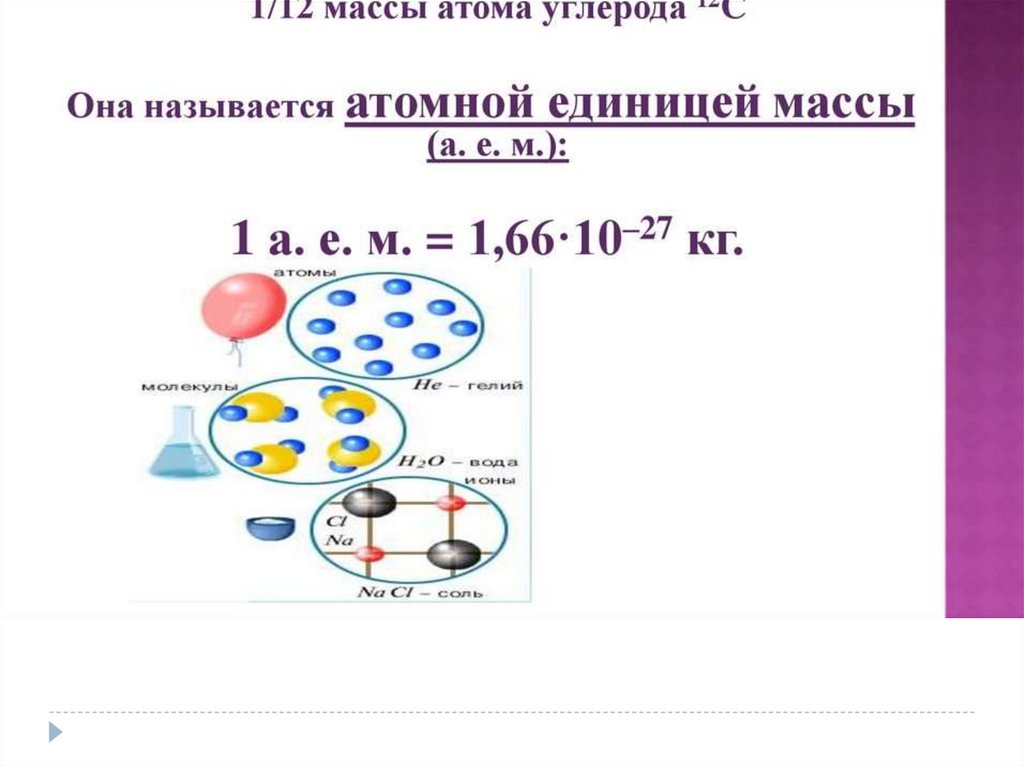
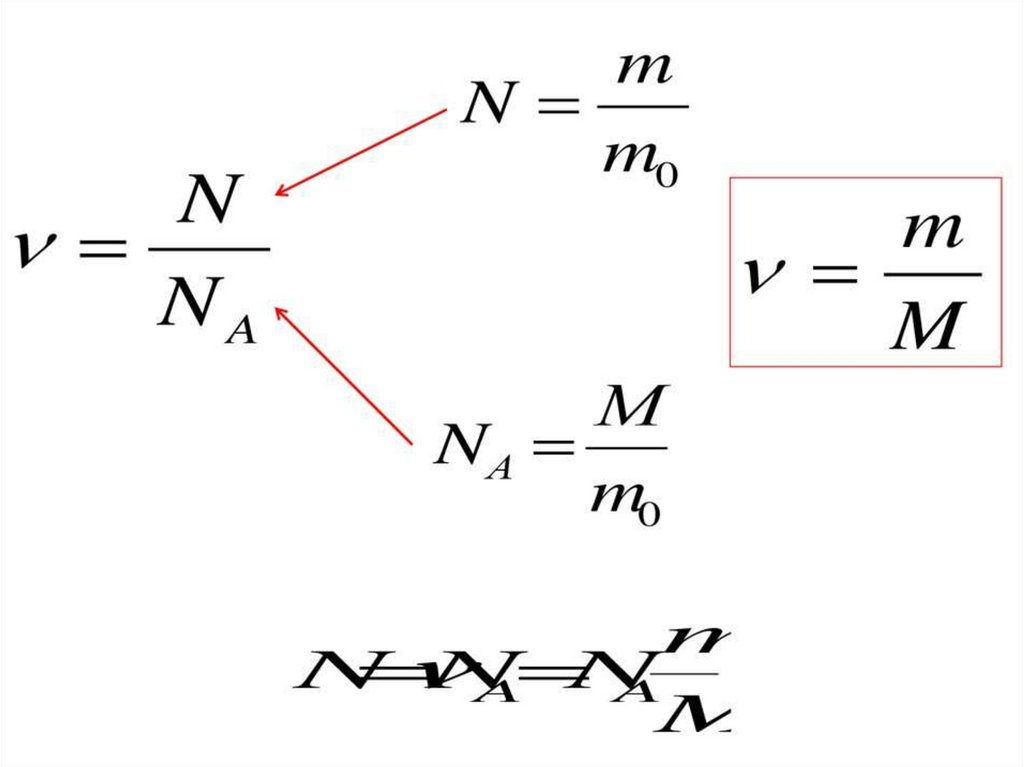
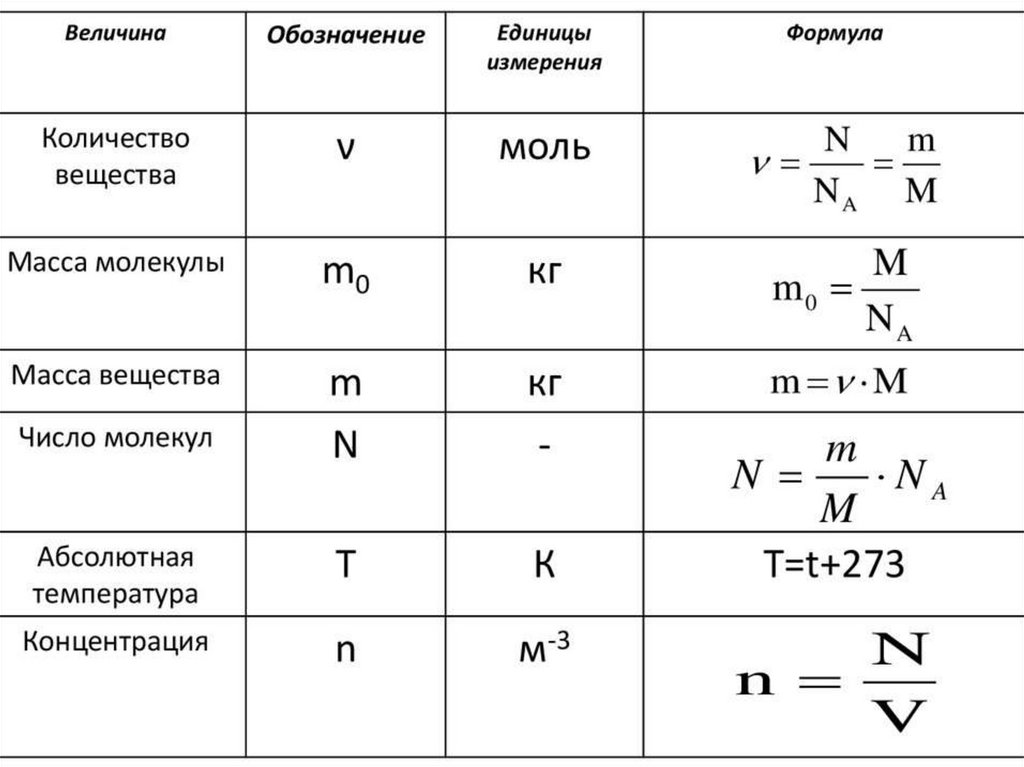
Величины МКТЧисло Авогадро –
число атомов в 12
граммах углерода.
Nа = 6,02 * 10²³ мольֿ¹
Количества вещества –
это количество
вещества, в котором
содержится столько же
частиц, сколько атомов
в 12 граммах углерода.
V=N/ Nа
V- количество вещества
N- число частиц
Молярной
массой М
называется
величина, равная
отношению массы
вещества m к
количеству
вещества ν (ню)
М = m/V
110.
111.
112.
113.
114.
115.
116.
117.
118.
119.
120.
121.
122.
123.
124.
125.
126.
127.
128.
129.
130.
131.
132.
133.
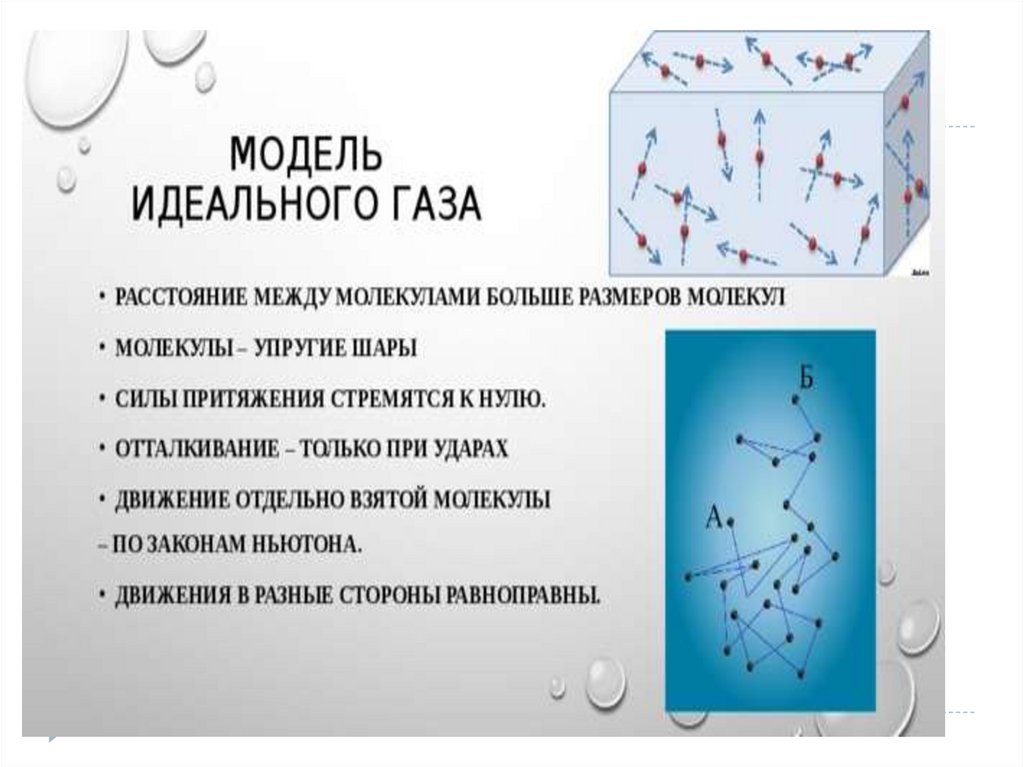
Идеальный газ –это газ, взаимодействие между
молекулами которого пренебрежимо мало
Свойства идеального газа
1.Суммарный объем молекул по сравнению с
объемом, занимаемым газом, пренебрежимо мал.
2. Молекулы представляют собой упругие шарики
3. Внутренняя энергия газа определяется лишь
кинетической энергией.
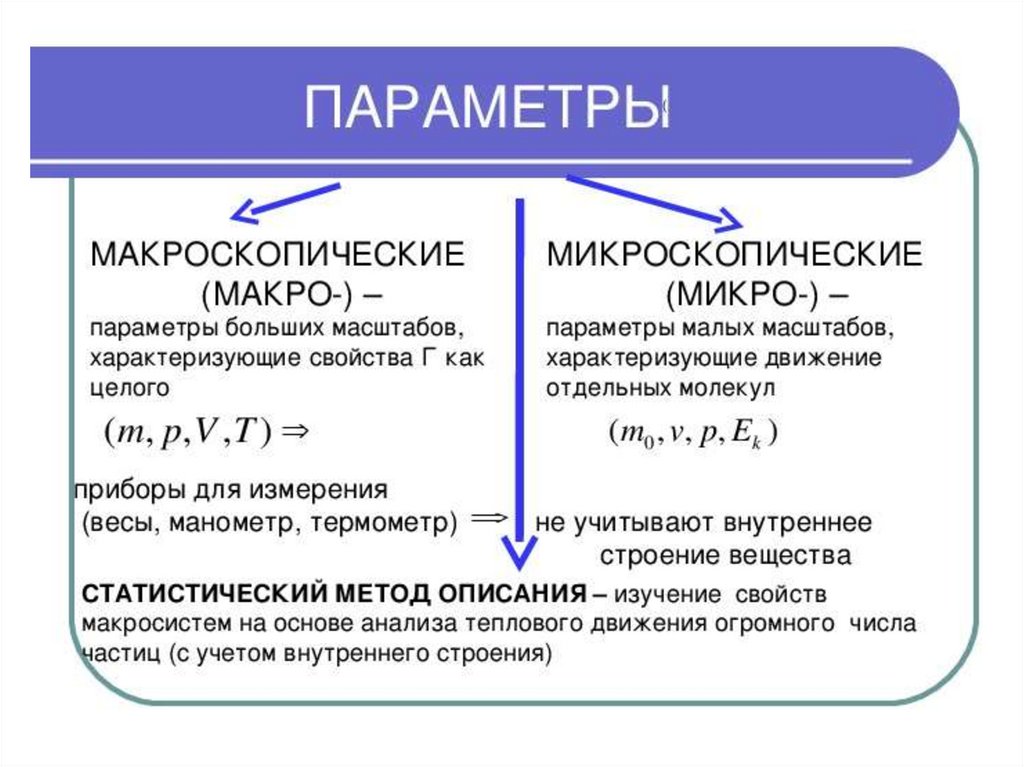
Макропараметры идеального газа :
– Давление
– Температура
– Объем
134.
135.
136.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯИДЕАЛЬНОГО ГАЗА.
Температура тела – мера средней кинетической
энергии хаотического поступательного движения его
молекул.
Абсолютный нуль температуры- температура, при
которой должно прекратиться движение молекул.
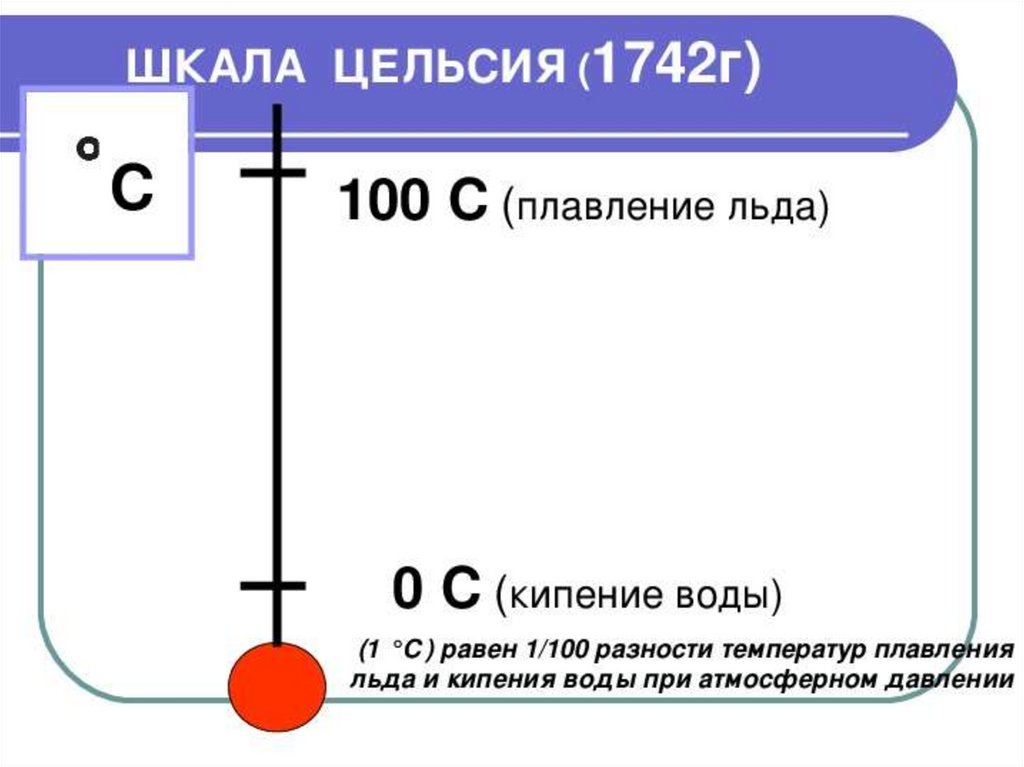
T = t + 273
137.
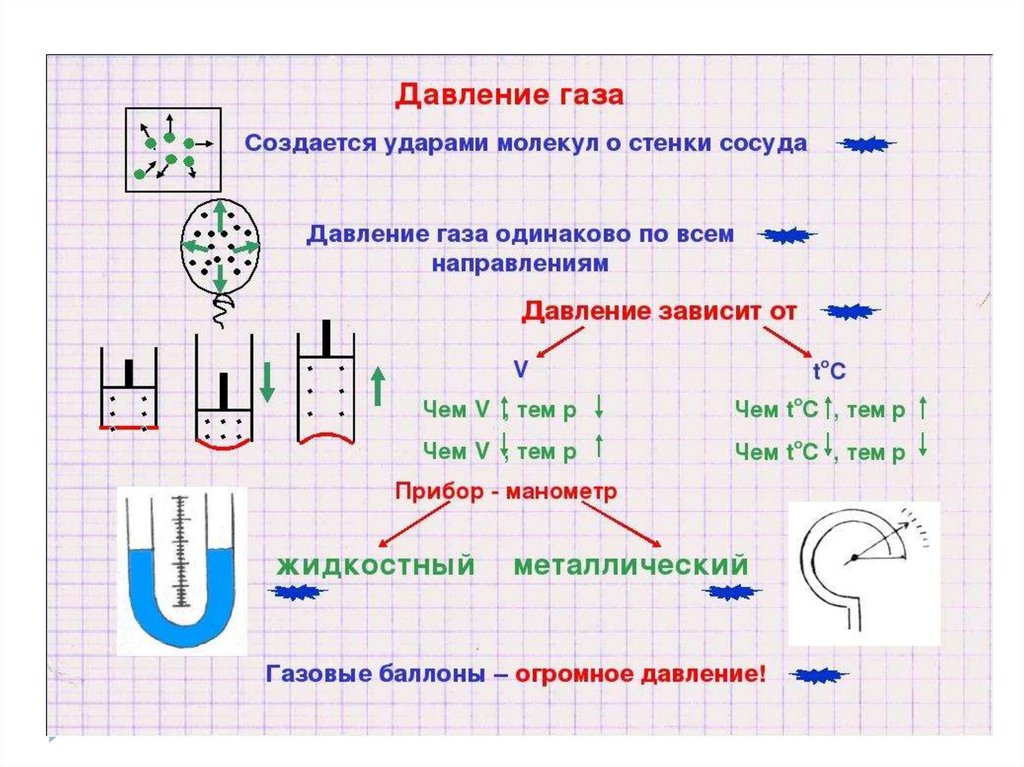
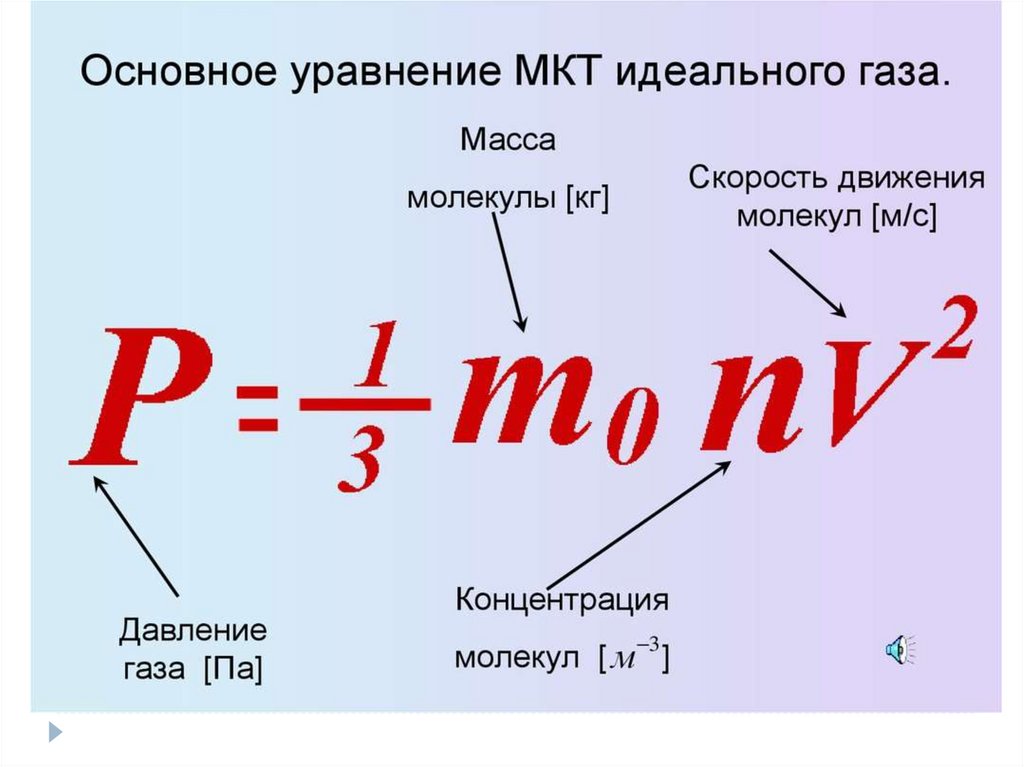
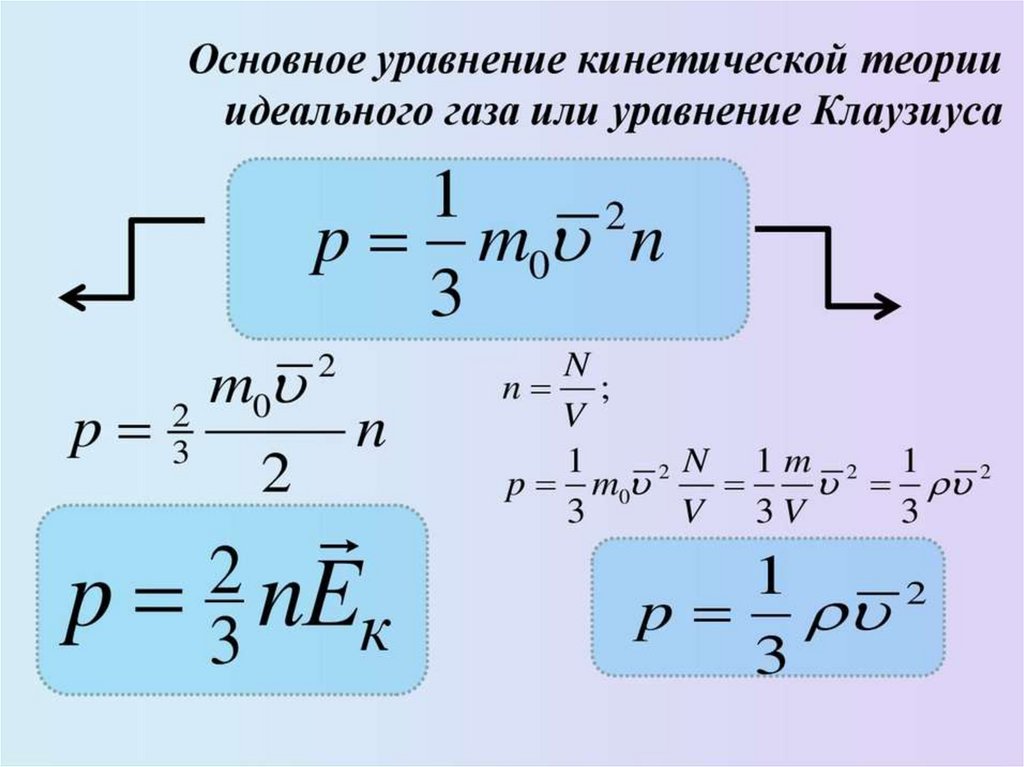
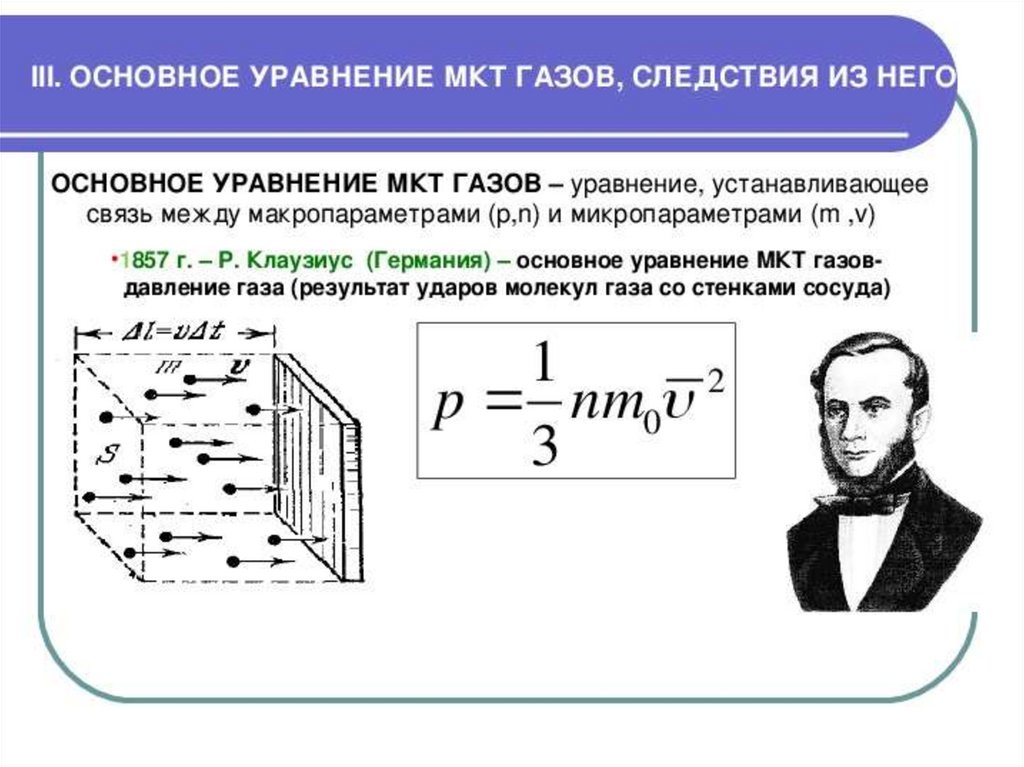
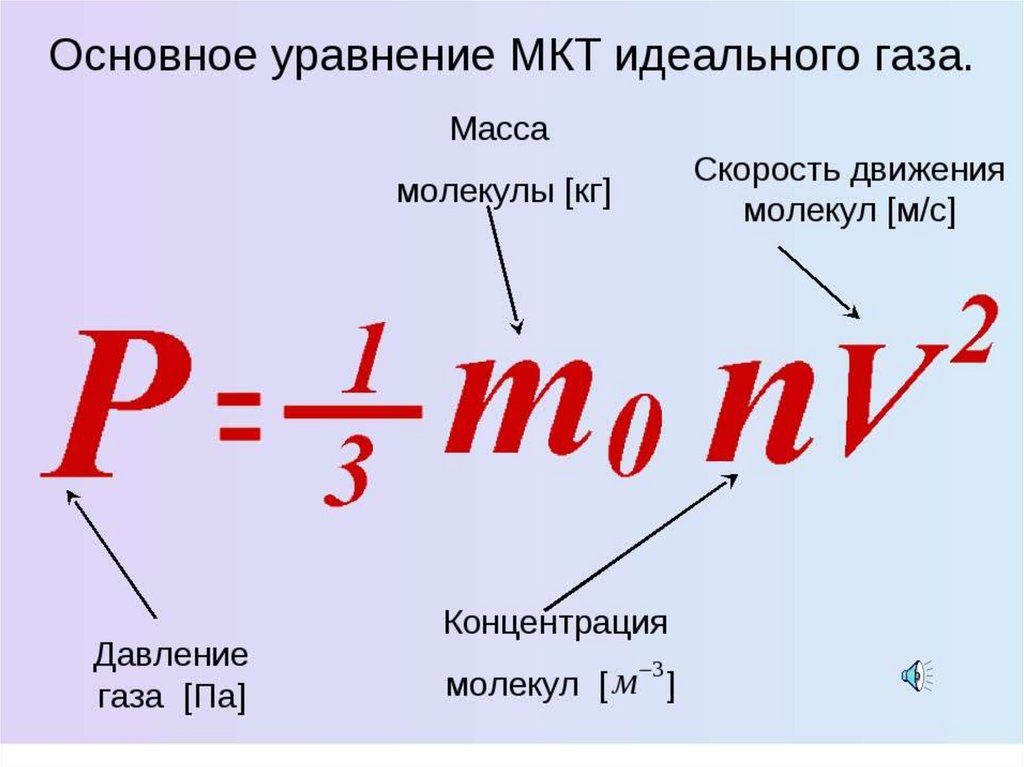
ОСНОВНОВНЫЕ УРАВНЕНИЯ МКТ:Давление идеального газа равно двум третям средней
кинетической энергии поступательного движения
молекул, содержащихся в единице объема
p=2/3 nEк,
где n – концентрация молекул
138.
139.
140.
141.
142.
143.
144.
145.
146.
147.
148.
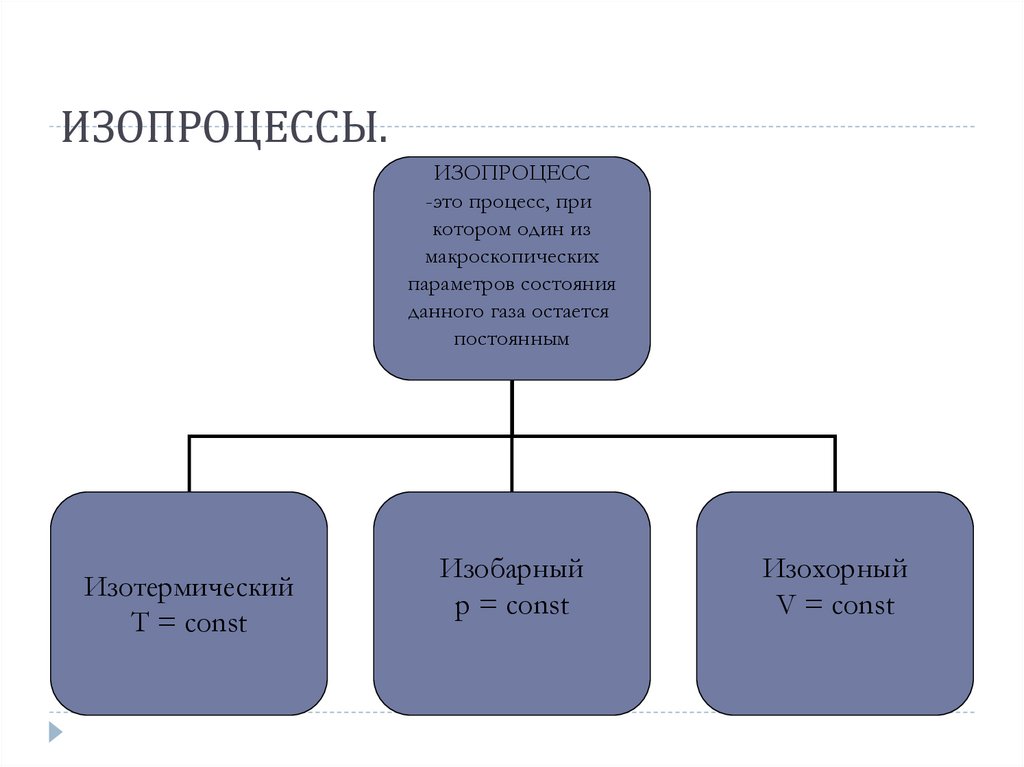
ИЗОПРОЦЕССЫ.ИЗОПРОЦЕСС
-это процесс, при
котором один из
макроскопических
параметров состояния
данного газа остается
постоянным
Изотермический
Т = const
Изобарный
p = const
Изохорный
V = const
149.
ТЕРМОДИНАМИКА (от термо... и динамика), раздел физики, изучающий наиболееобщие свойства макроскопических систем, находящихся в состоянии
термодинамического равновесия, и процессы перехода между этими состояниями.
(Неравновесные процессы изучает термодинамика неравновесных процессов.)
Термодинамика строится на основе фундаментальных принципов — начал
термодинамики, которые являются обобщением многочисленных
наблюдений и результатов экспериментов
Термодинамика возникла в 1-й пол. 19 в. в связи с развитием теории
тепловых машин (С. Карно) и установлением закона сохранения энергии (Ю.
Р. Майер, Дж. Джоуль, Г. Гельмгольц).
Основные этапы развития термодинамики связаны с именами Р. Клаузиуса и
У. Томсона (формулировки второго начала термодинамики), Дж. Гиббса
(метод термодинамических потенциалов), В. Нернста (третье начало
термодинамики) и др.
Различают химическую термодинамику, техническую термодинамику и
термодинамику различных физических явлений.
150.
Термодинамика.Внутренняя энергия тела – сумма кинетической
энергии хаотического теплового движения частиц
(атомов или молекул) тела и потенциальной энергии
их взаимодействия.
U- внутренняя энергия
[U] – Дж
U=Ек + Ер (1)
U=3/2 m/M RT (2)
U=3/2 pV (3)
151.
АДИАБАТНЫЙ ПРОЦЕСС (адиабатическийпроцесс), термодинамический процесс, при
котором система не получает теплоты извне
и не отдает ее. Быстропротекающие
процессы (напр., распространение звука)
могут приближенно рассматриваться как
адиабатный процесс и при отсутствии
теплоизолирующей оболочки.
































































































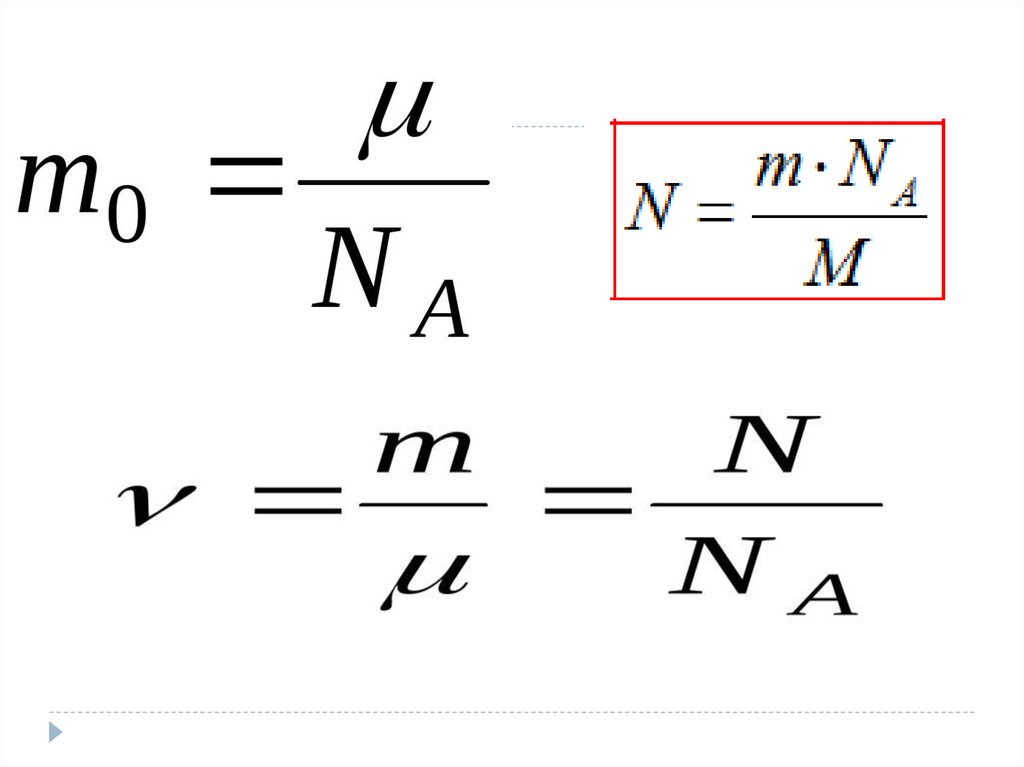



















 physics
physics








