Similar presentations:
Подготовка обучающихся к выполнению заданий КИМ ЕГЭ по химии при изучении темы "Гидролиз"
1.
"Подготовка обучающихся квыполнению заданий КИМ ЕГЭ по
химии при изучении темы
"Гидролиз"
Кушнаренко А.В.
ГБОУ СОШ №345
2.
Гидролиз солейГидролиз – обменная реакция веществ с
водой
Гидролиз солей – реакция ионов,
образующих соль с молекулами воды
3.
Гидролиз солей по катионуСоль, образованная катионом слабого основания и
анионом сильной кислоты
Водный раствор этой соли имеет кислую среду
ZnCl2 → Zn2+ + 2ClZn(OH)2 – слабый электролит
HCl – сильный электролит
1) Zn2+ + HOH = ZnOH+ + H+
ZnCl2 + H2O = ZnOHCl + HCl
2) ZnOH+ +HOH = Zn(OH)2 + H+
ZnOHCl + H2O = Zn(OH)2 +HCl
4.
Гидролиз солей по анионуСоль, образованная катионом сильного основания и
анионом слабой кислоты
Водный раствор этой соли имеет щелочную среду
Na2CO3→2Na+ +CO32NaOH – сильный электролит
H2CO3 – слабый электролит
1) CO32-+ HOH = HCO3-+ OHNa2CO3 + H2O = NaHCO3+NaOH
2) HCO3-+ HOH = H2CO3+OHNaHCO3 + H2O = H2CO3+NaOH
5.
Гидролиз солей по катиону ианиону
Соль, образованная катионом слабого основания и
анионом слабой кислоты
Водный раствор этой соли может иметь слабокислую
или слабощелочную среду, близкую к нейтральной
CH3COONH4 → CH3COO- + NH4+
CH3COO- +HOH = CH3COOH + OHNH4+ + HOH = NH3∙H2O + H+
CH3COONH4 + H2O = CH3COOH + NH3∙H2O
6.
Соли, не подвергающиесягидролизу
Соль, образованная катионом сильного
основания и анионом сильной кислоты
Водный раствор этой соли имеет
нейтральную среду
Примеры: Na2SO4, KNO3
7.
Необратимый гидролизFe2(SO4)3 + 3K2CO3 → Fe2(CO3)3 + 3K2SO4
+
Fe2(CO3)3 + 6 H2O → 2Fe(OH)3 + 3H2CO3 (3H2O + 3CO2)
Fe2(SO4)3 + 3K2CO3 +3H2O → 2Fe(OH)3↓ +3CO2↑ +3K2SO4
8.
Гидролиз бинарныхсоединений
Гидролиз нитридов и фосфидов:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3↑
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3↑
Гидролиз карбидов и силицидов:
CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Al4C3 +12 H2O → 4Al(OH)3 + 3CH4↑
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4↑
9.
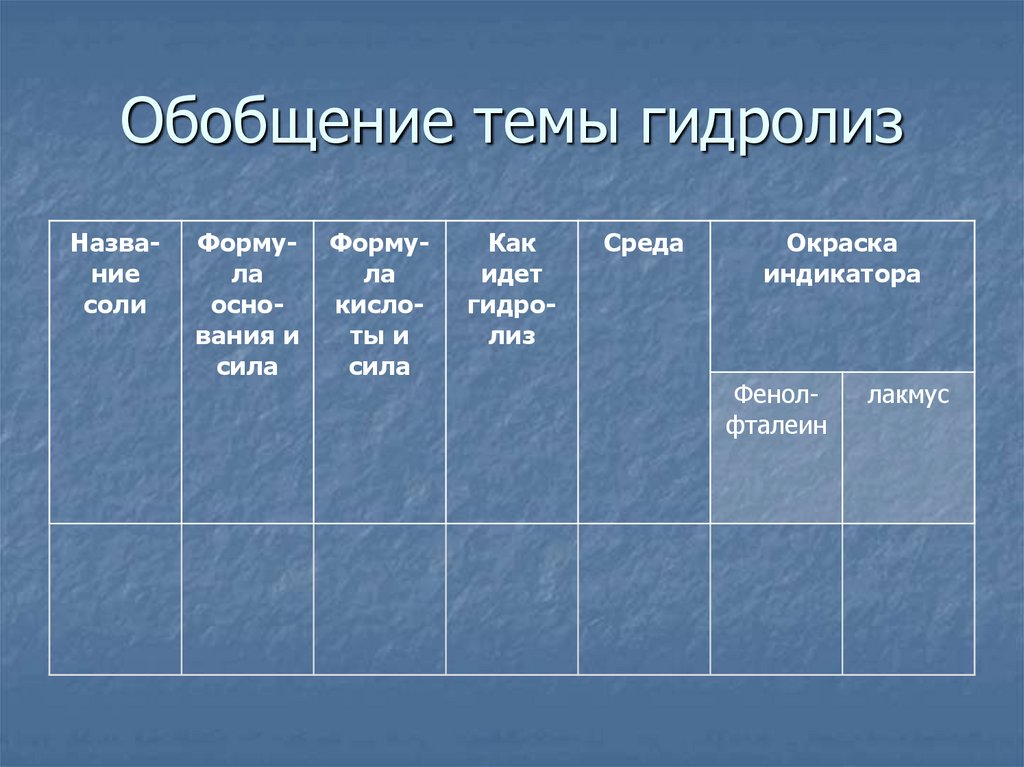
Обобщение темы гидролизНазвание
соли
Формула
основания и
сила
Формула
кислоты и
сила
Как
идет
гидролиз
Среда
Окраска
индикатора
Фенолфталеин
лакмус
10.
Надо запомнитьNaHPO4 -среда щелочная
NaHCO3 -среда щелочная
NaH2PO4 -среда кислая
NaHSO3 -среда кислая
11.
Задания для тренировкиКислую среду имеет водный раствор
1)Na3PO4
2)KCl
3)Na2CO3
4)ZnSO4
Щелочная среда в растворе соли
1)CuBr2
2)NaCl
3)K2CO3
4)MgSO4
12.
Задания на необратимыйгидролиз
Какие реакции будут протекать при
смешении водных растворов:
сульфида натрия и хлорида алюминия
нитрата алюминия и карбоната калия
13.
ЗаданияЕсли в раствор хлорид железа (III)
ввести немного порошка магния, можно
наблюдать выделение пузырьков газа.
Какой это газ? Дайте объяснение этому
явлению.
14.
Задания вопрос 30 (В4)Установите соответствие между
формулой соли и типом гидролиза
этой соли в водном растворе.
А)
Б)
В)
Г)
Cr2S3
AlCl3
K2SO4
Na3PO4
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
15.
Установите соответствие между названием соли иуравнением её гидролиза по первой ступени.
А) сульфит натрия
Б) гидросульфит натрия
В) сульфид натрия
Г) карбонат натрия
1) SO32- + H2O = HSO3- + OH2) CO32- + H2O = HCO3- + OH3) HSO3- + H2O = H2SO3 + OH4) HCO3- + H2O = H2CO3 + OH5) S2- + H2O = HS- + OH-
16.
Вопрос 39 (С4)Рассчитайте, какой объем 10%-ного
раствора хлороводорода плотностью
1,05 г/мл пойдет на полную
нейтрализацию гидроксида кальция,
образовавшегося при гидролизе
карбида кальция, если выделившийся
при гидролизе газ занял объем 8,96 л
(н.у.).
















 chemistry
chemistry








