Similar presentations:
Общая характеристика элементов IIА-группы и их соединений
1. Общая характеристика элементов IIА- группы и их соединений
2. II группа
IIA-группу(s-элементы- Ве,
Мg и щелочноземельные металлы
(Са, Sr, Ba,Ra))
IIВ-группу
(Zn, Cd, Hg)
3.
4. IIA-группа составляет:
Бериллий Be, магний Mg, кальций Ca,стронций Sr ,барий Ba и радий Ra
5. Щелочноземельные металлы-
Щелочноземельные металлыхимические элементы, гидроксидыкоторых обладают щелочными
свойствами, а оксиды
по своей тугоплавкости сходны с
оксидами тяжелых металлов,
называвшимися раньше «земли».
6. В группе
Сверху вниз:Радиус атома- УВЕЛИЧИВАЕТСЯ
Энергия ионизации- УМЕНЬШАЕТСЯ
Способность отдавать электроны с внешнего
слоя- УВЕЛИЧИВАЕТСЯ
Восстановительная способностьУВЕЛИЧИВАЕТСЯ
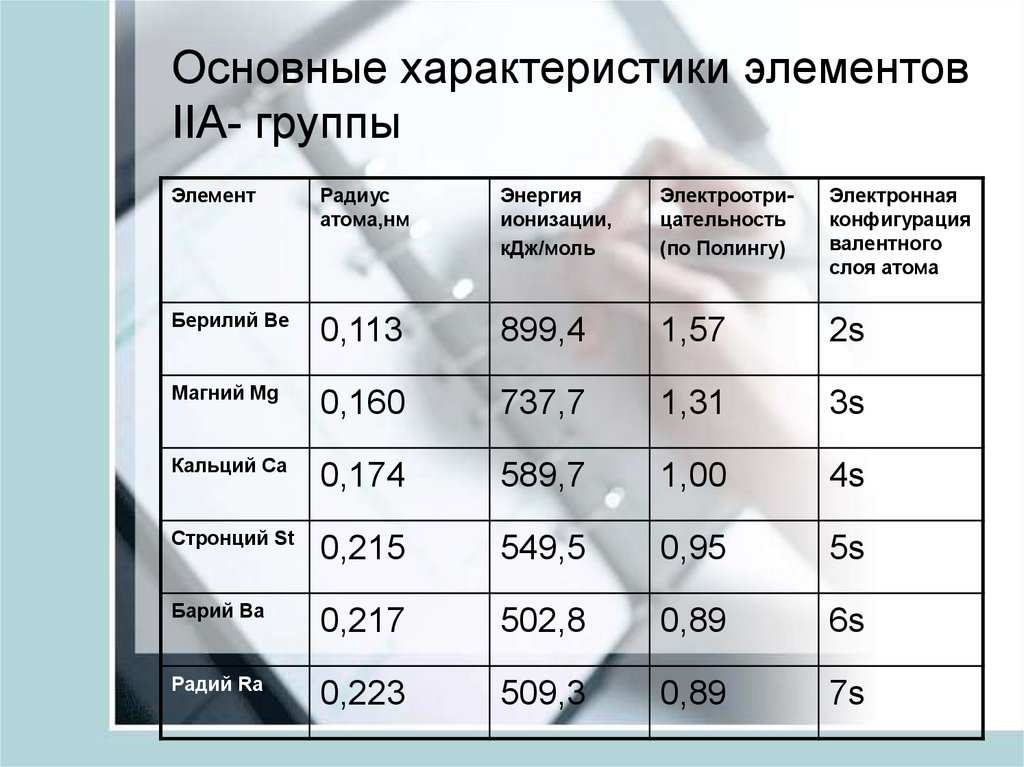
7. Основные характеристики элементов IIA- группы
ЭлементРадиус
атома,нм
Энергия
ионизации,
кДж/моль
Электроотрицательность
(по Полингу)
Электронная
конфигурация
валентного
слоя атома
Берилий Ве
0,113
899,4
1,57
2s
Магний Мg
0,160
737,7
1,31
3s
Кальций Ca
0,174
589,7
1,00
4s
Стронций St
0,215
549,5
0,95
5s
Барий Ва
0,217
502,8
0,89
6s
Радий Ra
0,223
509,3
0,89
7s
8. Физические свойства
ЭлементКристаллическая
решётка
Цвет
р, г/см3
tпл, °C
tкип, °C
Be
Гексагональная
Серебристосерый
1,85
1285
2970
Mg
Гексагональная
Серебристобелый
1,74
651
1107
Ca
Кубическая
гранецентрированная
или гексагональная
Серебристобелый
1,54
850
1480
Sr
Кубическая
гранецентрированная
Серебристобелый
2,63
770
1380
Ba
Кубическая
объемноцентрированная
Серебристобелый
3,76
710
1640
Ra
Кубическая
объемноцентрированная
Серебристобелый
6
960
1536
9. Получение
Т.к. металлы данной подгруппы сильныевосстановители, то получение возможно
только путем электролиза расплавов солей.
t°
CaCl2<=> Ca2+ + 2Cl-
катод(-)
анод(+)
Ca2+ + 2e–> Ca°
2Cl- - 2e –>Cl2°
CaCl2 –>Ca° + Cl2°
(расплав) эл.ток.
10. Стронций и барий чаще всего получают алюмотермическим методом
t°4SrO + 2Al = 3Sr + SrO • Al2O3
метааллюминат стронция
t°
4BaO + 2Al = 3Ba + BaO • Al2O3
метааллюминат бария
11. Химические свойства (на примере Са)
Взаимодействие с неметаллами:1. Взаимодействие с кислородом
2Ca + O2=2СaO (оксид кальция)
Ca + O2=СaO2 (пероксид кальция)
2. С галогенами образуются галогениды
Са + Сl2=CaCl2 (хлорид кальция)
Ca + Br2=CaBr2 (бромид кальция)
3. С серой образуются сульфиды
Ca + S=CaS (сульфид кальция)
t°
12.
4. С водородом образуются гидридыt°
Ca + H2 = CaH2 (гидрид кальция)
Гидрид кальция разлагается водой с образованием
щёлочи и свободного водорода:
СаН2 + 2H2O=Ca (OH)2 + 2H2
13.
Взаимодействие со сложнымивеществами
1.
Взаимодействие с водой
Са + 2H2O = Ca (OH)2 + H2
2. Взаимодействие с разбавленными кислотами
Сa + H2SO4 (р) = СaSO4 + H2
14. Be и Mg отличаются от других металлов
Be с водой не взаимодействует,а Mg взаимодействует лишь при
нагревании.
15.
Растворимость в воде и сила основанийувеличиваются в направлении,
указанном стрелками
Са (ОH)2, Sr (OH)2 , Ba (OH)2
16. Нахождение в природе Са
• Кальции относится к распространённым элементам• Общее его содержание в земной коре составляет 3,6%
• В природе наиболее широко распространены следующие
соединения кальция:
минерал кальция СаСO3
гипс CaSO4 •2H2O
ангидрит CaSO4
• В виде фосфата Сa(PO4) 2 входит в состав апатитов,
фосфоритов и костей животных
• Содержится в природных водах и почве
17. Применение
• Ве используется в атомной технике какзамедлитель и поглотитель нейтронов. Сплавы
бериллия с медью – бронзы – очень стойкие, а с
никелем – обладают высокой химической
устойчивостью, благодаря чему и используются
в хирургии.
• Mg, Ca – используются как хорошие
восстановители в металлотермии.
• Ca, Sr, Ba – достаточно легко реагируют с газами
и используются как геттеры (поглотители из
воздушной среды) в вакуумной технике.
















 chemistry
chemistry








