Similar presentations:
Типы химической связи
1.
Типы химической связи2.
3.
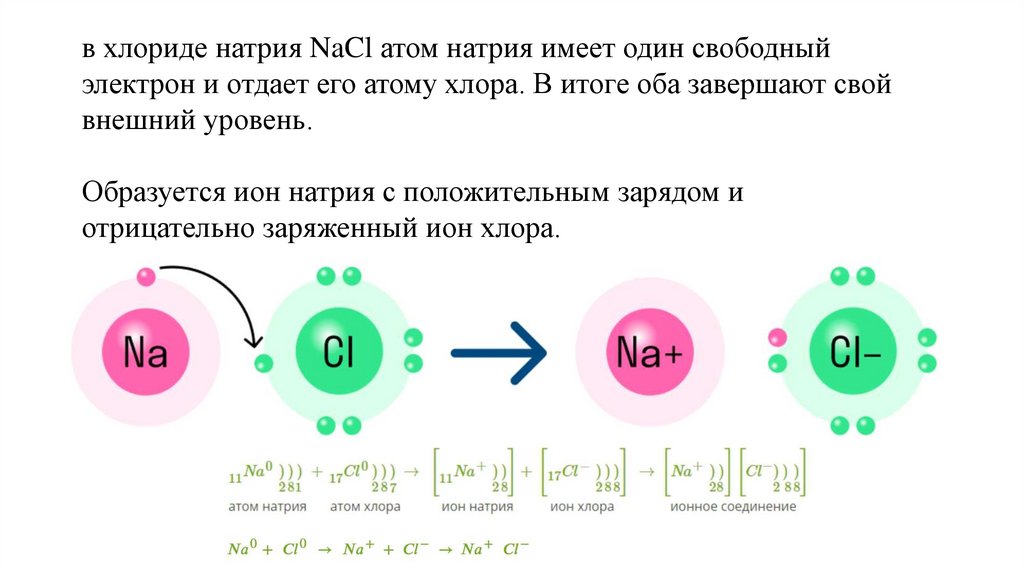
в хлориде натрия NaCl атом натрия имеет один свободныйэлектрон и отдает его атому хлора. В итоге оба завершают свой
внешний уровень.
Образуется ион натрия с положительным зарядом и
отрицательно заряженный ион хлора.
4.
В данном случае у нас также есть натрий с одним свободнымэлектроном и сера, у которой на внешнем уровне есть 2 свободных
электрона из 6. Таким образом, чтобы завершить уровень и обрести
стабильную форму, сере нужно 2 электрона. Поэтому в формуле
сульфида серы присутствует два атома натрия.
5.
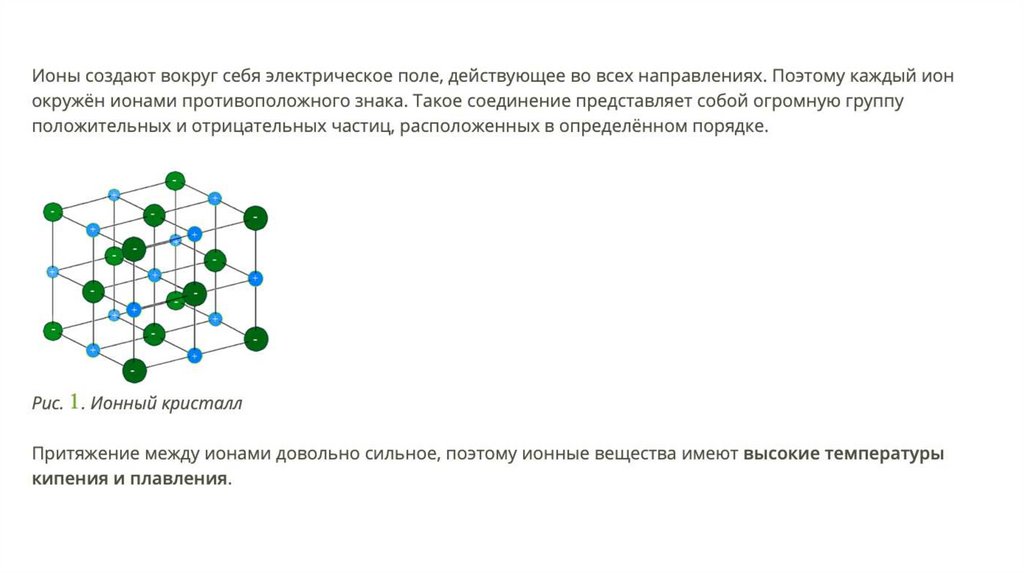
Характеристики ионной связи• не направлена;
Согласно закону Кулона притяжение между отрицательным
и положительным ионом идет по прямой, соединяющей
эти заряженные частицы.
• не насыщена;
• не имеет кратности.
6.
7.
Свойства ионных соединений:• твердость,
• хрупкость,
• нелетучесть,
• тугоплавкость,
• растворимость в воде,
• электропроводность.
8.
Для характеристики ковалентной связи используют следующие параметры:•полярность связи (полярная, неполярная);
•насыщаемость;
•длина связи; Длина связи — расстояние между ядрами связанных
атомов, соответствующее наименьшей энергии молекулы.
•энергия связи (прочность); Энергия связи — энергия, которую необходимо
затратить, чтобы разрушить связь. Такое же количество энергии
выделяется при образовании химической связи. Энергия ковалентной
связи имеет значение приблизительно от 200 до 1000 кДж/моль.
•кратность связи (одинарная, двойная, тройная);
•способ перекрывания электронных орбиталей (сигма- и пи -связи);
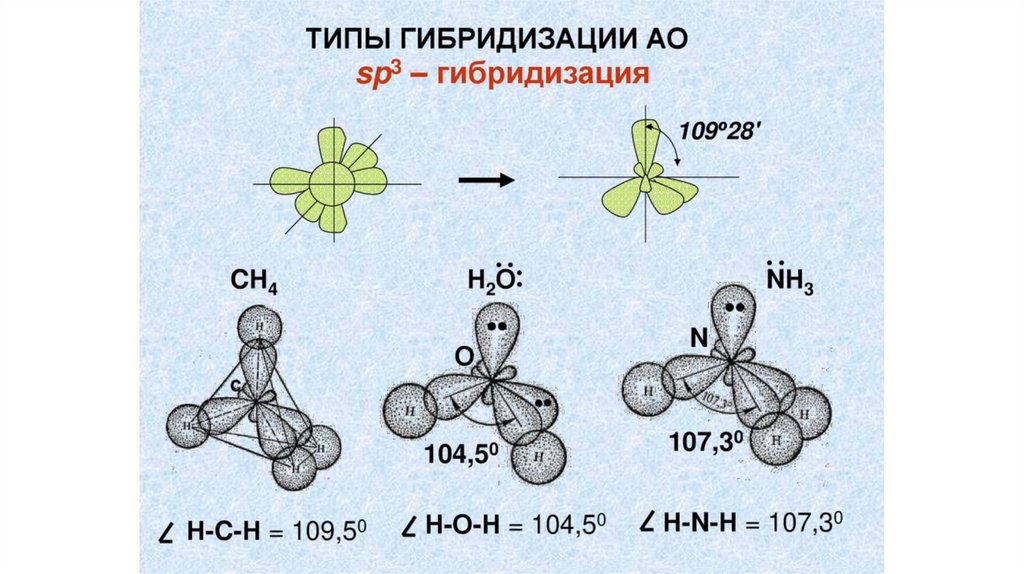
•направленность; Направленность связи обусловлена тем, что ковалентная
связь образуется при перекрывании электронных орбиталей, которые
направлены друг к другу под определённым углом. Угол между линиями,
соединяющими химически связанные атомы, называется валентным углом.
•механизм образования.
9.
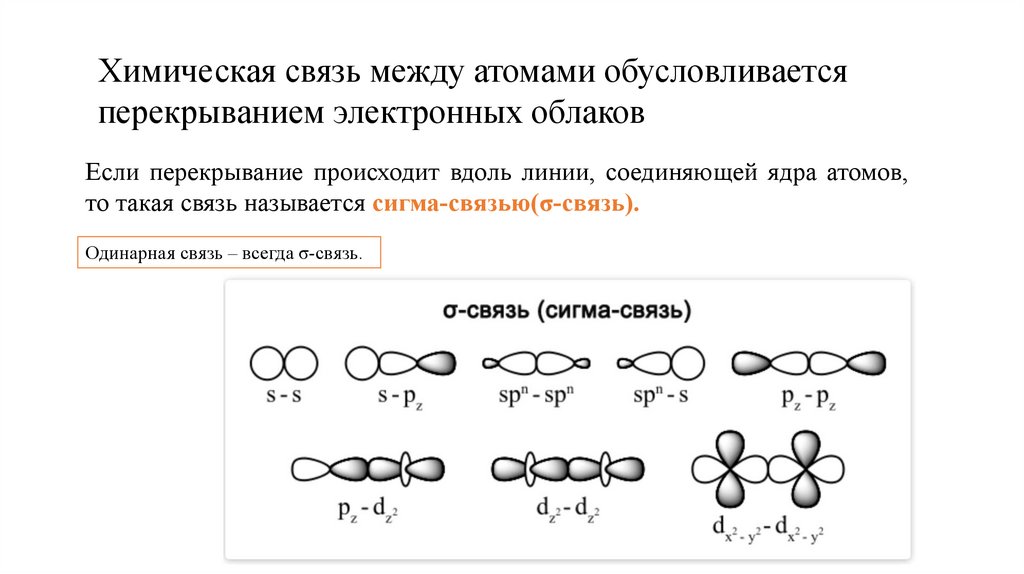
Химическая связь между атомами обусловливаетсяперекрыванием электронных облаков
Если перекрывание происходит вдоль линии, соединяющей ядра атомов,
то такая связь называется сигма-связью(σ-связь).
Одинарная связь – всегда σ-связь.
10.
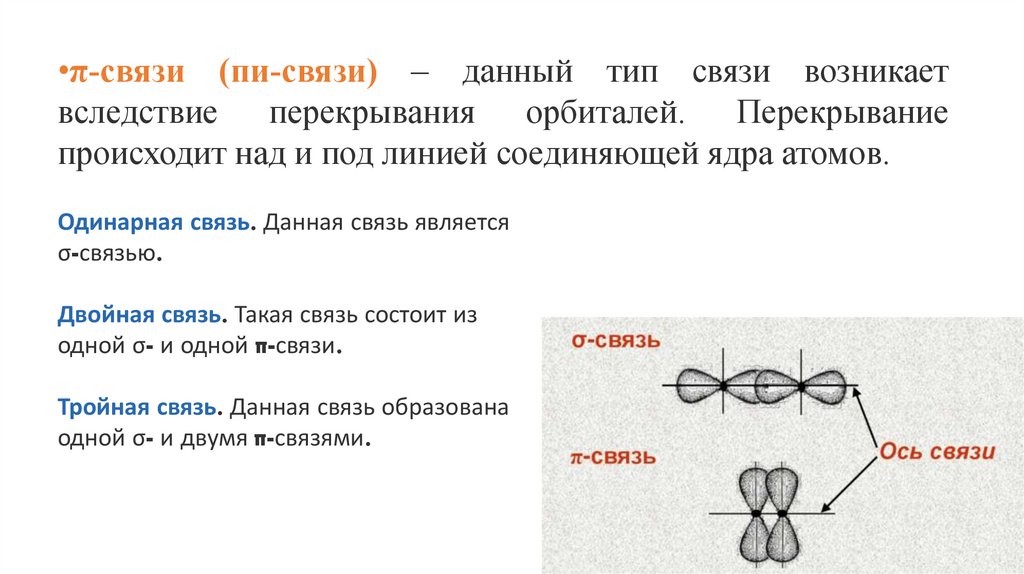
•π-связи (пи-связи) – данный тип связи возникаетвследствие перекрывания орбиталей. Перекрывание
происходит над и под линией соединяющей ядра атомов.
Одинарная связь. Данная связь является
σ-связью.
Двойная связь. Такая связь состоит из
одной σ- и одной π-связи.
Тройная связь. Данная связь образована
одной σ- и двумя π-связями.
11.
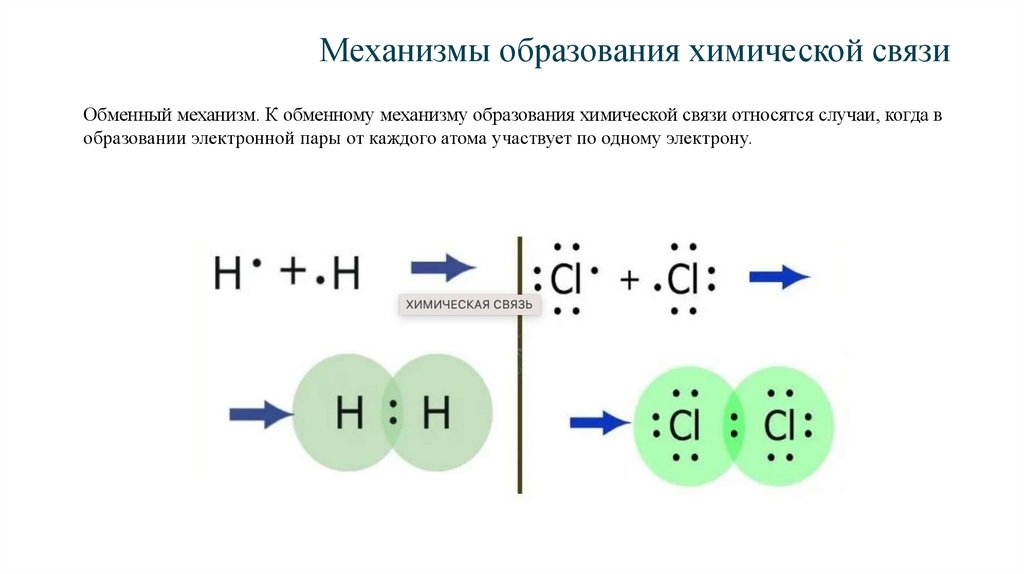
Механизмы образования химической связиОбменный механизм. К обменному механизму образования химической связи относятся случаи, когда в
образовании электронной пары от каждого атома участвует по одному электрону.
12.
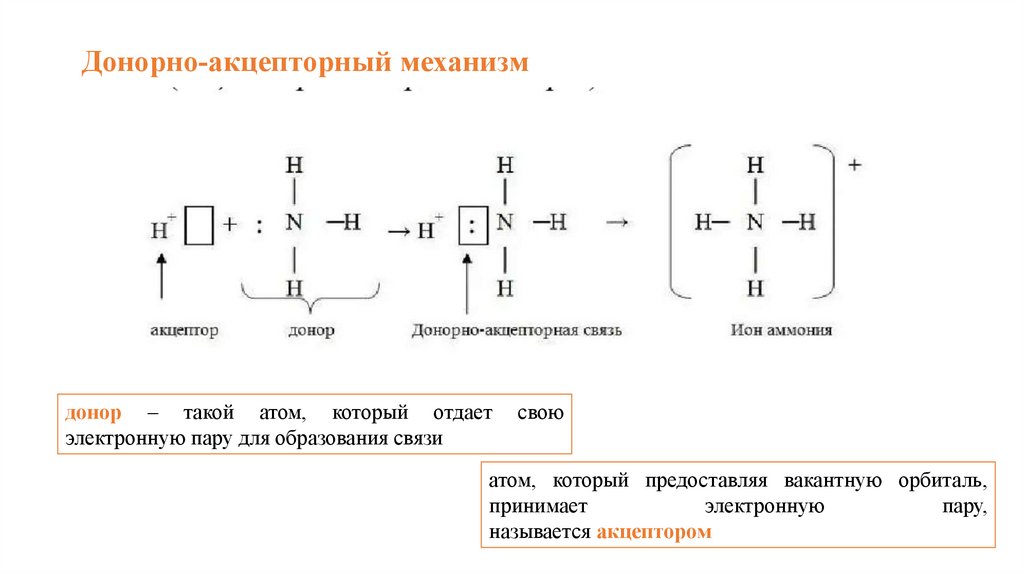
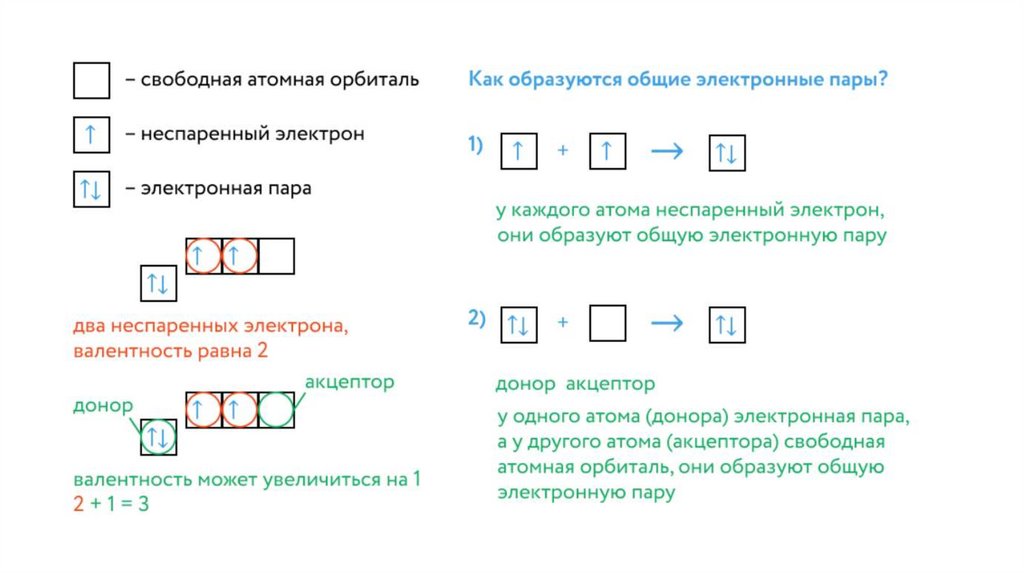
Донорно-акцепторный механизмдонор – такой атом, который отдает
электронную пару для образования связи
свою
атом, который предоставляя вакантную орбиталь,
принимает
электронную
пару,
называется акцептором









 chemistry
chemistry








