Similar presentations:
Радиоактивность. Модели атомов. Опыт Резерфорда
1.
Тема урока:Радиоактивность. Модели атомов.
Опыт Резерфорда
Основные понятия урока:
• Радиоактивность, виды радиоактивности.
• Модель Томсона.
• Экспериментальная установка Резерфорда.
• Выводы из эксперимента Резерфорда.
• Планетарная модель атома.
• Закон сохранения зарядового и массового чисел.
2.
Открытие радиоактивностиА в 1896 году французкий
физик Анри Беккерель
обнаружил, что соединения
химического элемента урана
самопроизвольно испускают
какое-то неизвестное
невидимое излучение,
проникающее сквозь картон
и действующее на
фотопластинку.
3.
Открытие радиоактивностиВ 1896 г. Беккерель случайно открыл радиоактивность во время работ по
исследованию фосфоресценции в солях урана. Исследуя работу Рентгена, он
завернул флюоресцирующий материал — уранилсульфат калия в
непрозрачный материал вместе с фотопластинками, с тем, чтобы
приготовиться к эксперименту, требующему яркого солнечного света. Однако
ещё до осуществления эксперимента Беккерель обнаружил, что
фотопластинки были полностью засвечены. Это открытие побудило Беккереля
к исследованию спонтанного испускания ядерного излучения. В 1903 г. он
получил совместно с Пьером и Марией Кюри Нобелевскую премию по физике
«В знак признания его выдающихся заслуг, выразившихся в открытии
самопроизвольной радиоактивности»
4.
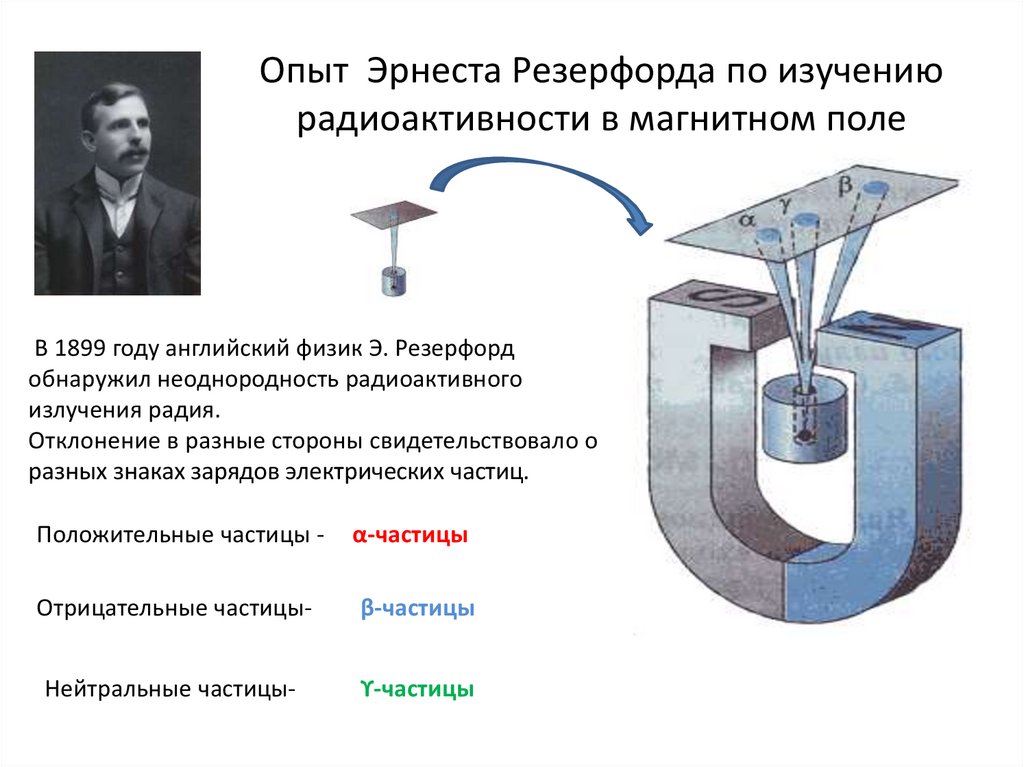
Опыт Эрнеста Резерфорда по изучениюрадиоактивности в магнитном поле
В 1899 году английский физик Э. Резерфорд
обнаружил неоднородность радиоактивного
излучения радия.
Отклонение в разные стороны свидетельствовало о
разных знаках зарядов электрических частиц.
Положительные частицы -
α-частицы
Отрицательные частицы-
β-частицы
Нейтральные частицы-
ϒ-частицы
5.
Фундаментальный опыт ядернойфизики
В 1903 году Дж Дж Томсон
предложил одну из первых
моделей атома, названной
моделью Томсона.
По предположению
Томсона, атом - это шар, по
свему объему которого
равномерно распределено
вещество атома и
положительный заряд.
Внутри шара расположены
электроны, подобно тому,
как расположены
изюминки в кексе. Каждый
электрон, считал Томсон,
может совершать
колебания около своего
положения равновесия, но
в целом далеко не
сдвигается. Положительный
заряд по модулю равен
суммарному
отрицательному заряду
всех электронов, поэтому в
целом атом
электронейтрален
В 1911 году Эрнест Резерфорд с сотрудниками своей лаборатории
провел ряд экспериментов.
Многие из первоначальных сведений о строении атомов были
получены зондированием тонких слоев вещества движущимися
заряженными частицами. Резерфорд использовал альфа-частицы,
которые испускаются при радиоактивном распаде
6.
Планетарная модель строения атомаПо результатам эксперимента
Резерфорд сделал очень важные
выводы:
1. Положительная α-частицы могла
отталкиваться только от
положительной области ядра.
2. Размеры этой области очень
малы.
3. Масса этой области значительно
больше массы самой α-частицы.
(попробуйте объяснить?)
7.
Зарядовое и массовое числоA
Z
X
Любой химический элемент принято обозначать, указывая
число протонов в ядре Z-зарядовое число и число
протонов и нейтронов в ядре А - массовое число.
Для Li такая запись означает, что у ядра данного атома 3
протона и 4 нейтрона. Итого всего 3+4=7 нуклонов.
Z-зарядовое число - равно числу элементарных электрических
зарядов в ядре атома и совпадает с порядковым номером атома в
таблице Менделеева
А - массовое число- равно числу атомных единиц массы в таблице
Менделеева
8.
Радиоактивные превращенияОпытным путём было установлено, что некоторые вещества могут
самопроизвольно испускать α-частицы. Происходит α-распад с испусканием
ядра атома гелия
226
88
Ra He Rn
4
2
222
86
При самопроизвольном испускании β-частицы происходит β-распад
с испусканием электрона.
C 10 145B
14
6
Но в каждом случае выполняется закон сохранения зарядовых и массовых
чисел.
9.
• Чмм4
2
He








 physics
physics








