Similar presentations:
Расчёты по управлениям неорганических реакций
1. 1 моль любого вещества в любом агрегатном состоянии содержит одинаковое число молекул равное 6 • 1023
2KOH2 молекулы
+ H2SO4
1 мол.
= K2SO4
+ 2H2O
1 мол.
2 мол.
2 млн. мол.
1 млн. мол.
1 млн. мол.
2 млн. мол.
4 млн. мол.
2 млн. мол.
2 млн. мол.
4 млн. мол.
12 • 1023 мол.
6 • 1023 мол.
6 • 1023 мол.
12 • 1023 мол.
1 моль
1 моль
2 моль
2 моль
2.
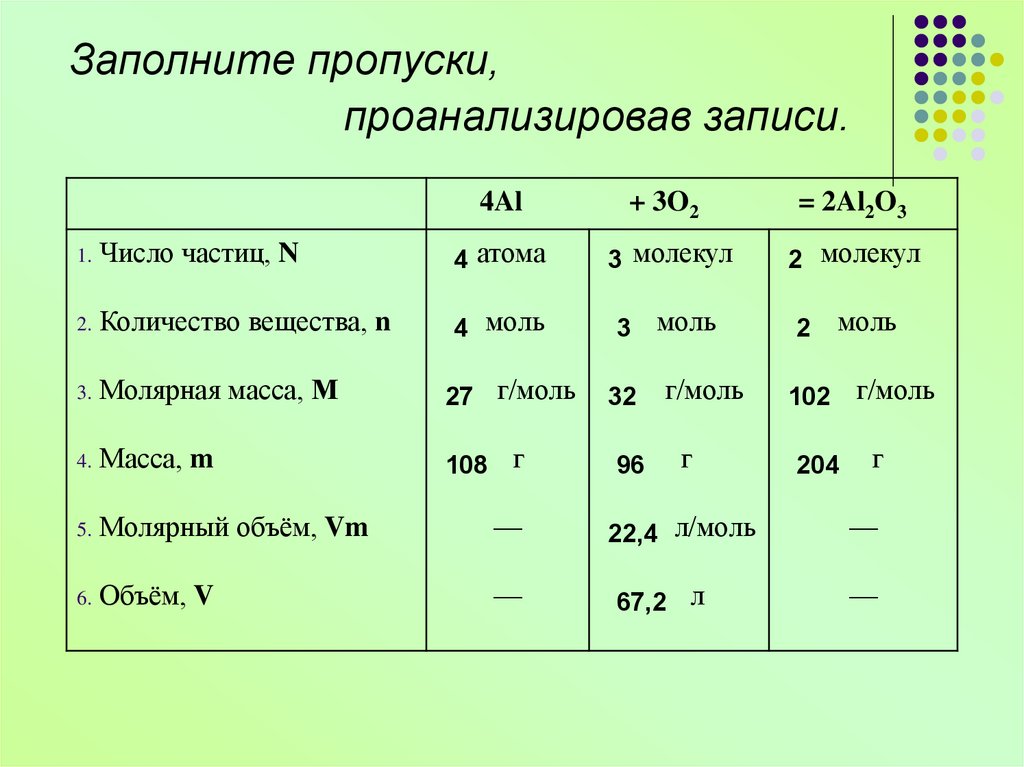
Заполните пропуски,проанализировав записи.
4Al
+ 3O2
= 2Al2O3
1.
Число частиц, N
? атома
? молекул
? молекул
2.
Количество вещества, n
? моль
? моль
? моль
3.
Молярная масса, М
? г/моль
? г/моль
? г/моль
4.
Масса, m
?г
?г
?г
5.
Молярный объём, Vm
—
? л/моль
—
6.
Объём, V
—
?л
—
3.
Заполните пропуски,проанализировав записи.
4Al
+ 3O2
= 2Al2O3
2 молекул
1.
Число частиц, N
4 атома
3 молекул
2.
Количество вещества, n
4 моль
3 моль
3.
Молярная масса, М
27 г/моль
4.
Масса, m
108 г
5.
Молярный объём, Vm
—
6.
Объём, V
—
32
96
г/моль
г
22,4 л/моль
67,2 л
2
моль
102 г/моль
204
г
—
—
4. Заполните пропуски (самостоятельно).
Если в реакцию вступит 2 моль алюминия,то потребуется ? моль кислорода, ? моль
оксида алюминия (III).
Для получения 4 моль оксида алюминия
(III) потребуется ? моль алюминия и ? моль
кислорода.
Из ? г алюминия при взаимодействии с
67,2 л кислорода образуется ? г оксида
алюминия (III).
Для получения 20,4 г оксида алюминия (III)
необходимо ? л кислорода и ? г алюминия.
5. Осуществите самопроверку и самооценку
Если в реакцию вступит 2 моль алюминия,то потребуется 1,5 моль кислорода, 1 моль
оксида алюминия (III).
Для получения 4 моль оксида алюминия
(III) потребуется 8 моль алюминия и 6 моль
кислорода.
Из 108 г алюминия при взаимодействии с
67,2 л кислорода образуется 204 г оксида
алюминия (III).
Для получения 20,4 г оксида алюминия (III)
необходимо 6,72 л кислорода и 10,8 г
алюминия.
6.
7. Выводы
Химическое уравнение показывает нетолько качественную сторону процесса,
но (что очень важно!) и количественную
сторону его.
Отношение числа молекул реагирующих
веществ и продуктов реакции, выраженное
в уравнении реакции коэффициентами,
есть в тоже время отношение числа
молей.
8.
«Отношения количеств веществ, участвующих вхимической реакции, к их собственным
коэффициентам в уравнении химической реакции
равны между собой»
Пусть дано уравнение химической реакции:
aA + bB = cC + dD
тогда выполняется соотношение
nA
nB
nC
nD
--------- = -------- = -------- = --------- [моль]
a
b
c
d
где nA, nB – количества вступивших в реакцию
реагентов; nC, nD – количества продуктов; а = νА,
b = νВ, c = νС, d = νD – стехиометрические
коэффициенты.
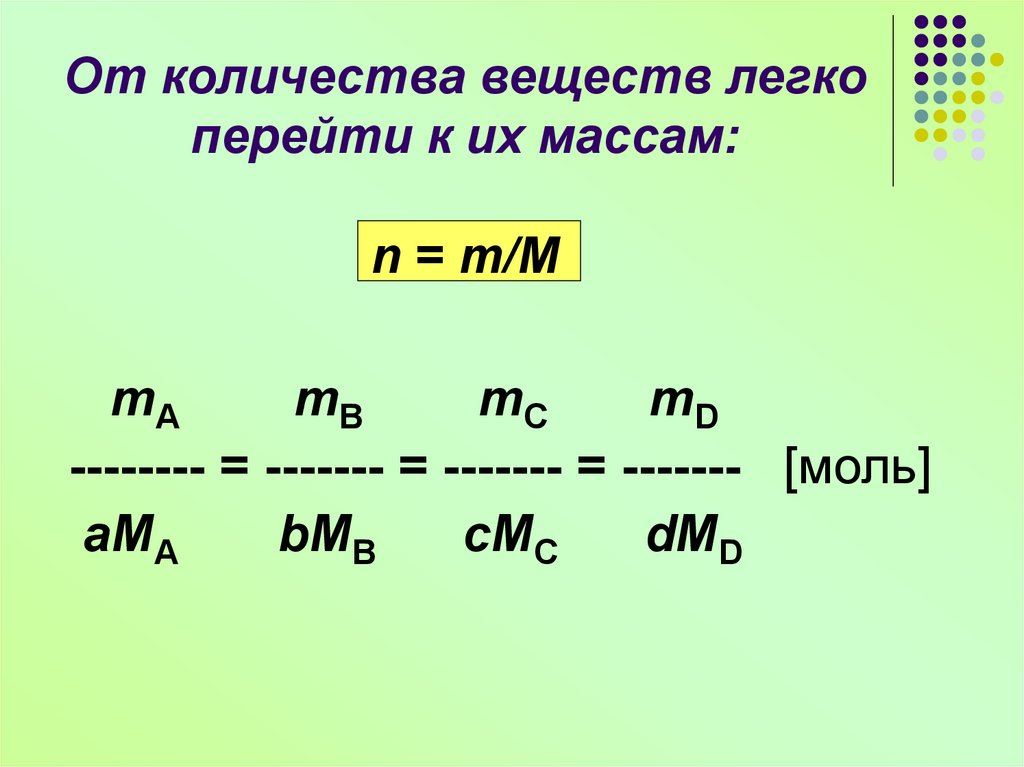
9. От количества веществ легко перейти к их массам: n = m/M
mAmB
mC
mD
-------- = ------- = ------- = ------- [моль]
aMA
bMB
cMC
dMD
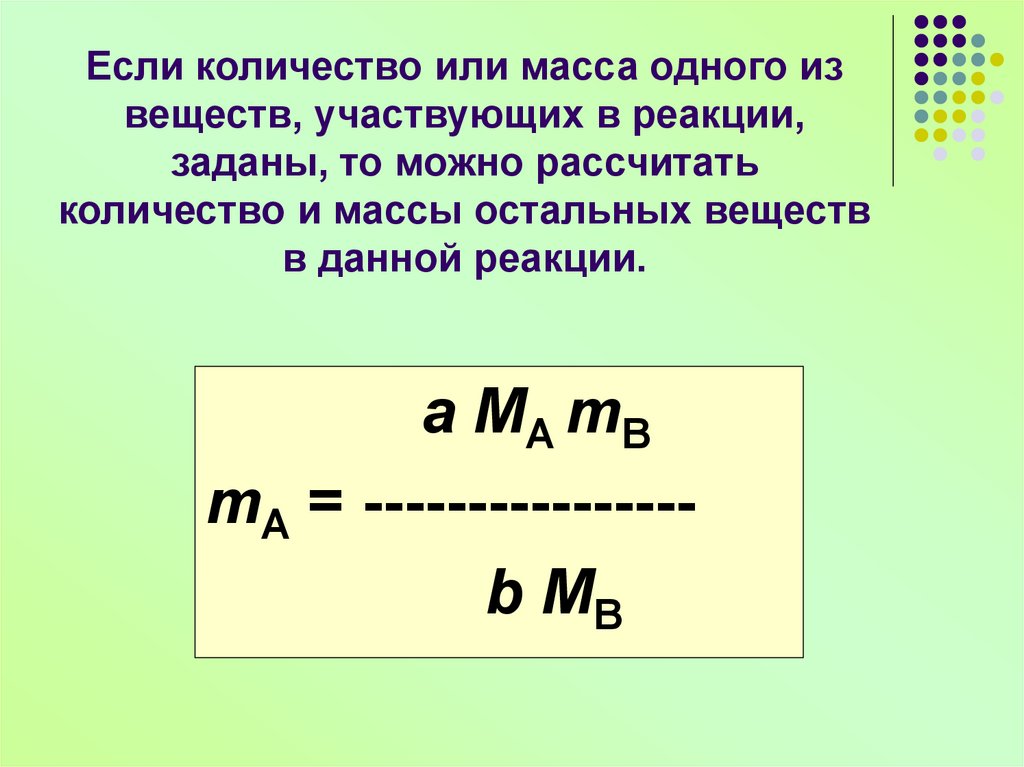
10. Если количество или масса одного из веществ, участвующих в реакции, заданы, то можно рассчитать количество и массы остальных
веществв данной реакции.
a MA mB
mA = ---------------b MB
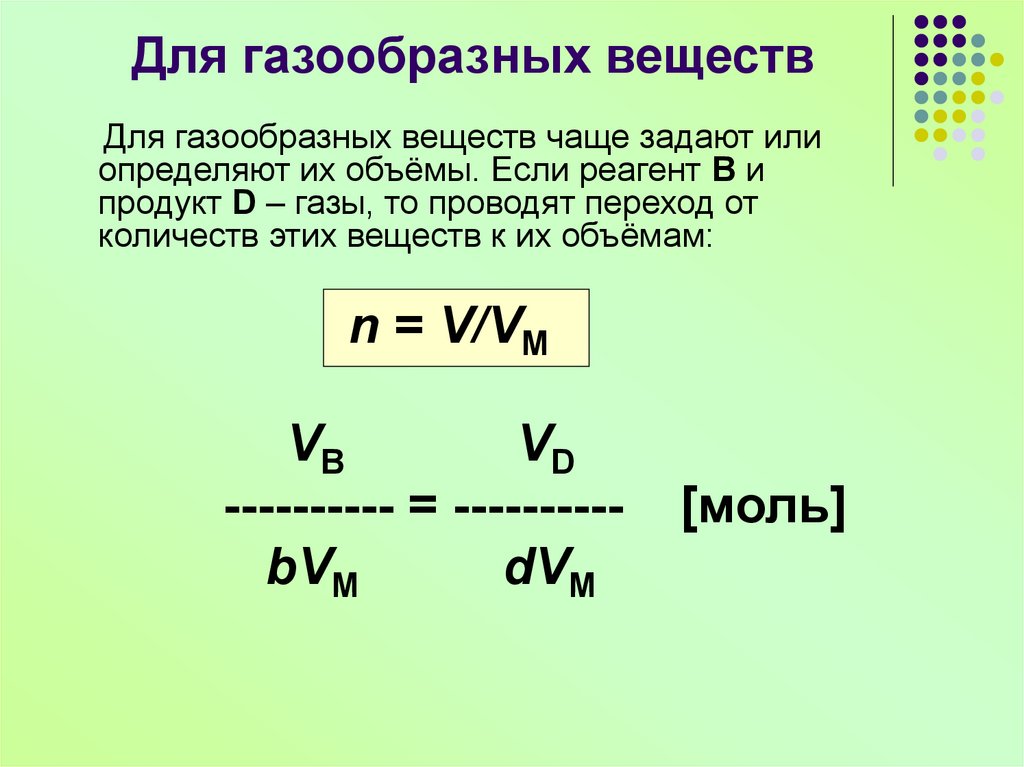
11. Для газообразных веществ
Для газообразных веществ чаще задают илиопределяют их объёмы. Если реагент В и
продукт D – газы, то проводят переход от
количеств этих веществ к их объёмам:
n = V/VM
VB
VD
---------- = ---------bVM
dVM
[моль]
12. Зная одно из значений (VB или VD, а для веществ А и С – mA или mC), можно рассчитать значения всех остальных величин.
b VM mCVB = ---------------c MC
13. Расчёты по уравнениям реакций на «избыток» и «недостаток»
Количества, массы и объёмы (для газов)реагентов не всегда берутся
стехиометрическими, т.е. в соответствии с
уравнением реакции. Чаще один реагент берётся
в избытке, а следовательно, другой реагент
окажется в недостатке. Избыток реагента
вступать в реакцию не будет.
Определение реагентов, взятых в избытке и
в недостатке, проводят по неравенству (реагент
А – в недостатке, реагент В – в избытке):
14.
nАnобщ.В
nВ + nизб.В
------ < --------- = ----------------- [моль]
a
b
b
где nобщ.В – общее (взятое с избытком) количество
реагента В,
nВ – стехиометрическое (необходимое для реакции)
количество В,
nизб.В – избыточное (не реагирующее) количество В.
Расчёт получаемых количеств, масс и объёмов
(для газов) продуктов проводят только по реагенту в
н е д о с т а т к е!
15. Расчёты по уравнениям реакций на практический выход продукта
Количество продукта, например В, рассчитанноепо уравнению реакции, является максимально
возможным значением (теоретическое
количество nВ). На практике из-за потерь обычно
получают меньшее количество (практическое
количество, nпр.В < nВ).
Практический выход продукта В (ηВ)
определяется отношением его практического
количества к теоретическому:
nпр.В
ηВ = ---------nВ
[доля 1 или в %]
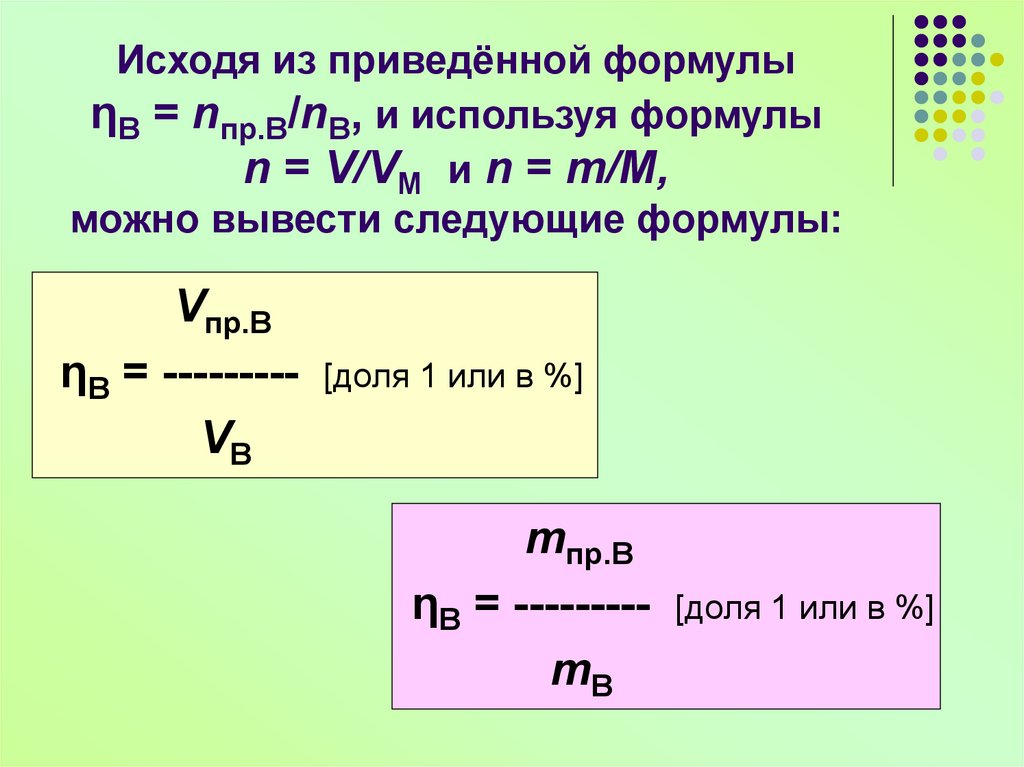
16. Исходя из приведённой формулы ηВ = nпр.В/nВ, и используя формулы n = V/VМ и n = m/M, можно вывести следующие формулы:
Vпр.ВηВ = --------VВ
[доля 1 или в %]
mпр.В
ηВ = --------mВ
[доля 1 или в %]
17. Задача 1
Вычислите объём кислорода(н. у.), необходимый для
сжигания 3 г алюминия. (Такая
реакция происходит при
поджигании бенгальских огней).
18.
РешениеVВ = ?
4Al + 3O2 = 2Al2O3
mА = 3 г
(А)
mА
--------------------------------------
MА = 27 г/моль
VМ = 22,4 л/моль
VВ
mА b VМ
-------- = --------- → VВ = ------------а MА
а = 4 (Al)
b = 3 (O2)
(В)
b VМ
mА bVМ
a MА
3 г · 3 · 22,4 л/моль
VВ = ------------ = ----------------------------- = 1,87 л
aMА
Ответ: V (O2) = 1,87 л
4 · 27 г/моль
19. Задача 2
При сгорании аммиака в избыткекислорода после охлаждения
конечной смеси обнаружено 56 л
(н. у.) газообразного продукта с
практическим выходом 85%.
Найдите массу (в граммах) взятой
порции аммиака.
20.
РешениеmA = ?
Vпр.В = 56 л
ηВ = 85% или 0,85
---------------------------------------
MА = 17 г/моль
VМ = 22,4 л/моль
а = 4 (NH3)
b = 2 (N2)
4NH3 + 3O2 = 2N2 + 6H2O
(А)
(В)
a MА VB
ηВ = Vпр.В / VВ
a MA Vпр.В
mA = ------------ = ---------------- =
b VМ
b VМ ηВ
4 · 17 г/моль · 56 л
= ----------------------------- = 100 г
2 · 22,4 л/моль · 0,85
Ответ: m (NH3) = 100 г
21. Итог урока
— Выразите в виде формулы отношения количестввеществ, участвующих в химической реакции, к их
собственным коэффициентам.
— С помощью, какой формулы можно рассчитать
массу (или объём) вещества в данной реакции, если
масса одного из веществ, участвующих в реакции,
задана.
— Как (при помощи какого неравенства) можно
определить, какое вещество в данной реакции взято
в «избытке», а какое – в «недостатке»?
— Как определить практический выход продукта?
22. Домашнее задание
§ 28;конспект урока;
выбрать и решить из предложенного
списка не менее 3-х задач;
записать выведенные формулыдефиниции для расчёта по уравнениям
неорганических реакций в особую
тетрадь.

















 chemistry
chemistry








