Similar presentations:
Метод электронного баланса
1. Метод электронного баланса
Цель: научитьсяиспользовать метод
электронного баланса
при записи уравнений
химических реакций.
Учитель химии: Ткаченко Алла Евгеньевна, МОУ СОШ № 84, г. Пермь, 2009 г.
2.
Что такое С.О. элемента?0
x
+1 x -2
x x -2
О2 ; Al ; HNO3 ; CaCO3
x
x
x
Ba(OH)2
3.
Что такое С.О. элемента?0
0
+1 +5 -2
+2 +4 -2
О2 ; Al ; HNO3 ; CaCO3
+2 -2 +1
Ba(OH)2
4.
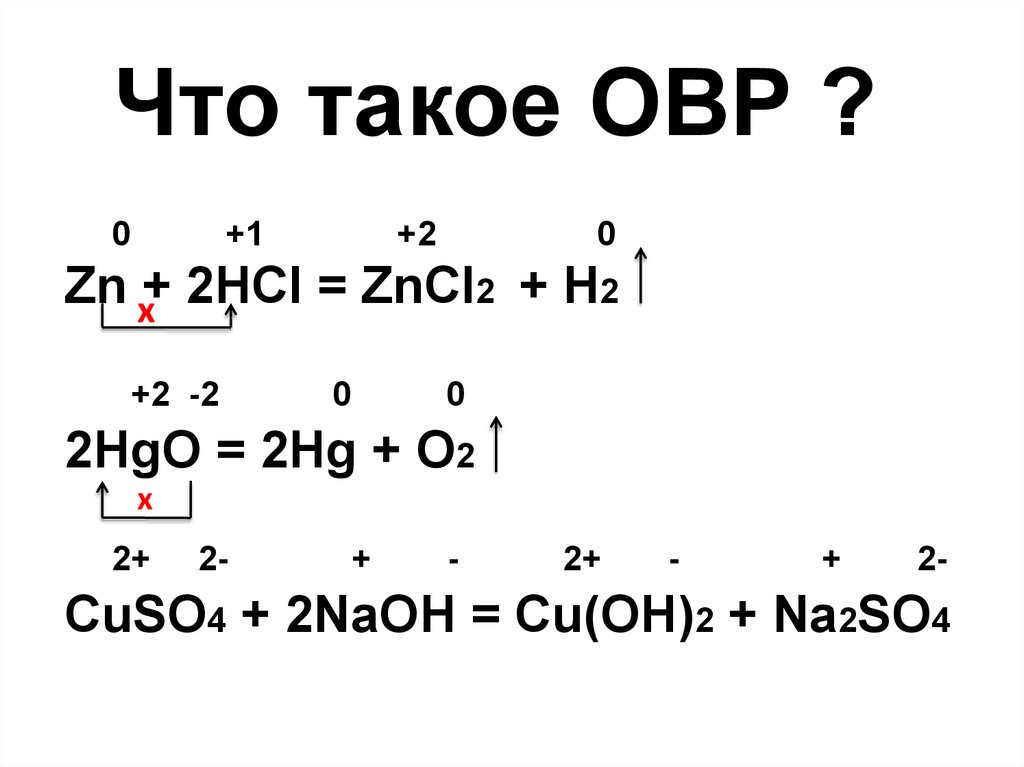
Что такое ОВР ?0
+1
+2
0
Zn x+ 2HCl = ZnCl2 + H2
+2 -2
0
0
2HgO = 2Hg + O2
x
2+
2-
+
-
2+
-
+
2-
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
5.
Что такое ОВР ?0
+1
+2
0
Zn2e
+ 2HCl = ZnCl2 + H2
+2 -2
0
0
2HgO = 2Hg + O2
4e
2+
2-
+
-
2+
-
+
2-
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
6.
Что такое окислениеи восстановление?
+1
2H + 2ē
0
S–xē
0
H2 ;
+6
S;
0
Zn - 2ē
+5
N+xē
+2
Zn
-3
N
7.
Что такое окислениеи восстановление?
+1
2H + 2ē
0
S–6ē
0
H2 ;
+6
S;
0
Zn - 2ē
+5
N+8ē
+2
Zn
-3
N
8.
Алгоритм :1) Определяем С.О. элементов до и
после реакции.
2) Выписываем элементы , в которых
изменилась С.О.
3) Составляем уравнение электронного баланса ( помни! что число принятых и отданных ē равно) .
4) Находим коэффициенты и расставляем их в ур-е р-и .
5) Определяем ок-ль и восст-ль .
9.
Cумма всех коэффициентов в молекулярномуравнении реакции равна:
Mg + H2SO4 = MgSO4 + H2S + H2O
1.22
2. 18
3. 16
4. 20
10. Основные выводы:
Метод электронного балансапозволяет понять сущность
окислительновосстановительных
процессов и помогает в
расстановке коэффициентов
при записи уравнений
химических реакций.









 chemistry
chemistry








