Similar presentations:
Оксиды
1. Оксиды
2. Содержание
Оксид (понятие)Классификация
Основный оксид
Кислотный оксид
Амфотерный оксид
Физические свойства
оксидов
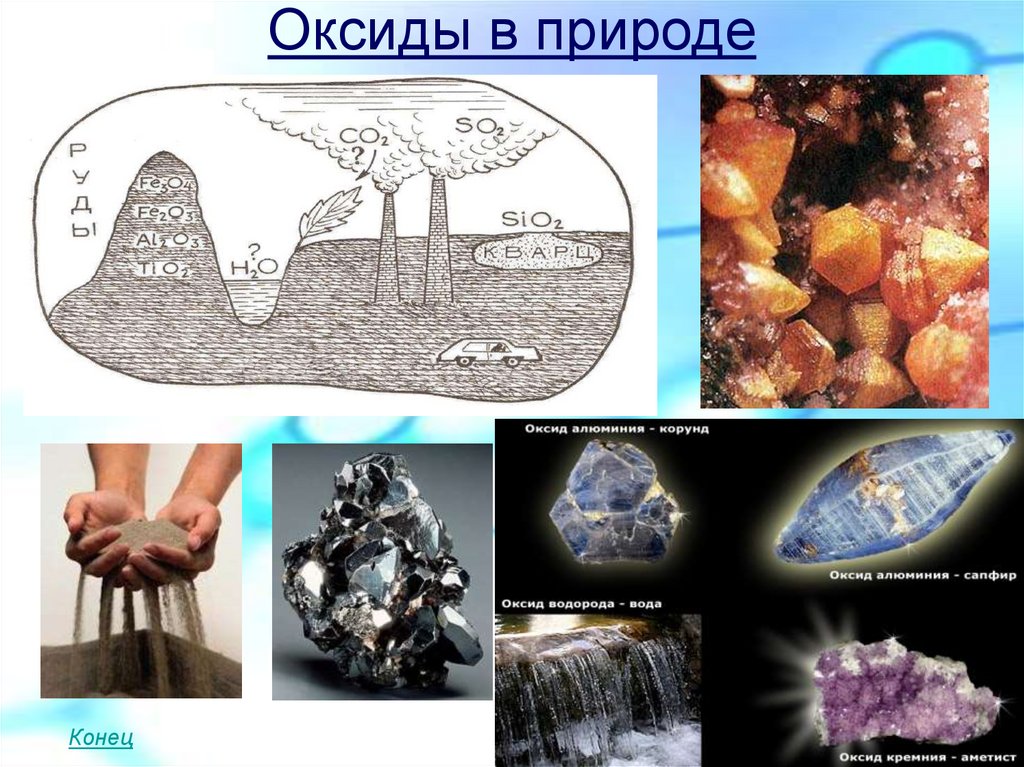
Оксиды в природе
3. Оксид
Оксиды —весьма распространённый тип соединений,
содержащихся в земной коре и во Вселенной вообще. Примерами
таких соединений являются: ржавчина, вода, песок, углекислый газ,
ряд красителей. Оксидами называется класс минералов,
представляющих собой соединения металла с кислородом.
ЭхОу - Общая формула оксидов.
• Э - атомы химического элемента
• О – атомы кислорода
• х, у – индексы, указывающие число
общих элементов, образующих оксид
Оксид хрома(III)
Содержание
Оксид свинца
4. Классификация
В зависимости от химических свойств различают:ОСНОВНЫЕ ОКСИДЫ
Оксиды металлов и переходных элементов с
переменной степенью окисления, если она +1,+2.
КИСЛОТНЫЙ ОКСИД
Оксиды неметаллов и переходных элементов, с
переменной степенью окисления, если она +5, +6, +7.
АМФОТЕРНЫЙ ОКСИД
Оксиды переходных элементов с постоянной степенью
окисления. Если переходный элемент имеет несколько
степеней окисления, то +3,+4.
Содержание
5. Основный оксид
ХИМИЧЕСКИЕ СВОЙСТВА1. Основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
2. Основный оксид + вода = щёлочь
CaO + H2O = Ca(OH)2
Примечание: только оксиды 10-ти активных металлов.
3. Основный оксид + кислотный оксид = соль + вода
CaO + SO3 = CaSO4 (при нагревании)
4. Основный оксид + амфотерный оксид = соль (при нагревании)
CaO + ZnO = CaZnO2
5. Основный оксид + амфолит = соль + вода
Na2O + Be(OH)2 = Na2BeO2 + H2O
Содержание
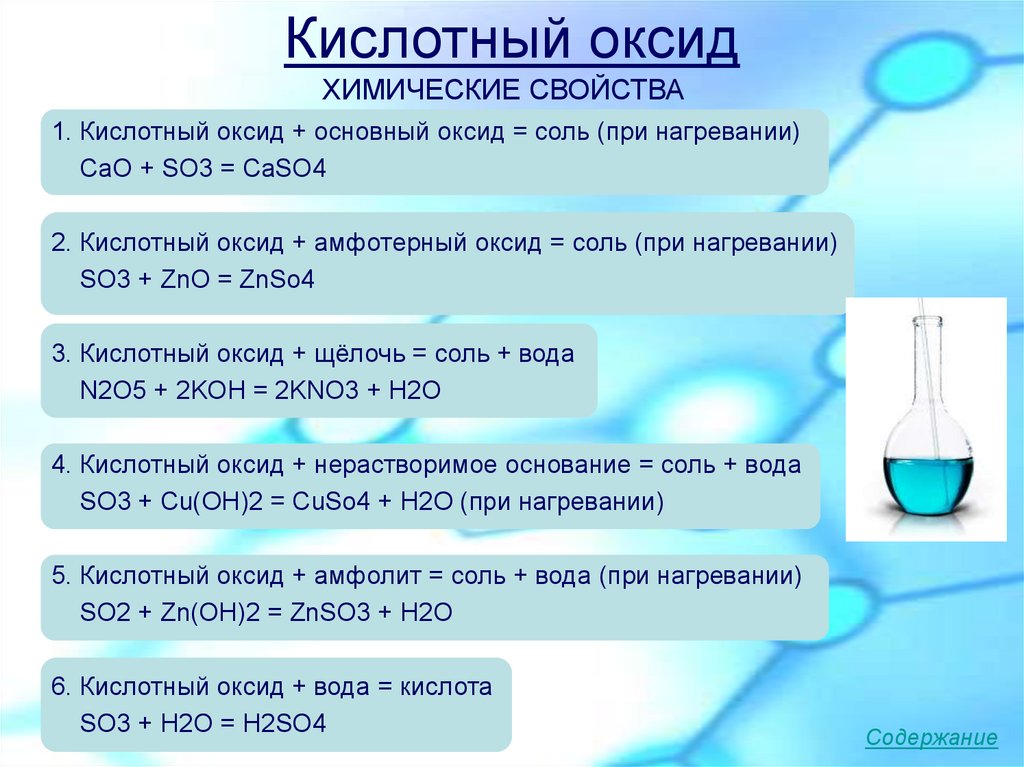
6. Кислотный оксид
ХИМИЧЕСКИЕ СВОЙСТВА1. Кислотный оксид + основный оксид = соль (при нагревании)
СaO + SO3 = CaSO4
2. Кислотный оксид + амфотерный оксид = соль (при нагревании)
SO3 + ZnO = ZnSo4
3. Кислотный оксид + щёлочь = соль + вода
N2O5 + 2KOH = 2KNO3 + H2O
4. Кислотный оксид + нерастворимое основание = соль + вода
SO3 + Cu(OH)2 = CuSo4 + H2O (при нагревании)
5. Кислотный оксид + амфолит = соль + вода (при нагревании)
SO2 + Zn(OH)2 = ZnSO3 + H2O
6. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
Содержание
7. Амфотерный оксид
ХИМИЧЕСКИЕ СВОЙСТВА1. Амфотерный оксид + кислотный оксид = соль (при нагревании)
SO3 + ZnO = ZnSO4
2. Амфотерный оксид + основный оксид = соль (при нагревании)
CaO + ZnO = CaZnO2
3. Амфотерный оксид + щёлочь = соль + вода
BeO + 2KOH = K2BeO2 + H2O
4. Амфотерный оксид + кислота = соль + вода
BeO + 2HCl = BeCl2 + H2O
Содержание
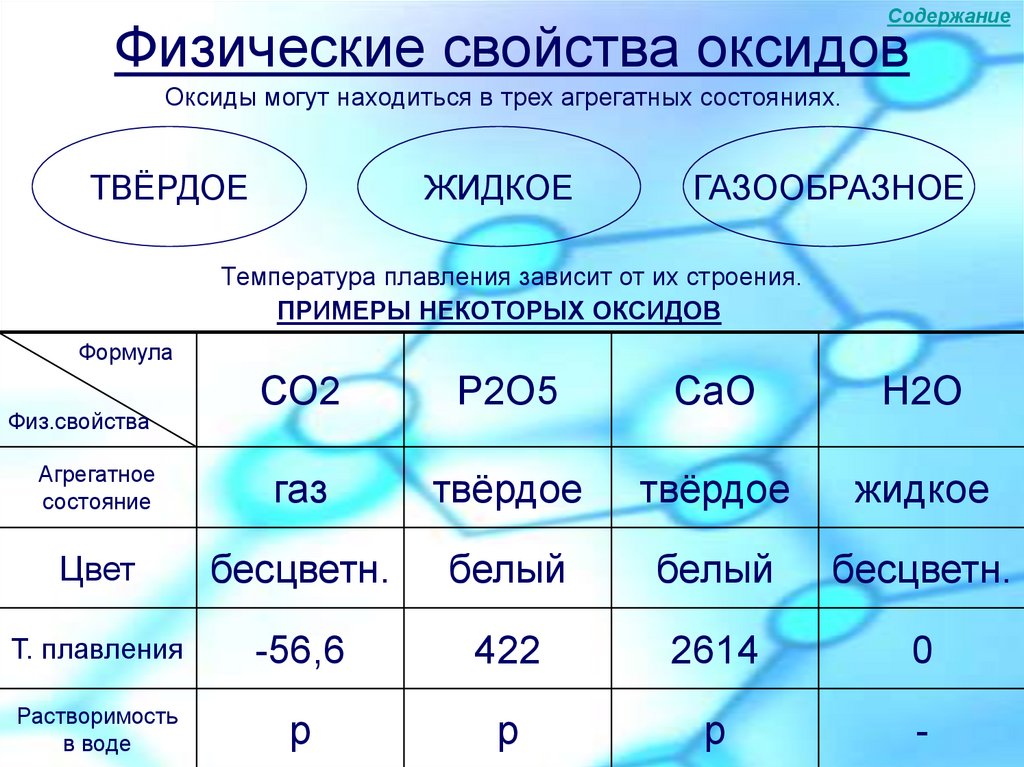
8. Физические свойства оксидов
СодержаниеФизические свойства оксидов
Оксиды могут находиться в трех агрегатных состояниях.
ТВЁРДОЕ
ЖИДКОЕ
ГАЗООБРАЗНОЕ
Температура плавления зависит от их строения.
ПРИМЕРЫ НЕКОТОРЫХ ОКСИДОВ
Формула
СО2
Р2О5
СaO
Н2О
Агрегатное
состояние
газ
твёрдое
твёрдое
жидкое
Цвет
бесцветн.
белый
белый
бесцветн.
T. плавления
-56,6
422
2614
0
Растворимость
в воде
р
р
р
-
Физ.свойства
9. Применение оксидов
• Приготовление строительных растворов.• Глазурное покрытие для керамических изделий.
• Изготовление стекла.
• Получение кислот, оснований.
Содержание
10. Оксиды в природе
Конец11.
Презентацию по теме «Оксиды» подготовили ученики 11-2 классаСвеженцев Дмитрий и Саенко Евгений.








 chemistry
chemistry








