Similar presentations:
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
1. Тема: Електролітична дисоціація. Електроліти та неелектроліти
https://www.youtube.com/watch?v=zrN-cCxn26YУрок хімії в 9 класі
LOGO
2.
Мета:Дати відповідь на запитання: Чому одні
речовини проводять струм, а інші - ні?
Як їх класифікують? Що відбувається з
речовинами, коли їх розчиняють?
Де застосовуються електроліти.
LOGO
3.
Цілі:Електролітична дисоціація.
Електроліти та неелектроліти.
ТЕД(теорія електролітичної дисоціації)
Електролітична дисоціація кислот,
основ, солей у водних розчинах.
Сильні й слабкі електроліти.
LOGO
4.
Як ви думаєте: які з цих речовин будутьпроводити електричний струм?
LOGO
5.
Чи всі речовини проводять струм?LOGO
6.
Н2 ОНе проводить електричний струм
LOGO
7.
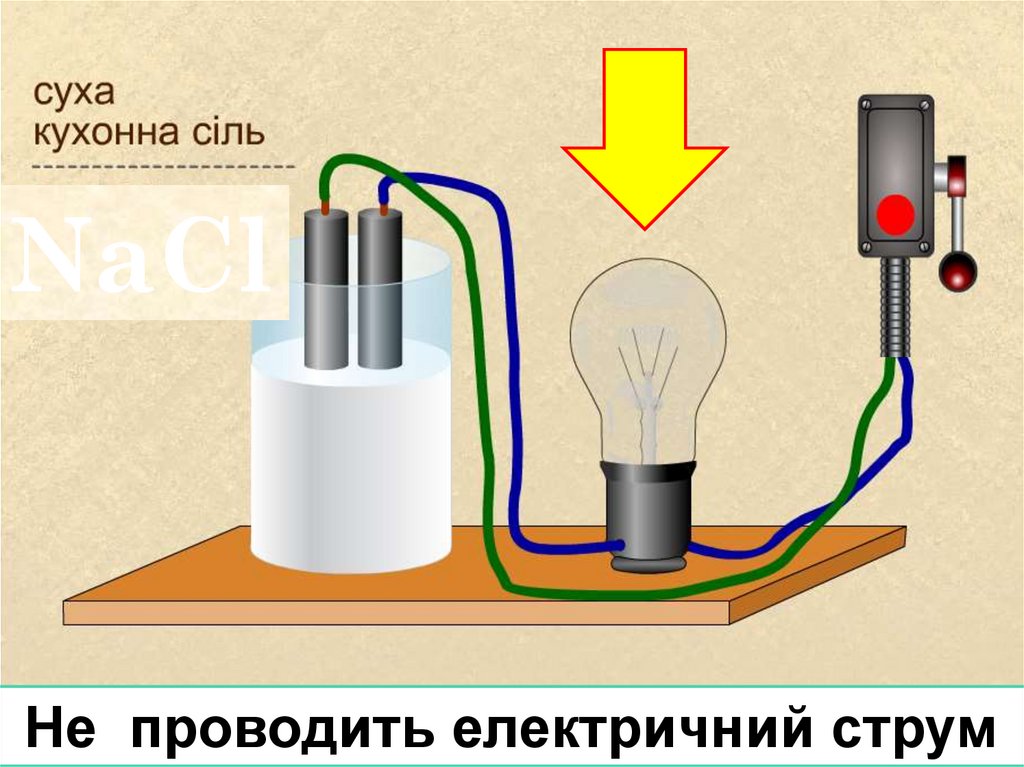
NaClНе проводить електричний струм
LOGO
8.
Що являє собою кристал натрій хлориду?У кристалі солі йони утримуються за рахунок сил
електростатичного притягання.
Це речовина з йонним звязком
LOGO
9.
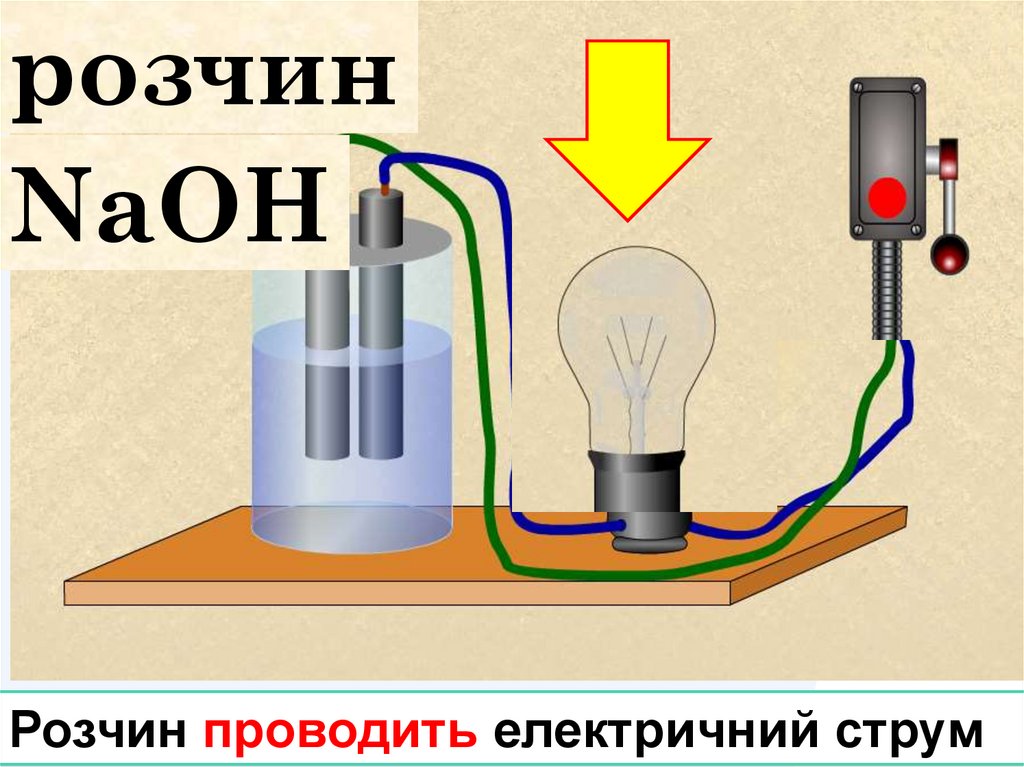
NaClРозчин проводить електричний струм
LOGO
10.
Що відбувається з кристалом натрій хлориду,коли він потрапляє у воду?
Гідратовані
йони
Між йонами кристалічних
граток і диполями води
Кристалічні гратки натрій хлориду
руйнуються і утворюються гідратовані
йони
виникають зв'язки
LOGO
11.
розчинNaОH
Розчин проводить електричний струм
LOGO
12.
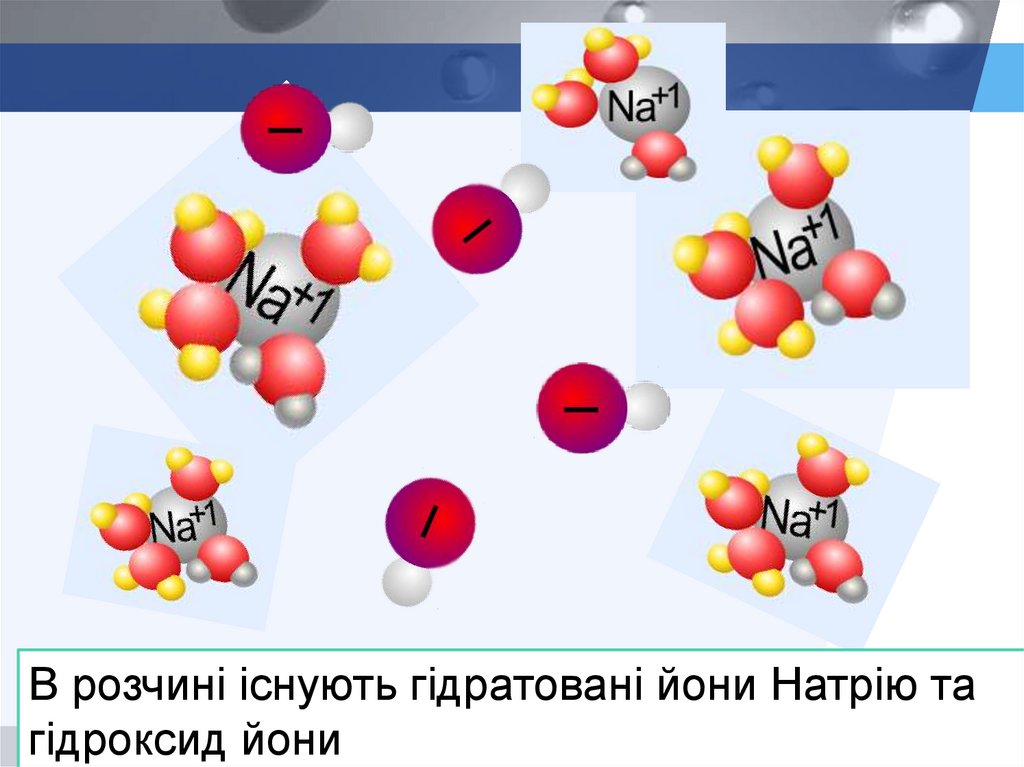
В розчині існують гідратовані йони Натрію тагідроксид йони
LOGO
13.
НClРозчин проводить електричний струм
LOGO
14.
Послідовність процесів дисоціації речовини піддією молекул води
Cl─
+
─
Н+
1. Орієнтація
молекул води
навкруги полюсів
молекули HCl
2. Гідратація (взаємодія) молекул води з
молекулами електроліта
LOGO
15.
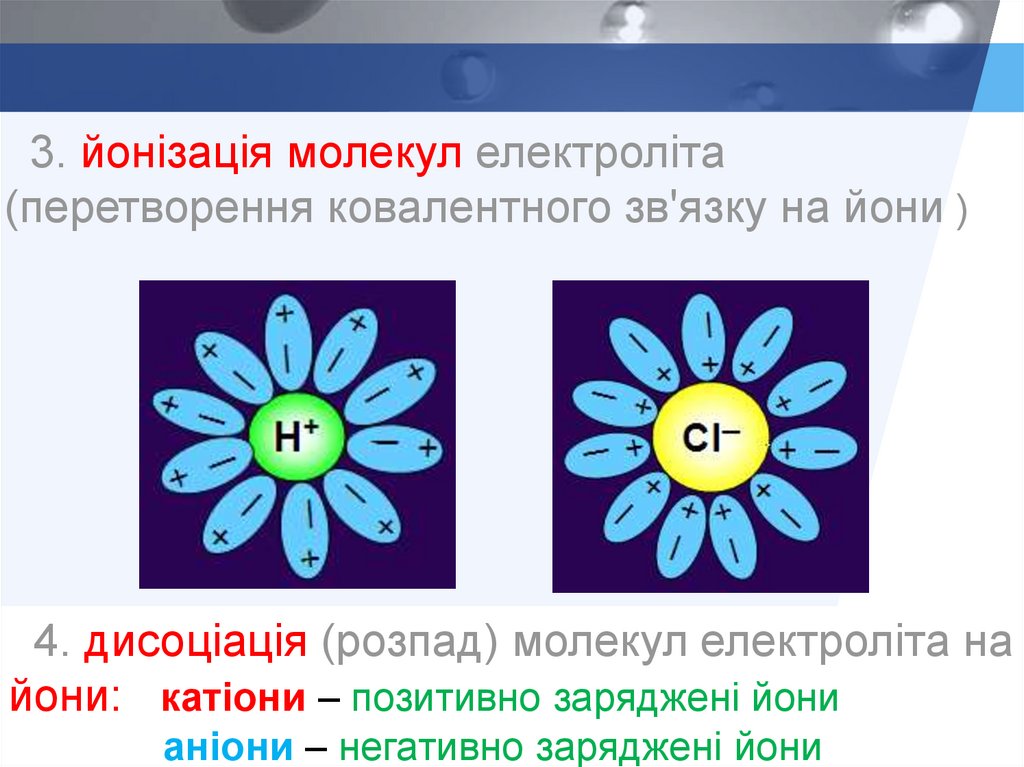
3. йонізація молекул електроліта(перетворення ковалентного зв'язку на йони )
4. дисоціація (розпад) молекул електроліта на
йони: катіони – позитивно заряджені йони
аніони – негативно заряджені йони
LOGO
16.
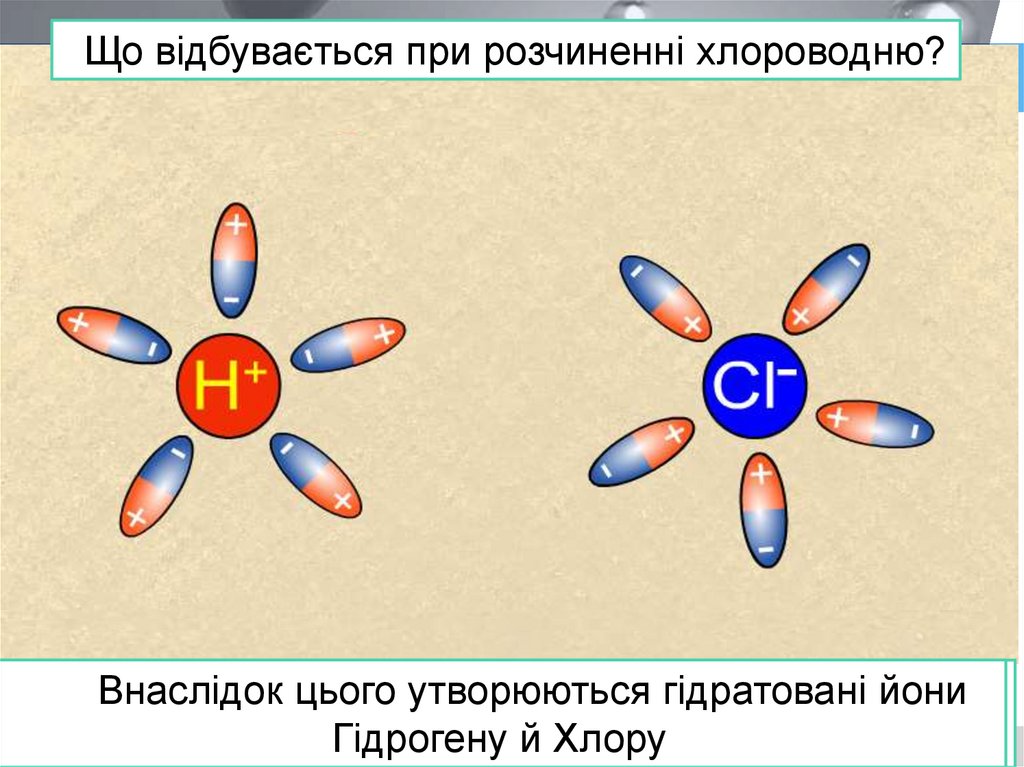
Що відбувається при розчиненні хлороводню?Поляризовані молекули води орієнтуються
навкруги полюсів молекули хлороводню та
взаємодіють з нею
Внаслідок
цього утворюються
гідратовані
йони
Спільна
електронна
пара переходить
від атома
Гідрогену
Гідрогену до атома
Хлору й Хлору
LOGO
17.
―+
Cl
К
а
т
о
д
Cl
─
─
Н
Н
+
Cl
+
─
Cl
Н
─
+
Cl
─
Н
+
Cl
Н
+
─
Н
+
Н
А
н
о
д
+
Носіями зарядів являються йони
LOGO
18.
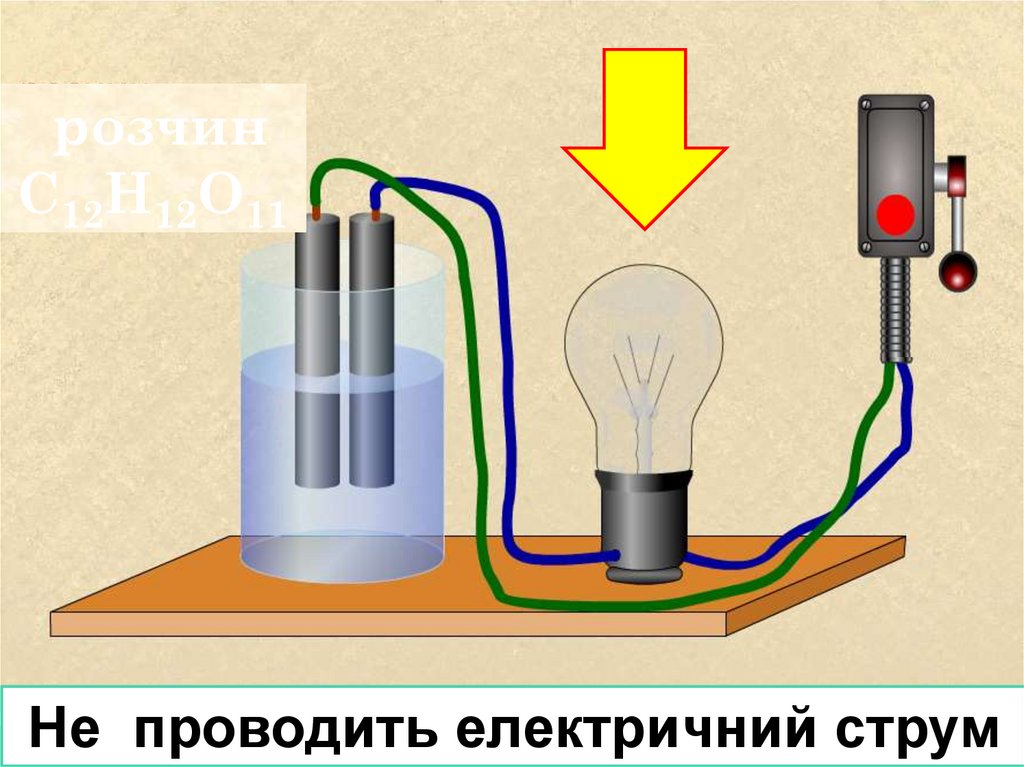
розчинС12Н12О11
Не проводить електричний струм
LOGO
19.
Цукор в розчині розпадається до молекулLOGO
20.
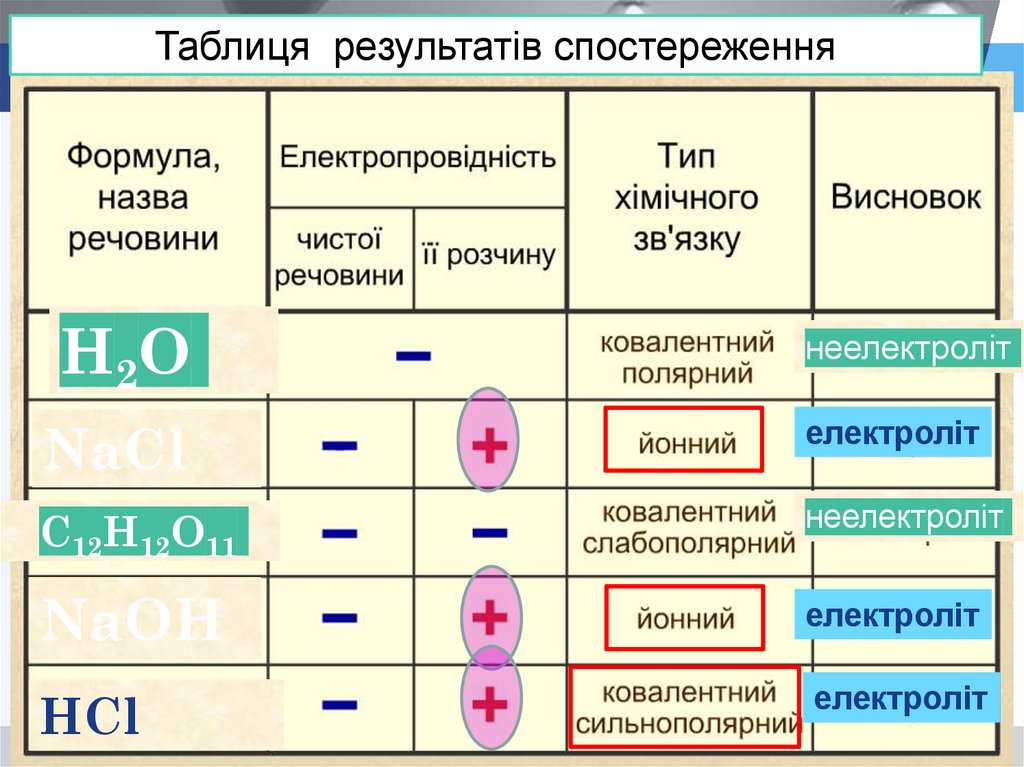
Таблиця результатів спостереженняН2О
неелектроліт
NaCl
електроліт
С12Н12О11
неелектроліт
NaОH
електроліт
НCl
електроліт
LOGO
21.
Майкл Фарадейзапропонував поділити
речовини на дві групи за
здатністю проводити
струм
LOGO
22.
РечовиниЕлектроліти
Речовини, водні розчини
Натисніть яких
або розплави
проводять електричний
струм
Неелектроліти
Речовини, водні розчини
Натисніть яких не
або розплави
проводять електричний
струм
Клас сполук:
•солі
•кислоти Клас сполук
•основи
Клас сполук:
•Більшість органічних речовин
Класгліцерин,
сполук глюкоза)
(цукор, спирт,
•О2, Н2, N2 та інші
Тип зв’язку: йонний або
Тип зв’язку
ковалентний
сильно
полярний
Тип зв’язку: ковалентний
Тип зв’язку
малополярний
або
ковалентний неполярний
23.
Чому електроліти проводять струм?При розчиненні речовини чи при сплавленні
з’являються зарядженні частинки, які можуть вільно
рухатися. Ці частинки називаються йонами.
Електролітична дисоціація – процес
розщеплення електролітів на йони під час
розчинення або розплавлення (с. 65 підручника)
LOGO
24. Йони - заряджені частинки
Катіони – позитивно заряджені йониАніони – негативно заряджені йони
LOGO
25.
Теорію електролітичноїдисоціації сформулював швед
Сванте Арреніус (1887 р.), за
що у 1901 р. отримав
Нобелівську премію з хімії.
LOGO
26.
Сучасний зміст ТЕД можназвести до чотирьох основних положень
I- положення:
Всі речовини по їх здатності
проводити електричний струм в
розчинах діляться на електроліти та
неелектроліти
LOGO
27.
ІІ положення: В розчинах електролітидисоціюють (розпадаються) на позитивні
(катіони)і негативні (аніони) йони.
ІІІ положення: Причиною дисоціації
електроліту є його взаємодія з молекулами
води (гідратація).
Процес розпаду електроліту на йони
називається електролітичною
дисоціацією (ЕД).
LOGO
28.
LOGO29.
1.2.
3.
4.
5.
6.
7.
8.
9.
Речовини, розчини яких проводять електричний струм.
Процес розпаду електроліту на йони.
Позитивно заряджені йони.
Негативно заряджені йони.
Електроліти, які при дисоціації утворюють катіони гідрогену і
анйони кислотного залишку.
Електроліти, які при дисоціації утворюють катіони металу і
анйони гидроксогрупп ОН-.
Електроліти, які при дисоціації утворюють катіони металу і
анйони кислотних залишків
Молекули, що мають два електричних заряду, рівних за
величиною, але протилежних за знаком, і розташованих на
деякій відстані один від одного.
Автор теорії електролітичної дисоціації.
LOGO
30.
Підкресліть речовини – електролітихлоридна кислота, кисень, натрій хлорид,
натрій гідроксид, спирт, ацетон, кальцій гідроксид,
глюкоза, вуглекислий газ, сульфатна кислота.
LOGO
31.
завдання 1Назвіть катіони: Sn2+, OH−, Al3+, PO43−, K+, Fe2+, Cl−
SiO32−, Ва2+, К+, Fe3+, SO42-? S2завдання 2
Випиши прості йони : Sn2+, OH−, Al3+, PO43−, K+, Fe2+, SiO32−, Ва2+,
К+, Fe3+, SO42- S2завдання 3
випиши йони, які під час електролітичної дисоціації будуть
рухатися до анода: Sn2+, OH−, Al3+, PO43−, K+, Fe2+, Cl−
SiO32−, Ва2+, К+, Fe3+, SO42- S2LOGO
32.
Домашнє завдання:§8 опрацювати, вивчити
основні терміни та поняття,
виконати завдання з
презентації
LOGO
























 chemistry
chemistry








