Similar presentations:
Гидролиз солей
1.
ХимияТема: Гидролиз солей
Учебные вопросы:
1. Основные понятия гидролиза
солей;
2. Гидролиз солей
2.
Водородным показателем рН называетсяотрицательный десятичный логарифм концентрации
ионов водорода : рН = - lg [H]
3.
ГИДРОЛИЗ солей – это процесс взаимодействияионов соли с водой, в результате которого
образуются слабые электролиты
Степень гидролиза (h) равна отношению числа
гидролизированных молекул соли к общему числу
растворенных молекул:
n – число молекул соли,
подвергшихся гидролизу
N – общее число
растворенных молекул
соли
4.
5.
6.
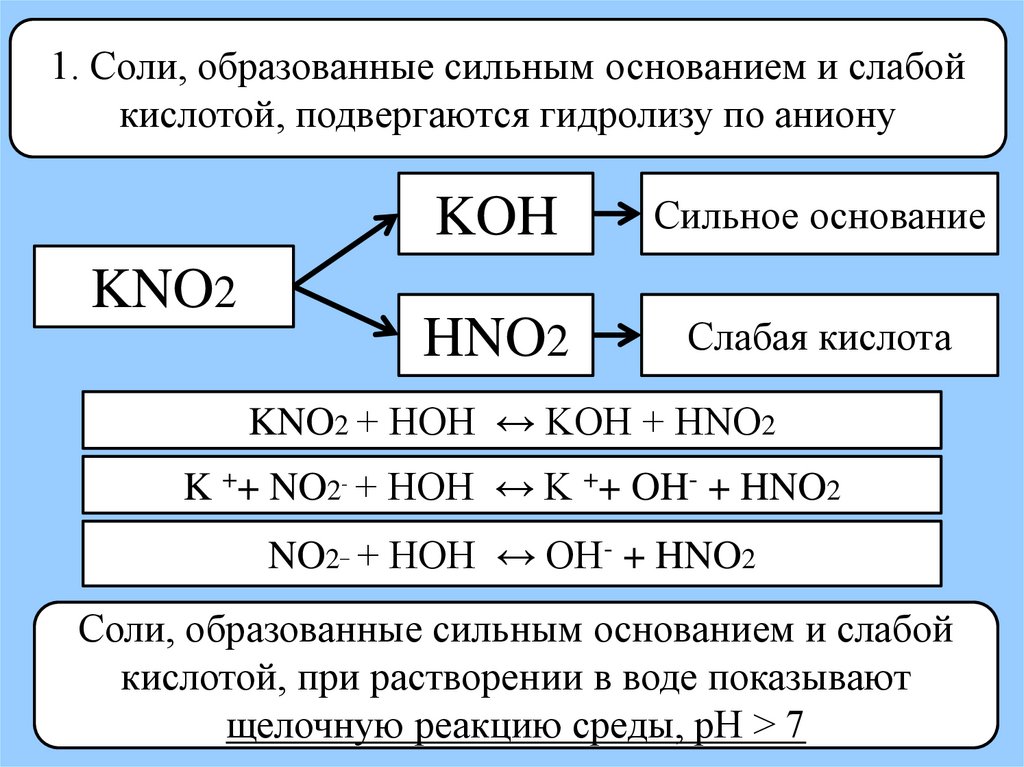
1. Соли, образованные сильным основанием и слабойкислотой, подвергаются гидролизу по аниону
KNO2
KOH
Сильное основание
HNO2
Слабая кислота
KNO2 + HOH ↔ KOH + HNO2
K ++ NO2- + HOH ↔ K ++ OH- + HNO2
NO2_ + HOH ↔ OH- + HNO2
Соли, образованные сильным основанием и слабой
кислотой, при растворении в воде показывают
щелочную реакцию среды, рН > 7
7.
2. Соли, образованные слабым основанием и сильнойкислотой, подвергаются гидролизу по катиону
NH4 Cl
NH4OH
Слабое основание
HCl
Сильная кислота
NH4 Cl + HOH ↔ NH4 OH + HCl
NH4+ + Cl- + HOH ↔ NH4 OH + H+ + ClNH4+ + HOH ↔ NH4 OH + H+
Соли, образованные слабым основанием и сильной
кислотой, при растворении в воде показывают
кислую реакцию среды, рН < 7
8.
3. Соли, образованные слабым основанием и слабойкислотой, подвергаются гидролизу по катиону и по
аниону
NH4 CN
NH4OH
Слабое основание
HCN
Слабая кислота
NH4 CN + HOH ↔ NH4 OH + HCN
NH4 + CN + HOH ↔ NH4 OH + HCN
Соли, образованные слабым основанием и слабой
кислотой, при растворении в воде показывают
нейтральную реакцию среды, рН = 7
9.
4. Соли, образованные сильным основанием исильной кислотой гидролизу не подвергаются








 chemistry
chemistry








