Similar presentations:
Строение атома. Форма электронных орбиталей
1. СТРОЕНИЕ АТОМА
ЭЛЕКТРОННАЯ БИБЛИОТЕКА ШКОЛЫ 5782.
СОДЕРЖАНИЕ1. Строение атома
2. Форма электронных орбиталей
3. Распределение электронов
4. Электронные конфигурации
3.
Строение атомаВ конце XIX - начале XX века физики доказали, что атом является
сложной частицей и состоит из более простых (элементарных)
частиц. Были обнаружены:
•катодные лучи (английский физик Дж. Дж. Томсон, 1897 г.),
частицы которых получили название электроны e− (несут
единичный отрицательный заряд);
•естественная радиоактивность элементов (французские ученые
- радиохимики А. Беккерель и М. Склодовская-Кюри, физик Пьер
Кюри, 1896 г.) и существование α-частиц (ядер гелия 4He2+);
•наличие в центре атома положительно заряженного ядра
(английский физик и радиохимик Э. Резерфорд, 1911 г.);
•искусственное превращение одного элемента в другой,
например азота в кислород (Э. Резерфорд, 1919 г.). Из ядра атома
одного элемента (азота - в опыте Резерфорда) при соударении с
α-частицей образовывалось ядро атома другого элемента
(кислорода) и новая частица, несущая единичный
положительный заряд и названная протоном (p+, ядро 1H)
•наличие в ядре атома электронейтральных частиц - нейтронов n0
(английский физик Дж. Чедвик, 1932 г.).
4.
следы альфа-частиц в кислороде5.
Врезультате
проведенных
исследований
было
установлено, что в атоме каждого элемента (кроме 1H)
присутствуют протоны, нейтроны и электроны, причем
протоны и нейтроны сосредоточены в ядре атома, а
электроны - на его периферии (в электронной
оболочке).
Число протонов в ядре равно числу электронов в
оболочке атома и отвечает порядковому номеру этого
элемента в Периодической системе.
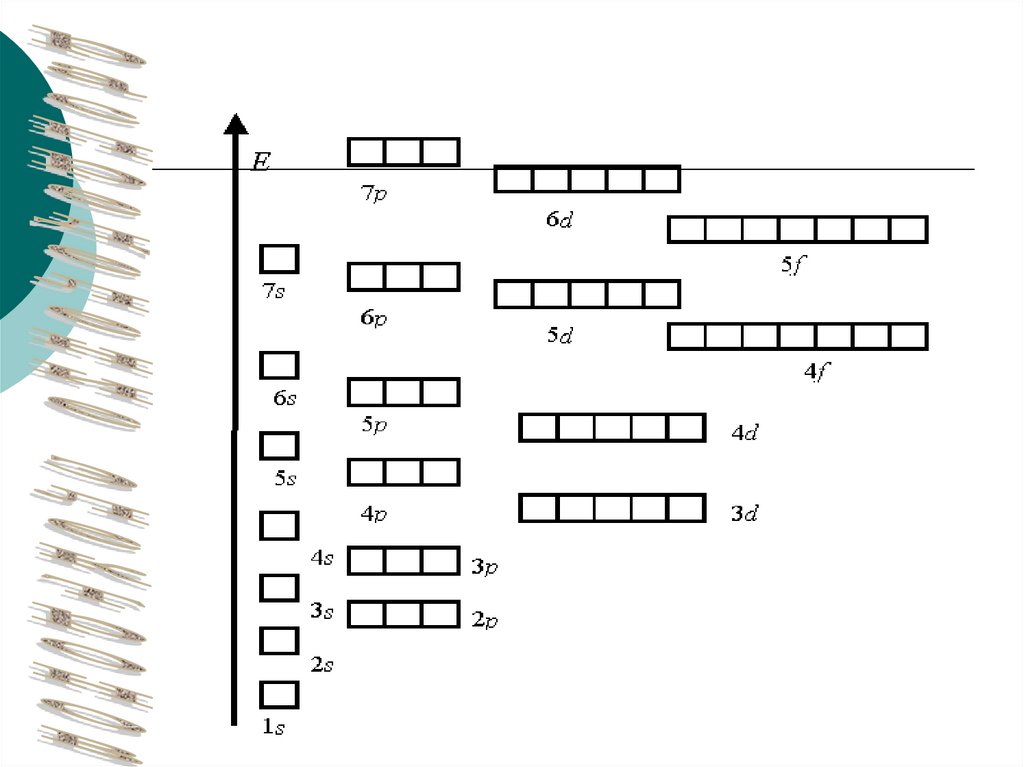
Электронная оболочка атома представляет собой
сложную систему. Она делится на подоболочки с
разной энергией (энергетические уровни); уровни, в
свою очередь, подразделяются на подуровни, а
подуровни включают атомные орбитали, которые могут
различаться формой и размерами (обозначаются
буквами s, p, d, f и др.).
6.
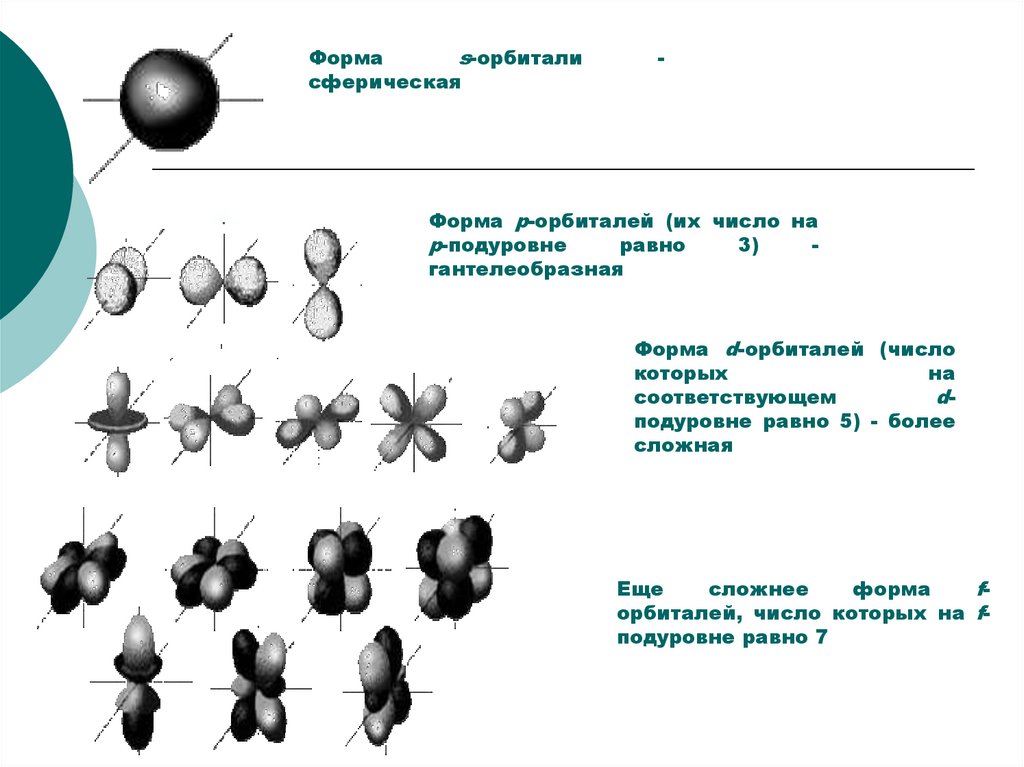
Формаs-орбитали
сферическая
.
-
Форма p-орбиталей (их число на
p-подуровне
равно
3)
гантелеобразная
Форма d-орбиталей (число
которых
на
соответствующем
dподуровне равно 5) - более
сложная
Еще
сложнее
форма
fорбиталей, число которых на fподуровне равно 7
7.
8.
Электронные конфигурации атомовЭлектронные конфигурации атомов записываются в виде
полных и сокращенных электронных формул:
1
1H 1s
2
2He 1s
2
1
1
3Li 1s 2s = [2He] 2s
2
2
2
4Be 1s 2s = [2He] 2s
2
2
1
2
1
5B 1s 2s 2p = [2He] 2s 2p
2
2
2
2
2
6C 1s 2s 2p = [2He] 2s 2p
2
2
3
2
3
7N 1s 2s 2p = [2He] 2s 2p
2
2
4
2
4
8O 1s 2s 2p = [2He] 2s 2p
2
2
5
2
5
9F 1s 2s 2p = [2He] 2s 2p
2
2
6
6
10Ne 1s 2s 2p = [2He] 2s2 2p
2
2
6
1
1
11Na 1s 2s 2p 3s 10Ne] 3s
2
2
6
2
2
12Mg 1s 2s 2p 3s = [10Ne] 3s
2
2
6
2
1
2
1
13Al 1s 2s 2p 3s 3p = [10Ne] 3s 3p
2
2
6
2
2
2
2
14Si 1s 2s 2p 3s 3p = [10Ne] 3s 3p
2
2
6
2
3
2
3
15P 1s 2s 2p 3s 3p = [10Ne] 3s 3p
2
2
6
2
4
2
4
16S 1s 2s 2p 3s 3p = [10Ne] 3s 3p
2
2
6
2
5
2
5
17Cl 1s 2s 2p 3s 3p = [10Ne] 3s 3p
2
2
6
2
6
2
6
18Ar 1s 2s 2p 3s 3p = [10Ne] 3s 3p
2
2
6
2
6
1
1
19K 1s 2s 2p 3s 3p 4s = [18Ar] 4s
2
2
6
2
6
2
2
20Ca 1s 2s 2p 3s 3p 4s = [18Ar] 4s
2
2
6
2
6
1
2
1
2
21Sc 1s 2s 2p 3s 3p 3d 4s = [18Ar] 3d 4s
2
2
6
2
6
2
2
2
2
22Ti 1s 2s 2p 3s 3p 3d 4s = [18Ar] 3d 4s







 chemistry
chemistry








