Similar presentations:
Составить уравнения возможных реакций (на примере темы «Химические свойства оснований»)
1.
Составить уравнениявозможных реакций
(на примере темы
«Химические свойства оснований»)
Составитель:
Анна Валерьевна Дзенис
учитель химии
СП ЦО 109 в ФНКЦ ДГОИ
им. Д.Рогачева
Анна Валерьевна Дзенис
2.
Уважаемые восьмиклассники!Предлагаемая презентация поможет вам закрепить умения
выполнять задания вида «Составить уравнения возможных
реакций» на примере темы «Химические свойства оснований».
Презентация содержит:
- обучающие примеры (в них с помощью анимации показана
последовательность действий),
- тренировочные примеры (их нужно выполнить в тетради
самостоятельно, а для проверки нажать соответствующую
выноску),
- справочный материал (выноска-облачко), который может
понадобиться при выполнении упражнения.
УСПЕХОВ!
Анна Валерьевна Дзенис
3.
Задание:составьте уравнение возможной реакции
Если вы забыли
формулы
кислотных
остатков
Решение:
I
N2 O5
кислотный
оксид
+
I
NaOH →
= 22 Na NO3 + H2O
щелочь
соль
вода
(Взаимодействие возможно,
так как щелочи реагируют с кислотными оксидами)
Следующий
пример
Анна Валерьевна Дзенис
4.
Задание: составьте уравнение возможной реакцииЕсли вы забыли
формулы
кислотных
остатков
Решение:
I
II
2 КOН + СO2 →
= К2СO3 + H2O
щелочь
Если вы
забыли
свойства
щелочей
кислотный
оксид
соль
Проверьте
себя
Анна Валерьевна Дзенис
вода
Следующий
пример
5.
Задание: составьте уравнения возможных реакцийЕсли вы забыли
формулы
кислотных
остатков
Решение:
I
III
а) 3 NaOH + H3PO4 →
= Na 3 PO4 + 3 Н2О
щелочь
б) 2 HCl
кислота
соль
кислота
II
вода
I
= CuCl 2 + 2 Н2О
+ Cu(OH)2 →
нерастворимое
основание
соль
(Реакция возможна:
взаимодействие основания и кислоты – реакция
нейтрализации)
Анна Валерьевна Дзенис
вода
Следующий
пример
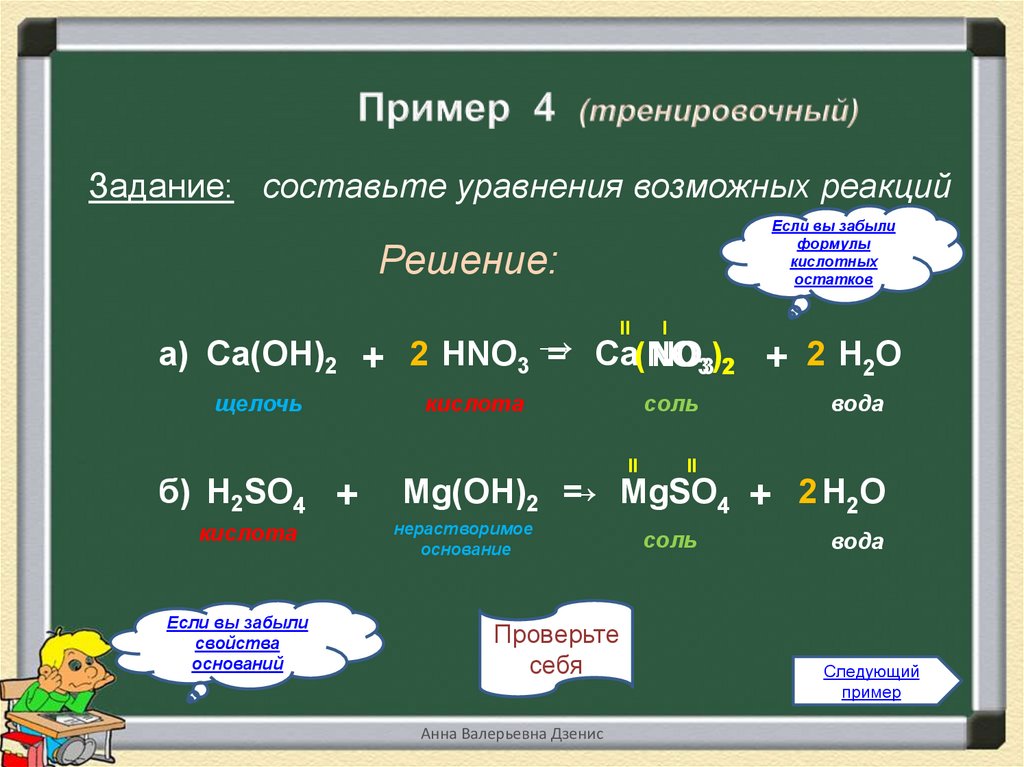
6.
Задание: составьте уравнения возможных реакцийЕсли вы забыли
формулы
кислотных
остатков
Решение:
II
I
а) Ca(OH)2 + 2 HNO3 →
= Ca(NO
NO33)2 + 2 Н2О
щелочь
б) H2SO4 +
кислота
Если вы забыли
свойства
оснований
кислота
соль
II
вода
II
Mg(OH)2 =
→ MgSO4 + 2 Н2О
нерастворимое
основание
Проверьте
себя
Анна Валерьевна Дзенис
соль
вода
Следующий
пример
7.
Задание: составьте уравнения возможных реакцийРешение:
а) LiOH +
щелочь
HCl →
=
кислота
I
I
LiCl + Н2О
соль
вода
б) NaOH + KOH →
≠
щелочь
Если вы забыли
свойства щелочей
щелочь
Проверьте
себя
Анна Валерьевна Дзенис
Следующий
пример
8.
Задание: составить уравнение возможной реакцииРешение:
Fe(OH)2
t
FeO
+ Н2О
(Реакция возможна: нерастворимые основания разлагаются при нагревании)
Выполните самостоятельно аналогичные примеры:
а) Cu(OH)2
t
CuO +
Н2О
б) Mg(OH)2
t
MgO +
Н2О
Проверьте
себя
Анна Валерьевна Дзенис
Следующий
пример
9.
Задание: составить уравнение возможной реакцииРешение:
II
2 KOH +
щелочь
I
I
FeCl2 →
= Fe(OH)
OH 2 +
р-р соли
новое
основание
(нерастворимое)
I
KCl
новая соль
(растворимая)
Проверим (по таблице растворимости) растворимость каждого
из продуктов реакции
Если вы
забыли
свойства
щелочей
(Реакция обмена между щелочью и раствором
соли протекает до конца, если хотя бы один из
продуктов реакции нерастворим (↓))
Следующий
пример
Анна Валерьевна Дзенис
10.
Задание: составить уравнения возможных реакцииЕсли нужна
таблица
растворимости
Решение:
I
a)
II
II
K2CO3 + Са(OH)2 →
= 2 KOH + Са CO3
р-р соли
б)
I
NaOH +
щелочь
Если вы забыли
свойства
оснований
новое
основание
щелочь
BaSO4
новая соль
(нерастворимая)
→
≠
нерастворимая
соль
Проверьте
себя
Анна Валерьевна Дзенис
Следующий
пример
11.
Задание: составить уравнение возможной реакцииЕсли нужна
таблица
растворимости
Решение:
I
I
I
I
КОН + NaCl ↔
→ К Cl + Na OH
щелочь
р-р соли
р-р соли
щелочь
Реакция обмена между щелочью и раствором соли протекает до конца, если
хотя бы один из продуктов реакции нерастворим (↓)
Если вы
забыли
свойства
щелочей
Так как в данном случае оба продукта – KCl и NaOH –
растворимы в воде (таблица растворимости),
осадок не образуется,
процесс обратим (
Анна Валерьевна Дзенис
↔)
Следующий
пример
12.
Задание: составить уравнения возможных реакцийЕсли нужна
таблица
растворимости
Решение:
а) 2 КNО3 + Ва(ОН)2 →
↔
I
I
II
К ОН +
I
Ва (NO
NО33)22
р-р соли
р-р соли
щелочь
щелочь
Так как в данном случае оба продукта – KOH и Ba(NO3)2 – растворимы в
воде, осадок не образуется, процесс обратим
б) 2 NaOH
щелочь
Если вы забыли
свойства
щелочей
I
II
II
I
+ CuSO4 →
= Na2SO4 + CuOH
(OH)2
р-р соли
р-р соли
Проверьте
себя
Анна Валерьевна Дзенис
нерастворимое
основание
Далее
13.
Задание: составить уравнения возможных реакцийа) Ni(NO3)2 + NаОН →
б) Ва(ОН)2 + Na2CO3 →
Если вы
забыли
свойства
оснований
в)
H3PO4
+ Са(OH)2 →
г)
AgCl +
Mg(OH)2 →
Если вы
забыли
формулу
кислотного
остатка
д) SO2 + Вa(OH)2 →
е) KOH +
СаO →
ж) NaOH + K2SO4 →
Анна Валерьевна Дзенис
Проверьте
себя
14.
Проверьте себя= 2 NaNO3 + Ni(OH)2↓
щелочь
б) Ва(ОН)2 + Na2CO3 =
щелочь
р-р соли
II
р-р соли
I
I
а) Ni(NO3)2 + 2 NаОН
I
новая соль
II
II
новое
основание
I
I
BaCO3 ↓ + 2 NaOH
новая соль
II
новое
основание
III
в) 2 H3PO4 + 3 Са(OH)2 = Ca3(PO4)2 + 6 H2O
кислота
основание
соль
вода
продолжение
Анна Валерьевна Дзенис
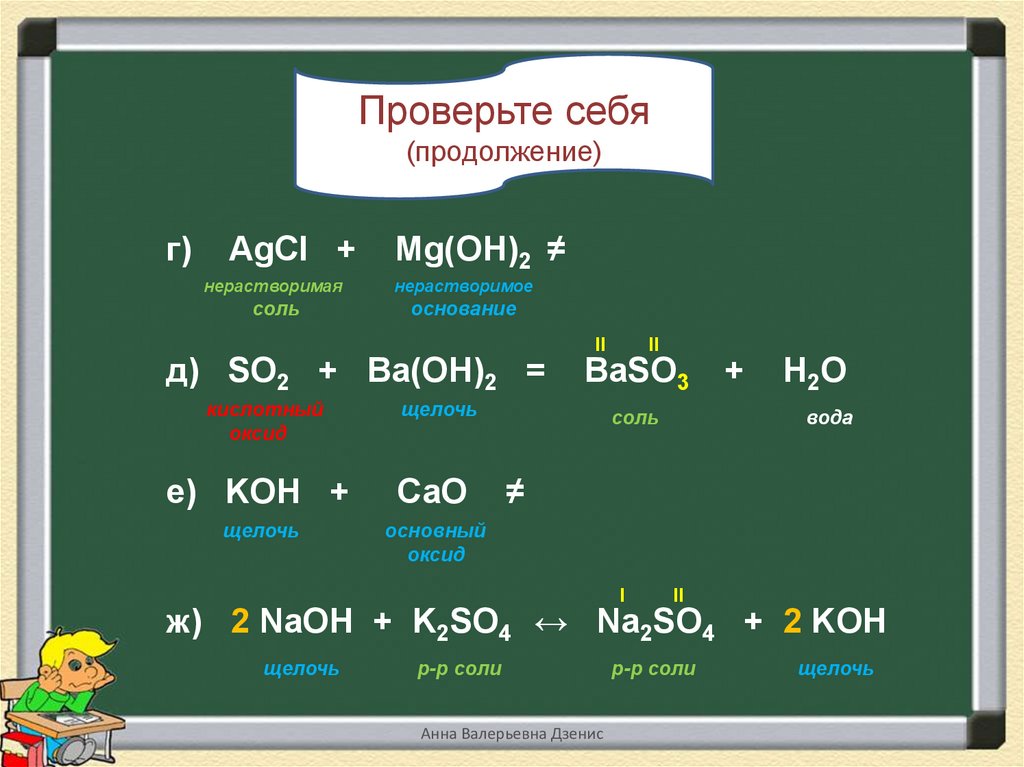
15.
Проверьте себя(продолжение)
г)
AgCl +
Mg(OH)2 ≠
нерастворимая
нерастворимое
соль
основание
д) SO2 + Вa(OH)2 =
кислотный
оксид
II
ВаSO3
щелочь
е) KOH +
СаO
щелочь
основный
оксид
II
соль
+
Н2О
вода
≠
I
II
ж) 2 NaOH + K2SO4 ↔ Na2SO4 + 2 KOH
щелочь
р-р соли
Анна Валерьевна Дзенис
р-р соли
щелочь
16.
Молодец!Анна Валерьевна Дзенис















 chemistry
chemistry








