Similar presentations:
Алканы
1.
АЛКАНЫДругие названия:
гомологический ряд метана,
предельные УВ,
насыщенные УВ
парафины.
2.
• Алканы (гомологический ряд метана илипредельные или насыщенные УВ или
парафины) – нециклические УВ, в молекулах
которых все атомы углерода находятся в
состоянии SP3- гибридизации и связаны друг
с другом только σ-связями.
3.
• 1. Строение основной молекулы;• 2. Характеристика гомологического ряда
(номенклатура, изомерия);
• 3. Физические свойства и нахождение УВ в
природе;
• 4. Химические свойства УВ;
• 5. Способы получения УВ;
• 6. Области практического применения УВ;
• 7. Качественные реакции.
4.
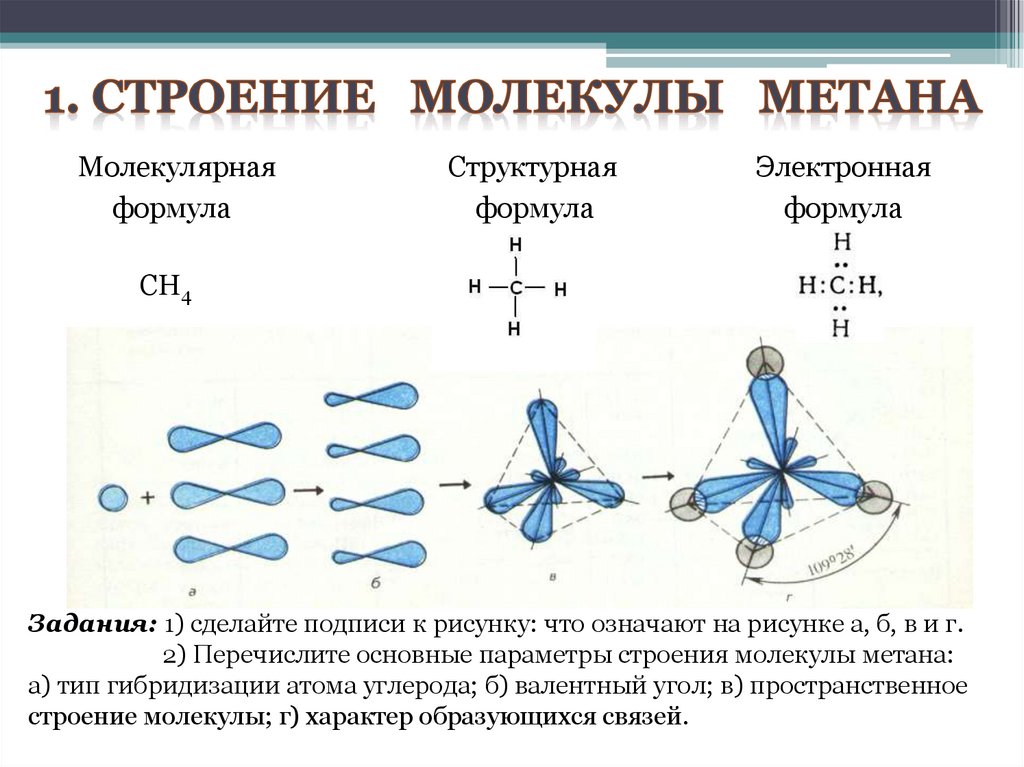
Молекулярнаяформула
Структурная
формула
Электронная
формула
СН4
Задания: 1) сделайте подписи к рисунку: что означают на рисунке а, б, в и г.
2) Перечислите основные параметры строения молекулы метана:
а) тип гибридизации атома углерода; б) валентный угол; в) пространственное
строение молекулы; г) характер образующихся связей.
5.
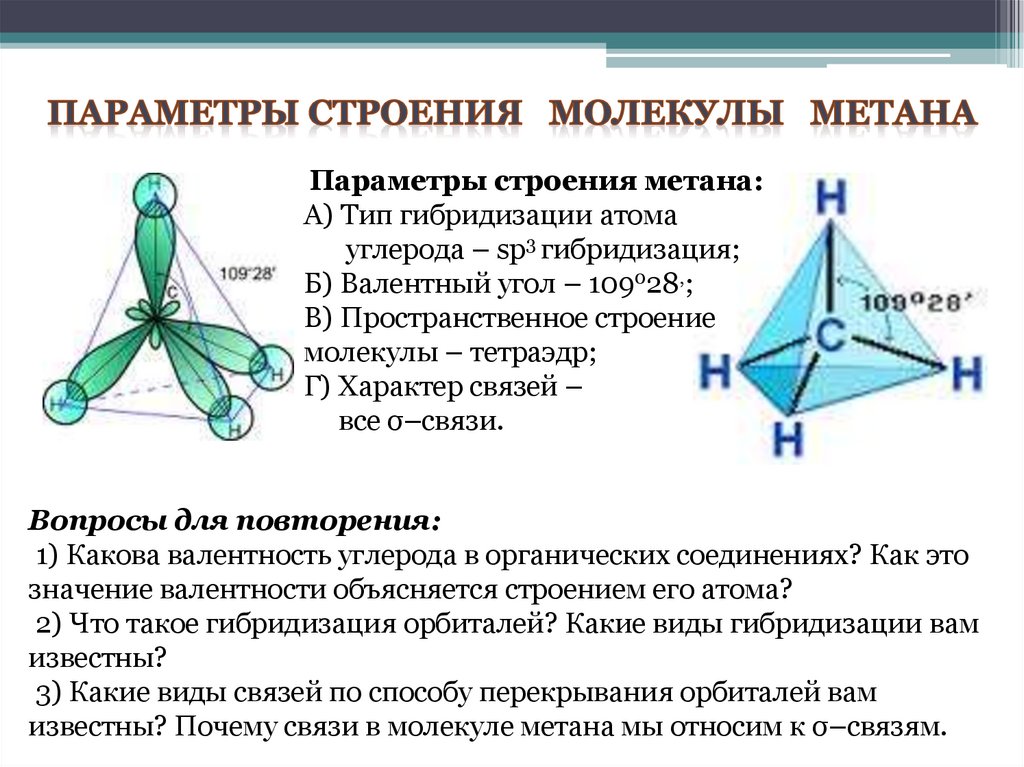
Параметры строения метана:А) Тип гибридизации атома
углерода – sp3 гибридизация;
Б) Валентный угол – 109028,;
В) Пространственное строение
молекулы – тетраэдр;
Г) Характер связей –
все σ–связи.
Вопросы для повторения:
1) Какова валентность углерода в органических соединениях? Как это
значение валентности объясняется строением его атома?
2) Что такое гибридизация орбиталей? Какие виды гибридизации вам
известны?
3) Какие виды связей по способу перекрывания орбиталей вам
известны? Почему связи в молекуле метана мы относим к σ–связям.
6.
ПРЕДЕЛЬНЫЕ или НАСЫЩЕННЫЕУГЛЕВОДОРОДЫ или ПАРАФИНЫ или АЛКАНЫ
метан
Общая формула ряда
алканов – СnH2n+2
Окончание в
названии - ан
7.
Для алканов характерно:1. Зигзагообразное строение углеродной цепи;
2. Возможность свободного вращения вокруг
С – С-связи (0,154 нм);
3. Изомерия углеродной цепи (углеродного
скелета).
Задание для повторения: 1. составьте в
структурном виде изомеры бутана, пентана,
гексана. Назовите вещества по систематической
номенклатуре. 2. Конструктор эл. прил. 4.49
8.
9.
Легче воды,в воде нерастворимы
Жирные на ощупь
Горючи
Горящий метан, Туркмения.
10.
Метан образуется в природе в результатеразложения растительных и животных
остатков без доступа воздуха, в том числе
на дне водоемов.
Метан составляет основную часть
природного газа (80-97%).
Основная часть его
используется как топливо.
Горящий метан, Туркмения
11.
Этан, пропан и бутан выделяютиз попутного нефтяного газа.
Используют как топливо.
В нефти содержатся жидкие
и твердые алканы.
Сжигание попутного
нефтяного газа
12.
• АЛКАНЫ очень трудно вступают в химическиереакции, для этого необходимы жесткие условия!
• Реакции замещения - наиболее характерные
реакции алканов. Т.к. все связи атомов углерода
насыщены до предела (поэтому алканы иначе
называют насыщенными или предельными
углеводородами), то атомы водорода, соединенные
с атомами углерода, можно только замещать
другими атомами.
• Необходимо уметь записывать реакции замещения алканов с
галогенами (галогенирование) и азотной кислотой (нитрование).
13.
Н+
Н С Н + Сl Сl
Н
h
СН4 + Cl2 CH3Cl + HCl
хлорметан
Аналогично вступают в реакции замещения другие галогены:
F2 (со взрывом), Br2, I2 (труднее, чем другие)
14.
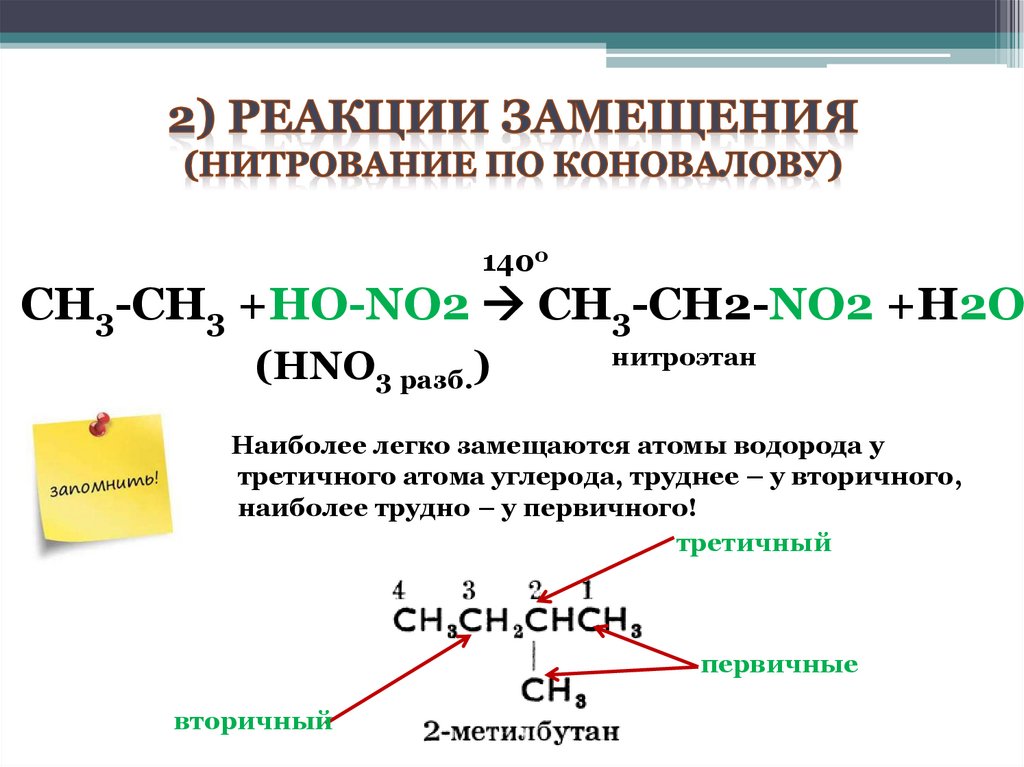
1400СН3-CH3 +HO-NO2 CH3-CH2-NO2 +H2O
(HNO3 разб.)
нитроэтан
Наиболее легко замещаются атомы водорода у
третичного атома углерода, труднее – у вторичного,
наиболее трудно – у первичного!
третичный
первичные
вторичный
15.
• Запишите уравнения реакций:1) последовательного замещения бромом: 4-х атомов
водорода в молекуле метана;
2) двух стадий замещения хлором в молекуле этана
(замещение протекает у одного и того же
атома углерода);
3) двух стадий замещения иодом в молекуле пропана
(замещение протекает у второго атома
углерода);
• Реакции нитрования метана и пропана.
16.
Все производные хорошиерастворители для синтеза
различных веществ
Хлороформ анестетик
(сейчас не
используется)
Негорюч – тушит пожары
17.
СН4 + 2О2 СО2 + 2 Н2О + 880 кДжТепло, выделяющееся
при этих реакциях,
позволяет использовать
алканы как топливо.
Взрыв метана в угольной шахте
Смеси с воздухом газообразных
алканов взрывоопасны (особенно в
соотношении 1:2).
18.
• Запишите уравнения реакций горения этана,пропана и бутана.
• Помните, что продуктами полного сгорания
всех УВ являются углекислый газ и вода!
• При неполном сгорании (при
недостатке кислорода) могут
образоваться СО (угарный газ)
или С (сажа).
19.
• При крекинге алканов без доступа воздуха (пиролизе)происходит отщепление водорода (дегидрирование):
1000о С
СН4 С + 2Н2 или
сажа
1500о С
_
2 СН4 Н-С=С-Н
+ 3Н2
ацетилен
700о , Ni
2СН4 СН2=СН2 + 2Н2
этилен
Ацетилен и этилен, полученные из метана (природного газа),
используются для получения спирта, каучуков, пластмасс и др.
веществ. Сажа используется в шинной или типографской
промышленности.
20.
Реакция может протекать и без измененияколичества атомов углерода:
tо , Ni
СН3-СН3 СН2=СН2 + Н2
этилен
tо , кат.
C16H34
С8Н18 + С8Н16
октан
октен
Реакция используется для получения бензина из высших
нефтяных фракций, например мазута.
21.
tо , AlCl3Реакции изомеризации используются для
повышения качества моторного топлива.
Задание: Составьте аналогично уравнения реакций
изомеризации гексана с образованием двух разных
изомеров.
22.
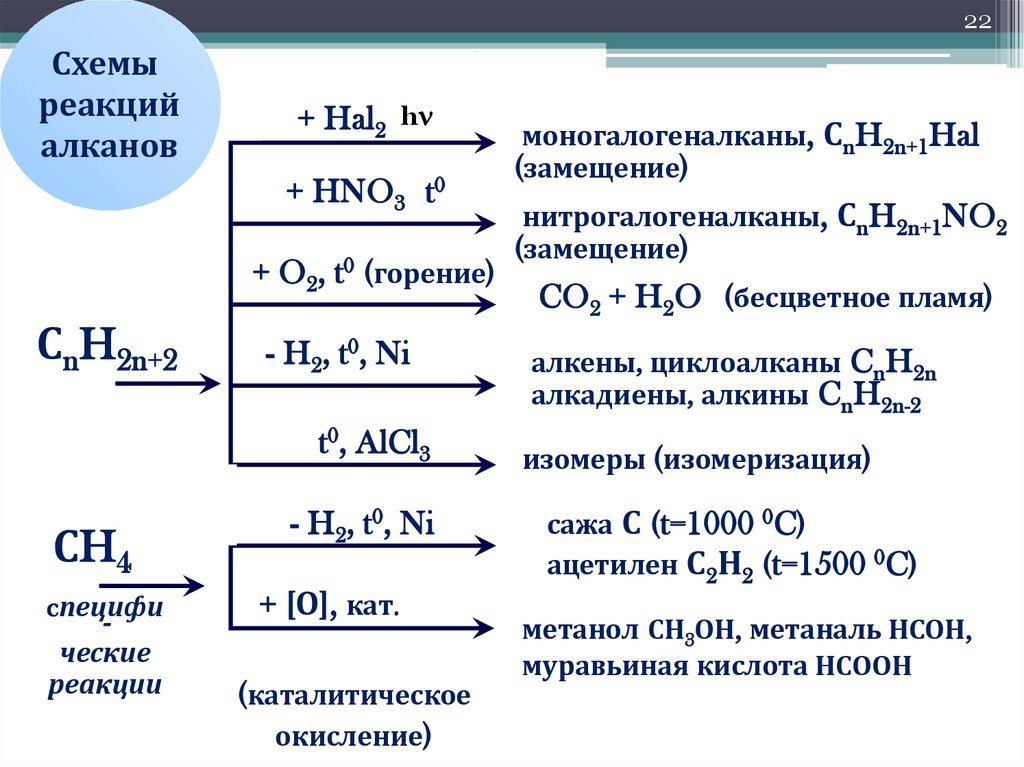
22Схемы
реакций
алканов
+ Hal2 h
+ HNO3 t0
+ O2, t0 (горение)
СnH2n+2
- H2, t0, Ni
t0, AlCl3
СH4
cпецифи
ческие
реакции
- H2, t0, Ni
+ [О], кат.
(каталитическое
окисление)
моногалогеналканы, СnH2n+1Hal
(замещение)
нитрогалогеналканы, СnH2n+1NO2
(замещение)
CO2 + H2O (бесцветное пламя)
алкены, циклоалканы CnH2n
алкадиены, алкины CnH2n-2
изомеры (изомеризация)
сажа С (t=1000 0C)
ацетилен С2Н2 (t=1500 0C)
метанол СН3ОН, метаналь НСОН,
муравьиная кислота НСООН
23.
• В промышленности алканы выделяют изприродного газа или нефти.
• В лаборатории метан получают
1) сплавлением ацетата натрия СН3СООNa и
гидроксида натрия: 0
t
СН3СООNa + NaOH CH4 + Na2CO3
2) гидролизом карбида алюминия:
Al4C3 + 12H2O 4Al(OH)3 + 3CH4
24.
3) Для увеличения углеродной цепи используютреакцию Вюрца – взаимодействие галогензамещенных предельных углеводородов с
металлическим натрием:
2 СН3Br + 2 Na CH3-CH3 + 2 NaBr
или
2 СН3-СН2Br + 2 Na CH3-СН2-СН2 -CH3 + 2NaBr
25.
Название вещества,Для алканов не
Вещества,
Число
формула
изомеров
вступающие
которого
состава
Алкан,
у которого
нет в
характерны
реакцию
СН
другом
изомеров
ССН
Н14- сСН
2 -друг
6
реакции 3
СН3 СН3
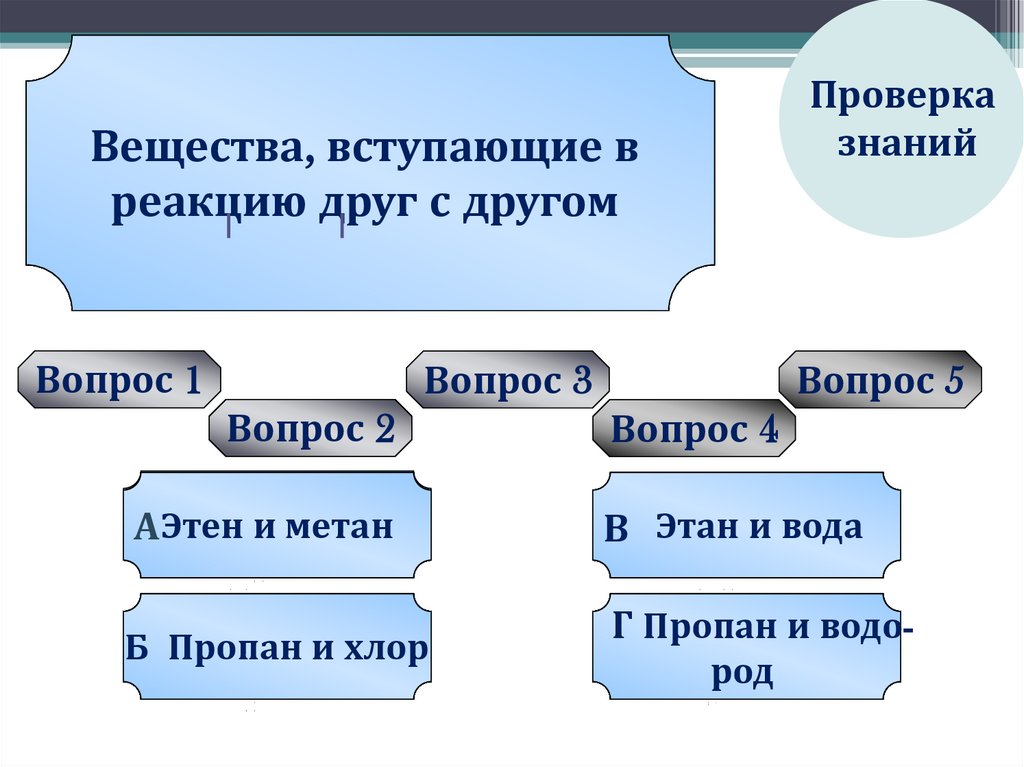
Вопрос 1
Проверка
знаний
Вопрос 3
Вопрос 2
Вопрос 5
Вопрос 4
Попробуй
Попробуй
Попробуй
УРА!
гидрирования
Этен
и3еще
метан
А3-метилбутан
гексан
еще
еще
Попробуй
1,2-диметилПопробуй
разложения
иеще
вода
В Этан
УРА!
УРА!
5
пропан
еще
пропан
ГалогенироПопробуй
Попробуй
Попробуй
Попробуй
ББ 2-метилбутан
Пропан
и хлор
УРА!
2
бутан
вания
еще
еще
еще
еще
Г Пропан
и водоПопробуй
Попробуй
горения
2-метилбутан
Г пентан
УРА!
4еще
еще
род
26.
1. Бутан → этан → этилхлорид → бутан → изобутан.2. Ацетат натрия → метан → хлорметан → этан → этен.
3. Метан → ацетилен → этан → пропан → хлорпропан.
4. Углерод → метан → бромметан → этан → бутан.
5. 1-хлорпропан → гексан → пропан → 2-хлорпропан →
2,3- диметилбутан.
6. Ацетат натрия → этилен → этан → пропан → оксид
углерода(IV).
7. Пропионат натрия → этан → бутан → этан → 1,1дихлорэтан.
27.
1. Сравните строение атома углерода в основном и возбужденном состоянии.Почему возможно распаривание 2s-электронов.
2. Охарактеризуйте строение молекулы метана (тип гибридизации атома
углерода, пространственное расположение атомов, валентный угол, тип
связей).
3. Какие соединения называют предельными углеводородами. Приведите
примеры.
4. Приведите общую формулу гомологического ряда алканов и формулы
десяти первых представителей этого ряда.
5. Что такое гомологическая разность?
6. Что называют радикалами? Напишите формулы и названия радикалов,
которые образованы первыми шестью представителями алканов.
7. Напишите сокращенные структурные формулы и названия всех возможных
изомеров гексана.
8. Для 2,2-диметилпропана приведите формулы двух гомологов и одного
изомера. Дайте этим веществам названия по систематической номенклатуре.
9. Где и в каком виде предельные углеводороды встречаются в природе?
10. Какое применение в промышленности находит природный газ?
28.
11. Какие преимущества имеет природный газ перед другими видами топлива?12. Охарактеризуйте физические свойства предельных углеводородов.
13. Какие типы реакций характерны для алканов. Подтвердите ответ
примерами.
14. Опишите, при каких условиях происходит дегидрирование метана и этана.
Запишите уравнения этих реакций и поясните, какое значение они имеют на
практике.
15. * Опишите механизм реакции хлорирования метана. Почему он называется
радикальным?*
16. Составьте уравнения реакций согласно схеме превращений:
С СН4 СН3Cl C2H6 C2H5Cl
Укажите условия, типы протекающих реакций и названия всех органических
веществ.
17. Составьте уравнения реакций:
o Полного сгорания бутана; Двух стадий хлорирования пропана;
o Изомеризации гексана.
18. Расскажите о практическом использовании предельных углеводородов и
их галогенпроизводных.
19. Какой объем воздуха (н.у.) расходуется при полном сгорании 1 кг гексана?
Объемная доля кислорода в воздухе составляет 21%.
20. Какая масса сажи образуется при термическом разложении этана массой 90
г ? Массовая доля выхода сажи составляет 80%.
29.
Базовый: §3, упр.7,8• По желанию: Задачa 12.
Профильный: §11, упр.2,5, 6*.
Эл.прил. (проф.) 4.30,36, 38-40, 42– тесты
























 chemistry
chemistry