Similar presentations:
Синтез и катаболизм аминокислот. Орнитиновый цикл. Лекция 3
1.
Лекция 3Синтез и катаболизм
аминокислот
Орнитиновый цикл
2.
Синтез аминокислот3.
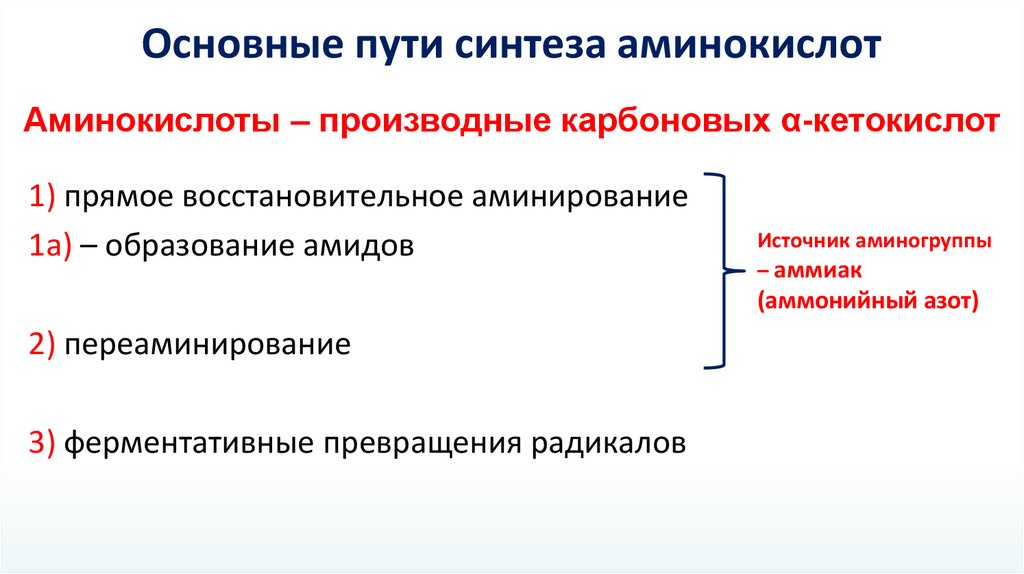
Основные пути синтеза аминокислотАминокислоты – производные карбоновых α-кетокислот
1) прямое восстановительное аминирование
1а) – образование амидов
Источник аминогруппы
– аммиак
(аммонийный азот)
2) переаминирование
3) ферментативные превращения радикалов
4.
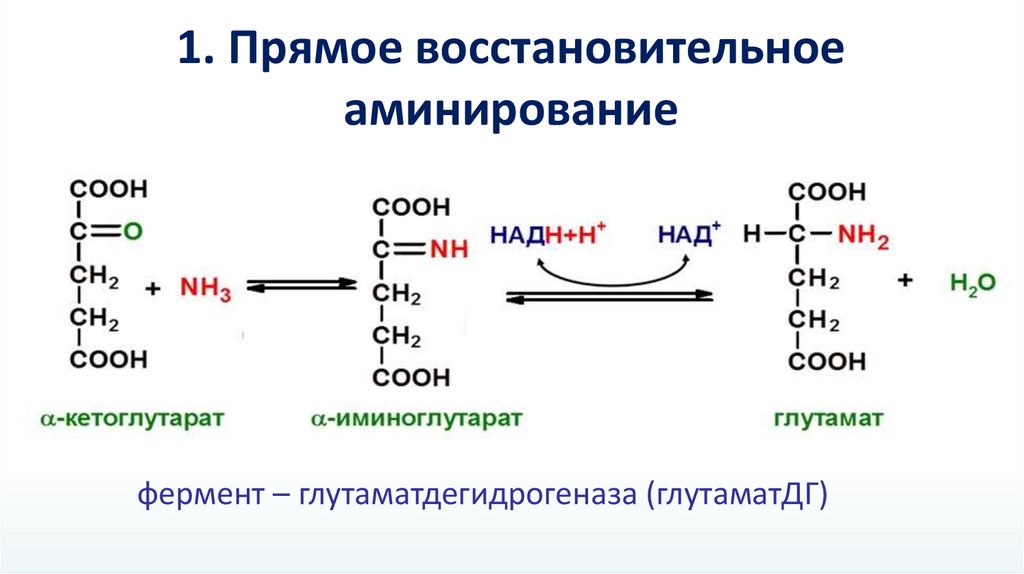
1. Прямое восстановительноеаминирование
фермент – глутаматдегидрогеназа (глутаматДГ)
5.
1а. Образование глутаминаФермент - глутаминсинтетаза
6.
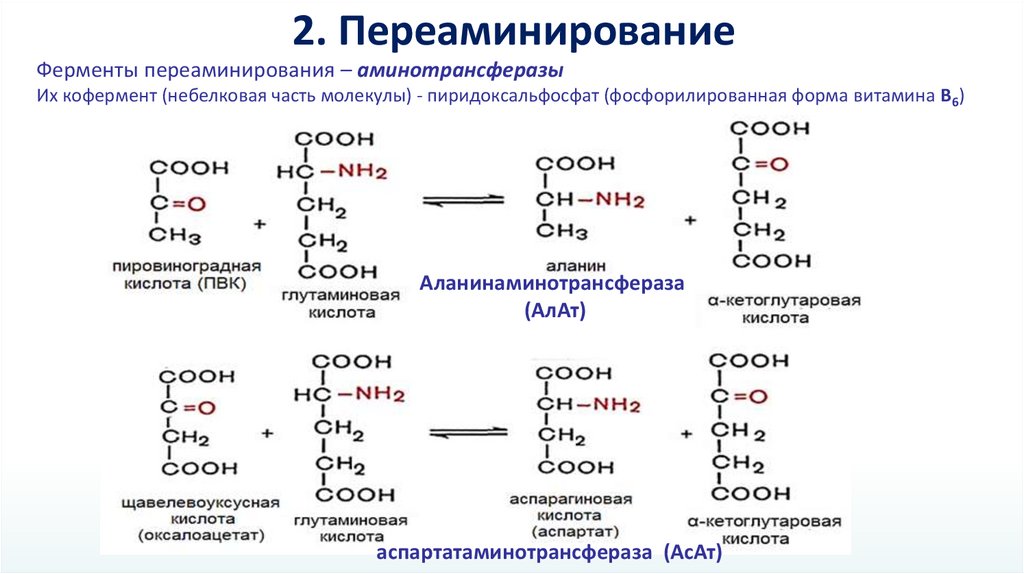
2. ПереаминированиеФерменты переаминирования – аминотрансферазы
Их кофермент (небелковая часть молекулы) - пиридоксальфосфат (фосфорилированная форма витамина В6)
Аланинаминотрансфераза
(АлАт)
аспартатаминотрансфераза (АсАт)
7.
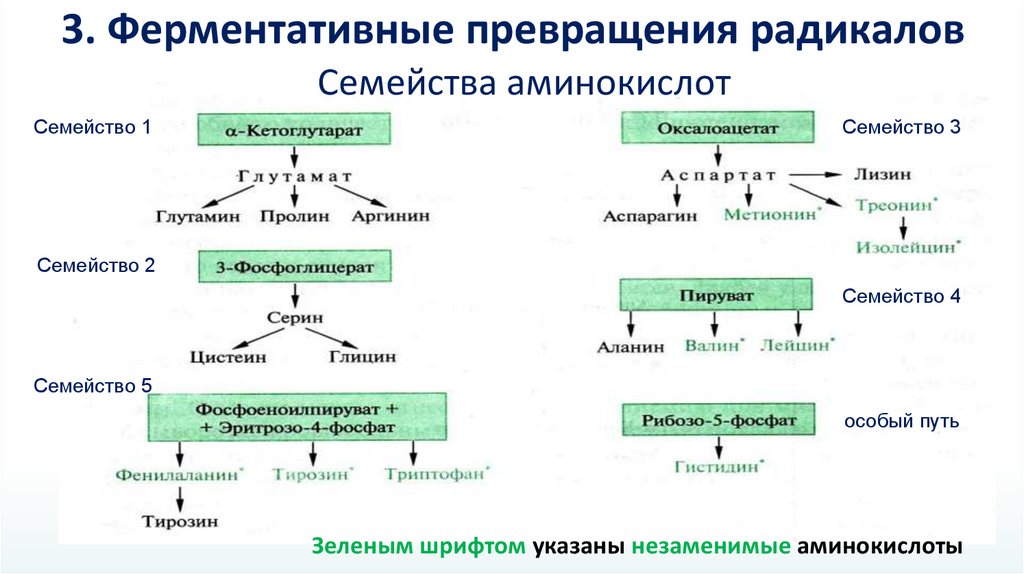
3. Ферментативные превращения радикаловСемейства аминокислот
Семейство 1
Семейство 3
Семейство 2
Семейство 4
Семейство 5
особый путь
Зеленым шрифтом указаны незаменимые аминокислоты
8.
Заменимые и незаменимые аминокислотыдля человека
Взрослый
организм
не нуждается
Селеноцистеин
Человек может синтезировать сам
Есть необходимые ферменты
Человек НЕ может синтезировать сам
Нет ферментов
Должен поглощать с пищей
9.
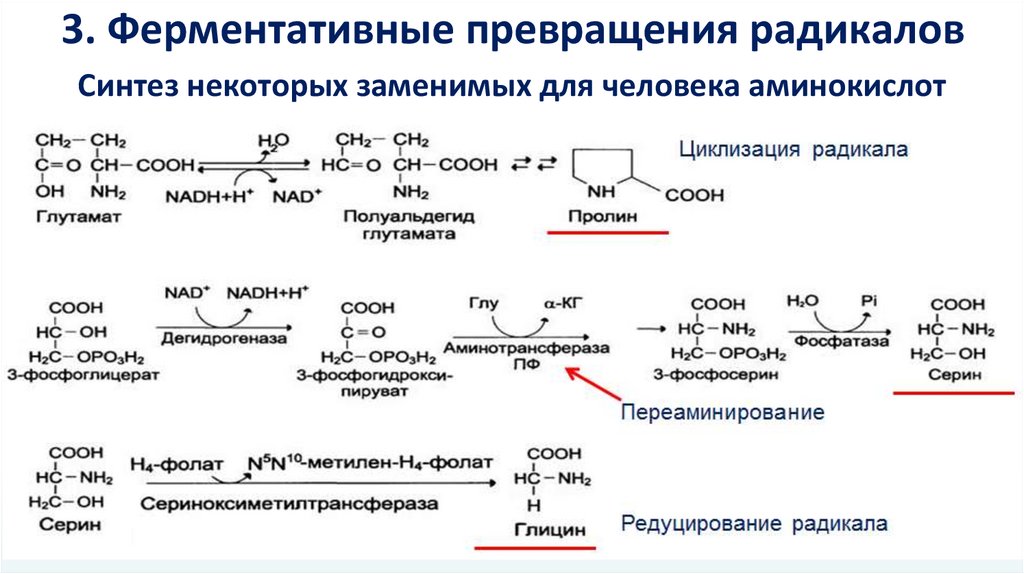
3. Ферментативные превращения радикаловСинтез некоторых заменимых для человека аминокислот
10.
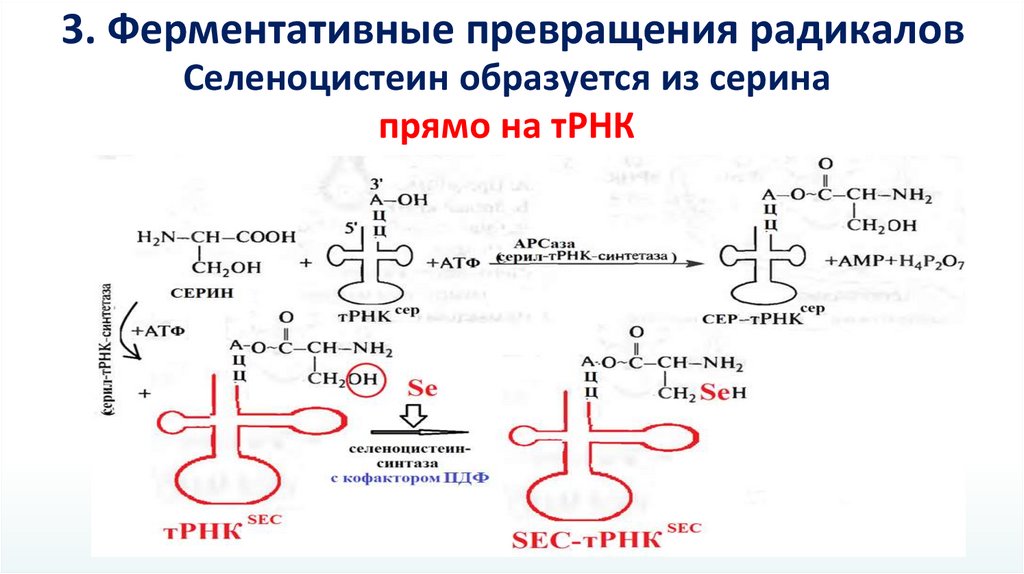
3. Ферментативные превращения радикаловСеленоцистеин образуется из серина
прямо на тРНК
11.
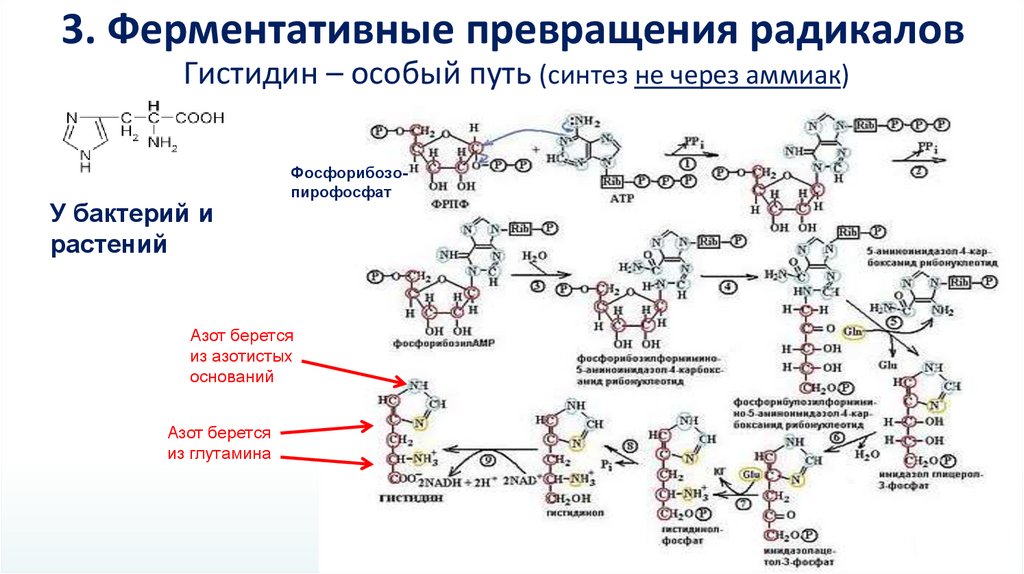
3. Ферментативные превращения радикаловГистидин – особый путь (синтез не через аммиак)
У бактерий и
растений
Фосфорибозопирофосфат
Азот берется
из азотистых
оснований
Азот берется
из глутамина
12.
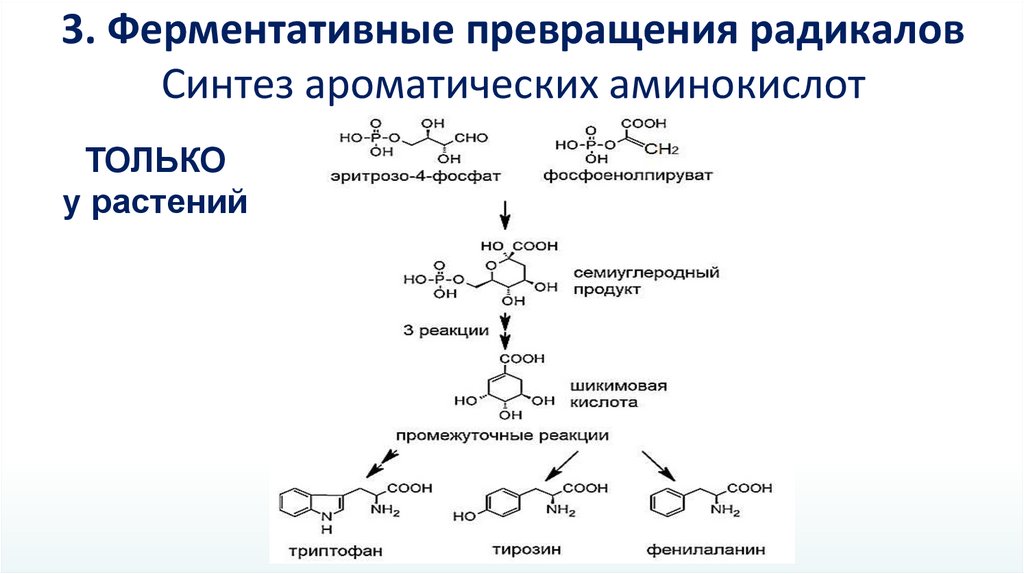
3. Ферментативные превращения радикаловСинтез ароматических аминокислот
ТОЛЬКО
у растений
13.
КАТАБОЛИЗМАМИНОКИСЛОТ
14.
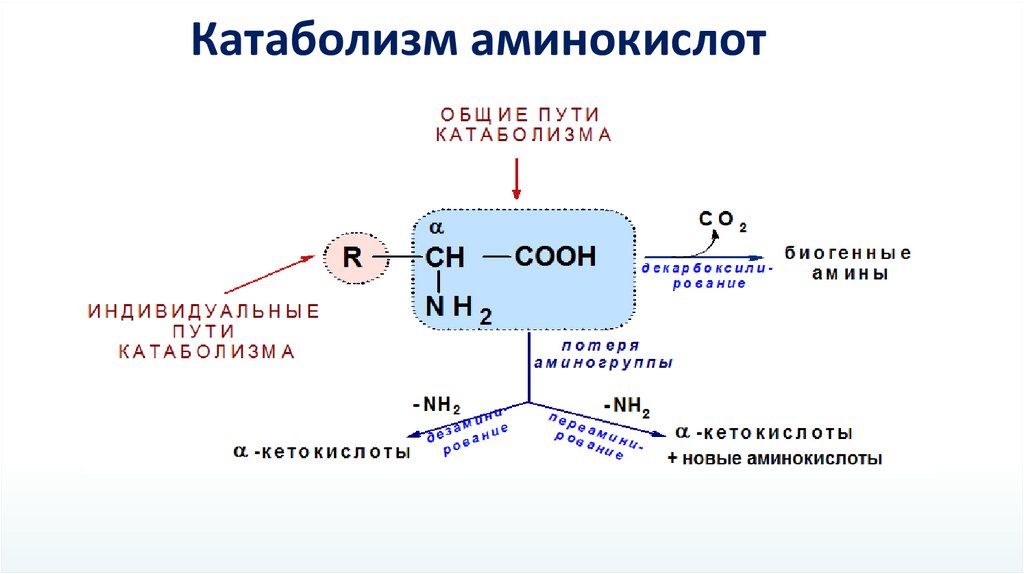
Катаболизм аминокислот15.
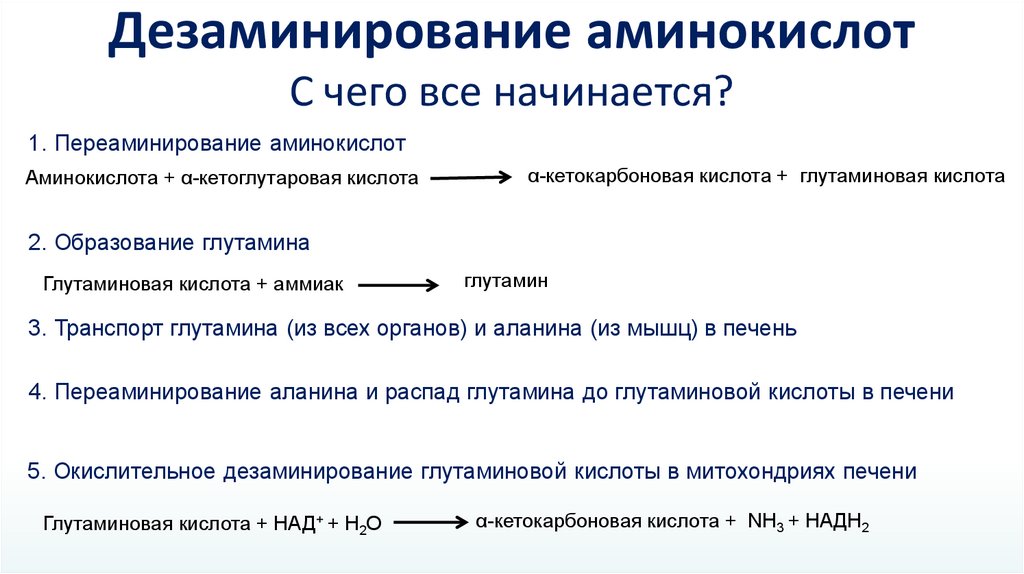
Дезаминирование аминокислотС чего все начинается?
1. Переаминирование аминокислот
Аминокислота + α-кетоглутаровая кислота
α-кетокарбоновая кислота + глутаминовая кислота
2. Образование глутамина
Глутаминовая кислота + аммиак
глутамин
3. Транспорт глутамина (из всех органов) и аланина (из мышц) в печень
4. Переаминирование аланина и распад глутамина до глутаминовой кислоты в печени
5. Окислительное дезаминирование глутаминовой кислоты в митохондриях печени
Глутаминовая кислота + НАД+ + Н2О
α-кетокарбоновая кислота + NH3 + НАДН2
16.
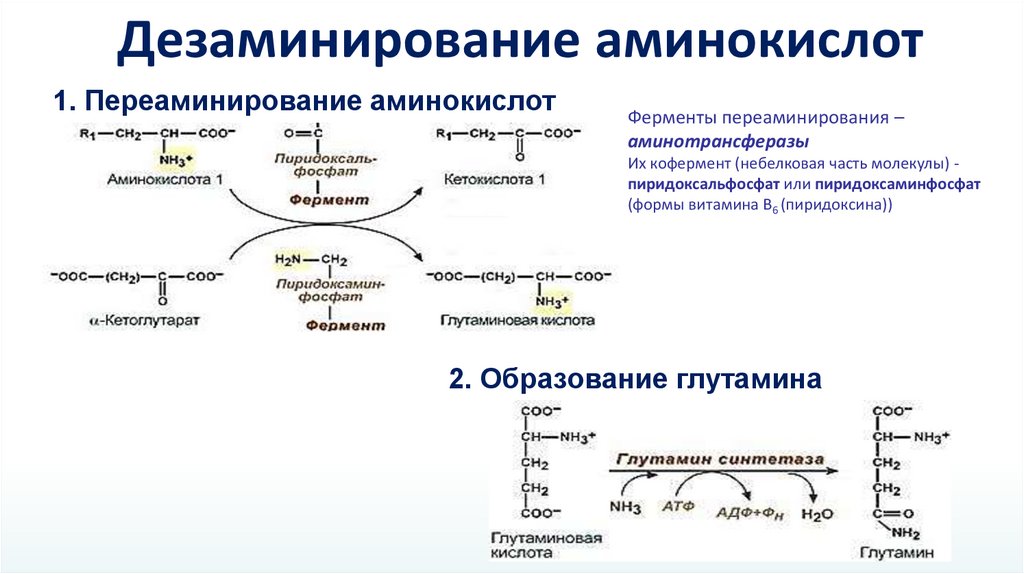
Дезаминирование аминокислот1. Переаминирование аминокислот
Ферменты переаминирования –
аминотрансферазы
Их кофермент (небелковая часть молекулы) пиридоксальфосфат или пиридоксаминфосфат
(формы витамина В6 (пиридоксина))
2. Образование глутамина
17.
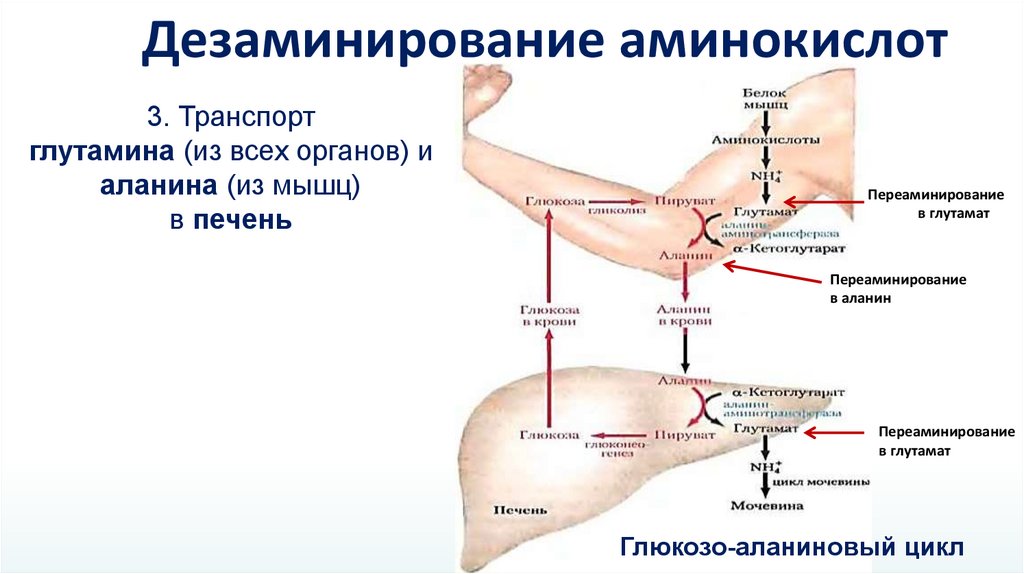
Дезаминирование аминокислот3. Транспорт
глутамина (из всех органов) и
аланина (из мышц)
в печень
Переаминирование
в глутамат
Переаминирование
в аланин
Переаминирование
в глутамат
Глюкозо-аланиновый цикл
18.
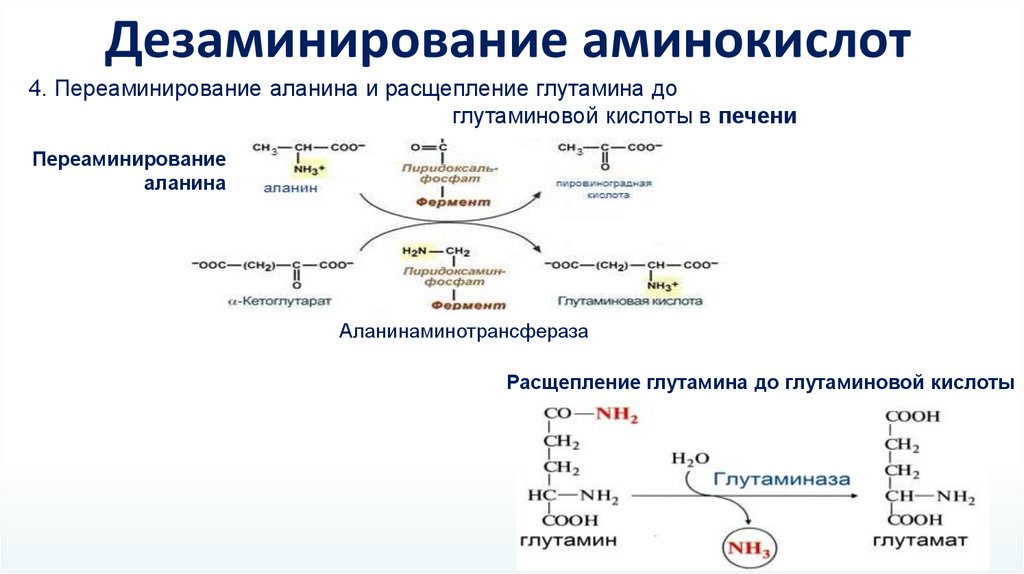
Дезаминирование аминокислот4. Переаминирование аланина и расщепление глутамина до
глутаминовой кислоты в печени
Переаминирование
аланина
Аланинаминотрансфераза
Расщепление глутамина до глутаминовой кислоты
19.
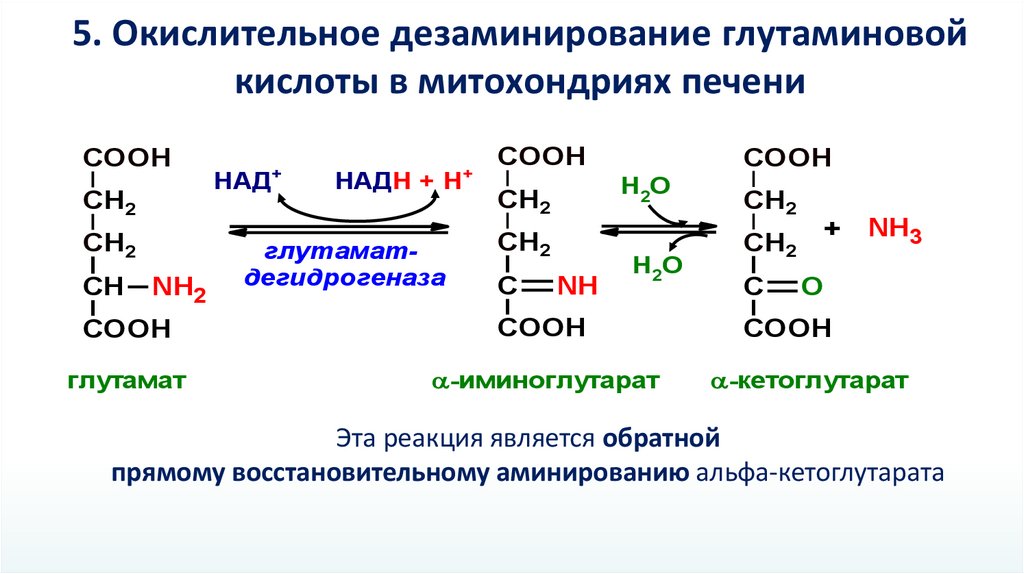
5. Окислительное дезаминирование глутаминовойкислоты в митохондриях печени
COOH
CH2
CH2
СН
NH2
+
НАД
+
НАДН + Н
глутаматдегидрогеназа
COOH
Н2О
CH2
CH2
С
COOH
NH
Н2О
COOH
COOH
глутамат
-иминоглутарат
CH2
+ NH3
CH2
С
O
COOH
-кетоглутарат
Эта реакция является обратной
прямому восстановительному аминированию альфа-кетоглутарата
20.
Специфические для животных реакциидезаминирования аминокислот
1.
Оксидазы L и D- аминокислот. В печени и почках есть специфические оксидазы, которые могут
напрямую дезаминировать некоторые аминокислоты. ФМН и ФАД зависимые ферменты.
2.
Специфические дегидратазы в печени:
- сериндегидратаза
(серин до пировиноградной кислоты (ПВК))
- треониндегидротаза
(треонин до α-кетобутирата)
- цистатионин-γ-лиаза (цистеин до ПВК)
3.
Внутримолекулярное дезаминирование с помощью гистидазы (гистидинаммиаклиазы)
21.
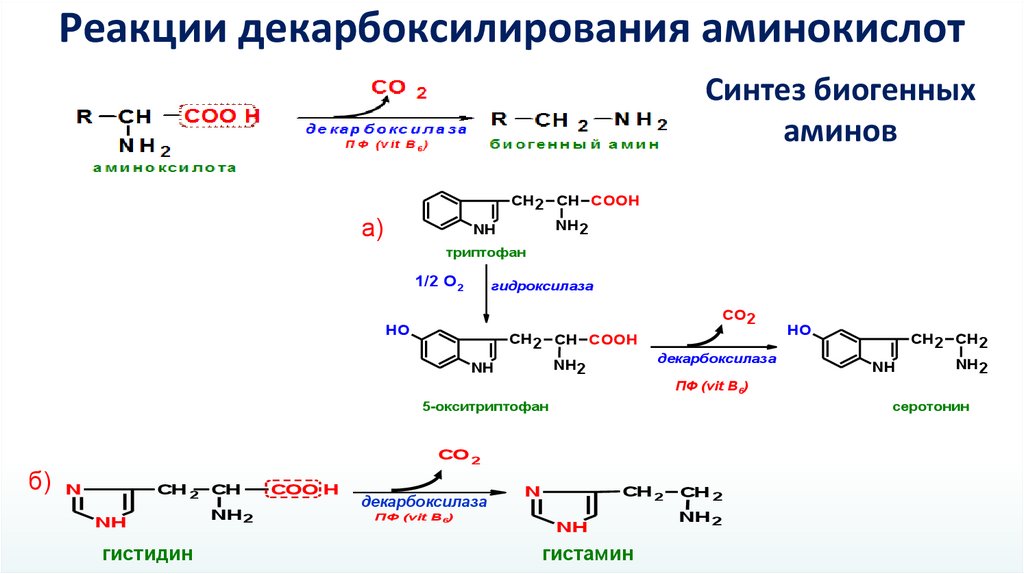
Реакции декарбоксилирования аминокислотСинтез биогенных
аминов
СН2 СН COOH
а)
NH2
NH
триптофан
1/2 О2
гидроксилаза
СО2
HO
СН2 СН COOH
NH2
NH
декарбоксилаза
HO
NH
СН2 СН2
NH2
ПФ (vit B6)
5-окситриптофан
серотонин
CO 2
б) N
СН 2 СН
NH
гистидин
NH2
COO H
декарбоксилаза
ПФ (vit B6)
СН 2
N
NH
гистамин
СН 2
NH2
22.
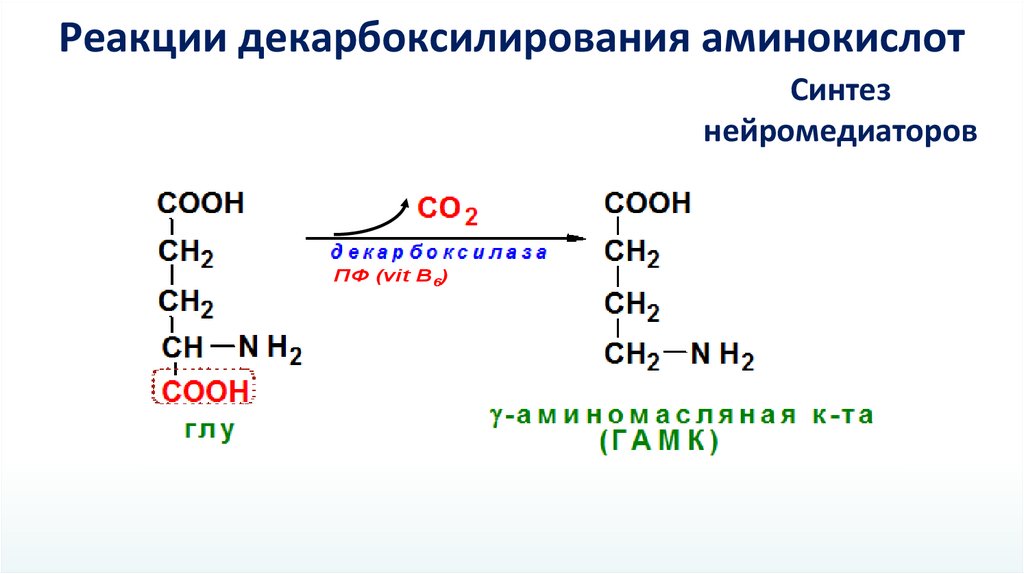
Реакции декарбоксилирования аминокислотСинтез
нейромедиаторов
ПФ (vit B6)
23.
Выведение аммиака24.
Аммиак токсичен!• Его следует быстро удалить во внешнюю среду
или связать в нетоксичное соединение:
• АМИДЫ Глу → глн, асп → асн.
У животных амиды – транспортная безопасная
форма аммиака
25.
Отходы N-метаболизма животныхМочевина – уреотелические
(наземные позвоночные: млекопитающие, взрослые амфибии),
хрящевые рыбы.
Аммиак – аммониотелические
(водные беспозвоночные, головастики, крокодилы, костистые
рыбы – вместе с небольшим кол-вом мочевины)
Мочевая кислота - урикотелические
(птицы, насекомые, рептилии)
26.
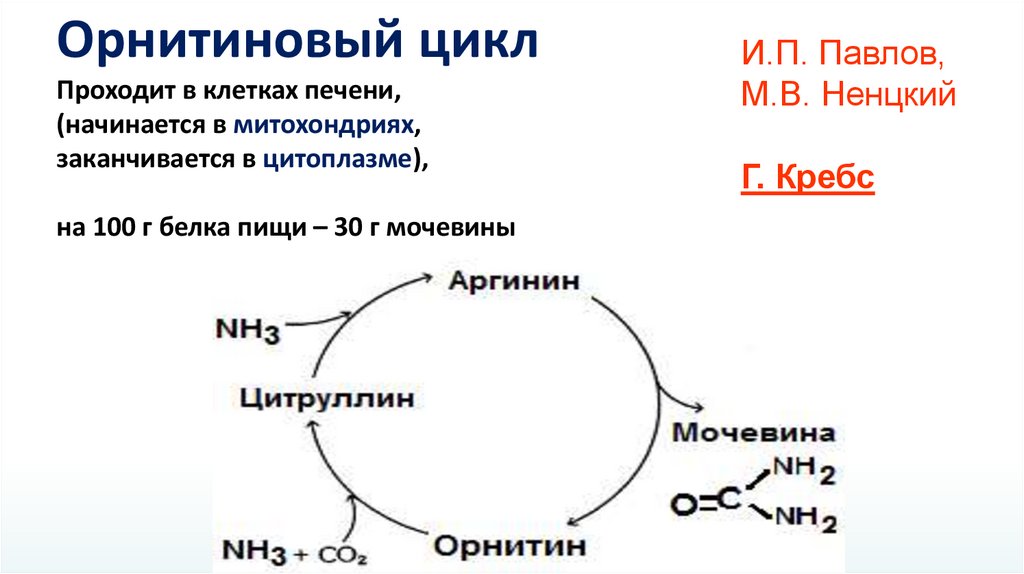
Орнитиновый циклПроходит в клетках печени,
(начинается в митохондриях,
заканчивается в цитоплазме),
на 100 г белка пищи – 30 г мочевины
И.П. Павлов,
М.В. Ненцкий
Г. Кребс
27.
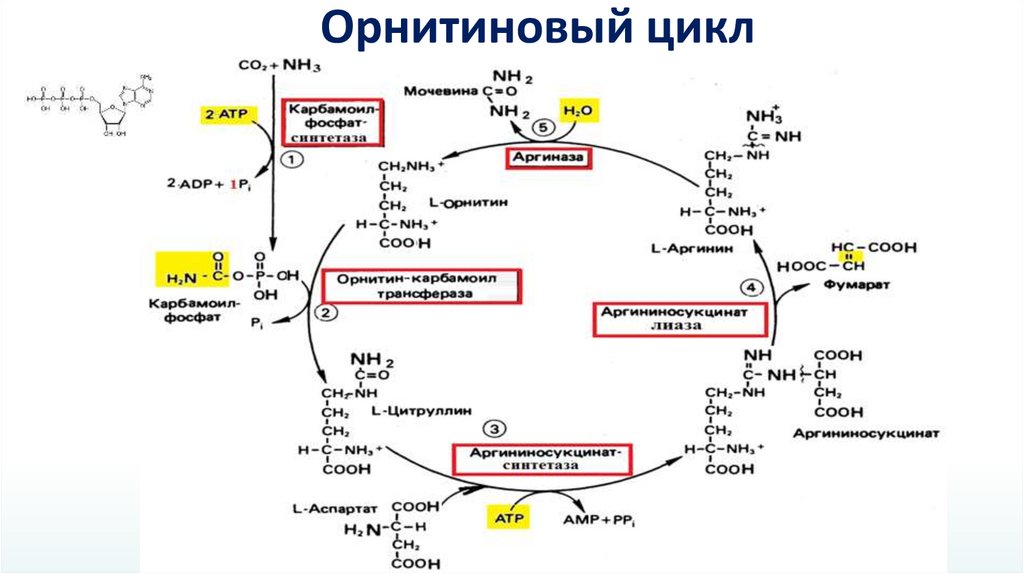
Орнитиновый цикл28.
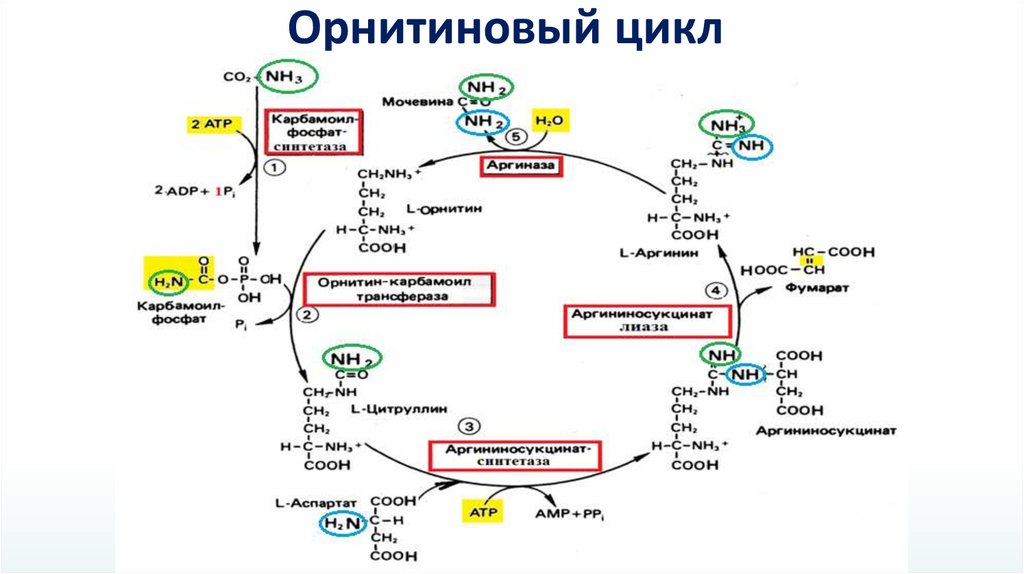
Орнитиновый цикл29.
Подготовка к КР 21. Реакции синтеза аминокислот
2. Реакции катаболизма аминокислот
3. Синтез аминов и ГАМК
Подготовка к семинару 2
1. Реакции синтеза аминокислот
2. Реакции катаболизма аминокислот
3. Токсичность аммиака (самостоятельно разобрать механизмы)










 biology
biology chemistry
chemistry








