Similar presentations:
Забор крови для лабораторных исследований
1. Забор крови для лабораторных исследований
автономное профессиональное образовательное учреждение УР«Республиканский медицинский колледж
имени Героя Советского Союза Ф.А. Пушиной МЗ УР»
Забор крови для лабораторных
исследований
Выполнил: преподаватель
Скурихина Е.В.
2. План занятия
• Роль медицинской сестры в преаналитическом этапе лабораторнойдиагностики.
• Факторы, влияющие на достоверность результата лабораторных
исследований.
• Требования подготовки пациента к лабораторных исследованиям крови.
• Состав и принцип действия вакуумной системы для забора крови.
• Правила оформления сопроводительного направления
• Правила взятия проб венозной крови.
• Осложнения, возникающие при работе с вакуумными системами, меры их
профилактики.
3.
Нормативная базаГОСТ 53079-2008 Технологии лабораторные медицинские. Обеспечение качества
клинических лабораторных исследований.
ГОСТ Р 15189-2006 «Лаборатории медицинские. Частные требования к качеству и
компетенции».
Национальный стандарт РФ ГОСТ Р ИСО 6710-09. «Контейнеры для сбора
образцов венозной крови одноразовые» Утвержден и введен в действие Приказом
Федерального агентства по техническому регулированию и метрологии от 3 июля
2009г. № 232-ст.
«Правила и методы исследований и правила отбора образцов донорской крови,
необходимые для применения и исполнения технического регламента о требованиях
безопасности крови, ее продуктов, кровезамещающих растворов и технических
средств, используемых в трансфузионно-инфузионной терапии», утверждены
постановлением Правительства Российской Федерации от 31 декабря 2010 г. № 1230.
4.
Цель лабораторных исследованийУстановление этиологии заболевания (его причины); иногда это единственный
критерий оценки клинической ситуации
Назначение лечения;
Контроль эффективности лечения
5. Преаналитический этап (долабораторный)
Преаналитический этап – это комплекс мероприятий (процессов и действий),выполняемый от момента назначения лабораторных анализов до начала
проведения аналитического измерения (загрузки проб в анализаторы).
Основная цель – обеспечить стабильность компонентов биоматериала, взятых на
исследование, и свести к минимуму влияние различных факторов, влияющих на
полученный результат.
6. Преаналитический этап включает:
1) Заполнение бланка направления на исследование;2) Контроль правил подготовки пациентом к исследованию;
3) Забор материала;
4) Правила первичной маркировки материала;
5) Правила транспортировки материала;
6) Правила хранения реактивов и материала.
7.
Факторы преаналитического этапа, способные влиять нарезультаты лабораторных исследований
НЕИЗМЕННЫЕ
1. Пол пациента
2. Этногеографические особенности
ДОЛГОВРЕМЕННО ВЛИЯЮЩИЕ
1. Масса тела (увел. холестерин, инсулин)
2. Образ жизни, занятия спортом (увел. общий белок, глюкоза)
3. Возраст (увел. СОЭ, глюкоза)
4. Беременность
КОРОТКОДЕЙСТВУЮЩИЕ
1. Биоритмы организма (суточные, месячные, сезонные)
2. Физическая нагрузка, стрессы
3. Диета (потребление пищи)
4. Курение, алкоголь, наркотики
5. Лекарственные препараты
6. Положение тела во время забора материала
8.
Основные ошибкипреаналитического этапа
Перепутали пробирки
Пропущенные тесты
Неправильная маркировка пробирок
Неправильный антикоагулянт
Некачественный забор крови (гемолиз)
Нестерильный образец
Недостаточный объем забранного образца,
Загрязненный образец (плохо вымытые пробирки),
Неправильная консервация пробы.
Преаналитический 46-68%
8
9.
Факторы, влияющие на рост числа преаналитическихошибок
Сейчас:
• Пробы берутся в и за пределами ЛПУ
• Снижающаяся квалификация ср. медперсонала за счет частой смены кадров
• Увеличение числа методов, тестов и видов анализаторов
• Чувствительность тестов
• Доставка проб на большие расстояния
• Маленький объем пробы
9
10.
Факторы, влияющие на рост числа преаналитическихошибок
Раньше:
• Пробы брались только в клинике
• Относительно высокая квалификация среднего медперсонала
• Ограниченное число методов, тестов и видов анализаторов
• Большой объем отбираемой анализатором пробы
• Аналиты не мониторировались по времени
• Доставка проб на малые расстояния в пределах ЛПУ
10
11. На точность и правильность результатов также оказывает влияние:
• техника взятия крови;• пробирки, в которые берется, а в последующем хранится и
транспортируется кровь;
• а также условия хранения и подготовки пробы к анализу
12.
Аналитический (лабораторный) этап• Это непосредственно - проведение лабораторного теста
специалистами по диагностике (7 – 13 %).
13.
Постаналитический этапСвязан с оцениванием результатов исследования и заключается во
взаимодействии сотрудников лаборатории и клиницистов стационара (18-47%).
Убедитесь, что каждый результат записан на соответствующей форме для
результатов исследования.
Используйте стандартные формы для
результатов исследования и систему
регистрации результатов.
Всегда включайте пределы нормальных
показателей в формы для результатов
исследования
14. Меры предосторожности при сборе биологического материала:
• Избегать непосредственного контакта с биологическим материалом работать только в резиновых перчатках;• Аккуратно обращаться с лабораторной посудой, а в случае её повреждения
осторожно убрать осколки стекла;
• Тщательно дезинфицировать ёмкости, используемые в процессе сбора
биологического материала;
• Перед сливом в канализацию
обеззараживать выделения
пациентов.
15.
Последовательность взятия кровив вакуумные пробирки
Флаконы для гемокультуры, пробирки
без добавок (пластик, стекло)
Пробирки с цитратом для коагулологии
и для определения СОЭ
Пробирки (пластик) с активатором свертывания
(и гелем) для сыворотки
Пробирки с гепарином (и гелем) для плазмы
Пробирки с ЭДТА для цельной крови
(гематология)
Пробирки с фторидом/ЭДТА для исследования
глюкозы,
лактата,
HbA1c,
этанола,
гомоцистеина
16. Требования подготовки пациента к лабораторным исследованиям крови
Все анализы крови сдаются строго натощак (между последним приемом пищии взятием крови должно пройти не менее 8 ч, т.е. между 07.00 и 09.00. Сок, чай,
кофе — тоже еда, можно пить только воду).
За 1-2 дня до обследования исключить из рациона жирную и жареную пищу,
а также алкоголь.
За час до взятия крови воздержитесь от курения.
Для исследования гормонов
щитовидной железы желательно за
несколько дней исключить из своего
рациона йодсодержащие продукты
(рыба, морепродукты, морская капуста,
йодированная соль).
17.
Требования подготовки пациента к лабораторнымисследованиям крови
Кровь для исследования женских половых
менструального цикла (уточните у гинеколога).
гормонов
сдают
по
дням
Кровь не следует сдавать после рентгенографии, ректального исследования или
физиотерапевтических процедур.
Исключить физическое и эмоциональное перенапряжение (бег, подъем по
лестнице и т.д.);
Если анализы срочные - с отметкой о времени взятия (журнал, бланк направления).
До выполнения диагностических/терапевтических процедур и введения лекарств !
Анализ пробы, взятой не вовремя, может быть хуже, чем отсутствие анализа
вообще.
18.
• При транспортировке в лабораторию образцы крови надо предохранять от тряскиво избежание гемолиза.
• Температура ниже 4 0С и выше 30 0С может изменить содержание многих
аналитов.
• Сыворотка и бестромбоцитная плазма (в пластик, пробирках) могут быть
заморожены.
Оттаивание
–
в
тщательное перемешивание!
теплой
воде,
после
него
Ca2+
–
19.
Основным видом биологического материала, который подвергается анализу,является кровь.
Кровь состоит из клеток (эритроцитов, тромбоцитов и лейкоцитов) и жидкой
части, которая представляет собой раствор многих органических и
неорганических веществ.
Жидкая часть крови, которую получают после центрифугирования, может быть
сывороткой или плазмой.
Цельная кровь – проба венозной, артериальной или капиллярной крови, в
которой компоненты остаются относительно неизмененными по сравнению с
состоянием in vivo.
Добавление антикоагулянтов в пробу цельной крови стабилизирует клеточные
компоненты на определенный период времени.
20.
Сыворотка – биологическая бесклеточная жидкость, не содержащая факторовсвертывания крови и фибриногена.
Для отделения сыворотки от клеток крови в пробе, взятой у пациента,
вакуумную пробирку следует оставить при комнатной температуре в течение не
менее 30 минут.
Плазма – это жидкая часть крови, лишенная форменных элементов. Если в
вакуумную пробирку с пробой крови добавлены антикоагулянты, кровь остается
жидкой (не сворачивается) и получаемая после центрифугирования жидкая часть
называется плазмой.
21.
Преимущества плазмы перед сывороткойЭкономия времени: пробы крови могут быть
отцентрифугированы сразу после их получения (нет
необходимости ждать 30 минут для получения сыворотки);
Больший выход материала для исследования. Из цельной
крови м.б. получено плазмы на 15-20% больше, чем
сыворотки.
Практически отсутствует интерференция, связанная с
последующим свертыванием. В сыворотке может произойти
свертывание после центрифугирования, а в плазме нет.
Результаты исследования более точно отражают
состояние in vivo, чем анализ сыворотки.
Меньший риск гемолиза и тромбоцитолиза. Свободного
гемоглобина в 10 раз меньше в плазме. В плазме тромбоциты
остаются интактными in vitro, и , следовательно, отсутствует
ложная гиперкалиемия, как в сыворотке.
22. Принцип действия вакуумной системы
Под действием вакуума кровь втягивается через иглу напрямую из вены впробирку и сразу же смешивается с химическим реактивом.
Тщательно дозированный объем вакуума обеспечивает точное соотношение
кровь/реагент в пробирке.
Крышка надежно закрывает пробирку, легко прокалывается иглой,
открывается и повторно закрывается.
Резко снижает разбрызгивание при открывании.
Исключает контакт с кровью, находящийся в пробирке благодаря форме
(колпачка).
Имеет выступы на внешней поверхности для более прочного захвата при
открывании
23. Преимущества вакуумной системы
система готова к использованию, уменьшается количество операций по подготовкеобразца крови в лаборатории;
возможность прямого использования в качестве первичной пробирки в целом ряде
автоматических анализаторов (экономия на приобретении вторичных пластиковых
пробирок);
герметичные и небьющиеся пробирки упрощают и делают безопасным процесс
транспортировки и центрифугирования проб крови;
четкая идентификация пробирок, используемых для различных типов анализов, за
счет цветной кодировки крышек;
сокращение затрат на приобретение центрифужных пробирок, на мойку, дезинфекцию
и стерилизацию пробирок;
24. Преимущества вакуумной системы
простая методика обучения персонала;уменьшение риска профессионального инфицирования;
экономия времени в процессе взятия крови;
внутри пробирки вакуум для забора точного объема крови
количество наполнителя в пробирке, точно соответствует объему забираемой
пробы;
внутренняя сторона пробирки покрыта силиконом;
простота конструкции вакуумсодержащих систем и их надежность.
25. Строение системы для взятия венозной крови
Вакуумная система состоит из трех основных элементов, соединяющихсямежду собой:
26. Двухсторонние стерильные иглы
Двусторонние иглы с мембраной, предотвращающей ток крови при сменепробирки, используются для отбора проб в несколько пробирок за одну процедуру
венепункции.
Имеют ультратонкие стенки.
Покрыты силиконом с внешней и внутренней стороны для меньшего
травмирования пациента и улучшения тока крови.
За счет уникальной V-образной заточки обеспечивают гладкий и безболезненный
ввод в вену.
Имеют различные длину и диаметр, что позволяет наименее травматично
пунктировать разные вены. Цветовая кодировка позволяет быстро определять
размер иглы.
Иглы проходят индивидуальный контроль качества.
27. Виды игл и адаптеров
• Игла стандартная.• Игла с защитным колпачком.
• Игла для визуального контроля тока крови.
• Комплекты для забора крови – для взятия крови из труднодоступных вен.
• Адаптеры - для забора крови через обычную иглу или венозный катетер.
28.
Правила хранения пробирокДо момента использования пробирки должны храниться и
транспортироваться при комнатной температуре
Правила хранения:
1. Избегать воздействия прямого солнечного света,
особенно при высоких температурах ( около + 50°С)
2. Хранить пробирки при температуре +4 +25 С
3. Избегать складирования вблизи отопительных
приборов
4. Избегать хранения ниже 0°С –особенно содержащих
гель пробирок для сыворотки.
5. При хранении ниже 0°С перед использованием их
необходимо
29. Вакуумные пробирки
Производятся из стекла или пластика, который легче стекла ипрактически не бьются.
Выпускаются готовыми к использованию и не требуют предварительной
подготовки пробирок и дозирования реагентов.
Стерильные, предназначены для одноразового использования, разных
объемов и размеров от 1,8 до 10 мл.
Пробирки защищены крышками, имеющими цветовые коды в
соответствии с назначением пробирок и типом содержащихся в них
химических реагентов.
Снабжены этикетками, содержащими информацию о реактиве, объеме
отбираемой пробы, номере партии, сроке годности и т.д.
30. ОБЪЕМ ПРОБЫ В ПРОБИРКЕ
Для обеспечения правильного соотношениякровь/антикоагулянт,
пробирка
должна
заполняться точно до указанного объема
(+10% от указанного на этикетке).
Каждая
пробирка
содержит
строго
определенное количество реагента
для указанного на ней объема крови.
Пробирка должна заполняться полностью,
т.е отсоединять пробирку от иглы нужно
только после полного прекращения тока
крови
Неправильное соотношение кровь/реагент в пробе ведет к ошибочным
результатам анализа.
31.
Для того чтобы быть уверенным в правильности выполнения исследования,важны следующие характеристики образца:
1. Кровь должна наполнять контейнер до риски наполнения (это происходит
автоматически, когда заполняется вакуум в пробирке). По истечении срока годности
пробирки, в неё попадает воздух, и она не полностью заполняется кровью, что
сказывается на соотношении кровь/антикоагулянт;
2. Кровь должна забираться в пробирку с теми наполнителями и реагентами, которые
предопределены для выполнения анализа тех или иных аналитов;
3. Если пробирка имеет гелевый наполнитель, очень важна маркировка «Запрет на
повторное центрифугирование».
Основные условия, которым соответствует забор крови в вакуумные контейнеры при
правильном их использовании:
o отсутствие тромбов; отсутствие гемолиза;
o правильное соотношение крови и реагента;
o отсутствие контаминации образца.
32. Правила взятия проб венозной крови
o Пункция вены должна быть малотравматичной;o Время наложения жгута должно быть не более 1 минуты;
o Должно быть соразмерное сдавление вены при наложении жгута;
o Пациент не должен сжимать и разжимать пальцы;
o Не рекомендуется похлопывать ладонью по месту взятия крови с
целью увеличения притока крови к нему;
o Категорически запрещается забирать кровь шприцом и переливать в
вакуумную систему для взятия крови в связи с опасностью
возникновения гемолиза и активации факторов свертывания крови!
33.
ПРАВИЛА ПЕРЕМЕШИВАНИЯ ПРОБ КРОВИСразу после заполнения пробирки ее нужно аккуратно
перевернуть 4-10 раз на 180° для смешивания пробы с
наполнителем.
Число перемешиваний зависит от вида наполнителя в
пробирке.
5-6 раз
В плохо перемешанной пробе образуются микросгустки,
приводящие к искажению результатов анализов, а также к
поломкам
лабораторных
анализаторов
вследствие
закупорки пробозабирающих зондов.
Воздушный пузырек должен переместиться из
одного конца пробирки в другой
3- 4 раза
5-6 раз
8-10 раз
Пробу нужно перемешивать аккуратно, не трясти во
избежание коагуляции и гемолиза.
Перемешивание пробирок
обязательное требование
при использовании
вакуумных пробирок!
34. Ошибки, возникающие при работе с вакуумными контейнерами
1. Кровь не поступает в пробирку.Возможные причины: конец иглы вплотную прилегает к стенке вены; игла
проколола вену насквозь; игла не полностью вошла в вену; жгут затянут слишком
туго или намного выше места взятия крови.
Способ решения проблемы: аккуратно повернуть иглу, не вынимая иглу из вены;
аккуратно потянуть иглу вместе с иглодержателем, не вынимая иглу из вены;
аккуратно надавить на иглу вместе с иглодержателем, не вынимая иглу из вены;
снять жгут; заменить пробирку на новую (пробирка уже использовалась либо
была предварительно открыта, либо пробка пробирки была проколота до того, как
игла вошла в вену).
35. Ошибки, возникающие при работе с вакуумными контейнерами
2. Ток крови быстро прекращается, не наполнив пробирку.Возможные причины: пробирка была слишком быстро снята с иглы и вынута из
держателя; всасывание крови в пробирку слишком быстро для вены (коллапс
вены); игла повредила вену в процессе венепункции или игла прошла вену
насквозь.
Способ решения проблемы: вставить пробирку обратно на иглу и оставить до
тех пор, пока в пробирке полностью не компенсируется вакуум (наполнив
пробирку, ток крови прекратится); вытащить пробирку из держателя на секунду,
а затем снова ее вставить; повторить венепункцию в другом месте, где нет
гематомы.
36. Ошибки, возникающие при работе с вакуумными контейнерами
3. Гемолиз крови в пробирке.Возможные причины: слишком сильное сдавливание вены (больше 1 минуты);
перенос крови в пробирку с помощью шприца; слишком интенсивное
перемешивание образца; пробирка неадекватно заполнена.
Способ решения проблемы: наложить жгут не более, чем на 1 минуту;
использовать специальные двусторонние иглы для вакуумных пробирок;
аккуратно перевернуть пробирку 6-8 раз.
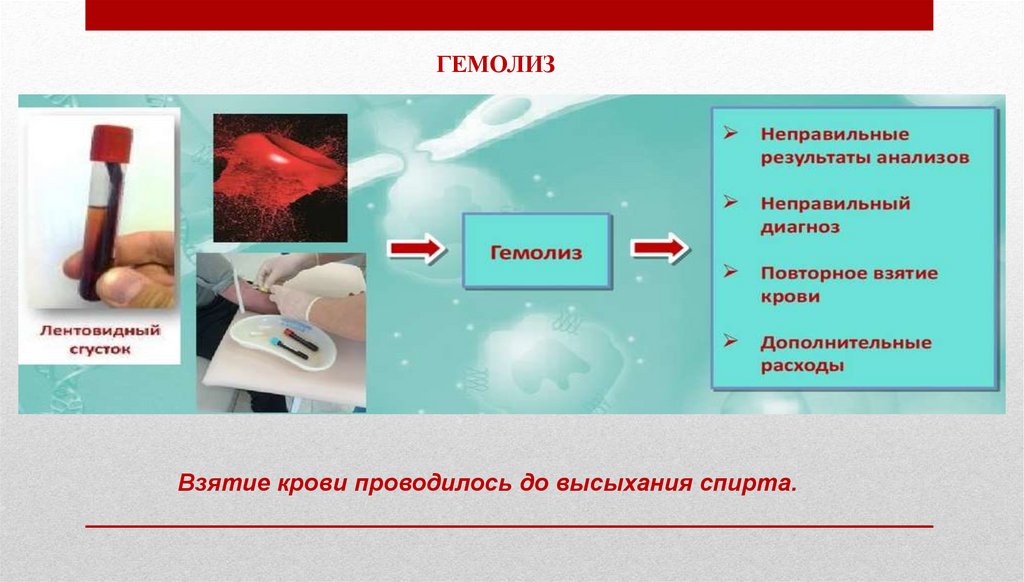
37.
ГЕМОЛИЗВзятие крови проводилось до высыхания спирта.
38. Возможные ошибки центрифугирования
Вертик. положениепробирки до ЦФ
(правильное)
Заниженное время ЦФ
(справа - норма)
ЦФ в горизонтальном
и угловом роторе
Заниженная скорость ЦФ
(справа - норма)
Горизонтальное поло-жение
пробирки до ЦФ
(сгусток по оси пробирки)
Горизонтальное положение пробирки
при транспорти-ровании + угловой
ротор
Сывороточная проба:
ЦФ сразу после взятия
(не дожидаясь свертывания)
www.gbo.com
/preanalytics
39. Плохая маркировка пробирок
Этикетка должна быть наклеена аккуратно и в нужном месте.При недостатке или отсутствии полной информации необходим
дополнительный запрос, или в исследовании должно быть отказано !
40. Центрифугирование пробирок с кровью
При комнатной температуре ! (особенно для пробирок сгелем, так как
его свойства меняются при сдвигах температуры).
ЦФ сывороточных пробирок – после образования
сгустка !!!
(не менее 30 мин – 1 ч после взятия пробы).
ЗАПРЕЩЕНО повторное центрифугирование проб
(особенно с гелем).
Осадок/сгусток отделять сразу после центрифугирования !
41. Кровь на стерильность
Данное обследование дает возможность выявить присутствие микроорганизмовв крови, которые свидетельствуют о развитии различных патологий, внутреннего
воспалительного процесса.
Показания:
если пациент страдает от специфической симптоматики, но медики длительное
время не могут определить, что служит первоисточников патологического
процесса;
медик предполагает наличие септической инфекции у обследуемого;
наличие осложнений, вызванных неграмотным хирургическим вмешательством;
постановка катетера во внутренние органы на длительное время;
человек периодически страдает от высокой температуры тела, но врачи не могут
определить, что служит причиной такой реакции организма;
наличие в организме импланта, напрямую контактирующего с биологическими
средами организма.
42.
! Взятие крови проводить до начала проведения антибактериальной терапии или наспаде концентрации антибиотиков в крови, т. е. перед очередным введением
препарата. Для повышения информативности рекомендуют проводить 3
исследования и более в ходе лечения до получения отрицательного результата.
Оценка эффективности антимикробной терапии по клиническим данным
проводится на 2-3 сутки от начала терапии; по данным контрольного
бактериологического исследования крови - на 3-5-е сутки.
Для подтверждения бактериемии и
исключения контаминации
микрофлорой кожных покровов
в процессе венепункции,
рекомендуется проводить забор
крови в 2 набора флаконов из двух
вен с интервалом не более 30 минут.
43.
КРОВЬ НА СТЕРИЛЬНОСТЬБАК. ЛАБ.
аэробные – развиваются в
присутствии кислорода
(зеленый колпачок)
10 мл крови
5 мл крови -дети
Всегда забираем
анаэробные –
развиваются в
отсутствии кислорода
(оранжевый колпачок)
10 мл крови
5 мл крови - дети
•Посев необходимо проводить во время
температуры, в начале появления лихорадки.
подъема
По доп. назначению врача
Кровь поступает во флакон самостоятельно благодаря наличию внутри него
отрицательного давления
Доставка
в бактериологическую
лабораторию
в течении 4-х часов
44.
Маркировка каждого образца должна быть правильной, т.е. этикетка должнабыть наклеена на корпус, а не на крышку. Маркируйте контейнер при помощи
отдельной полоски бумаги, приклеенной одним концом к контейнеру.
Убедитесь в том, что этикетка контейнера с образцами содержит ФИО пациента,
дату получения образца, № медицинской карты или направление от учреждения.
При сборе образца соблюдайте все процедуры, требуемых для соответсвующих
исследований. Зарегистрируйте каждый образец в соответствующем
регистрационном журнале.
44
45.
Требования к персоналу при работе с биологическимматериалом
К работе с биологическими материалами
допускаются лица моложе 18 лет.
не
Персонал проходит предварительные (при приеме на
работу) и периодические медицинские осмотры.
Персонал должен быть привит против гепатита В
соответствии с
национальным календарем
профилактических прививок.
При приеме на работу и затем ежегодно персонал
проходит обязательный инструктаж по правилам
безопасного
обращения
с
биологическим
материалом.
46. Оформление сопровождающих документов
Материал, направляемый в лабораторию, должен иметьсопроводительный бланк со следующими сведениями:
1.ФИО пациента.
2.Номер истории болезни и дата взятия заболевания.
3.Местонахождение пациента.
4.Диагноз заболевания.
5.Какой материал направляется в лабораторию и откуда
он взят.
6.Точное указание, на какое исследование посылается
материал в лабораторию.
7.Какой день заболевания.
8.Подпись лица, взявшего от пациента исследуемый
материал.
47. Хранение и транспортировка крови
Исследование крови на геманализаторах – либо сразу после взятия (поканет спонтанной агрегации тромбоцитов), либо спустя 30 мин (время
«адаптации» к антикоагулянту), но не позднее 6-8 час.
Хранение крови – при комнатной температуре!
Капиллярную кровь с ЭДТА исследуют в теч. 4 час. Изготовление мазков
крови - не позднее 1-2 час после взятия.
48. Хранение и транспортировка крови
При отсрочке анализа пробы крови хранят при 4–8о С до одних суток.Цельную кровь не замораживают!
Хранить венозную кровь можно максимум 6 часов при комнатной температуре
(остаются стабильными в этих условиях концентрация Hb и количество
тромбоцитов). 24 часа при температуре +4-8
При транспортировке пробирки должны быть в вертикальном положении.
Перед анализом кровь нужно согреть до комнатной температуры и тщательно перемешать!
49.
Критерии для отказа в принятии лабораториейбиоматериала на исследование
Отсутствие этикетки на пробирке;
Расхождение между данными заявки и этикетки (инициалы, дата, время);
Невозможность прочесть на заявке и/или этикетке данные пациента;
Отсутствие названия отделения, номера истории болезни, ФИО врача,
подписи процедурной сестры, перечня исследований;
Гемолиз (кроме исследований, на которые он не влияет);
Взятый материал - в несоответствующей емкости (другой антикоагулянт,
добавка, консервант и др.);
Сгустки в пробах с антикоагулянтом;
Недостаточное количество биоматериала для анализа;
Истекло время стабильности аналита в образце;
Материал взят в вакуумные емкости с истекшим сроком годности.

















































 medicine
medicine








