Similar presentations:
Гидравлические и воздушные вяжущие материалы
1. Гидравлические и воздушные вяжущие материалы
© 2023 Шабанова И.В.кафедра химии
2. Классификация неорганических вяжущих материалов
Неорганическимивяжущими
веществами
называются
материалы,
которые
при
смешивании с водой способны переходить из
жидкого или тестообразного состояния в
камневидное.
По условиям твердения и водостойкости продуктов
твердения неорганические вяжущие вещества
делят на воздушные и гидравлические.
К воздушным относятся вяжущие вещества,
которые после затворения водой твердеют и
сохраняют прочность только на воздухе.
Гидравлические
вяжущие
вещества
после
замешивания с водой и начального твердения на
воздухе в дальнейшем могут твердеть и под
водой, набирая при этом прочность.
3. Классификация неорганических вяжущих материалов
воздушные вяжущиегидравлические вяжущие
Гипсовые
Портландцемент
состоит из соединений Ca2+
ортосиликатов Ca2SiO4
алюминатов Ca3(AlO3)2
ферритов кальцияСa(FeO2)
CaSO4•0.5H2O - гипс
CaSO4 - ангидрид
Известковые
CaO – негашеная известь
Ca(OH)2 – гашеная известь
Магнезиальные
MgO–каустический магнезит
MgО - затворяют раствором
MgCl2
Растворимое стекло
Na2SiO3, K2SiO3
производные
портландцемента:
глиноземистый,
пуццолановый
4. Гипсовые вяжущие вещества
Сырье для производства природный гипсCaSO4•2H2O.
Получение: дегидратация природного
гипса при обжиге
CaSO4•2H2O = CaSO4•0.5H20 + 1.5H2O
По условиям обжига, схватывания и
твердения гипсовые вяжущие вещества
делят на две группы: низко- и
высокообжиговые.
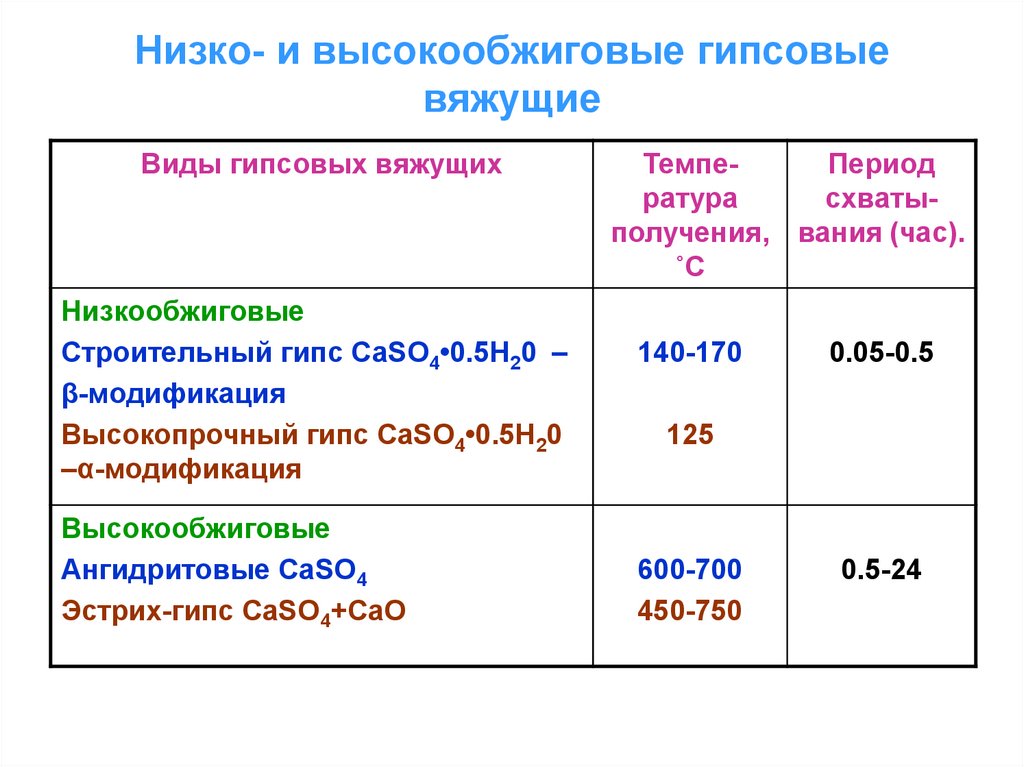
5. Низко- и высокообжиговые гипсовые вяжущие
Виды гипсовых вяжущихНизкообжиговые
Строительный гипс CaSO4•0.5H20 –
β-модификация
Высокопрочный гипс CaSO4•0.5H20
–α-модификация
Высокообжиговые
Ангидритовые CaSO4
Эстрих-гипс CaSO4+CaO
ТемпеПериод
ратура
схватыполучения, вания (час).
˚С
140-170
0.05-0.5
125
600-700
450-750
0.5-24
6. Твердение гипсовых вяжущих
По Байкову включает 3 периода1) Гидратация. При смешении гипса с водой он
гидратируется и образует его насыщенный раствор
CaSO4•0.5H20 + 1.5H2O = CaSO4•2H2O
2)
Коллоидирование.
Образуется
коллоид
CaSO4•2H2O в виде геля, что сопровождается
схватыванием массы.
3) Коагуляция и кристаллизация. Коллоидные
частички CaSO4•2H2O коагулируют, кристаллизуются с
образованием более крупных кристаллов, что
сопровождается твердением системы
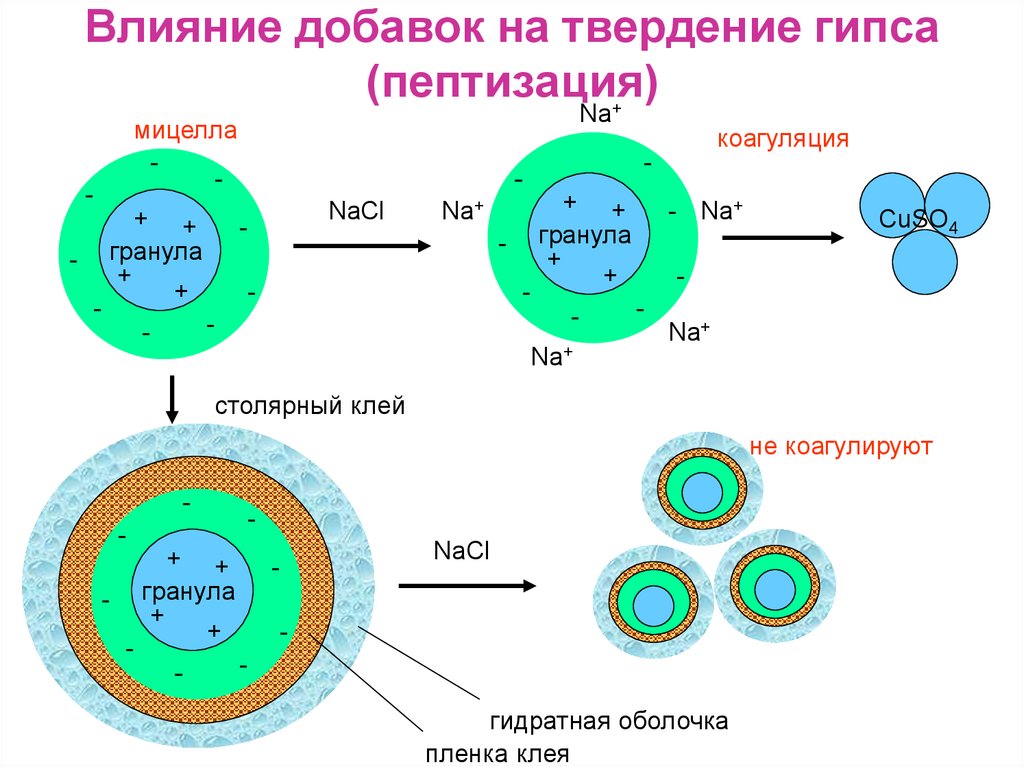
замедлители схватывания - столярный клей, сульфитспиритовую барду
ускорители схватывания - применяют молотый
природный гипс CaSO4•2H2O или поваренную соль
NaCl
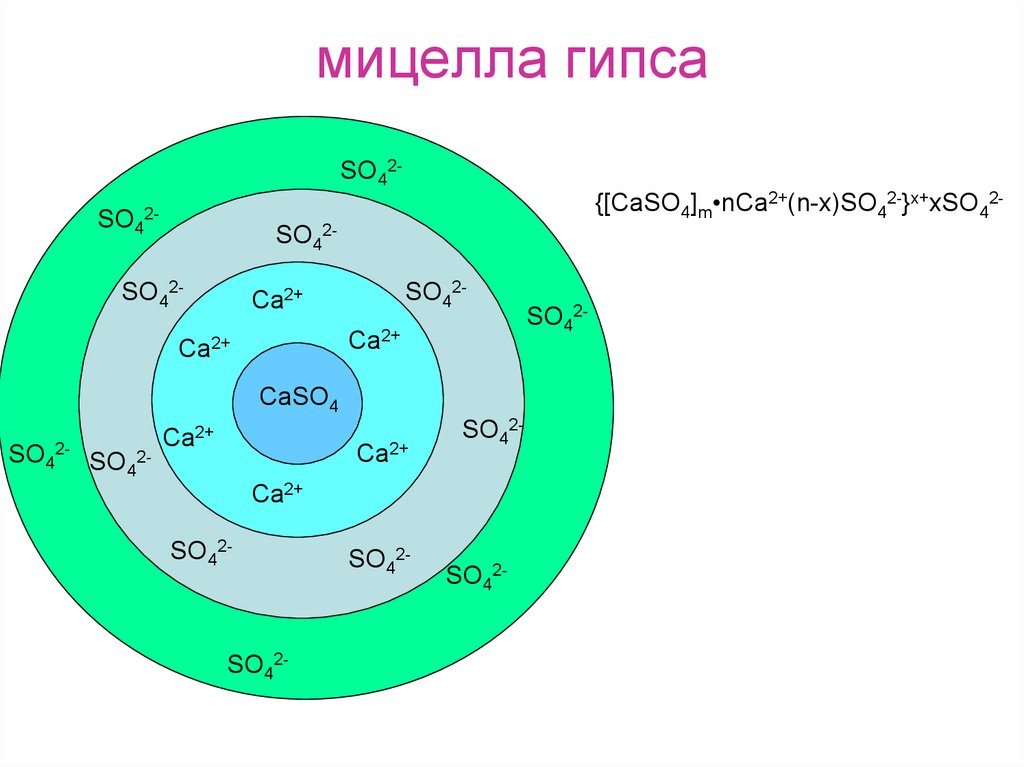
7. мицелла гипса
SO42SO42-{[СaSO4]m•nCa2+(n-x)SO42-}x+xSO42-
SO42-
SO42-
SO42-
Ca2+
Ca2+
Ca2+
CaSO4
SO42- SO 24
Ca2+
Ca2+
SO42-
Ca2+
SO42-
SO42-
SO42-
SO42-
SO42-
8. Влияние добавок на твердение гипса (пептизация)
Na+мицелла
-
-
+ +
гранула
+
+
-
Na+
-
-
+ +
гранула
+
+
-
-
-
-
NaCl
коагуляция
Na+
- Na+
СuSO4
-
Na+
столярный клей
не коагулируют
-
-
+ +
гранула
+
+
-
-
NaCl
-
гидратная оболочка
пленка клея
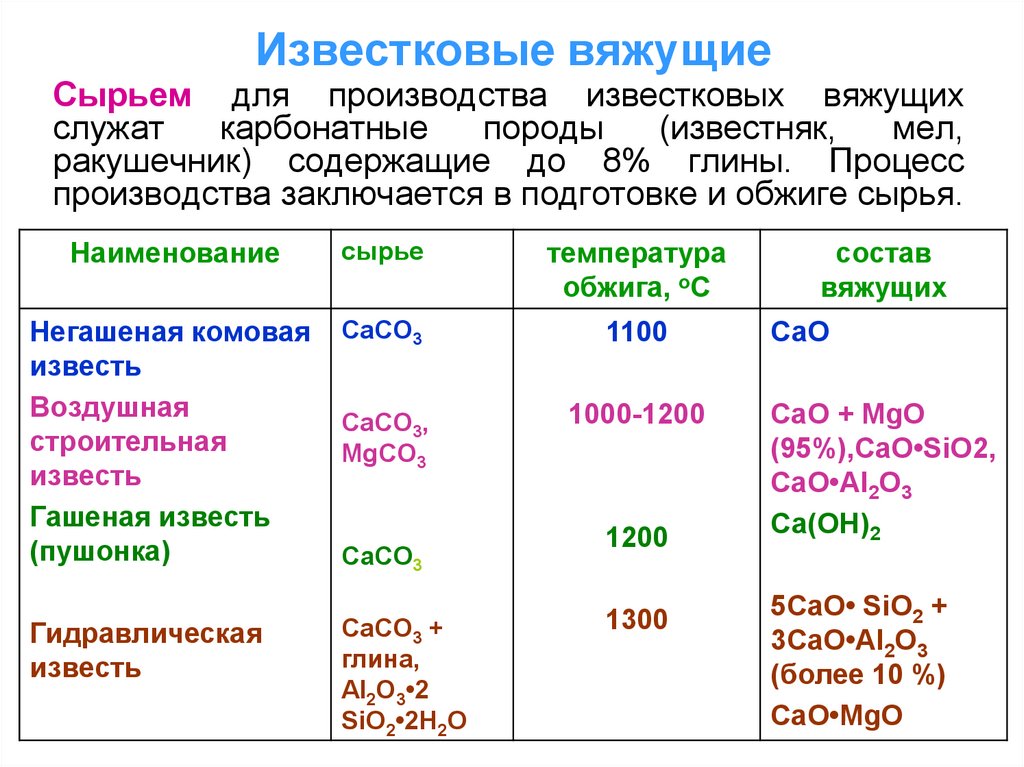
9. Известковые вяжущие
Сырьем для производства известковых вяжущихслужат
карбонатные
породы
(известняк,
мел,
ракушечник) содержащие до 8% глины. Процесс
производства заключается в подготовке и обжиге сырья.
Наименование
сырье
температура
обжига, оС
Негашеная комовая
известь
Воздушная
строительная
известь
Гашеная известь
(пушонка)
СaCO3
1100
СaCO3,
MgCO3
1000-1200
Гидравлическая
известь
СaCO3 +
глина,
Al2O3•2
SiO2•2H2O
СaCO3
1200
1300
состав
вяжущих
СаО
CaO + MgO
(95%),CaO•SiO2,
CaO•Al2O3
Ca(OH)2
5CaO• SiO2 +
3CaO•Al2O3
(более 10 %)
CaO•MgO
10. Затворение и твердение извести
При затворении известкового вяжущего можновыделить процессы:
Образование гидроксида кальция и гидратация
оксида кальция :
nCaO + mH2O = Ca(OH) 2 + (n-1)CaO•(m-1)H2O.
Твердение извести включает:
1) образование пересыщенного раствора гидроксида
кальция
Ca(OH)2.
2) испарение воды и кристаллизация Ca(OH)2.
3) карбонизация Ca(OH)2 + CO2 = CaCO3↓ + H2O
Образующийся на поверхности карбонат кальция
препятствует дальнейшему процессу карбонизации,
замедляет испарение воды и тормозит процесс
твердения извести, поэтому добавляют песок
улучшающий доступ CO2
11. Магнезиальные вяжущие (цемент Сореля).
Сырье:магнезит
(MgCO3)
или
доломит
(MgCO3•CaCO3)
Получение: обжиг магнезита и доломита
1) Разложение магнезита
MgCO3 400оС MgO + CO2
2) процесс спекания - при 900-1000 ˚С
3) получение спёкшегося огнеупорного магнезита
- при температуре выше 1500 ˚C
В зависимости от исходного сырья различают
каустический магнезит (MgO), полученный при
обжиге магнезита, и каустический доломит
(MgO•CaCO3), полученный при обжиге природного
доломита.
12. затворение магнезиальных вяжущих
Затворяют растворами солей хлоридамагния MgCl2 и сульфата магния MgSO4.
При затворении идет процесс гидролиза с
образованием основных солей,
обладающих вяжущими свойствами.
MgO + MgCl2 + H2O = 2MgOHCl
MgO + MgSO4 + H2O = (MgOH) 2SO4
13. Твердение магнезиального вяжущего
обусловлено процессами дегидратации иполимеризации.
Дегидратация
2MgOHCl = Cl—Mg—O—Mg—Cl + H2O
Полимеризация Длинные цепи образуются
благодаря ковалентным связям -O—Mg—
O—Mg-.
Эти
цепи
ограничены
гидроксильными
группами
и,
что
особенно важно – ионами хлора, которые
обладают свойством связывать атомы Zn,
Be, Al, образуя мостиковые связи (-Mg—
Cl—Mg-).
Сочетание
ковалентных
и
мостиковых
связей
обуславливает
высокую
прочность
магнезиальных
цементов.
14. Твердение магнезиального вяжущего
Твердениемагнезиальных
цементов
сопровождается
значительным
изменением
объема твердеющей массы, что приводит к
растрескиванию цементного камня.
Это происходит по причине спонтанного процесса
гидратации и полимеризации.
Введение в магнезиальную смесь соединений
цинка замедляет процессы кристаллизации
магнезиального
цемента
и
предотвращает
растрескивание камня.
Магнезиальные
цементы
применяются
для
изоляции высокоминерализованных пластовых
вод при строительстве скважин
15. Растворимое стекло. Кислотоупорный кварцевый цемент
Получают:1) спекают кальцинированную соды Na2СO3
или поташ K2CO3 с SiO2:
Na2CO3 + SiO2 = Na2SiO3 + CO2
2) силиката натрия или калия растворяют
при 120оС в воде, образуется 30-50 %
раствор.
3) Силикаты натрия и калия гидролизуются
образуя гель ортокремневой кислоты,
обладающей вяжущими свойствами:
Na2SiO3 + 3H2O = 2NaOH + H4SiO4
16. Ускорение коагуляции
1) Испарение воды (синерезис)2) Нейтрализация щелочной среды углекислым
газом
NaOH + CO2 = Na2CO3 + H2O
Na2O*nSiO2 + CO2 = Na2CO3 + nSiO2
3) Добавки кремнефтористого натрия, который в
избытке воды гидролизуется:
Na2SiF6 + 4H2O = H4SiO4 +2NaF + 4HF
Фторид натрия малорастворим в воде, ускоряет
процесс гидролиза силикатов натрия и калия и
выделение геля ортокремневой кислоты
(клеящего вещества), что приводит к быстрому
твердению системы
17. Классификация кварцевого кремнефторного цемента
1. Предназначен для кислотоупорныхзамазок (количество Na2SiF6 должно
быть 4±0.5%, начало схватывания 40
мин. – конец 8 часов)
2. Предназначен для растворов и бетонов
(количество Na2SiF6 8±0.5% , начало
схватывания 20 мин. –конец 6-8 часов)
18. Гидравлические вяжущие вещества.
• К гидравлическим вяжущим веществам относятсягидравлическая известь и различные цементы
(портландский, пуццолановый и глиноземистый).
• Вяжущие свойства этой группы веществ
обусловлены наличием в их составе
ортосиликатов, алюминатов и ферритов кальция:
Ca2SiO4, Ca3(AlO3)2, Ca(FeO2) 2
• Химический состав цемента находится в
следующих пределах: CaO – 62-68%, Al2O3 – 4-9%,
SiO2 – 18-26%, Fe2O3 – 0.3 – 6%.
• В качестве сырья используют смесь известняка и
глинистых пород
19. Прокаливание и обработка сырья
1)При 500 ˚С сырьевая смесь спекаетсяв комья
2)При 550-800 ˚С алюмосиликаты глины
разлагаются, и структура сильно
разрыхляется:
Al2O3* SiO2*2H2O = Al2O3 + 2SiO2 + 2H2O
3) При 900-1000 ˚С происходит
разложение карбоната кальция:
CaCO3 = CaO + CO2
20. Прокаливание и обработка сырья
4) При 1200-1300 ˚С получаются искусственныеминералы:
• двухкальциевый силикат (белит) – Ca2SiO4,
• трехкальциевый
алюминат
(целит)
–
Ca3(AlO3)2,
• четырехкальциевый алюмоферрит – 4CaO*
Al2O3* Fe2O3.
5) При более высоких температурах 1300-1400
˚С
обжигаемая
смесь
частично
расплавляется, и избыточный оксид кальция
взаимодействует с белитом с образованием
трехкальциевого силиката (алит):
Ca2SiO4 + CaO = Ca3SiO5
21. Прокаливание и обработка сырья
• Полученная смесь минералов называетсяклинкером. Его состав: 2CaO*SiO2 – белит,
3CaO*SiO2 – алит, 3CaO*Al2O3 – целит,
4CaO*Al2O3*Fe2O3 – алюмоферрит.
• В специальных устройствах-холодильниках
клинкер
быстро
охлаждается,
что
предотвращает образование в нем крупных
кристаллов. Остывший клинкер измельчают в
тонкий порошок на шаровых мельницах. При
размоле
добавляют
5%
гипса
для
регулирования процессов схватывания и до
15% гидравлических добавок (природный
кремнезем).
22. Твердение портландцемента
1) взаимодействие клинкера с водойсопровождают процессы гидролиза и
гидратации
Гидролиз ортосиликата кальция
протекает медленно (за 2 месяца на
80%) и этим объясняется повышение
прочности белитового цемента с
годами:
Ca2SiO4 + 4H2O = H4SiO4 + 2Ca2+ + 4OH2) Образующаяся ортокремневая кислота
способна к полимеризации
23.
3) Другая часть ортокремниевой кислотывзаимодействует с гидроксидом
кальция с образованием
гидросиликатов:
Ca(OH) 2 + 2H4SiO4 = Ca(H3SiO4)2 + 2H2O
Ca(OH) 2 + 2H4SiO4 = CaH2SiO4 + 2H2O
3Ca(OH)2 + 2H4SiO4 = Ca3(HSiO4)2+ 6H2O
• Гидросиликаты представляют собой
полимерные соединения с
упорядоченной структурой (кристаллы)
и малоупорядоченной (гели).
24.
Гидролиз трехкальциевого силикатапротекает быстрее, что обусловлено
избыточным содержанием оксида
кальция:
2 Ca2SiO4*CaO + 4H2O =
Ca3(HSiO4)2 + 3Ca(OH)2
25.
Причины ускорения схватывания1) процесс гидратации избыточной извести,
сопровождающийся выделением тепла, что
вызывает усиленное испарение воды и
процесс кристаллизации гидроксидов и
гидросиликатов ускоряется.
2) Избыточное содержание оксидов кальция и
алюминия
обуславливает
высокую
гидратируемость алюмината, что вызывает
быстрое схватывание и неравномерность
изменения объема.
Ca(AlO2)2 + 2CaO + 6H2O = Ca3[Al(OH)6]2
Поэтому такой цемент нельзя использовать
при строительстве массивных сооружений.
26. Рекомендуемая литература
1.2.
3.
4.
5.
6.
7.
8.
Угай Я.А. Общая и неорганическая химия.М.:
Высшая школа, 1997. – 527 с
Суворов А.В., Никольский А.Б. Общая химия. СПб.:
Химия, 1994.- 624 с
Ахметов Н.С. Неорганическая химия. М.: Высшая
школа, 1975. – 672 с
Платонов Ф.П. Лекционные опыты и демонстрации
по общей и неорганической химии. М.: Высшая
школа, 1976. – 327 с
Глинка Н.Л Общая химия, 2006. – 547 с
Воробьев В.А. Строительные материалы. М.:
Высшая школа, 1979. -382 с
Воробьев В.А. Лабораторный практикум по общему
курсу строительных материалов. М.: Высшая
школа, 1978. – 248 с
Акопов Е.К., Дробашева Т.И. Общая химия. Ростов
н/Д.: РГУ, 1992. – 256 с






















 chemistry
chemistry Construction
Construction








