Similar presentations:
Растворы
1.
2.
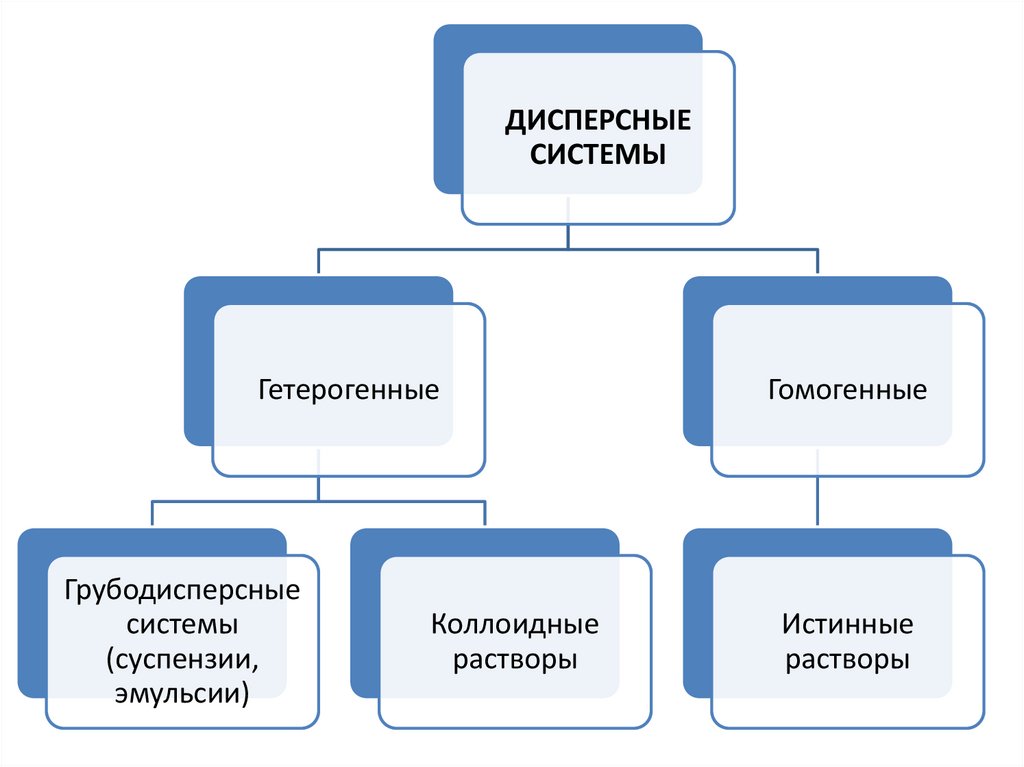
ДИСПЕРСНЫЕСИСТЕМЫ
Гетерогенные
Грубодисперсные
системы
(суспензии,
эмульсии)
Коллоидные
растворы
Гомогенные
Истинные
растворы
3.
Классификация систем по степени дисперсностиВ дисперсных системах одно вещество равномерно
распределено в виде частиц внутри другого вещества.
Истинные растворы (молекулы, ионы; 10-9 м)
Примеры: сплавы, смеси газов, жидкие растворы веществ.
Коллоидные растворы и системы (коллоидные частицы;
10-7м)
Примеры: кисель, обойный клей, мыло в воде, дым.
Грубодисперсные системы (крупные частицы, заметные при
увеличении; 10-5м)
Примеры: аэрозоли, суспензии (мел в воде), эмульсии (масло в
воде).
4.
ИСТИННЫЕ РАСТВОРЫРастворение – переход молекул вещества из одной фазы в
другую.
Различают:
ненасыщенные,
насыщенные,
пересыщенные
растворы.
растворение
кристаллизация
Причина растворения – взаимодействие частиц растворителя и
растворённого вещества.
Изменение физических свойств: температуры, объема, плотности,
вязкости, цвета раствора.
Изменение химических свойств заключается в изменении
реакционной способности веществ.
Растворение – обратимый физико-химический процесс.
Раствором называют гомогенную смесь переменного состава.
5.
Растворимость — способность вещества образовывать с другимивеществами истинные растворы.
Растворимость (S) выражается концентрацией растворённого
вещества в его насыщенном растворе либо в процентах, либо в
граммах, отнесённых к 100г или 100см³ (мл) растворителя.
Растворимость веществ существенно зависит:
• от природы растворяемого вещества и растворителя
(подобное растворяется в подобном),
• температуры и давления (с повышением температуры и
давления растворимость многих веществ увеличивается)
• от присутствия других компонентов в растворе:
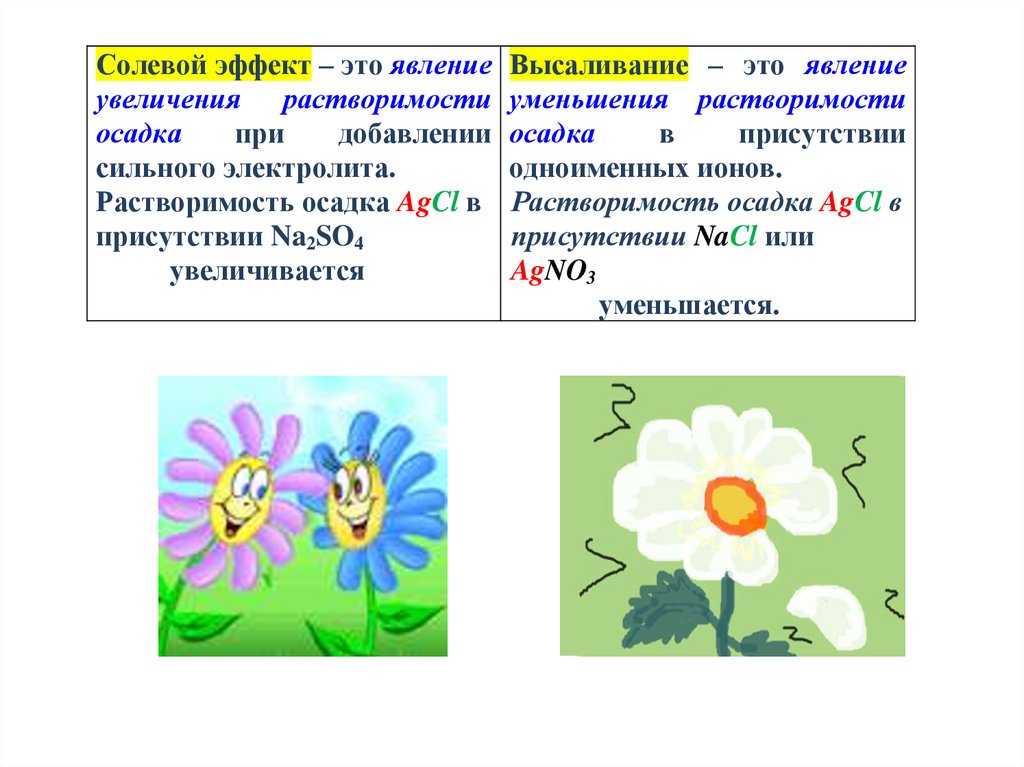
6.
Солевой эффект – это явление Высаливание – это явлениеувеличения растворимости уменьшения растворимости
присутствии
в
добавлении осадка
при
осадка
одноименных ионов.
сильного электролита.
Растворимость осадка AgCl в Растворимость осадка AgCl в
присутствии NaCl или
присутствии Na2SO4
увеличивается
AgNO3
уменьшается.
7.
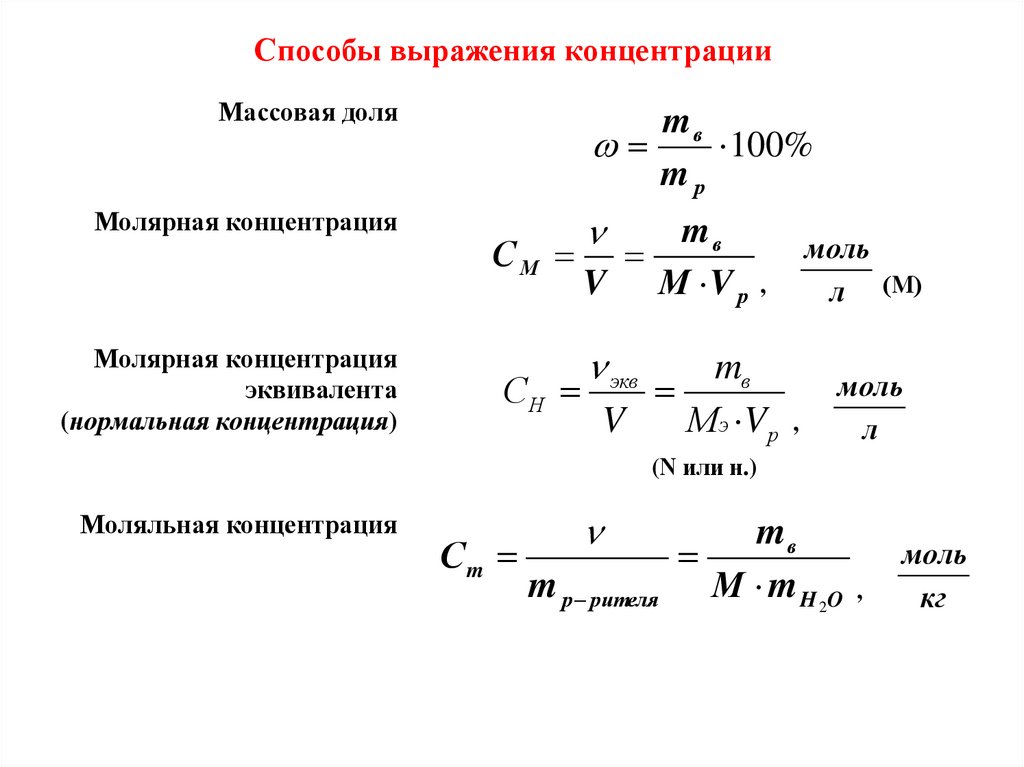
Способы выражения концентрацииМассовая доля
mв
100%
mр
Молярная концентрация
mв
СМ
V М V р ,
Молярная концентрация
эквивалента
(нормальная концентрация)
экв
mв
СН
V
МЭ V р ,
моль
л (М)
моль
л
(N или н.)
Моляльная концентрация
mв
Сm
m р рителя М m H 2O ,
моль
кг
8.
Коллигативные свойства растворов неэлектролитовКоллигативные свойства растворов - это те их свойства, которые
при данных условиях зависят только от числа растворенных частиц и
не зависят от химической природы растворённого вещества.
Второй закон Рауля. В 1886-1887 году Ф. М. Рауль
сформулировал
закон,
связывающий
изменение
температур
фазовых
переходов
раствора
с
концентрацией веществ:
T
зам
Т
зам
Н 2О
Т
зам
раствора
mв
K кр С m K кр
М m H 2O ,
Франсуа
Мари Рауль Kкр – криоскопическая константа;
кип
T кип Т кип
Т
раствора
Н 2О K эб Сm ,
Kэб – эбулиоскопическая константа.
9.
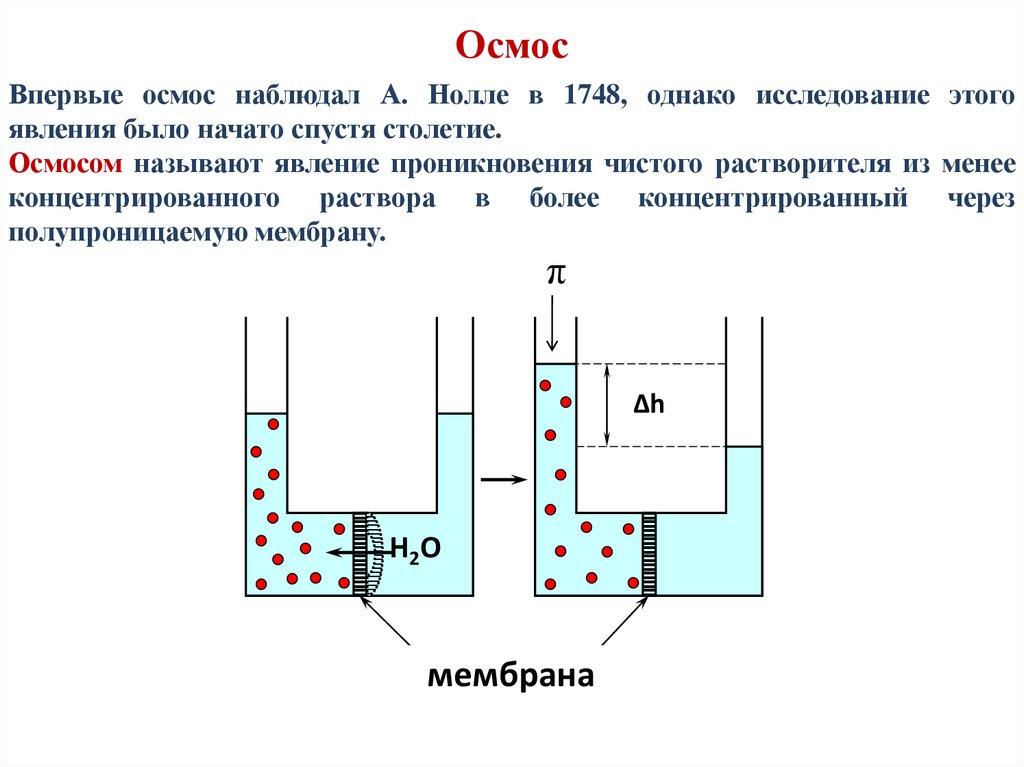
ОсмосВпервые осмос наблюдал А. Нолле в 1748, однако исследование этого
явления было начато спустя столетие.
Осмосом называют явление проникновения чистого растворителя из менее
концентрированного раствора в более концентрированный через
полупроницаемую мембрану.
π
Δh
Н2О
мембрана
10.
В 1886г. голландский физхимик Вант-Гоффобратил внимание на схожесть поведения растворенного
вещества и идеального газа.
с
R
T
Закон Вант-Гоффа:
,
π – осмотическое давление, кПа;
с – молярная концентрация, моль/л;
R – универсальная газовая постоянная (8.31 Дж/моль·К);
Т – температура, К.
11.
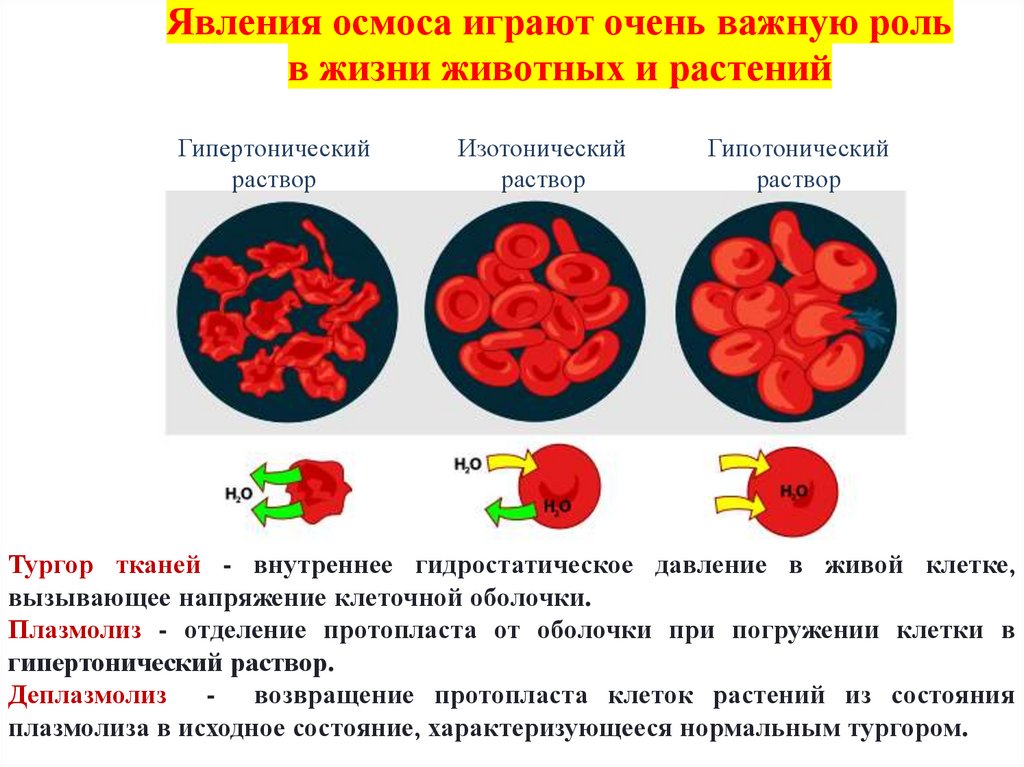
Явления осмоса играют очень важную рольв жизни животных и растений
Гипертонический
раствор
Изотонический
раствор
Гипотонический
раствор
Тургор тканей - внутреннее гидростатическое давление в живой клетке,
вызывающее напряжение клеточной оболочки.
Плазмолиз - отделение протопласта от оболочки при погружении клетки в
гипертонический раствор.
Деплазмолиз - возвращение протопласта клеток растений из состояния
плазмолиза в исходное состояние, характеризующееся нормальным тургором.
12.
Растворы электролитов.Основные понятия и положения
теории электролитической диссоциации
Электролитами называют сложные вещества,
способные проводить электрический ток в растворе
или расплаве.
Ионами называются атомы или молекулы,
имеющие электрический заряд.
Электролитическая диссоциация – это процесс
распада нейтральных молекул на ионы при
растворении или плавлении.
13.
Для растворов электролитов наблюдается отклонение от законовРауля и Вант-Гоффа и они приобретают вид:
Tзам i K кр сm ,
Tкип i K эб сm ,
i сRT ,
где i – изотонический коэффициент (фактор Вант-Гоффа).
Изотонический коэффициент показывает во сколько раз
коллигативное свойство раствора электролита больше
коллигативного свойства раствора неэлектролита при той же
концентрации.
i>1
14.
Основные положенияв следующем:
теории
С.Аррениуса
заключаются
1.Электролиты при растворении в воде диссоциируют, образуя
смесь положительно и отрицательно заряженных ионов. Сумма
зарядов ионов в растворе равна нулю.
2.Ионы в растворе пребывают в состоянии неупорядоченного
теплового движения, но при наложении постоянного электрического
поля приобретают направленное движение: положительно
заряженные ионы перемещаются к катоду (катионы), а
отрицательно заряженные – к аноду (анионы).
3.Электролитическая диссоциация есть процесс обратимый –
наряду с распадом молекул на ионы (диссоциацией) происходит
объединение ионов в молекулы (ассоциация).
15.
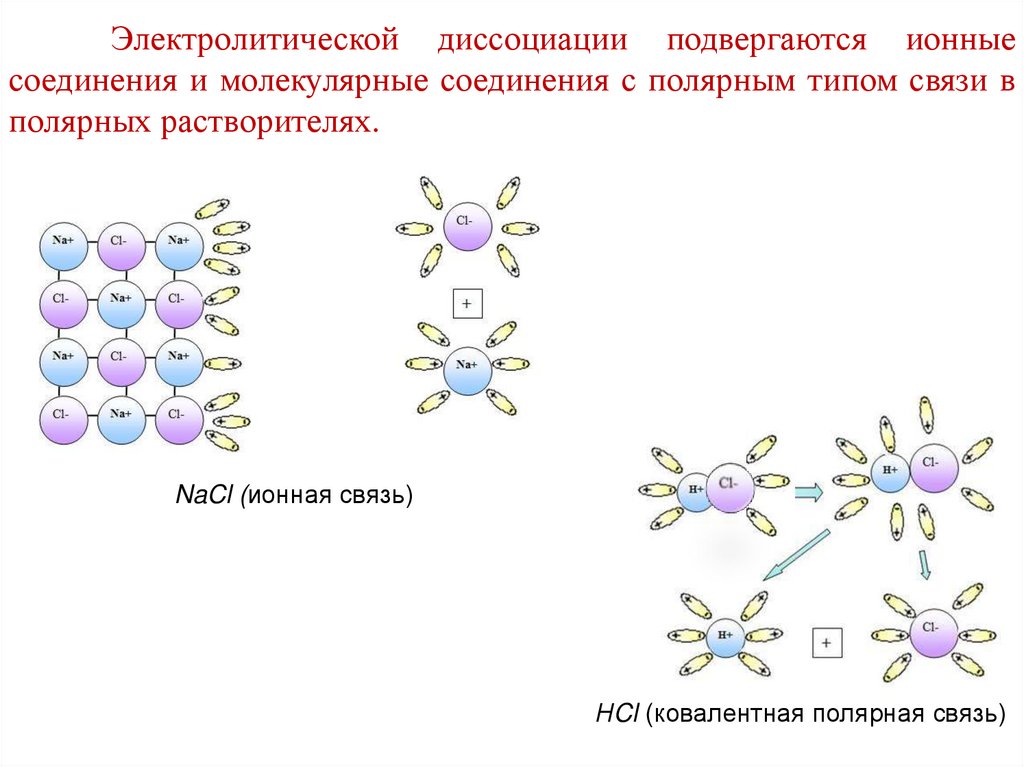
Электролитической диссоциации подвергаются ионныесоединения и молекулярные соединения с полярным типом связи в
полярных растворителях.
NaCl (ионная связь)
НCl (ковалентная полярная связь)
16.
СвантеАвгуст
Аррениус
(1859—1927)
принадлежал к тем немногих великим ученым,
которые чуть ли не от рождения изумляют
окружающих
своими
исключительными
способностями.
Естественно-математический
факультет университета в Упсале он окончил за
неполных два года, получив степень кандидата наук.
Затем уехал в Стокгольм и еще через два года работы
представил шведской Академии наук самый
значительный труд своей жизни — теорию
электролитической диссоциации и проводимости
растворов. В то время ему едва минуло двадцать три
года. Теория Аррениуса актуальна и по сей день.










 chemistry
chemistry








