Similar presentations:
Элементы химической термодинамики
1.
Элементы химической термодинамики2.
Элементы химической термодинамикиТермодинамика — раздел химии, в котором изучаются законы,
описывающие энергетические превращения, сопровождающие
физические, химические и биологические процессы.
Термодинамическая система — тело или группа тел, отделенная
от окружающей среды реальной или воображаемой поверхностью
раздела.
Открытые, закрытые, изолированные системы;
гомогенные и гетерогенные системы.
Система
Изолированная
Закрытая
Открытая
Нет обмена ни веществом, ни
Обменивается только
Обмен энергией и веществом
энергией с окружающей
энергией с окружающей
с окружающей средой (живой
средой (термос, подводная
средой (ампула с
организм)
лодка, космический корабль) лекарственным веществом)
3.
Параметр— величина, характеризующая какое-либо свойство
вещества или процесса
(масса, температура, концентрация, энергия).
Параметры системы могут быть экстенсивными (при
взаимодействии систем они суммируются) и интенсивными
(усредняются при взаимодействии систем).
Экстенсивные (суммируются)
Интенсивные
(усредняются)
Пропорциональны числу частиц в
системе
[масса (m), объем (V), количество
вещества (число молей n)]
Их величина не зависит от числа
частиц в системе [температура (T),
давление (p), концентрация (с),
плотность(р)]
Совокупность параметров определяет состояние
термодинамической системы.
4.
Термодинамический процесс — переход системы из одногосостояния в другое, сопровождающийся изменением хотя бы одного из
параметров системы.
Изотермические (T = const), изобарные (p = const), изохорные (V = const);
самопроизвольные и несамопроизвольные; обратимые и необратимые
процессы.
Функции состояния
— экстенсивные параметры, изменение которых (∆) зависит только от
конечного и начального состояния системы.
∆ = конечное значение параметра минус начальное значение параметра.
Функции состояния термодинамической системы
— внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса
(G).
Энергия (E) — количественная мера интенсивности различных форм
взаимодействия и перемещения частиц в термодинамической системе
(кДж/моль).
Для описания энергетического состояния термодинамической системы
используется одна из функций состояния — внутренняя энергия (U, кДж/моль).
5.
Первое начало термодинамики — энергия не создается ине уничтожается, а только превращается из одного вида в другой в
эквивалентных количествах (закон сохранения и превращения
энергии).
В изолированной системе внутренняя энергия (U) постоянна, т.е.
Δ U = 0.
Энтальпия (H)
— функция состояния термодинамической системы, изменение
которой (изменение теплосодержания ∆Н) представляет собой
тепловой эффект процесса (Qp), протекающего при постоянном
давлении (p = const, изобарный процесс).
ΔН = Qp
Δ fH0298 (вещество, состояние), Δ rH0298 (вещество, состояние), Δ сН0298
(вещество, состояние), кДж/моль (f — formation(образования), r —
reaction, c — combustion (сгорания);
г — газ, ж — жидкость, т — твердое вещество).
Δ rH < O — экзотермический процесс;
Δ rH > O — эндотермический процесс
6.
Энтропия (S)— функция состояния термодинамической системы, характеризующая
степень (меру) упорядоченности частиц в системе.
Увеличение энтропии (Δ S > O, Дж/моль-К) увеличивает
неупорядоченность расположения частиц.
Любая система стремится к переходу в наиболее вероятное состояние
(т.е. к увеличению беспорядка).
S(газ) > S(ж) > S(T)
Возможность самопроизвольного протекания процесса в
изолированных системах определяется изменением энтропии (ΔS), а в
закрытых и открытых (неизолированных) системах — изменением
энергии Гиббса (ΔG).
Второе начало термодинамики
для изолированных систем — самопроизвольно могут совершаться
только необратимые процессы,
для которых энтропия системы (S) возрастает, т.е. ΔS > O.
Для неизолированных систем нужно учитывать также изменение
энергии.
7.
Энергия Гиббса (G)— обобщенная функция состояния термодинамической системы,
учитывающая (а) изменение энергетики
и(б) неупорядоченности системы при постоянном давлении и
температуре (p, T = const, изобарно-изотермический процесс).
ΔG = ΔН - TS
ΔG0 = Δ H0 - T ΔS0
Δ rG < 0 — экзэргоническая реакция; Δ rG > 0 — эндэргоническая реакция;
Δ rG =0 — химическое равновесие.
Критерий возможности протекания процесса в неизолированных
системах: ΔG < O.
Для стандартных физиологических условий (pH = 7, Т = 310 K)
ΔG0 310
8.
Второе начало термодинамики для неизолированных систем —самопроизвольно могут совершаться процессы,
для которых при постоянной температуре и давлении энергия Гиббса
системы (G) уменьшается, т.е. ΔG < O.
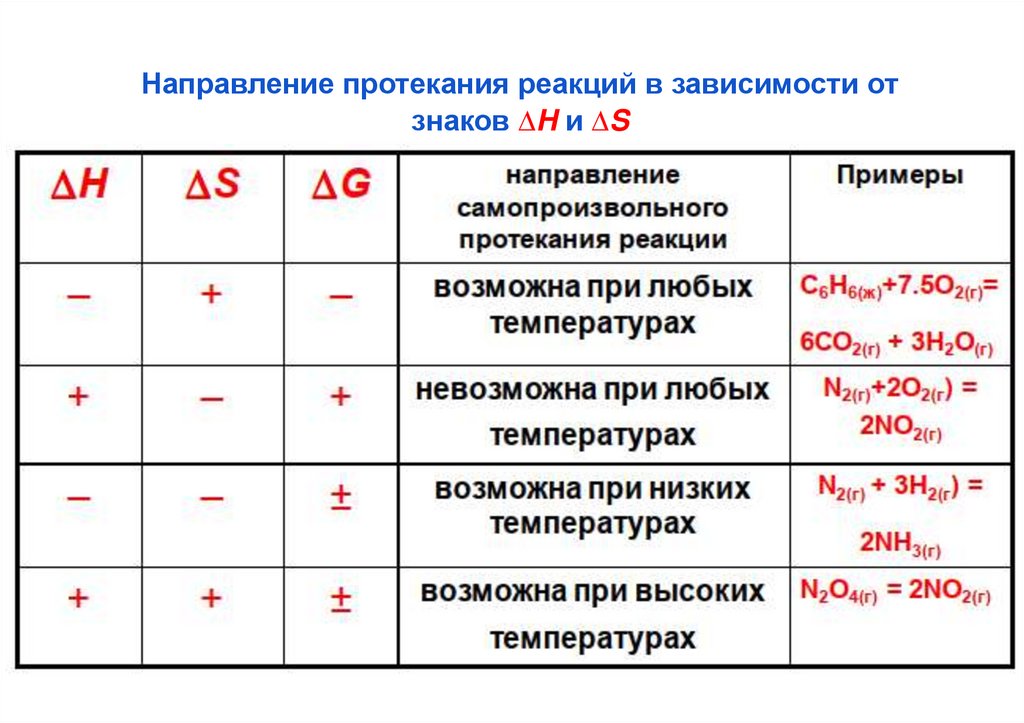
Направление протекания реакции в зависимости от знаков ΔH и T ΔS
— анализ уравнения Гиббса ΔG = Δ H - T ΔS
Δ Н < 0, Δ S > 0;
при этом Δ G < 0, реакция возможна при любых температурах.
Δ Н > 0, Δ S < 0;
при этом Δ G > 0, реакция невозможна при любых температурах.
ΔН < 0, ΔS < 0;
при этом Δ G может быть и больше и меньше 0, реакция возможна при
низких T.
Δ Н > 0, Δ S > 0;
при этом ΔG может быть и больше и меньше 0, реакция возможна при
высоких T.
9.
Процесс - переход системы из одного состояния в другое;характеризуется изменением хотя бы одного параметра
• В термодинамике изменение параметра (Δ) принято рассчитывать
как разность:
Δ = конечное значение параметра — начальное значение параметра
• Функции состояния - свойства, величины которых при переходе
системы из одного состояния в другое зависят только от начального и
конечного состояния системы и не зависят от пути перехода (давление,
объем, температура и т.д.)
• Материя содержит энергию в виде кинетической и потенциальной
энергии ее частиц, сумма которых - внутренняя энергия - функция
состояния, экстенсивный параметр:
ΔU = Eпотен + Eкинет измеряется в Дж или кДж
ΔU происходит в результате взаимодействия системы с окружающей
средой в двух формах работы (А) и теплоты (Q). A и Q в общем случае
не функции состояния
10.
I закон (первое начало) термодинамикизакон сохранения и превращения энергии (1842 г,
ученый врач Майер)
Формулировки I начала для различного вида систем:
1. В изолированной системе внутренняя энергия постоянна, т.е.
ΔU =0
2. Если к закрытой системе подвести теплоту Q, то эта энергия
расходуется на увеличение внутренней энергии системы и на
совершение системой работы против внешних сил окружающей
среды:
Q = ΔU + А Для изобарно-изотермических
условий А
= р ΔV, тогда:
Qр = ∆U + р∆V = (Uкон - Uнач ) + (рVкон - рVнач) =
= (Uкон + рVкон) - (Uнач + pVнач)
но U и V - функции состояния, тогда новая функция состояния энтальпия:
H ≡ U + pV и
Qp = Нкон - Ннач = ∆Н
11.
Измерение тепловых эффектов - калориметрияН - экстенсивный параметр, зависит от количества вещества, Т, р,
поэтому стандартные условия:
1. Количество химически чистого вещества 1 моль
2. В растворе С =1 моль / л (1моль / кг растворителя)
3. р =1 атм (101325 Па)
4. Т = 298 К
5. Наиболее устойчивая форма вещества
6. Обозначение и размерность - ΔН°298, Дж/моль
Т ермохимические уравнения
С2Н2 (г) + 2.5О2 (г) = 2 СО2 (г) + Н2О (ж)
ΔН °298 = -1256 кДж/моль
Δ Н > О — эндотермические процессы
Δ Н< О — экзотермические процессы
Стандартные энтальпии образования Обозначение и размерность - Δ Н°298
(вещество, агрегатное состояние) Дж/моль
12.
Для простых веществ Δ Н0298 приняты равными 0Δ Н0298 (О2, газ) = 0 , но
Δ Н0298(О3, газ) = 142.4 кДж /моль
Δ Н0298 (C, графит) =0,
Δ Н0298 (C, алмаз) = 1,83 кДж/моль
Для сложного вещества
Δ Н0298 (С2Н5ОН, ж) = -277 кДж/моль это
стандартная энтальпия реакции образования 1 моль
С2Н5ОН (ж) из простых веществ
2С(графит) + 3Н2 (газ) + 0.5 О2 (газ) = С2Н5ОН(ж)
Величины Δ Н0298 — справочные данные
13.
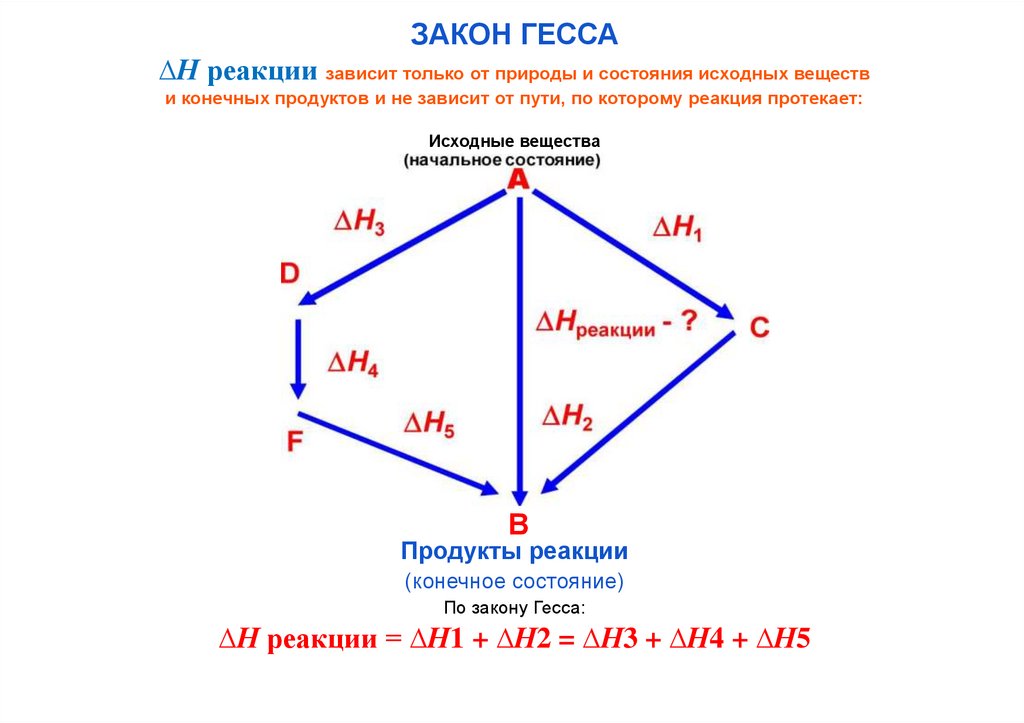
ЗАКОН ГЕССА∆Н реакции зависит только от природы и состояния исходных веществ
и конечных продуктов и не зависит от пути, по которому реакция протекает:
Исходные вещества
В
Продукты реакции
(конечное состояние)
По закону Гесса:
∆Н реакции = ∆Н1 + ∆Н2 = ∆Н3 + ∆Н4 + ∆Н5
14.
I следствие∆H реакции = ∆H(продукты) – ∆H(исходные вещества)
Пример:
2NH3(r) + СО2(г) = CO(NH2)2(TB) + Н2О(г)
∆Н0298
-45.8
-393.8
-333
-242 кДж/мол
∆H реакции = (-333 -242) - [-(2 х 45.8)- 393.8] = -89.6кДж/моль
II следствие
∆H реакции = ∆H (сгорания исходных веществ) - ∆H (сгорания продуктов)
Пример: расчета теплового эффекта с использованием ∆H 0сгорания:
С6Н6(ж) → 3С2Н2(г), ∆H реакции — ?
∆Н0 реакции = ∆Н0 сгорания (С6Н6(ж)) – 3∆Н0сгорания (С2Н2(г)) =
-3268 - (-3x1300) = 632 кДж /моль
∆H сгорания соответствует сгоранию 1 моль вещества в атмосфере О2 при 101.3 кПа с
образованием высших оксидов
Калорийность — энергия, выделяемая при полном окислении (сгорании) 1 г
питательных веществ.
Жиры (9.0-9.5 ккал/г ), белки, углеводы (4.0-4.1 ккал/г )
Справка: 1 калория = 4.18 Дж.
15.
II начало термодинамикиСамопроизвольный процесс совершается в системе без затраты работы извне.
Энтропия S - функция состояния, отражающая смысл II начала
Статистическое толкование энтропии
Энтропия S - мера неупорядоченности расположения частиц в системе. Одно и
то же состояние системы может быть реализовано большим числом
микросостояний. Это число - термодинамическая вероятность w
S = R lnw / NA (Больцман),
где R - газовая постоянная, NA- число Авогадро
Математическая вероятность 0 < W < 1
→∞
Термодинамическая вероятность W
измерить ее невозможно в связи с
неисчерпаемостью материи, поэтому:
термодинамическое определение энтропии - ∆S равно минимальной теплоте,
подведенной к системе в обратимом изотермическом процессе, деленной на
абсолютную Т, при которой осуществляется этот процесс (Клаузиус)
∆S = Qmin/T (Дж/моль *К)
Qmin определяется калориметрически
16.
ПРИМЕР качественной оценки ∆SДля реакции 2NO(r) + О2(г) > 2NO2(r) изменение энтропии ∆S < 0
можно установить качественно, не производя вычислений
Т1 > Т2 S1 > S2
Pi > Р2 Si < S2
S - экстенсивный параметр. Для сложной системы
S > S1 + S2 + S3
III (или нулевое) начало термодинамики (Нернст)
S 0(идеальный кристалл) = 0, поэтому
S 2980(простое в-во) ≠ 0 (справочные данные)
∆S298 реакции = ∆S298 продукты - ∆S298 исх. в-ва
17.
Формулировки II начала термодинамики1. В изолированной системе самопроизвольно совершаются
только такие процессы, при которых S возрастает, т.е. ∆S > 0
2. Для закрытых систем необходимо учитывать 2 фактора,
определяющих направление самопроизвольно протекающих
процессов
Энтальпийный - стремление системы к минимуму энергии за счет
экзотермической реакции
Энтропийный - к увеличению неупорядоченности в расположении
частиц за счет теплового движения, поэтому новая функция
состояния
G = H - TS, где G — энергия Гиббса
Для изобарно-изотермических условий G - функция состояния,
учитывающая энергетику и неупорядоченность системы
∆G 0298 р-ции = ∆G 298 продукты- ∆G 298 исх. в-ва
где ∆G 0 веществ - справочные данные для нестандартных условий
∆G =∆H – T∆S
18.
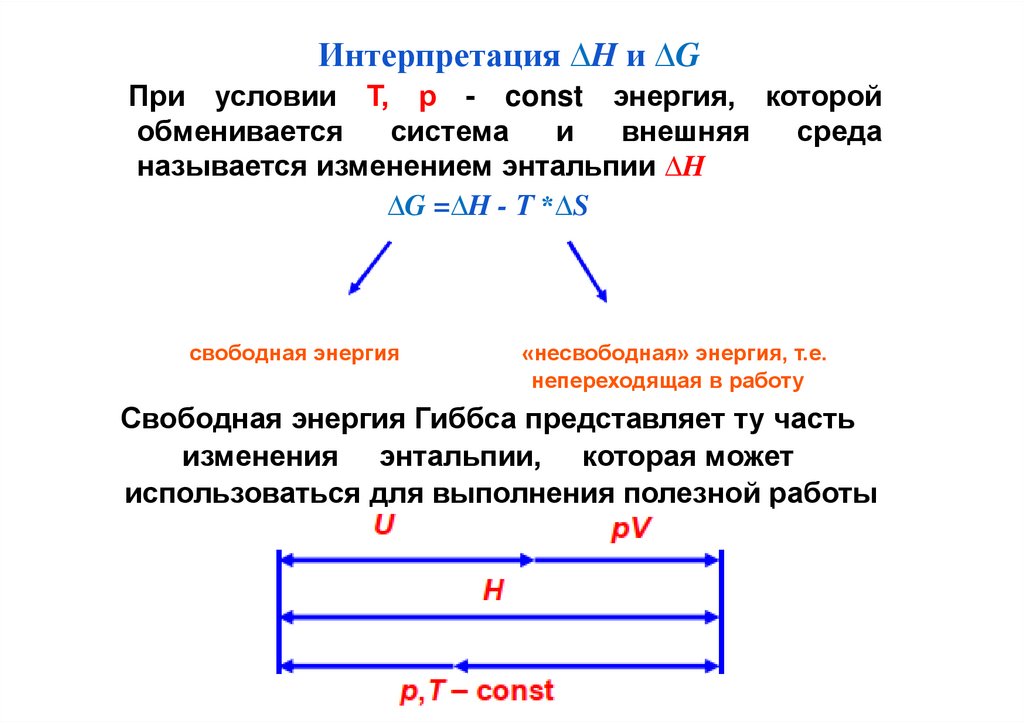
Интерпретация ∆H и ∆GПри условии Т, р - const энергия, которой
обменивается
система
и
внешняя
среда
называется изменением энтальпии ∆H
∆G =∆H - Т *∆S
свободная энергия
«несвободная» энергия, т.е.
непереходящая в работу
Свободная энергия Гиббса представляет ту часть
изменения энтальпии, которая может
использоваться для выполнения полезной работы
19.
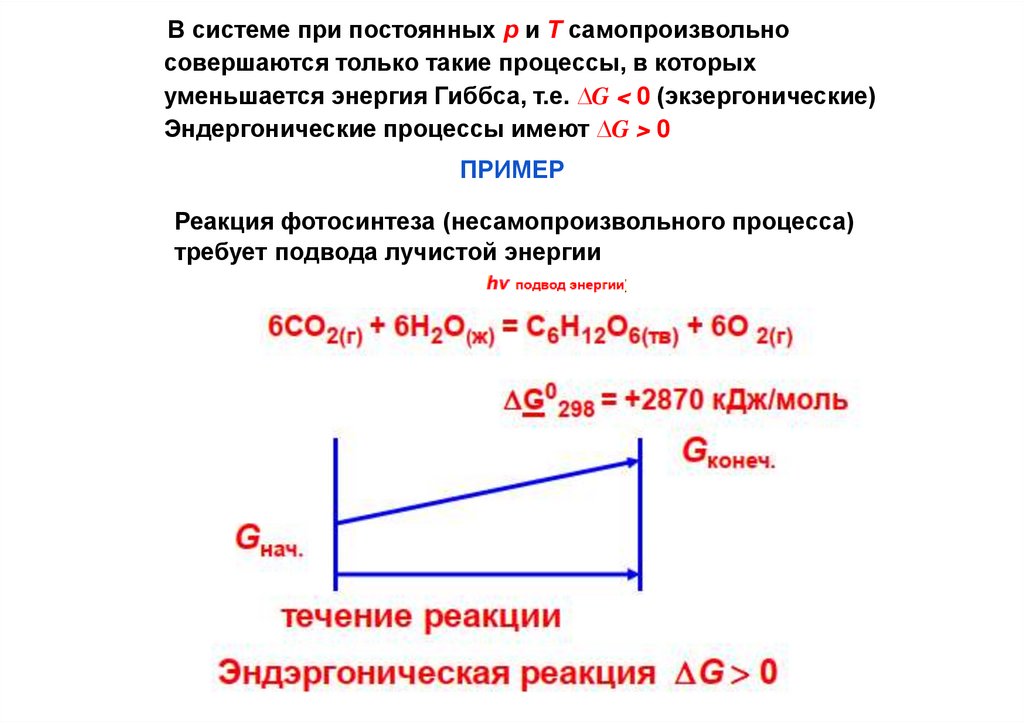
В системе при постоянных р и Т самопроизвольносовершаются только такие процессы, в которых
уменьшается энергия Гиббса, т.е. ∆G < 0 (экзергонические)
Эндергонические процессы имеют ∆G > 0
ПРИМЕР
Реакция фотосинтеза (несамопроизвольного процесса)
требует подвода лучистой энергии
20.
Направление протекания реакций в зависимости отзнаков ∆H и ∆S















 physics
physics chemistry
chemistry








