Similar presentations:
Получение суспензионных культур
1.
Выполнил студент 3 курса, группы 20БТ-3 Евгений Андреевич ШеляговичРуководитель практики
Ирина Анатольевна Ильючик
доцент, кандидат
биологических наук
2.
ВведениеКультивирование клеток и тканей растений — сравнительно молодая
отрасль биотехнологии. По технике приготовления культуры клеток
делятся на :
Однослойные — способные прикрепляться и размножаться на
поверхности лабораторной посуды;
Органные — цельные кусочки органов, сохраняющие жизнеспособность
вне организма;
Суспензионные – это культуры одиночных клеток и клеточных
агрегатов, растущие в аэрируемой жидкой питательной среде.
Представляют собой относительно гомогенную популяцию клеток,
которую легко подвергнуть воздействию химических веществ. Этот
метод применяют для культивирования клеток как растений, так и
животных(клетки крови).
3.
Направление использования клеточныхсуспензий
Клеточные суспензии используют в биотехнологии для получения
вторичных метаболитов, многие из которых являются ценными
лекарственными препаратами; для промышленного выращивания
клеточной биомассы и для клеточной селекции; кроме того,
суспензии клеток используют для получения изолированных
протопластов, а также для получения новых необычных
соединений (например, камптотецина, харрингтонинаантиканцерогены; пептиды).
4.
Преимущества в сравнении с другимиметодами
Клетки в суспензии имеют ряд преимуществ по
сравнению с клетками, выращиваемыми статическим
способом на агаризованной поверхности: клетки
популяции находятся в однородных условиях питания,
аэрация и удаление токсических метаболитов
клеточного окружения; у них легче проследить влияние на
рост и метаболизм различных экзогенных факторов; они
удобнее для биохимических и молекулярнобиологических исследований; на них реальнее
возможность получения стабильной клеточной популяции.
5.
Получение суспензионных культур из клеток растенийСуспензионные культуры получают из рыхлой
каллусной ткани, помещая ее в жидкую
питательную среду того же состава, что и для
каллуса, и выращивают в колбах на качалке (100120 оборотов в минуту). Суспензионную культуру
можно получать и непосредственно из первичного
экспланта (лист, стебель, корень и т. д.). Для
этого применяют ферменты, например пектиназу.
Вначале на поверхности экспланта образуется
каллусная ткань, а затем уже от нее отделяются
клетки и клеточные агрегаты, в результате чего
получается клеточная суспензия. Для некоторых
исследований культуру клеток получают путем
ферментативной
мацерации,например,
из
мезофилла листа, но такую суспензию невозможно
поддерживать в течение длительного времени.
6.
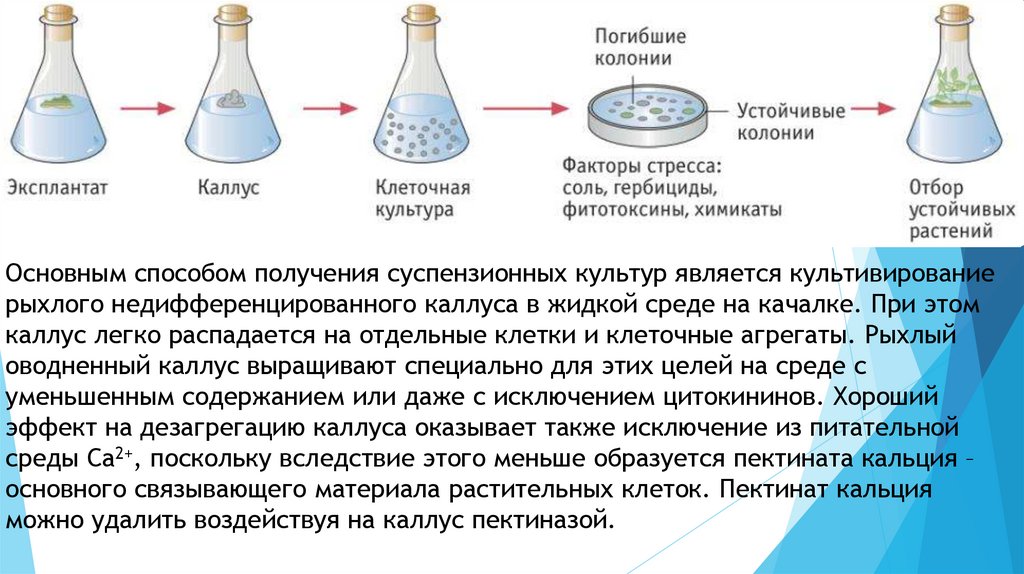
Основным способом получения суспензионных культур является культивированиерыхлого недифференцированного каллуса в жидкой среде на качалке. При этом
каллус легко распадается на отдельные клетки и клеточные агрегаты. Рыхлый
оводненный каллус выращивают специально для этих целей на среде с
уменьшенным содержанием или даже с исключением цитокининов. Хороший
эффект на дезагрегацию каллуса оказывает также исключение из питательной
среды Са2+, поскольку вследствие этого меньше образуется пектината кальция –
основного связывающего материала растительных клеток. Пектинат кальция
можно удалить воздействуя на каллус пектиназой.
7.
Часть каллусной ткани в жидкой средепри ее перемешивании распадается на
клетки и небольшие клеточные
агрегаты, образуя первичную
суспензию. Для избавления от крупных
плотных остатков каллуса, от больших
клеточных агрегатов ее фильтруют
через 1-2 слоя марли, нейлон либо
отбирают одиночные клетки и мелкие
агрегаты путем осаждения крупных
агрегатов при отстаивании суспензии в
течение нескольких минут. Кроме того,
долю одиночных клеток и мелких
агрегатов увеличивают частые пересевы
легких фракций суспензии.
8.
На степень диссоциации клеток оказывает влияние также состав питательнойсреды, способы аэрации и перемешивания суспензии. Несмотря на все усилия,
суспензия никогда не бывает однородной, состоящей только из одиночных клеток.
В лучшем случае последние составляют 50-60 %, остальное приходится на долю
групп из 2-10 клеток и многоклеточ-ные агрегаты. В очень крупных агрегатах
наружные и внутренние слои клеток оказываются в неравноценных условиях
питания и аэрации [5].
9.
Суспензионные культуры клетокживотных(крови)
Клетки крови лучше растут в суспензионной культуре, так как в естественных
условиях они живут во взвешенном состоянии. Для перевода клеток в суспензионную культуру используют различные способы адаптации к их росту в
суспензии.
Одним из способов получения суспензионной культуры является селекция или
система отбора. Способ основан на том, что в среде клеток, растущих в монослое,
существуют клетки способные к росту в суспензии, их отбирают и в процессе
длительной селекции получают клетки, способные расти в суспензии. Так были
получены суспензионные культуры LS из L-929 и НеLа-53 из НеLа.
Другим подходом к получению суспензионных культур является адаптация клеток
к росту в суспензии. Для этого культуры интенсивно пересаживают и
культивируют в суспензии, отбирают клетки, которые адаптированы к росту в
суспензии. Однако всегда существует вероятность возврата клеток к росту в
монослое.
10.
Общая характеристика суспензионных культурклеток животных
Как правило, клетки, отделившиеся от субстрата, на котором они
росли, неспособны к росту в суспензии и быстро деградируют. Но
если некоторые клетки культивировать во вра-щающемся флаконе
(2 об/мин), не дающем возможности прикрепления клеток к
поверхности, в среде, содержащей метилцеллюлозу,
предотвращающую агрегацию клеток, можно получить
жизнеспособные суспензионные клеточные штаммы. Иногда этого
бывает достаточно для получения суспензионной культуры, но
обычно требуются специальные сосуды для культивирования
суспензий и использование среды с дефицитом ионов кальция и
магния. Суспензионные культуры также можно получать путем
обработки отобранной для пересева монослойной клеточной
культуры 0,02 % раствором химопсина в фосфатно-солевом
буфере или 0,1 % трипсином и 0,01 % ЭДТА с последующим
длительным периодом адаптации, сопро-вождающимся
различными манипуляциями, предотвращающими возврат к
монослою.
11.
В заключении хочется отметить, что эта тема является очень перспективной дляфармацевтической промышленности, так как продуктивность культуры тканей
можно регулировать, а значит количество необходимого соединения будет
гарантировано. Кроме того культуры защищены от внешних неблагоприятных
факторов, способных снизить качество сырья. Процесс сбора и обработки такого
сырья значительно упрощается за счёт культивирования только нужной ткани
растения в стерильных условиях. Проблемой является трудоёмкий процесс отбора
необходимой ткани и разработки среды для получения оптимального результата.
12.
Суспензионные культуры лучше растут внутри ограниченногодиапазона концентраций клеток и в том случае, когда сосуд
наполнен средой наполовину. Для обеспечения этих условий
необходимо каждый день или (в случае медленно растущих
культур) через день, удалять половину суспензии через боковое
горлышко и добавлять равный объем свежей среды. Некоторые
клетки (трансформированные и кроветворные клетки, асцитные
опухоли) способны расти как на субстрате, так и в суспензии в
зависимости от солевого состава среды культивирования.
Культуры лимфоцитов не обнаруживают тенденции к адгезии к
поверхности стекла или пластика и выживают на дне
культивационного сосуда под тонким слоем среды.
Суспензионное культивирование первичных и перевиваемых
клеточных линий проводят в роллерных установках, где
создаются благоприятные для клеток условия постоянного
перемешивания жидкой и газовой фаз, общий объем среды при
этом снижается вдвое по сравнению со стационарными
условиями [1].
13.
Получение суспензионной культурымикроорганизмов
Для приготовления суспензии используют суточную
бульонную или агаровую культуру исследуемых
микроорганизмов. Для получения бульонной культуры
отбирают одну или несколько четко изолированных
колоний, легким прикосновением петли к центру колонии
переносят незначительное количество материала в
пробирку с 4-5 мл жидкой неселективной среды, например
МПБ. Инкубируют при 37 °С.
Для приготовления суспензии из агаровых культур можно
использовать только четко изолированные колонии,
выросшие на неселективных питательных средах.
14.
СПАСИБО ЗА ВНИМАНИЕ15.
Список литературы1.
Блажевич О.В. Культивирование клеток. Курс лекций/Мн.: БГУ, 2004. — 78 с
2.
Биотехнология растений: культура клеток. М. : Агропромиздат, 1989. 280 с. Бутенко, Р.Г. Биология клеток
высших растений in vitro и биотехнологии на их основе: учеб. пособие / Р.Г. Бутенко. М. : ФБК–ПРЕСС,
1999. 160 с.
3.
Бутенко Р.Г. Биология культивируемых клеток и биотехнология растений. М.: Наука, 1991. 280 с.
4.
Бутенко Р.Г. Клеточные технологии для получения экономически важных веществ растительного
происхождения. М.: 1996. с.3-20.
5.
Валиханова, Г.Ж. Биотехнология растений / Г.Ж. Валиханова. Алматы : «Конжык», 1996. 272 с.
6.
Войнов Н. А. Современные проблемы и методы биотехнологии: электрон. учеб. пособие / Н. А. Войнов, Т.
Г. Волова, Н. В. Зобова и др. ; под науч. ред. Т. Г. Воловой. – Красноярск: ИПК СФУ, 2009.














 biology
biology








