Similar presentations:
Система гемостаза
1.
2.
Система гемостаза – биологическая система, обеспечивающая, содной стороны, сохранение жидкого состояния крови, а с другой –
предупреждение и остановку кровотечений путем поддержания
целостности стенок кровеносных сосудов.
Основные структурно-функциональные компоненты:
1. стенки кровеносных сосудов (в особенности – интима);
2. клетки крови
3. плазменные ферментные системы (свертывающая,
противосвертывающая, фибринолитическая и др.).
Системе гемостаза присущи способность самостоятельного
наращивания тромботического потенциала и способность к
самоограничению.
Большое количество компонентов, составляющих систему
гемостаза, множество ее звеньев, дают возможность тонко управлять
системой механизмами положительной и отрицательной обратной
связи.
3.
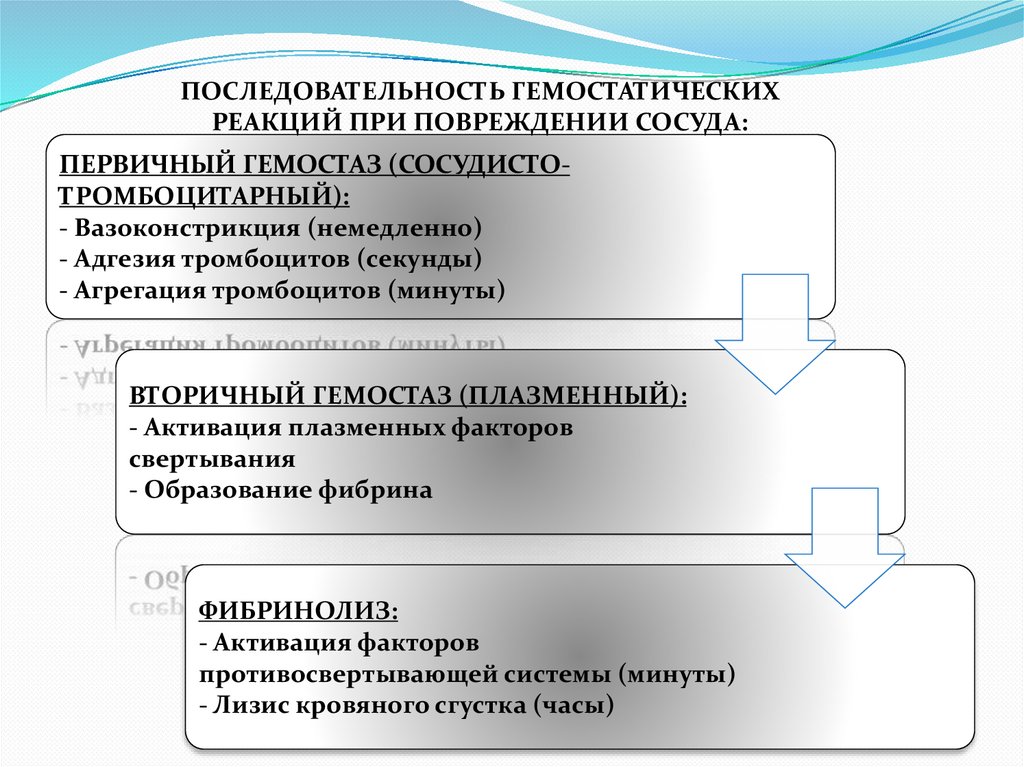
ПОСЛЕДОВАТЕЛЬНОСТЬ ГЕМОСТАТИЧЕСКИХРЕАКЦИЙ ПРИ ПОВРЕЖДЕНИИ СОСУДА:
ПЕРВИЧНЫЙ ГЕМОСТАЗ (СОСУДИСТОТРОМБОЦИТАРНЫЙ):
- Вазоконстрикция (немедленно)
- Адгезия тромбоцитов (секунды)
- Агрегация тромбоцитов (минуты)
ВТОРИЧНЫЙ ГЕМОСТАЗ (ПЛАЗМЕННЫЙ):
- Активация плазменных факторов
свертывания
- Образование фибрина
ФИБРИНОЛИЗ:
- Активация факторов
противосвертывающей системы (минуты)
- Лизис кровяного сгустка (часы)
4.
Каскадно-матричная теория свертывания кровиВ 1876 г. русский физиолог Александр Александрович Шмидт
опубликовал ферментативную теорию свертывания крови, которая
до сих пор является основой современного представления о данном
процессе.
В современном виде ферментативный каскад свертывания в своей
работе представил английский гематолог Robert Gwyn Macfarlane
(An enzyme cascade in the blood clotting mechanism, and its function as
a biochemical amplifier. Nature, London, 1964).
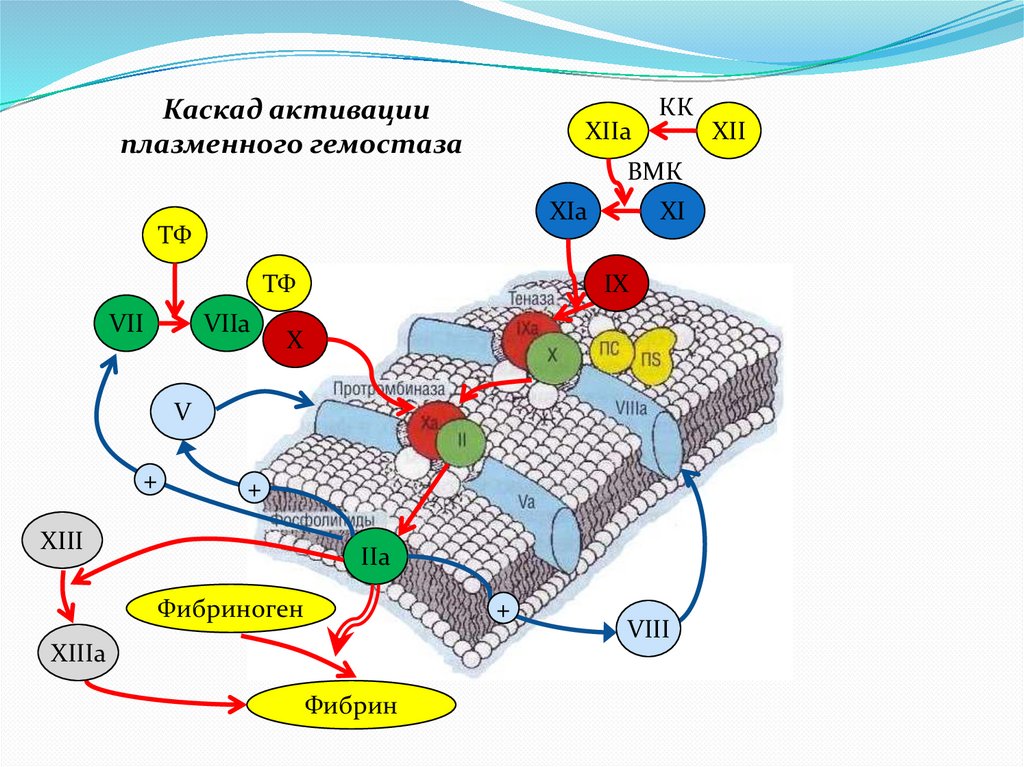
Теория ферментативного каскада заключается в последовательной
активации плазменных факторов свертывания.
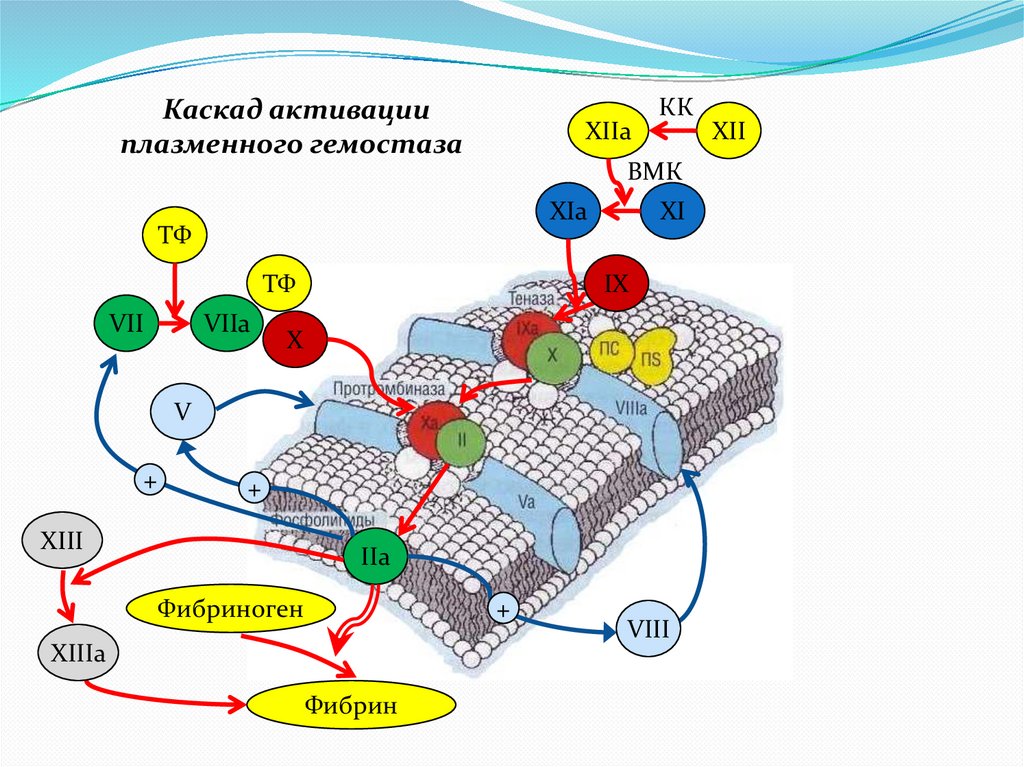
5.
Каскад активацииплазменного гемостаза
XIIa
КК
ВМК
XIa
ТФ
ТФ
VII
VIIa
XI
IX
X
V
+
+
XIII
IIa
+
Фибриноген
XIIIa
Фибрин
VIII
XII
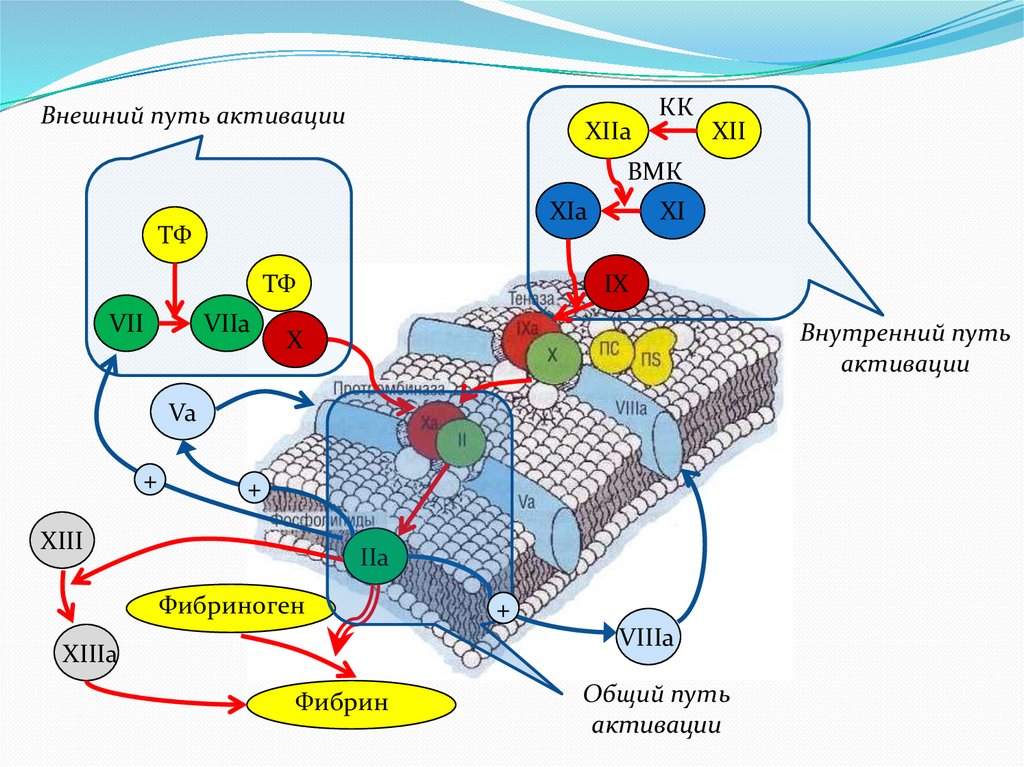
6.
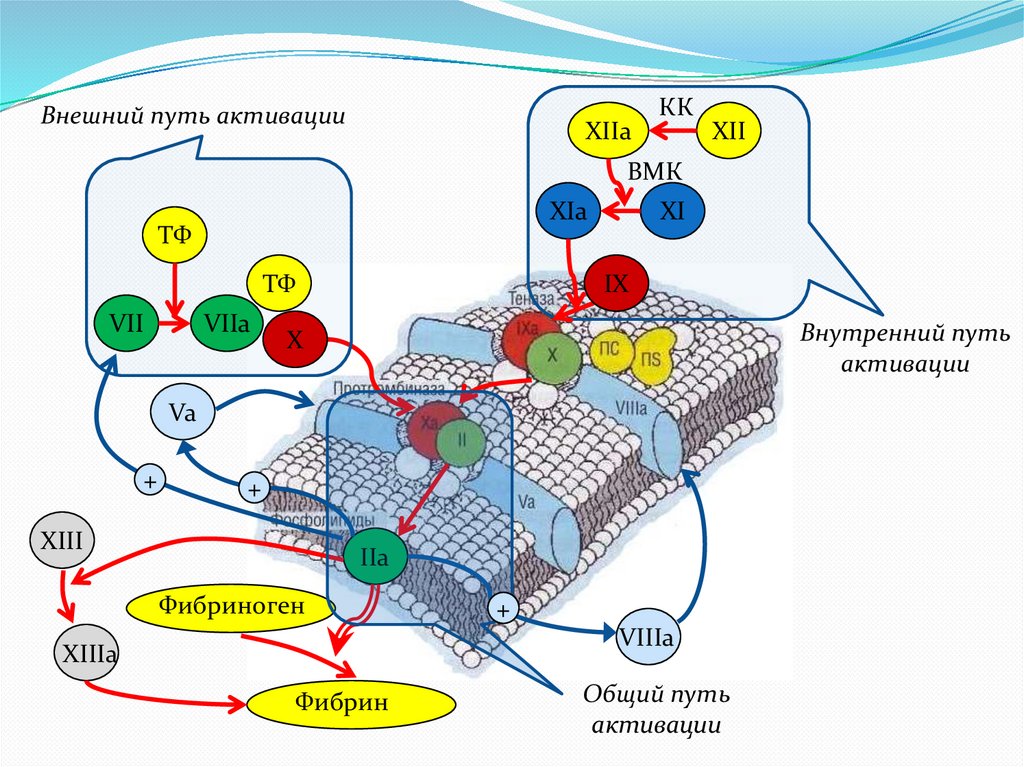
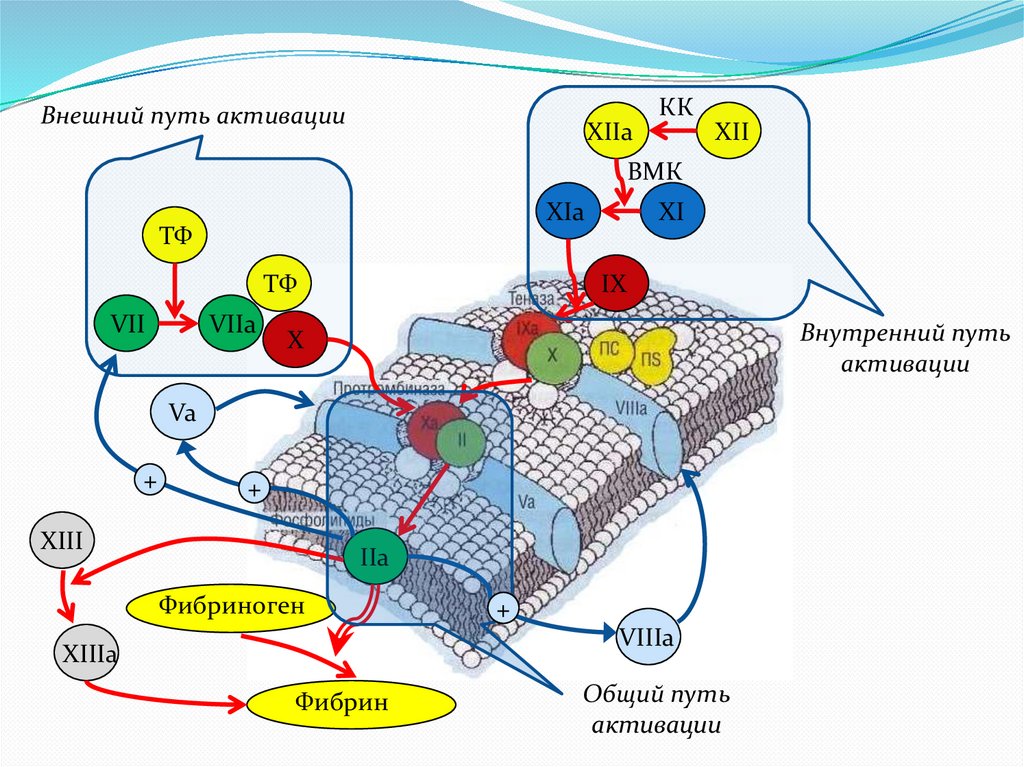
Внешний путь активацииXIIa
КК
XII
ВМК
XIa
ТФ
ТФ
VII
VIIa
XI
IX
Внутренний путь
активации
X
Va
+
+
XIII
IIa
Фибриноген
+
VIIIa
XIIIa
Фибрин
Общий путь
активации
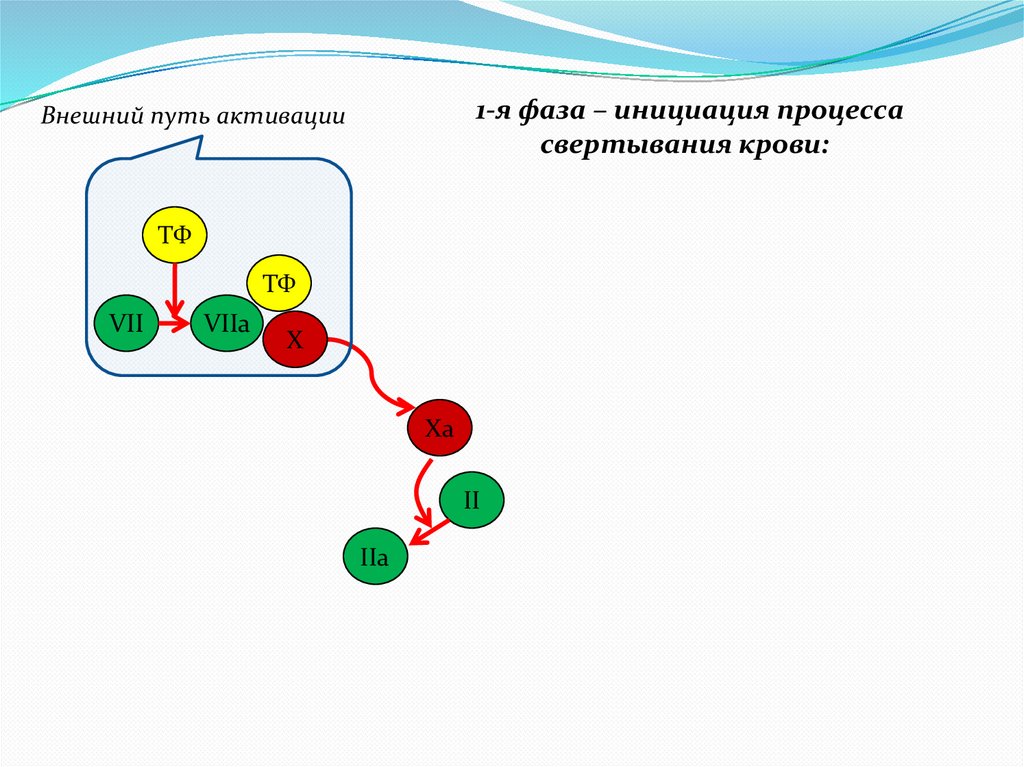
7.
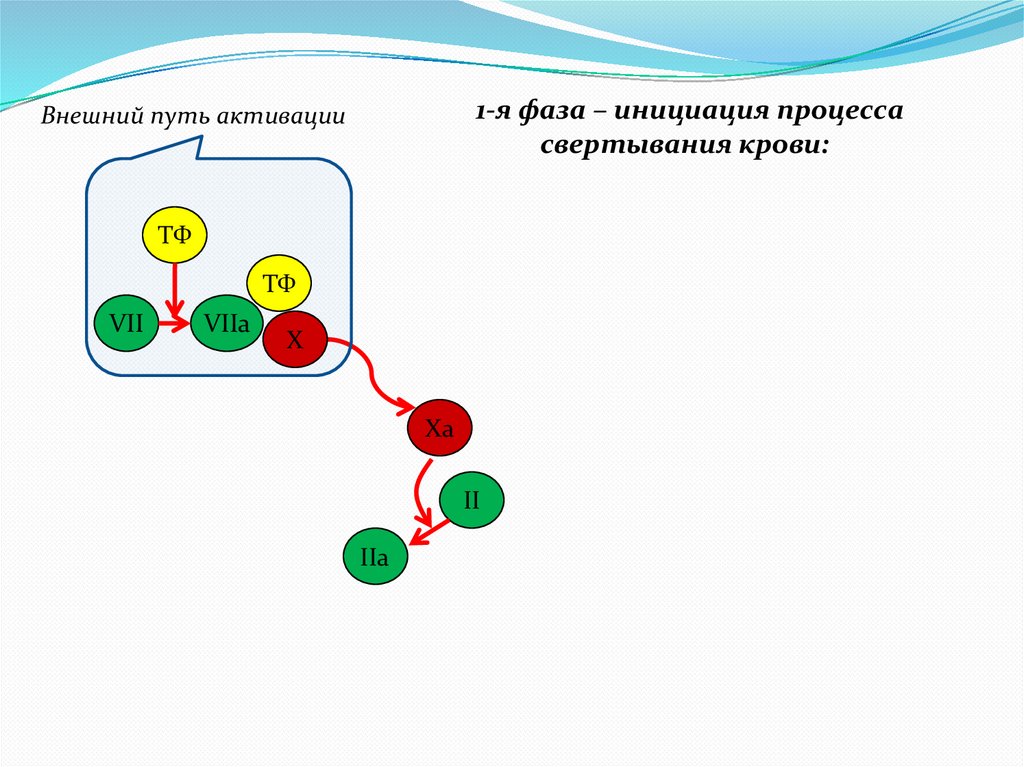
1-я фаза – инициация процессасвертывания крови:
Внешний путь активации
ТФ
ТФ
VII
VIIa
X
Xa
II
IIa
8.
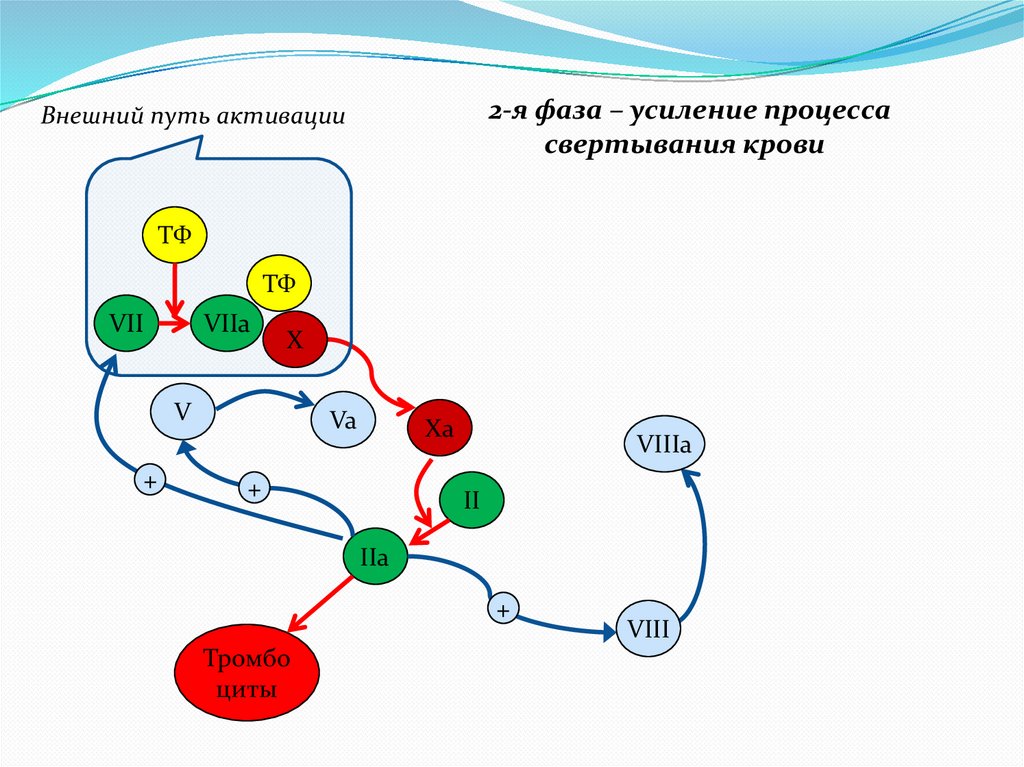
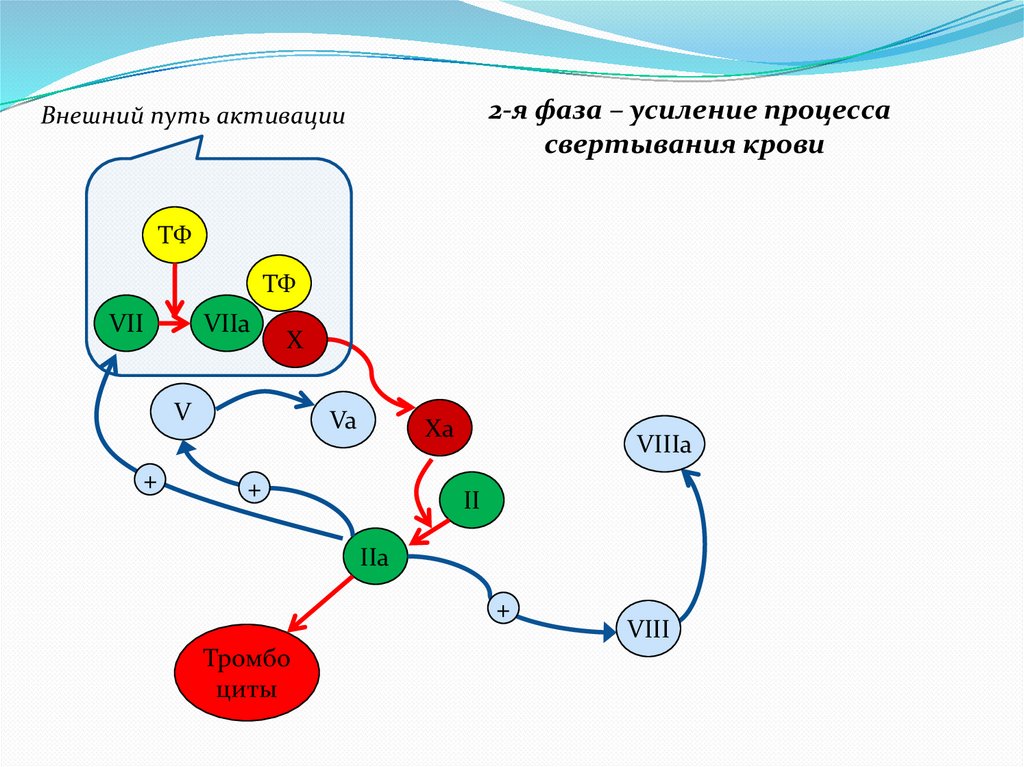
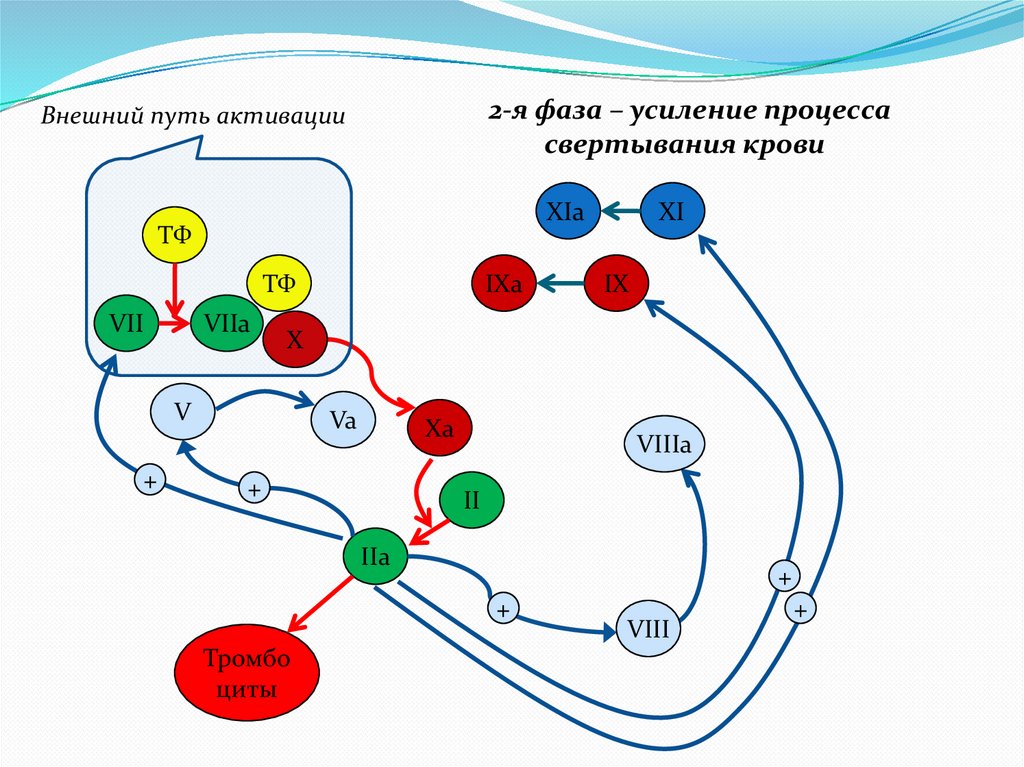
2-я фаза – усиление процессасвертывания крови
Внешний путь активации
ТФ
ТФ
VII
VIIa
X
V
+
Va
Xa
+
VIIIa
II
IIa
+
Тромбо
циты
VIII
9.
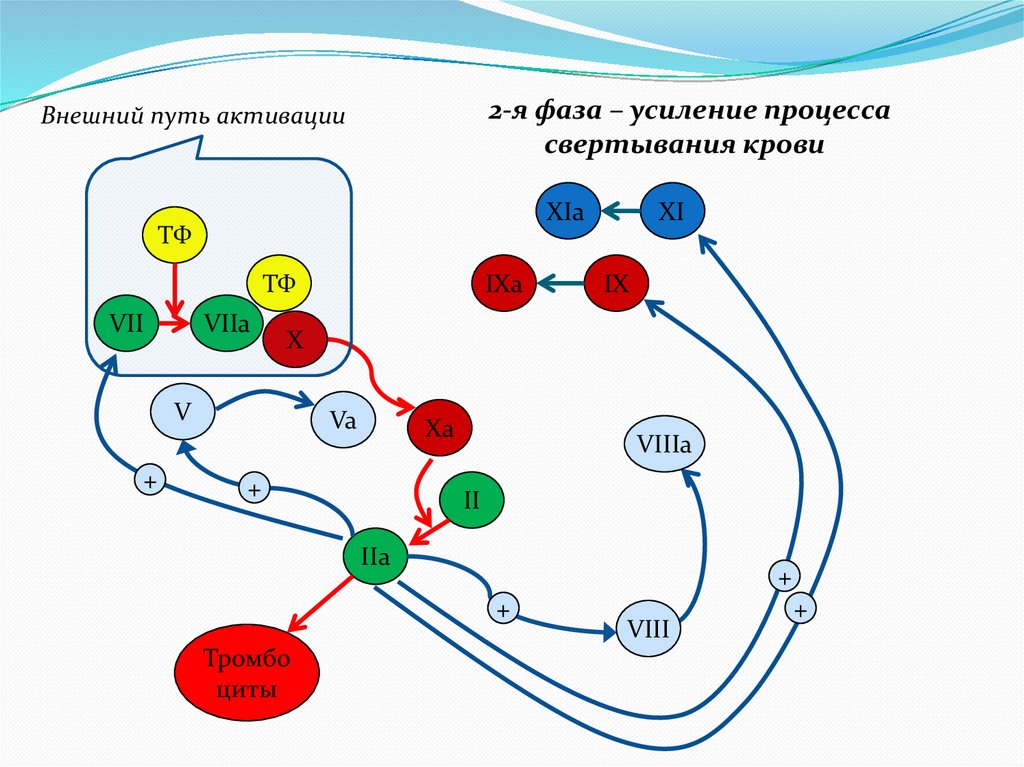
2-я фаза – усиление процессасвертывания крови
Внешний путь активации
XIa
ТФ
ТФ
VII
VIIa
IX
X
V
+
IXa
XI
Va
Xa
+
VIIIa
II
IIa
+
+
Тромбо
циты
VIII
+
10.
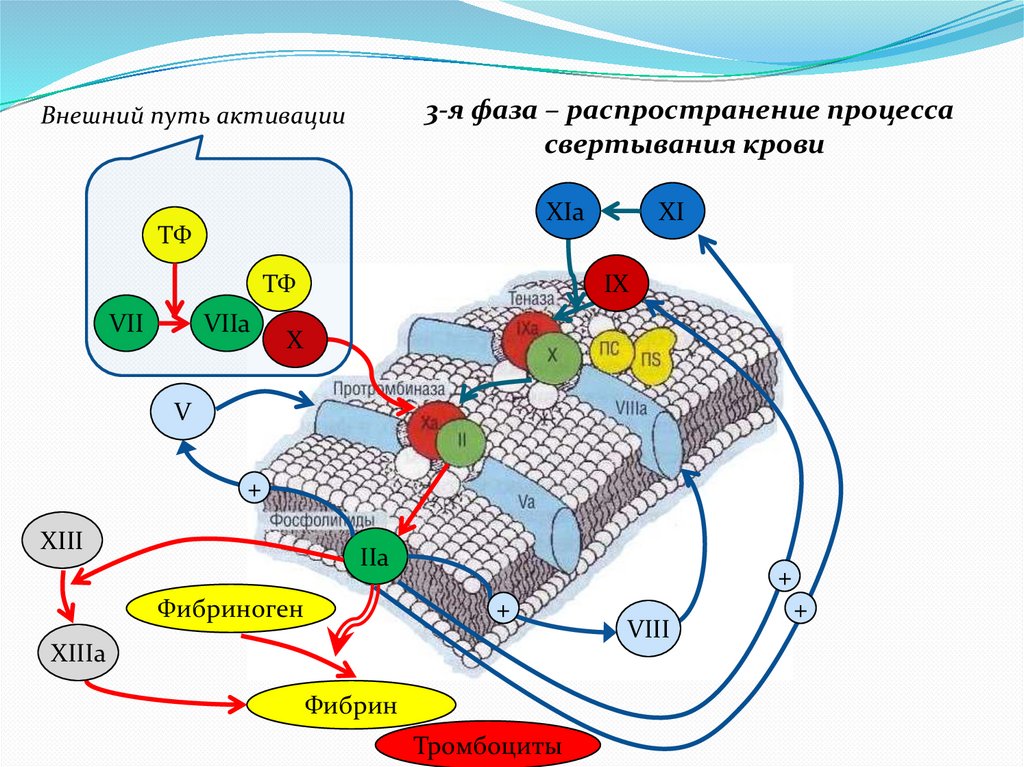
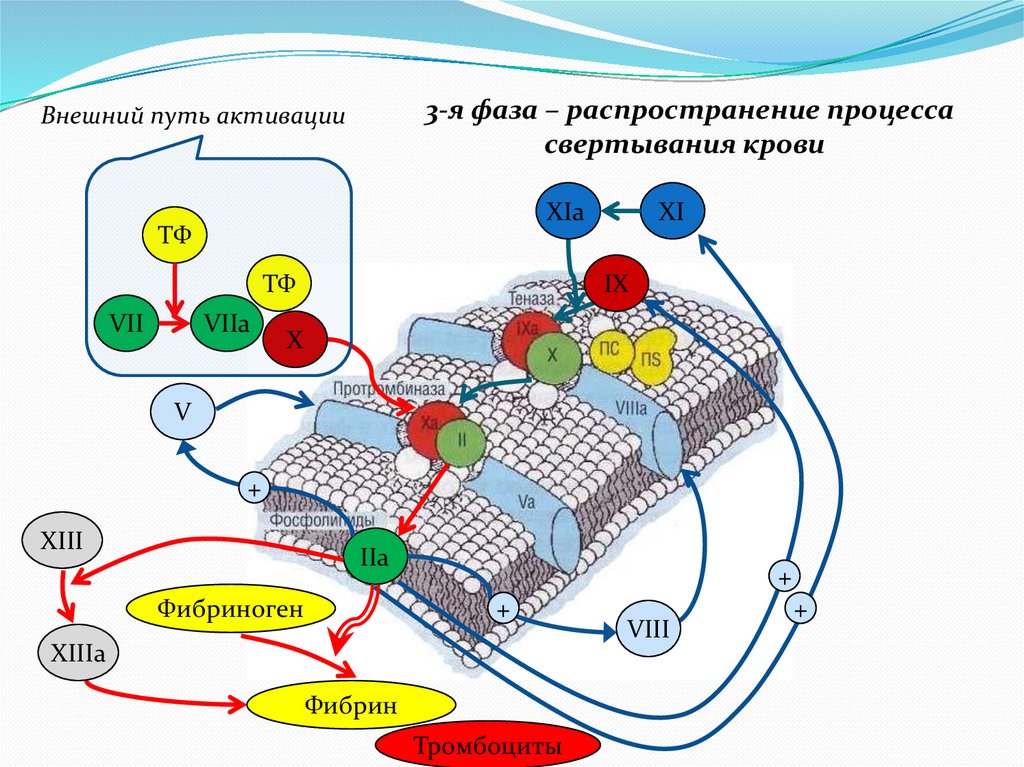
3-я фаза – распространение процессасвертывания крови
Внешний путь активации
XIa
ТФ
ТФ
VII
VIIa
XI
IX
X
V
+
XIII
IIa
+
+
Фибриноген
XIIIa
Фибрин
Тромбоциты
VIII
+
11.
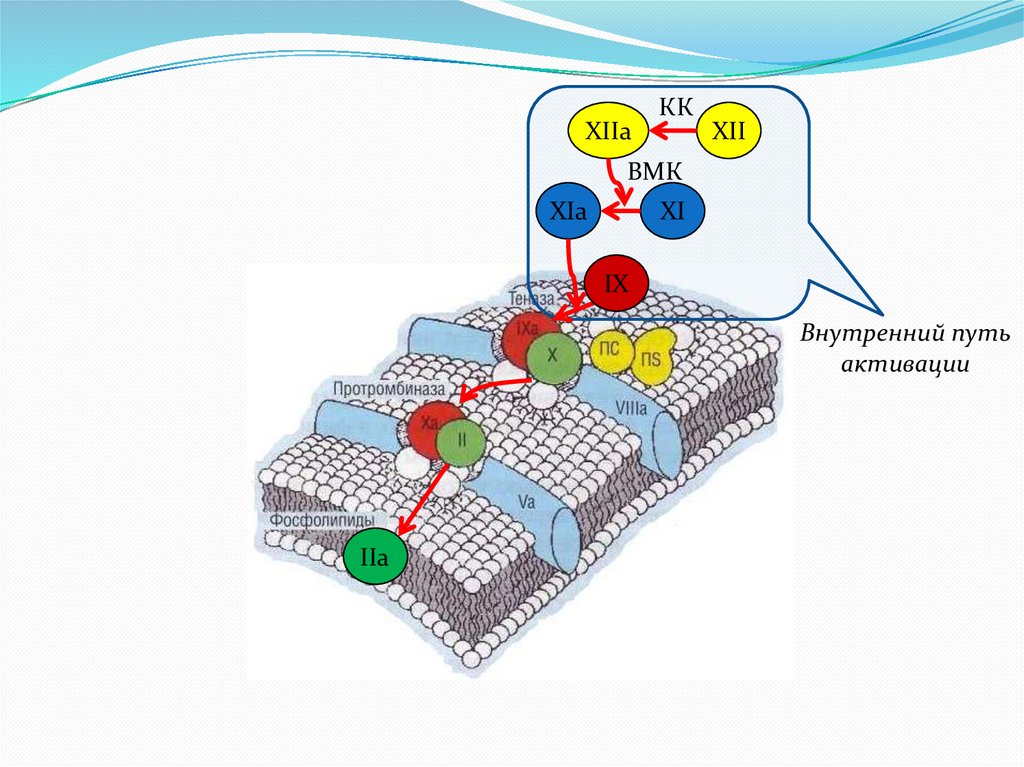
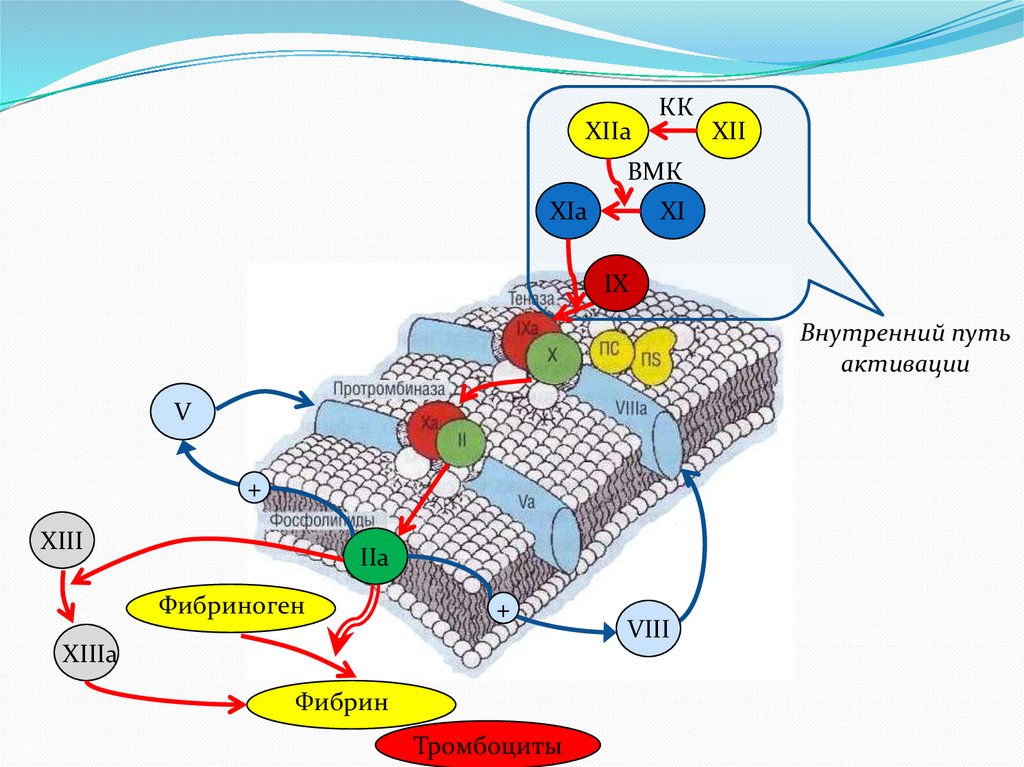
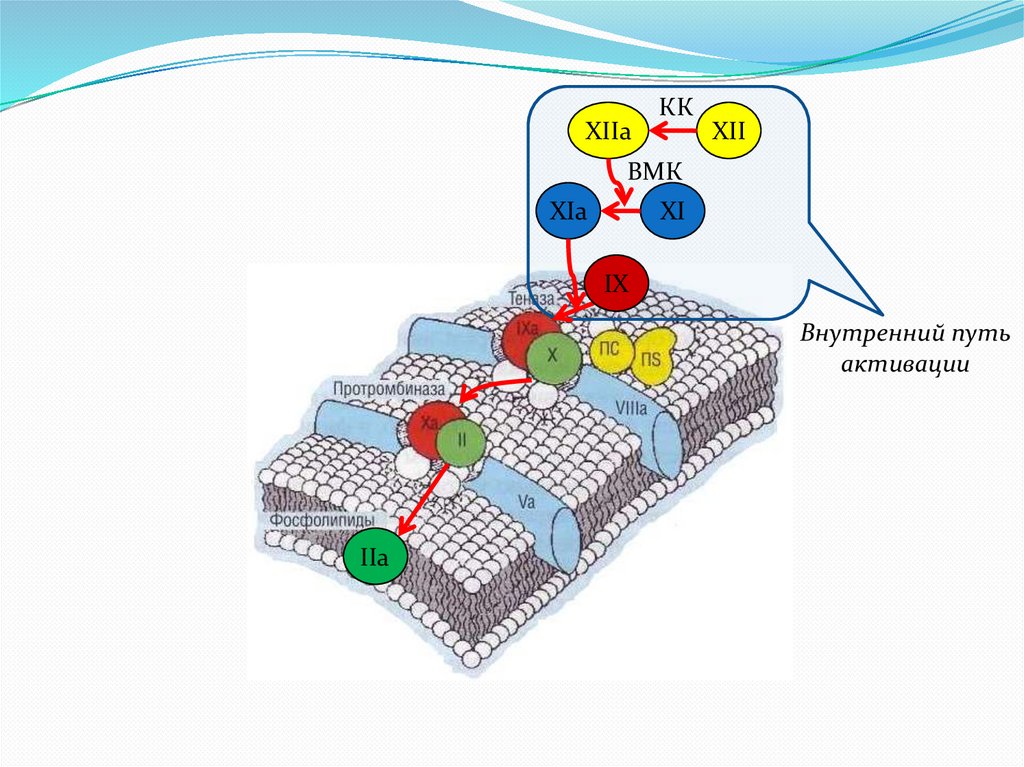
XIIaКК
XII
ВМК
XIa
XI
IX
Внутренний путь
активации
IIa
12.
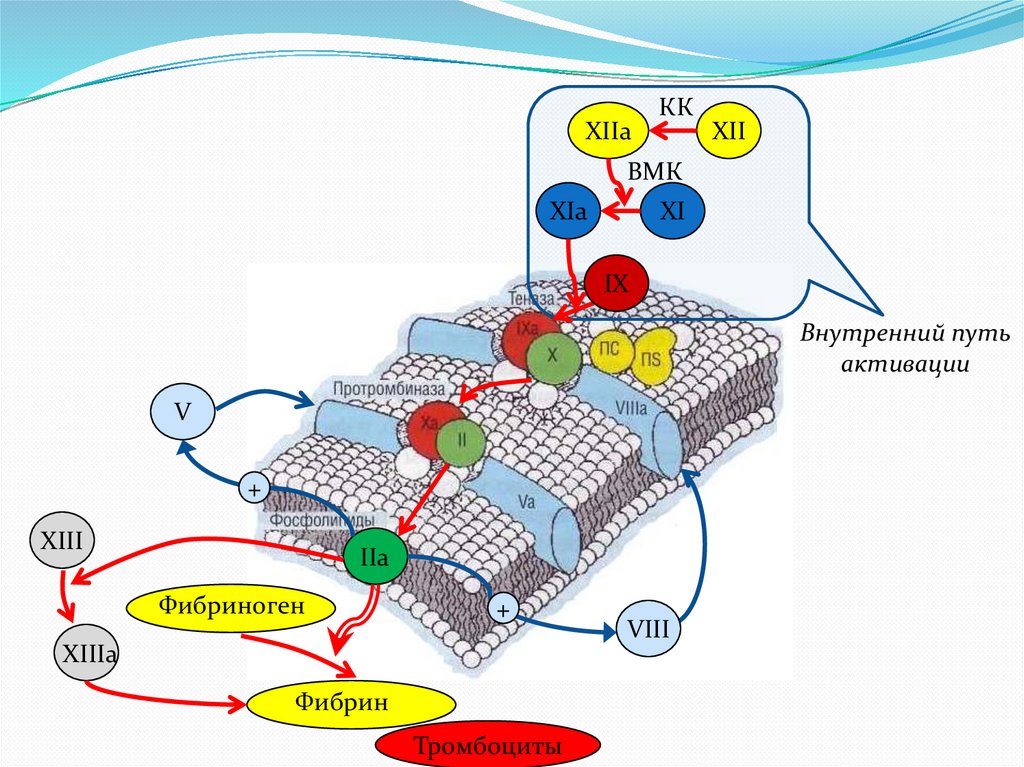
XIIaКК
XII
ВМК
XIa
XI
IX
Внутренний путь
активации
V
+
XIII
IIa
Фибриноген
+
XIIIa
Фибрин
Тромбоциты
VIII
13.
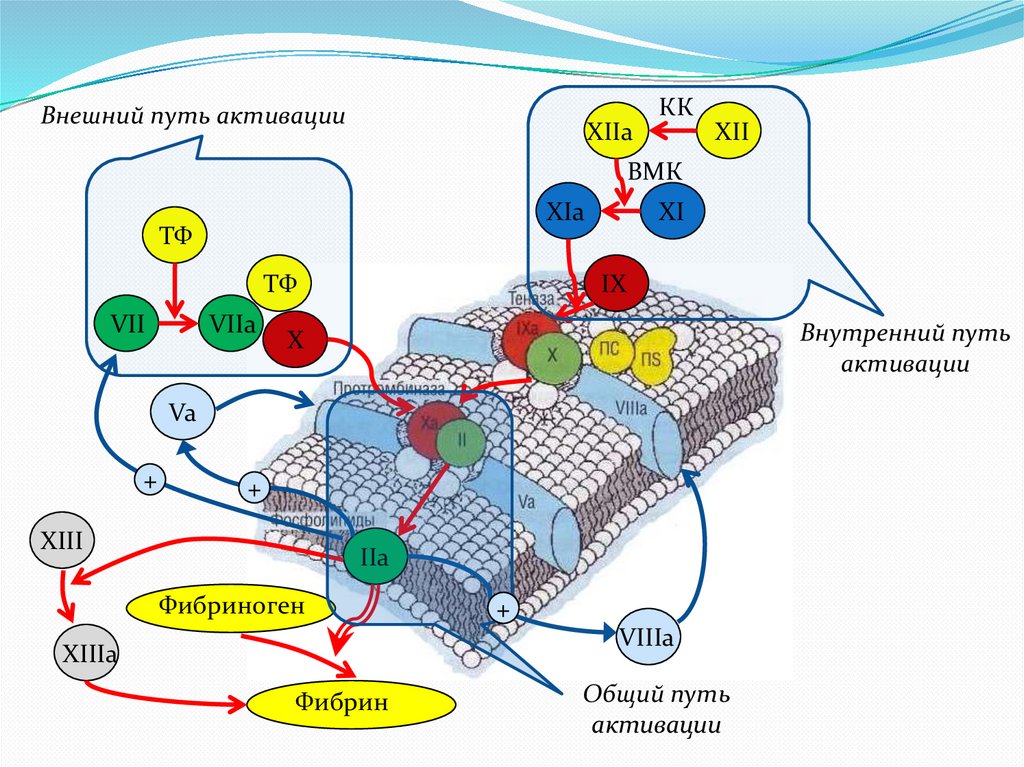
Внешний путь активацииXIIa
КК
XII
ВМК
XIa
ТФ
ТФ
VII
VIIa
XI
IX
Внутренний путь
активации
X
Va
+
+
XIII
IIa
Фибриноген
+
VIIIa
XIIIa
Фибрин
Общий путь
активации
14.
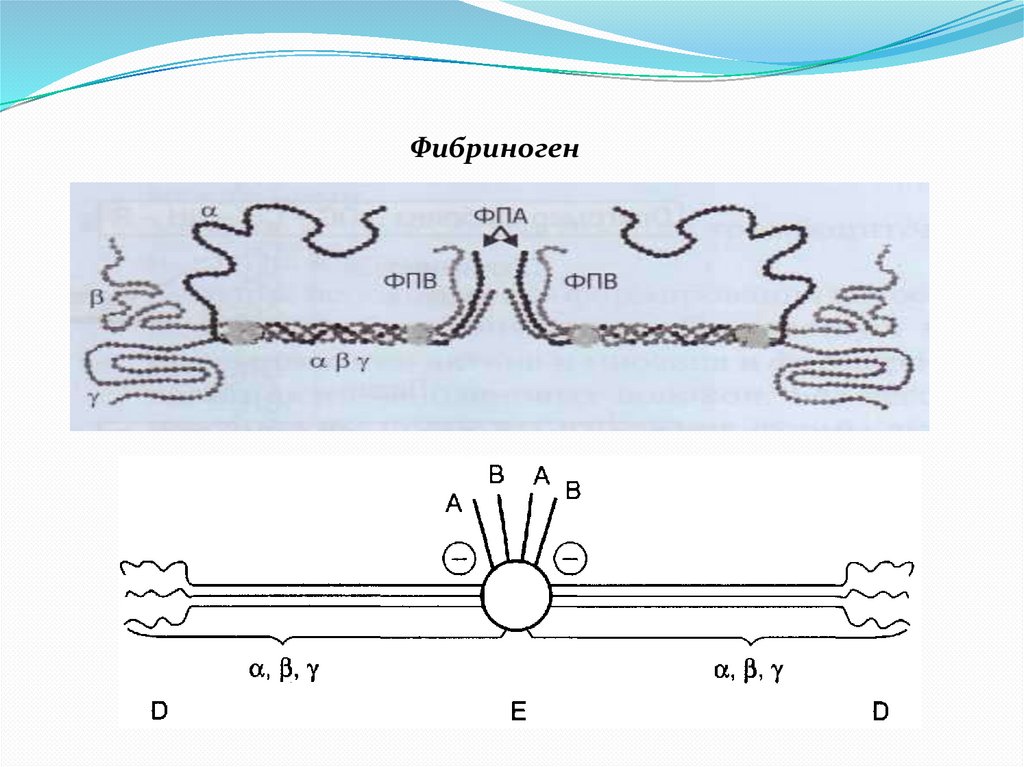
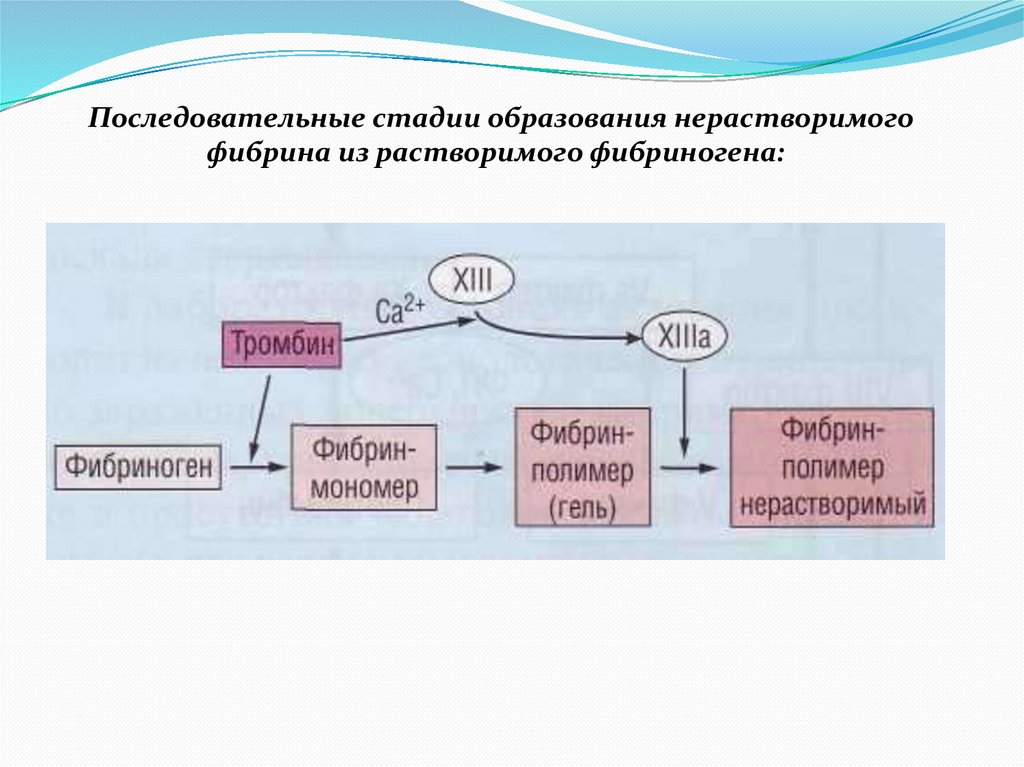
Фибриноген15.
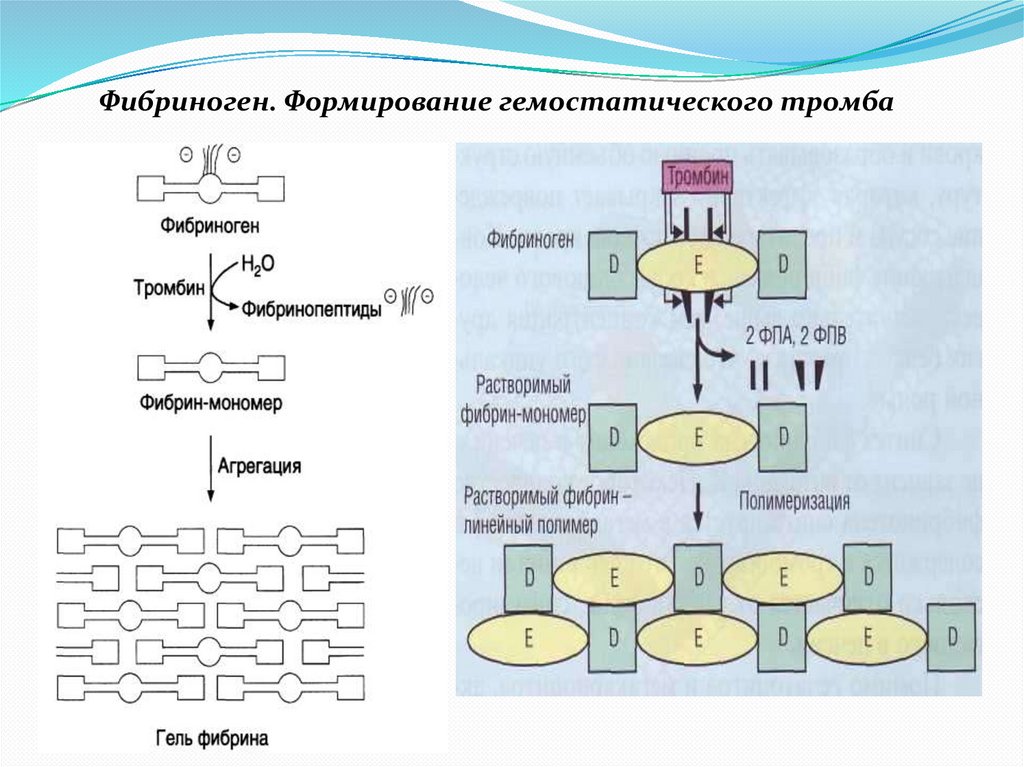
Фибриноген. Формирование гемостатического тромба16.
Последовательные стадии образования нерастворимогофибрина из растворимого фибриногена:
17.
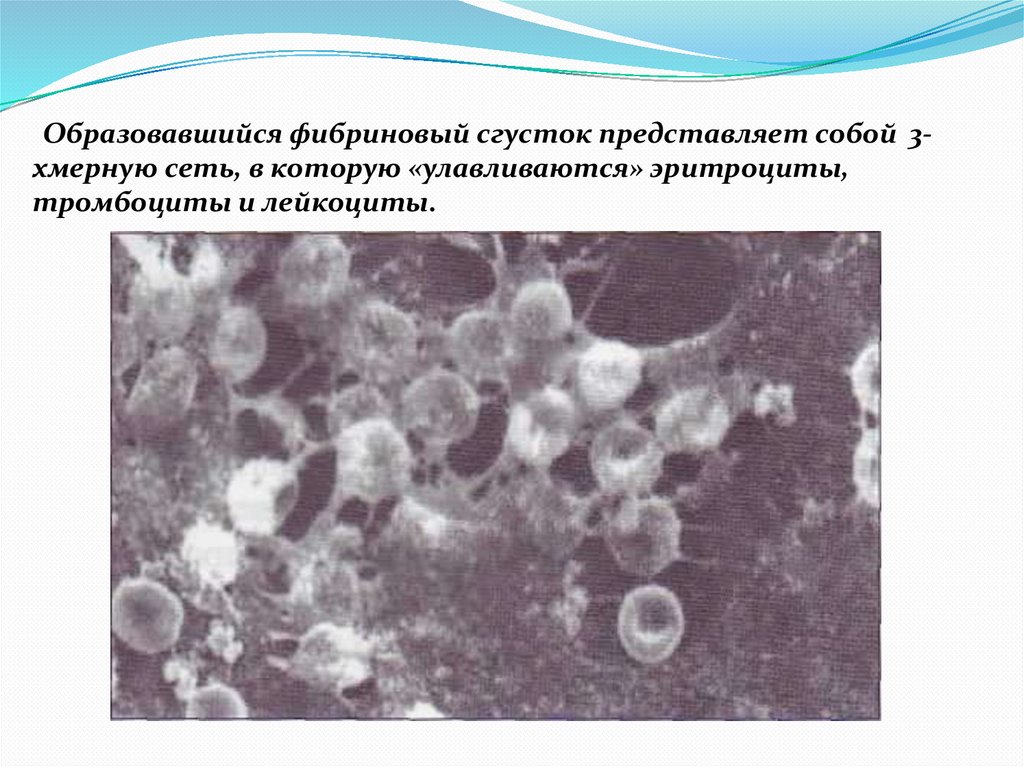
Образовавшийся фибриновый сгусток представляет собой 3хмерную сеть, в которую «улавливаются» эритроциты,тромбоциты и лейкоциты.
18.
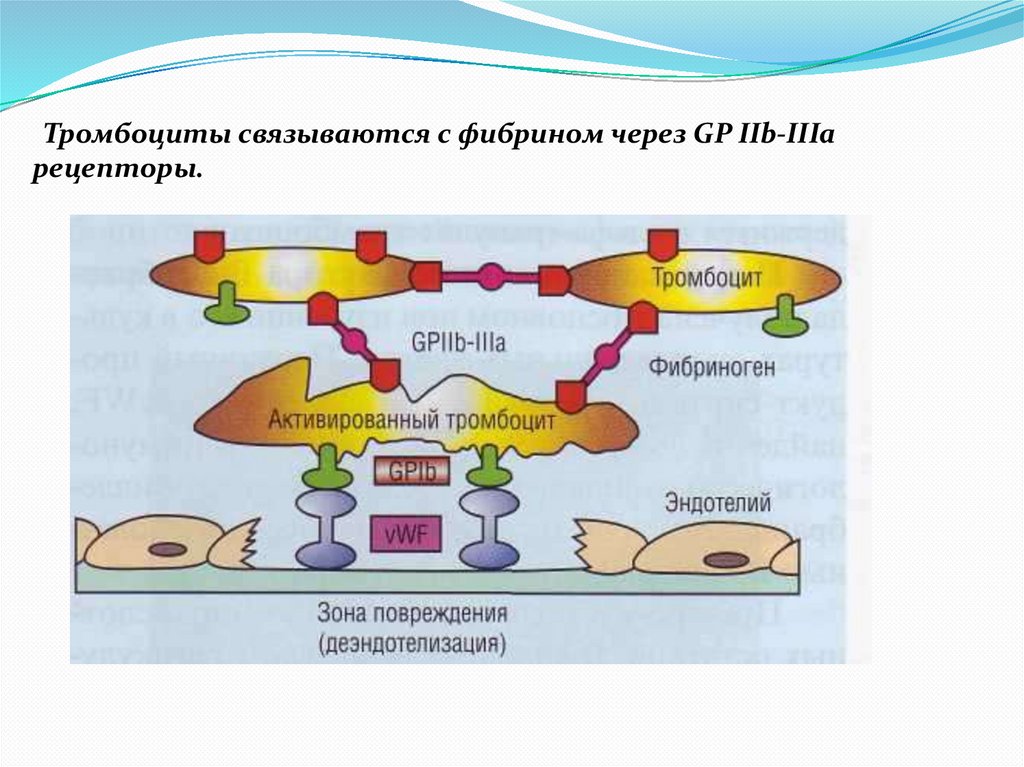
Тромбоциты связываются с фибрином через GP IIb-IIIaрецепторы.
19.
Тромбоциты, заключенные в тромб, активируются исокращаются под действием ТРОМБОСТЕНИНА
(тромбоцитарный актомиозин) – происходит РЕТРАКЦИЯ
СГУСТКА. Окончательный тромб формируется на 10-15
минуте.
Отсутствие ретракции сгустка – причина формирования рыхлого
тромба, который быстро лизируется, или отрывается и уносится током
крови (тромбоэмболия).
20.
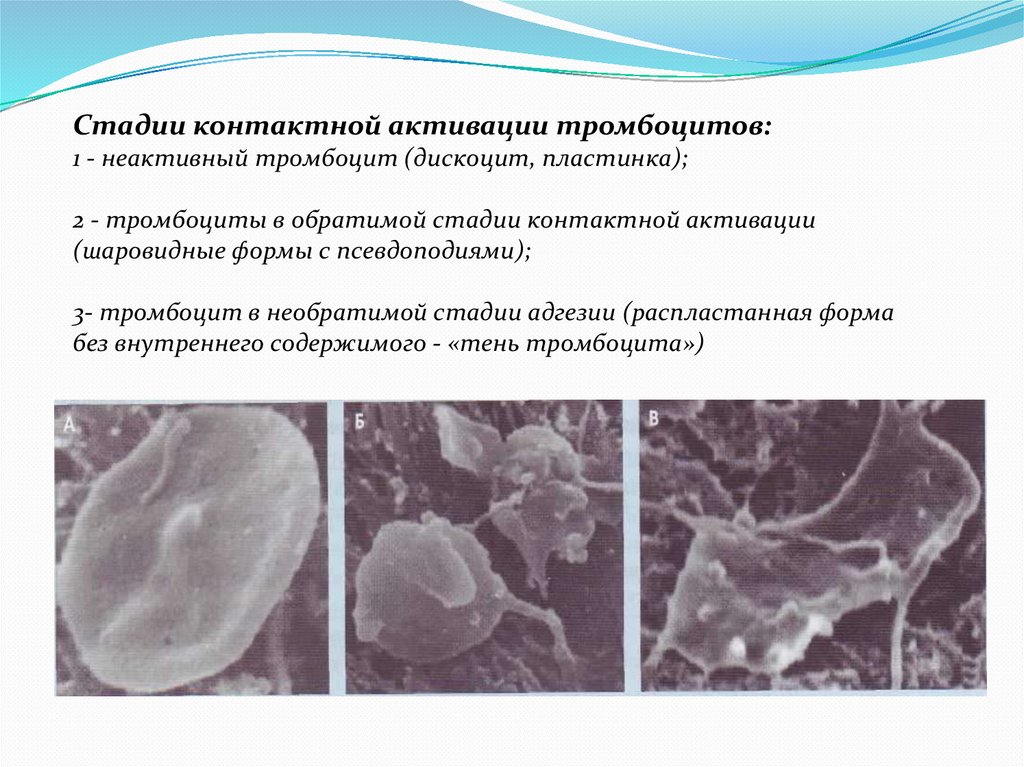
Стадии контактной активации тромбоцитов:1 - неактивный тромбоцит (дискоцит, пластинка);
2 - тромбоциты в обратимой стадии контактной активации
(шаровидные формы с псевдоподиями);
3- тромбоцит в необратимой стадии адгезии (распластанная форма
без внутреннего содержимого - «тень тромбоцита»)
21.
АНТИКОАГУЛЯНТНАЯ СИСТЕМА1. Система Гепарин-АТ III;
2. Система Протеина С (ПС + ПS);
3. Тромбомодулин;
4. Ингибитор пути ТФ (внешнего пути, TFPI);
5. Кофактор гепарина II;
6. α2-макроглобулин (неспецифический ингибитор
протеаз);
22.
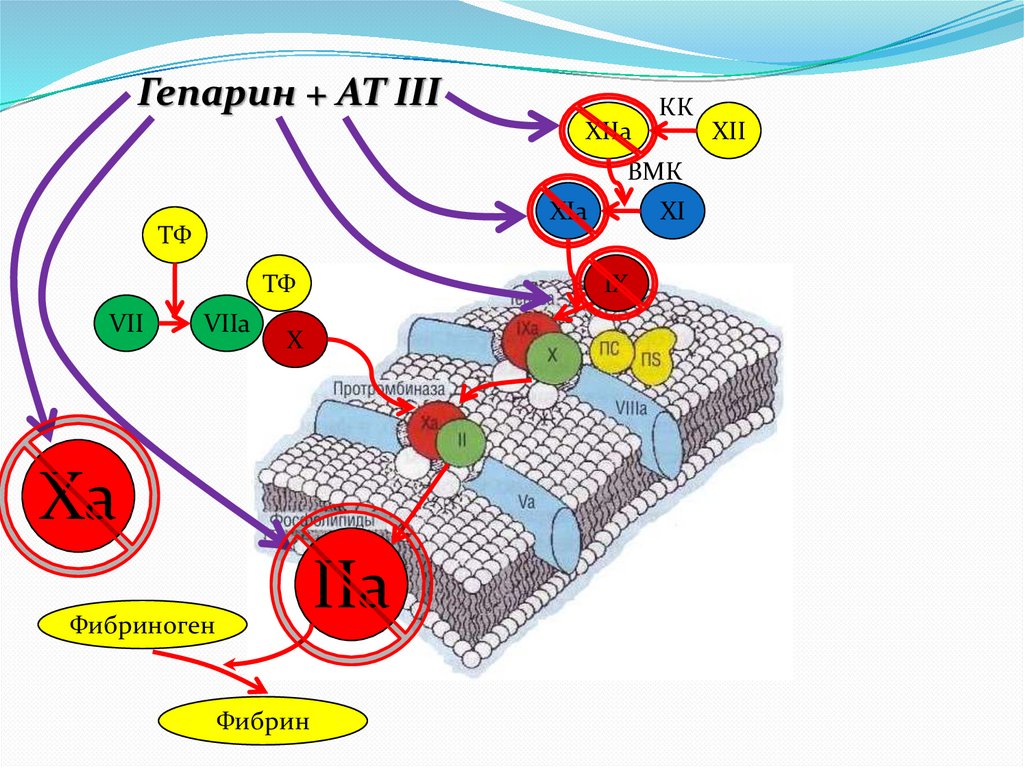
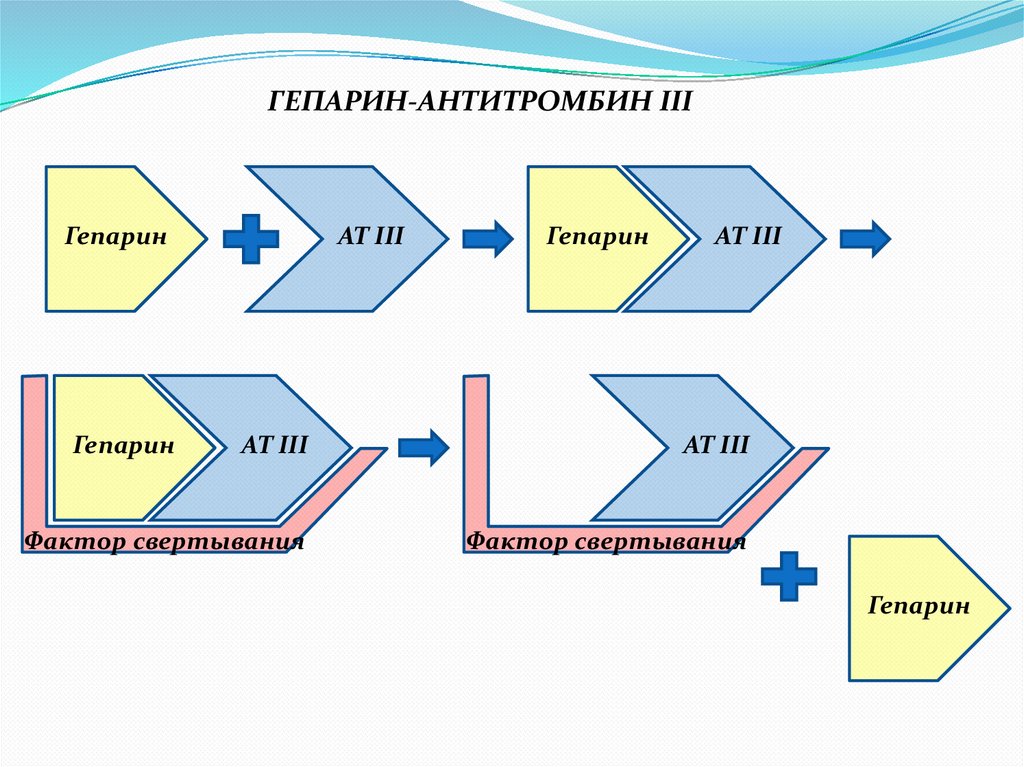
ГЕПАРИН-АНТИТРОМБИН III- гликопротеин, синтезируемый печенью.
- наиболее значимый ингибитор системы свертывания, при
снижении его активности в плазме ниже 60% возрастает риск
тромбозов.
- ингибирует Тромбин, Ф. Xa, IХa, XIa, XIIa и калликреин.
- функционирует в токе крови, в составе протромбиназного
комплекса (на ФЛ-поверхности) Ф.Ха защищен от действия АТ III.
- активность АТ III в десятки тысяч раз возрастает в
присутствии гепарансульфата эндотелия, гепарина тучных
клеток, или экзогенного гепарина.
23.
Гепарин + АТ IIIXIIa
КК
ВМК
XIa
ТФ
ТФ
VII
VIIa
IX
X
Хa
IIa
Фибриноген
Фибрин
XI
XII
24.
ГЕПАРИН-АНТИТРОМБИН IIIГепарин
Гепарин
АТ III
Гепарин
АТ III
АТ III
АТ III
Фактор свертывания
Фактор свертывания
Гепарин
25.
СИСТЕМА ПРОТЕИН С + ПРОТЕИН S- витамин-К-зависимые белки плазмы;
- протеин С – ингибитор активных Ф.Va и VIIIa, протеин S – его
кофактор;
- дефицит протеина С приводит к тромбозам;
На заметку:
- о важности Протеина С, как антикоагулянта, свидетельствует тот факт,
что не описано ни одного пациента с гомозиготным дефицитом протеина С,
т.к. это состояние, по видимому, не совместимо с жизнью;
- система Протеина С частично угнетается при тяжелых воспалительных
реакциях (в особенности, при грамм «-» сепсисе). Этим объясняется
наблюдающееся при грамнегативном сепсисе состояние гиперкоагуляции.
26.
Деградация активных факторов Va и VIIIa активированнымпротеином С (АПС), Транспортный С4-связывающий протеин (С4-СП)
доставляет протеин S (ПS), участвующий как кофактор в
формировании комплексов на фосфолипидной мембране:
27.
ТРОМБОМОДУЛИН- мембранный белок на поверхности эндотелия;
- связываясь с Тромбином, меняет «направленность» его
действия: комплекс Тромбин-Тромбомодулин активирует
Протеин С;
- отсутствует в свободном токе крови. Определение ТМ в крови
свидетельствует о повреждении эндотелия (СКВ, ДВС-синдром,
ОРДС, ТЭЛА, после ангиопластики и др.)
28.
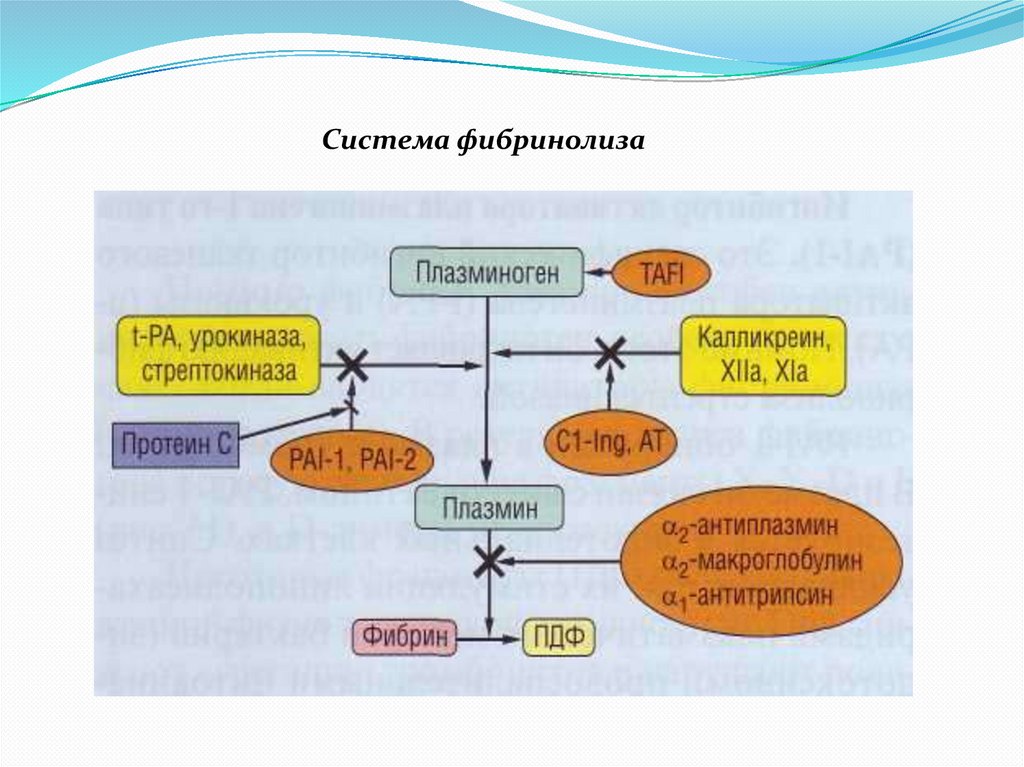
СИСТЕМА ФИБРИНОЛИЗАПЛАЗМИНОГЕН (Фибринолизин) – протеолитический фермент,
основной компонент системы фибринолиза.
Активаторы плазминогена (основные)– тканевый активатор (tPA) и урокиназа. (дополнительные – Ф.XIIa, стрептокиназа,
стафиллокиназа).
Ингибиторы фибринолиза – α2-антиплазмин, α2-макроглобулин,
α1-антитрипсин.
29.
Система фибринолиза30.
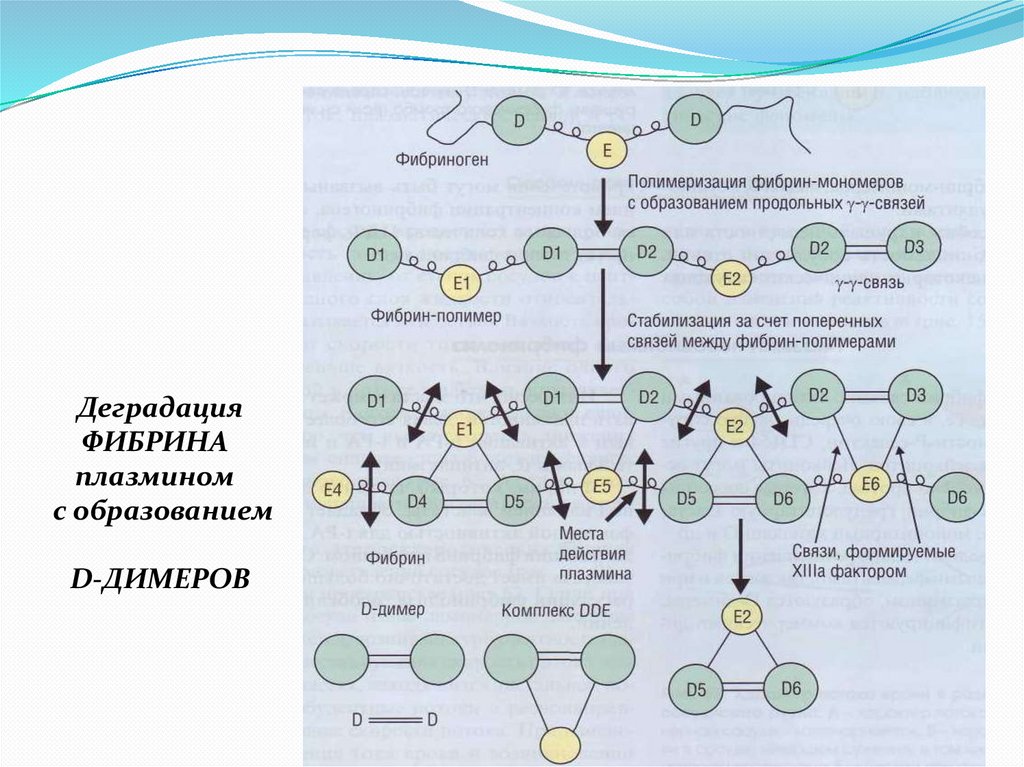
В зависимости от того, что «фибринолизируется» - фибрин, илифибриноген – образуются продукты деградации фибрина или
фибриногена (ПДФ).
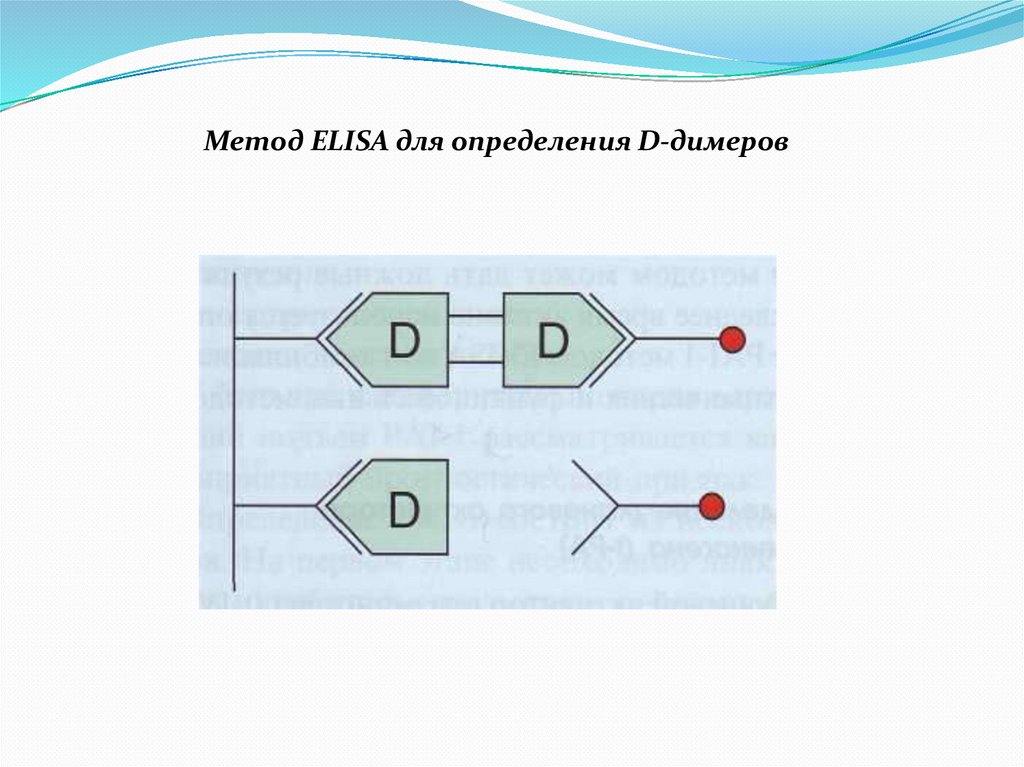
ПД Фибрина – D-димеры и комплексы DDE
ПД Фибриногена – фрагменты X, Y, D и E. D-димеры при этом не
образуются.
31.
ДеградацияФИБРИНА
плазмином
с образованием
D-ДИМЕРОВ
32.
ДеградацияФИБРИНОГЕНА
плазмином с
образованием
фрагментов
X, Y, D и E
33.
ОЦЕНКА СОСУДИСТОТРОМБОЦИТАРНОГОКОМПОНЕНТА СИСТЕМЫ
ГЕМОСТАЗА
34.
ОЦЕНКА СОСУДИСТО-ТРОМБОЦИТАРНОГО КОМПОНЕНТА СИСТЕМЫГЕМОСТАЗА
I. Ориентировочные методы:
1.время кровотечения (по Дьюку, по Айви, по Борхгревинку и др.);
2.тесты на определение резистентности микрососудов – пробы щипка,
жгута, баночная проба.
Дают лишь ориентировочную информацию о состоянии сосудистотромбоцитарного звена гемостаза. Не стандартизированы, слабо
воспроизводимы.
II. Тромбоцитарные показатели – PLT, MPV, PDW, PCT;
III. Агрегация тромбоцитов с использованием индукторов агрегации
(АДФ, адреналин, тромбин);
IV. Динамический анализ функции тромбоцитов на PFA-100;
V.
Тромбоэластография/метрия.
35.
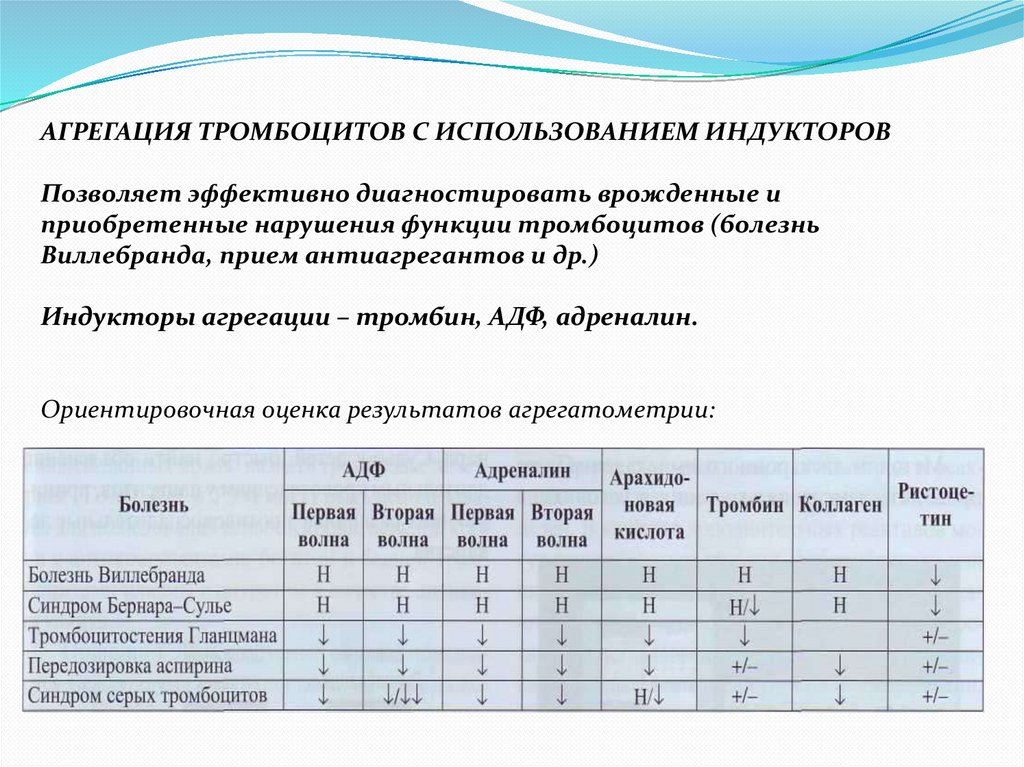
АГРЕГАЦИЯ ТРОМБОЦИТОВ С ИСПОЛЬЗОВАНИЕМ ИНДУКТОРОВПозволяет эффективно диагностировать врожденные и
приобретенные нарушения функции тромбоцитов (болезнь
Виллебранда, прием антиагрегантов и др.)
Индукторы агрегации – тромбин, АДФ, адреналин.
Ориентировочная оценка результатов агрегатометрии:
36.
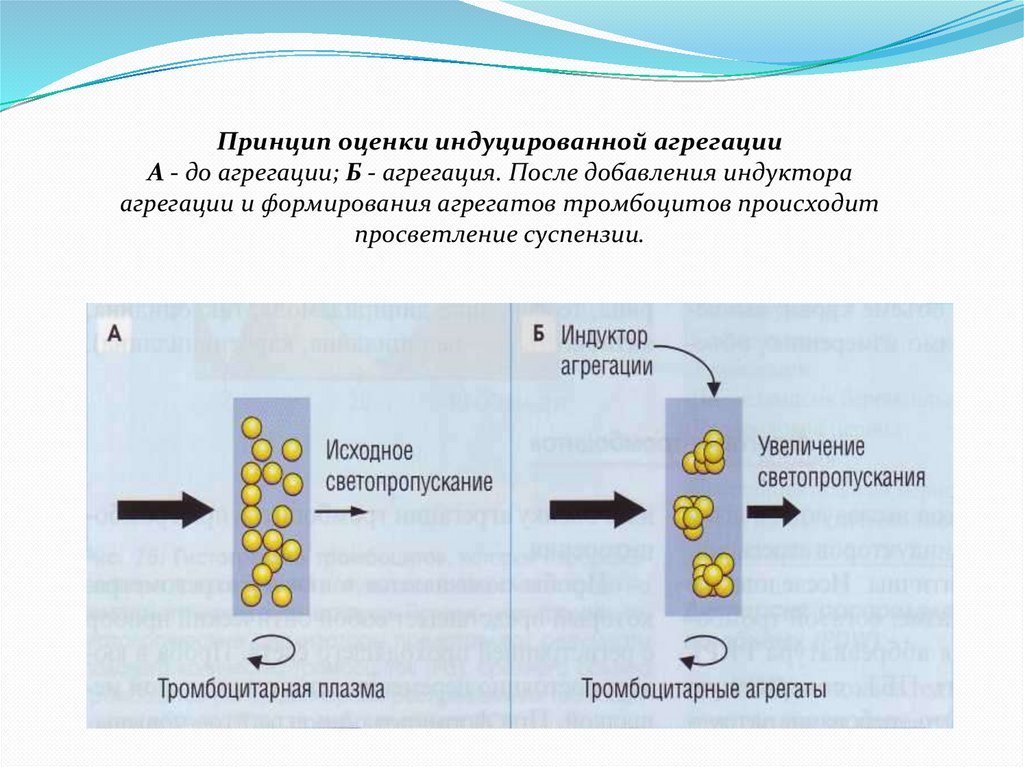
Принцип оценки индуцированной агрегацииА - до агрегации; Б - агрегация. После добавления индуктора
агрегации и формирования агрегатов тромбоцитов происходит
просветление суспензии.
37.
Недостаток оптического метода регистрации агрегации –искажение результатов в гемолизированных пробах, пробах с
высоким содержанием билирубина, липидов.
Этого недостатка лишены агрегометры с электронно-импедансным
методом регистации агрегации тромбоцитов.
38.
ДИНАМИЧЕСКИЙ АНАЛИЗ ФУНКЦИИ ТРОМБОЦИТОВна приборе PFA-100 (фирма «Dade Behring», Германия)
Кровь пропускается через капилляр
(150 мкм), покрытый пленкой из
коллагена/адреналина или
коллагена/АДФ.
При образовании тромбоцитарной
пробки прибор регистритует
повышение перфузионного
давления.
Позволяет с высокой чувствительностью выявлять дефицит ф. Виллебранда, нарушения функции тромбоцитов, обусловленные приемом
антиагрегантов, врожденные и приобретенные тромбоцитопатии.
39.
КОАГУЛЯЦИОННЫЕ(КЛОТТИНГОВЫЕ)
МЕТОДЫ
40.
КОАГУЛЯЦИОННЫЕ (КЛОТТИНГОВЫЕ) МЕТОДЫОснованы на определении времени от добавления стартового
реактива, запускающего каскад свертывания плазмы, до момента
образования сгустка (выпадения фибрина).
Методы регистрации выпадения сгустка:
1. механические;
2. турбидиметрические;
3. оптические;
4. иммунохимические – латекс-агглютинация и метод ELISA
41.
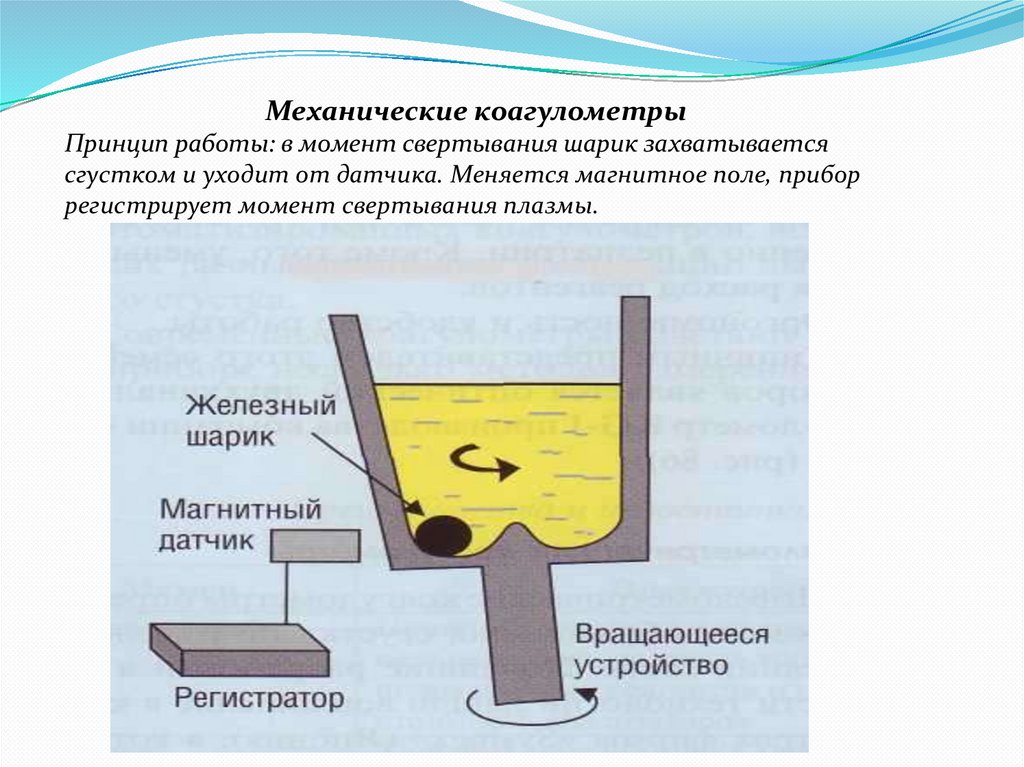
Механические коагулометрыПринцип работы: в момент свертывания шарик захватывается
сгустком и уходит от датчика. Меняется магнитное поле, прибор
регистрирует момент свертывания плазмы.
42.
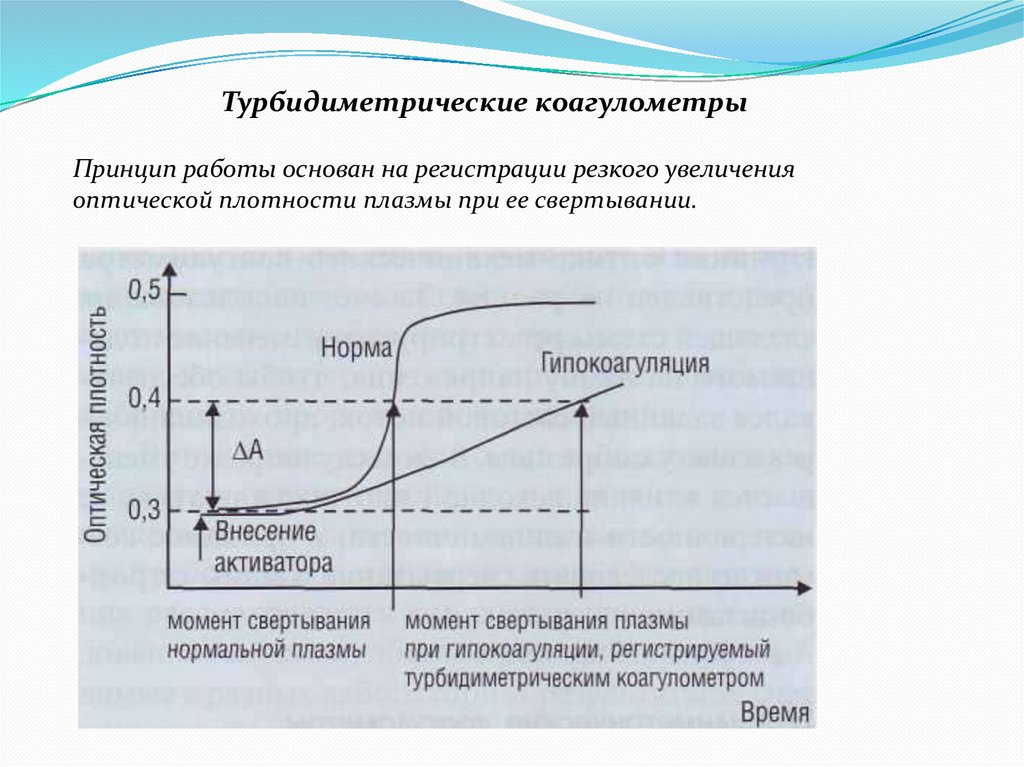
Турбидиметрические коагулометрыПринцип работы основан на регистрации резкого увеличения
оптической плотности плазмы при ее свертывании.
43.
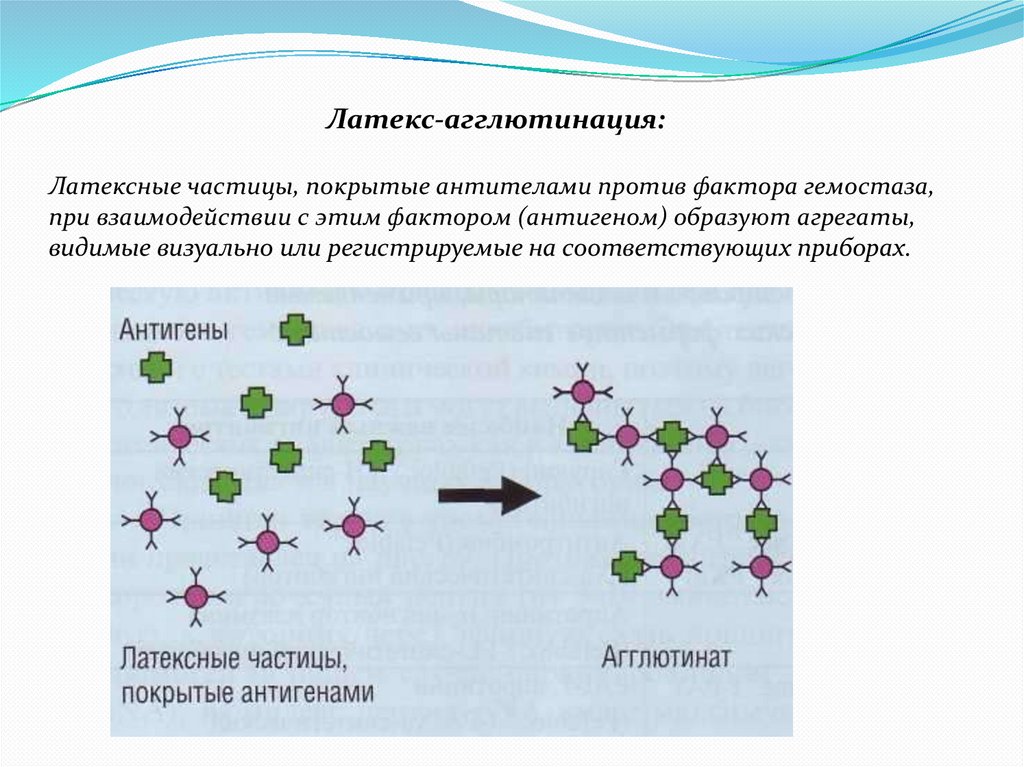
Латекс-агглютинация:Латексные частицы, покрытые антителами против фактора гемостаза,
при взаимодействии с этим фактором (антигеном) образуют агрегаты,
видимые визуально или регистрируемые на соответствующих приборах.
44.
Метод ELISA (Enzyme-Linked ImmunoSorbent Assay)- Плашка покрыта антителами против фактора.
- После добавления плазмы на фиксированных АТ осаждается АГ (фактор
системы гемостаза)
- Плашка промывается и заполняется проявляющими АТ,
конъюгированными с ферментом.
- Эти АТ связываются с антигеном, но по другим эпитопам.
Фермент меняет цвет хромогена пропорционально количеству антигена.
Регистрация осуществляется по светопропусканию раствора.
Методика позволяет количественно оценить содержание фактора
свертывания в плазме крови в концентрациях менее 1 нг/мл, что
достаточно для большинства компонентов системы свертывания.
45.
Метод ELISA46.
Метод ELISA для определения D-димеров47.
XIIaКК
ВМК
XIa
XI
XII
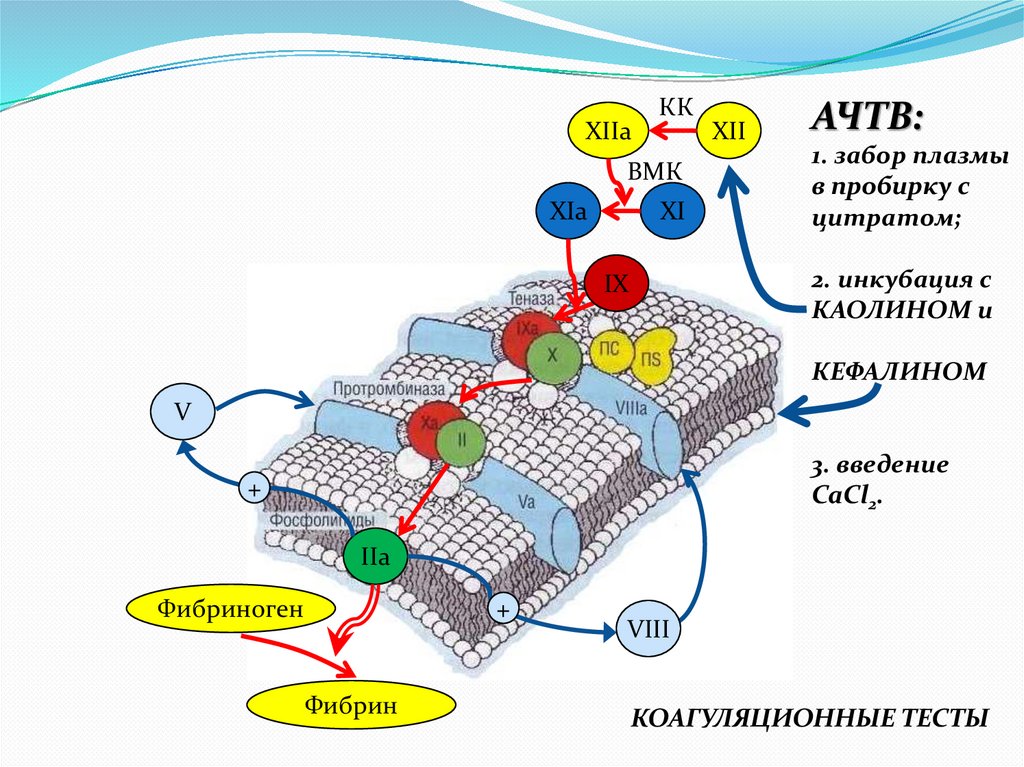
АЧТВ:
1. забор плазмы
в пробирку с
цитратом;
2. инкубация с
КАОЛИНОМ и
IX
КЕФАЛИНОМ
V
3. введение
CaCl2.
+
IIa
+
Фибриноген
Фибрин
VIII
КОАГУЛЯЦИОННЫЕ ТЕСТЫ
48.
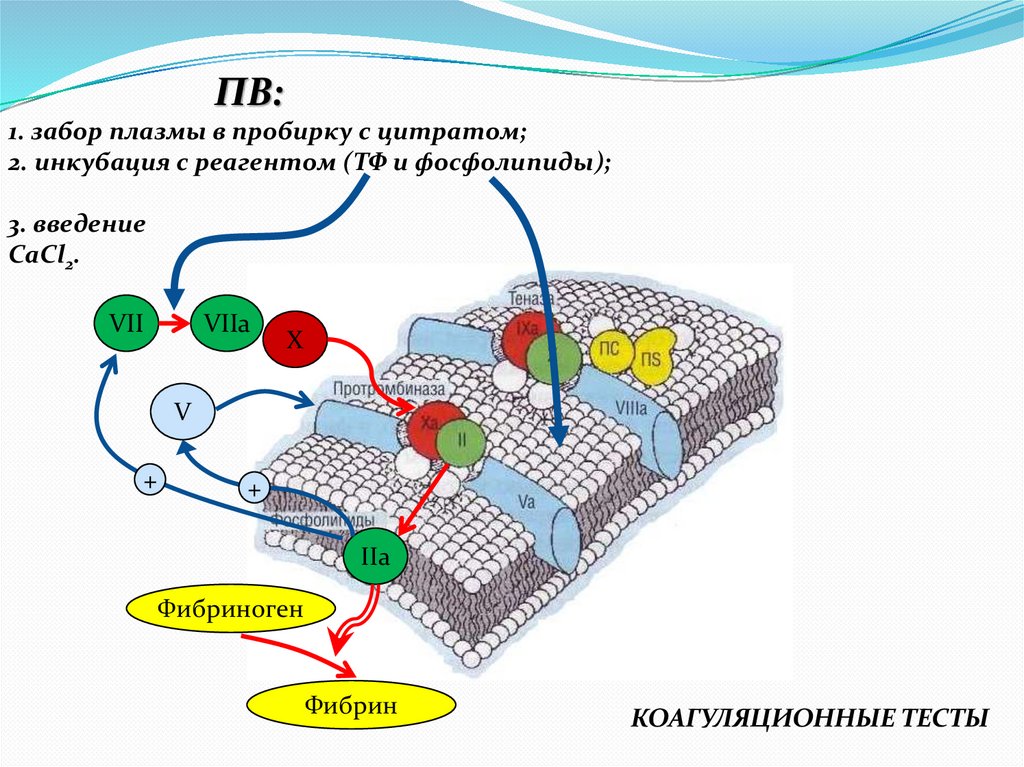
ПВ:1. забор плазмы в пробирку с цитратом;
2. инкубация с реагентом (ТФ и фосфолипиды);
3. введение
CaCl2.
VII
VIIa
X
V
+
+
IIa
Фибриноген
Фибрин
КОАГУЛЯЦИОННЫЕ ТЕСТЫ
49.
Применение основных коагуляционных тестов50.
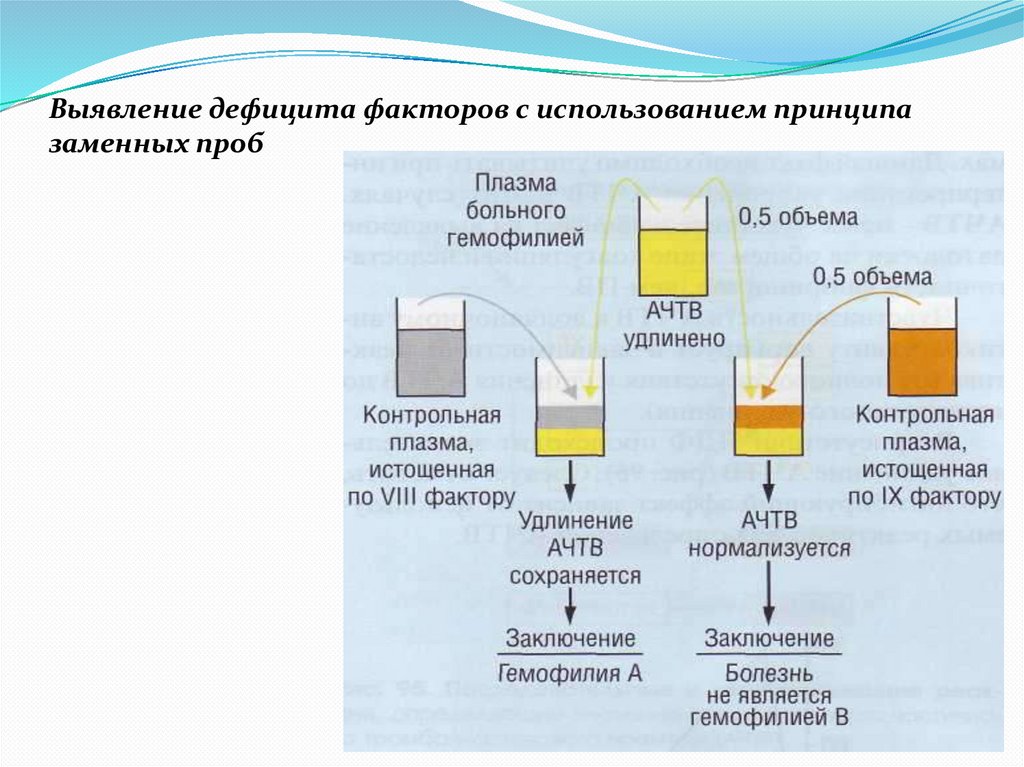
Выявление дефицита факторов с использованием принципазаменных проб
51.
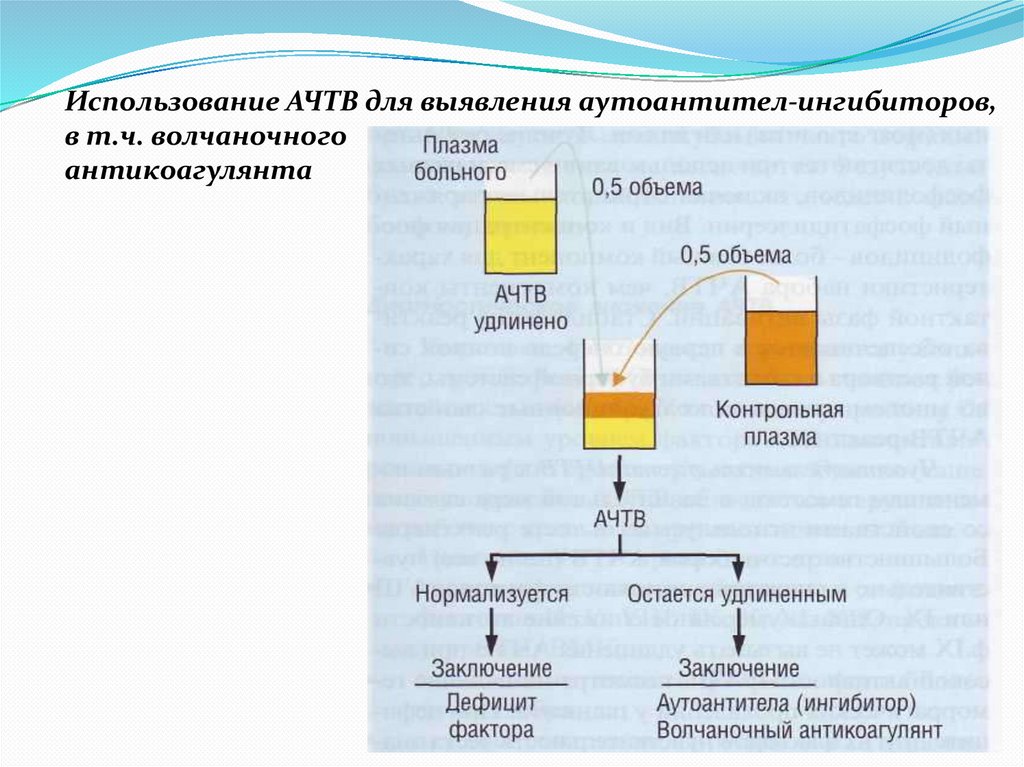
Использование АЧТВ для выявления аутоантител-ингибиторов,в т.ч. волчаночного
антикоагулянта
52.
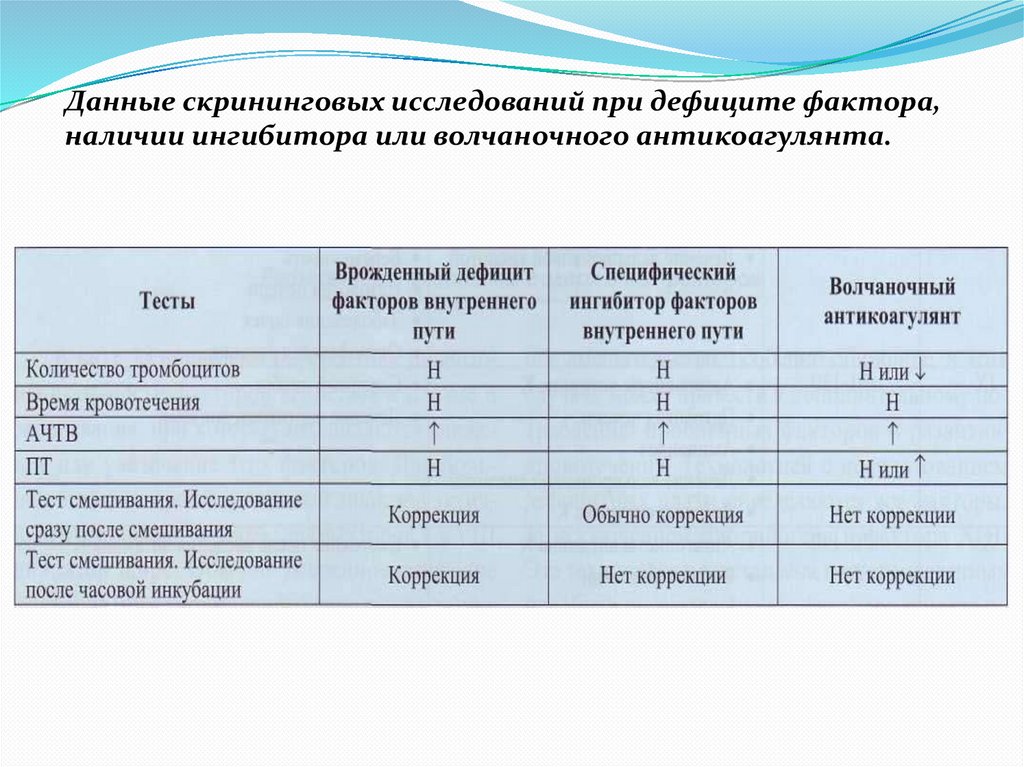
Данные скрининговых исследований при дефиците фактора,наличии ингибитора или волчаночного антикоагулянта.
53.
ПРОТРОМБИНОВОЕ ВРЕМЯДля выражения результатов ПВ в разное время использовались:
1. время свертывания в секундах;
2. протромбиновый индекс (ПИ), который определяется как
3. протромбиновое отношение (ПО), которое определяется как
4. ПТ по Квику – % от нормы, которая определяется по
калибровочному графику;
5. международное нормализованное отношение (MHO), которое
представляет собой ПО, возведенное в степень Международного
индекса чувствительности (МИЧ): МНО = ПОМИЧ.
54.
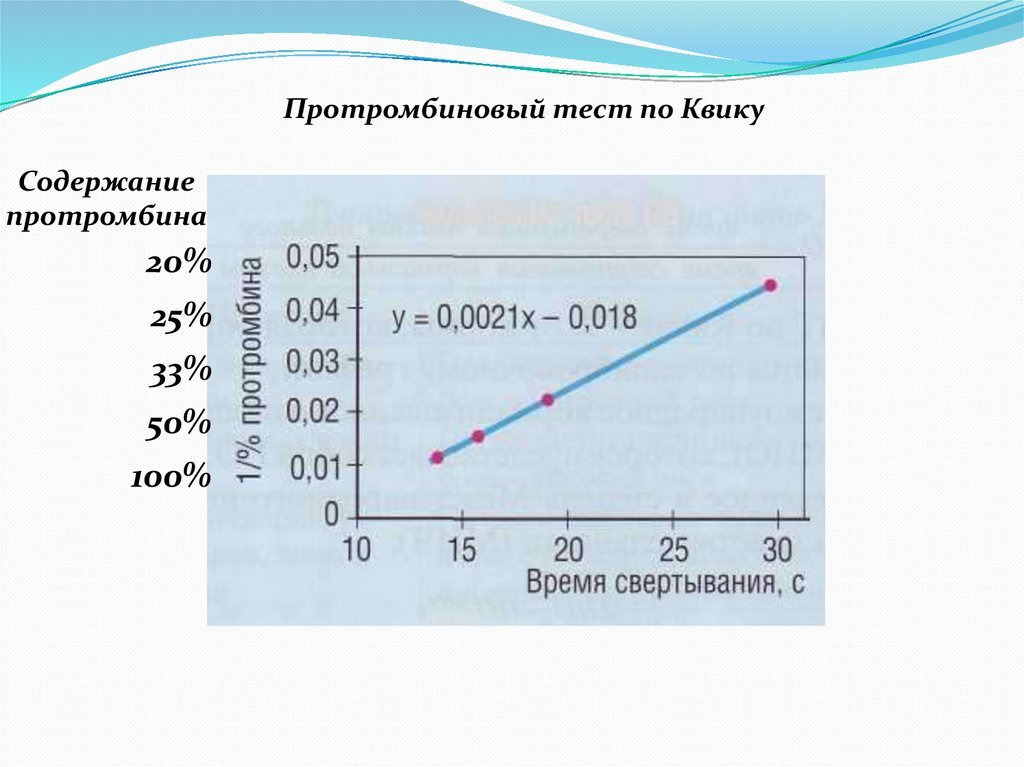
Протромбиновый тест по КвикуСодержание
протромбина
20%
25%
33%
50%
100%
55.
МНО (INR)Тест разработан Международным комитетом по стандартизации в
гематологии и Международным комитетом по тромбозу и гемостазу
и принят ВОЗ в 1983 году с целью стандартизации результатов теста
ПВ, получения результатов, сопоставимых между собой, несмотря на
использование разных тромбопластинов в качестве реагента.
Значения ПО, определенные с использованием разных
тромбопластинов, могут быть приведены путем возведения в
степень, представляющую собой МИЧ (ISI) используемого
тромбопластина, к величине, которая была бы получена при
определении факторов протромбинового комплекса с первичным
стандартом тромбопластина.
MHO рассчитывают по формуле:
МИЧ определяется производителем тромбопластина.
56.
МНО не может применяться для контроля состояния внешнегопути активации протромбиназы в общей популяции пациентов,
не принимающих непрямых антикоагулянтов. Для этих целей
служит Протромбиновый тест.
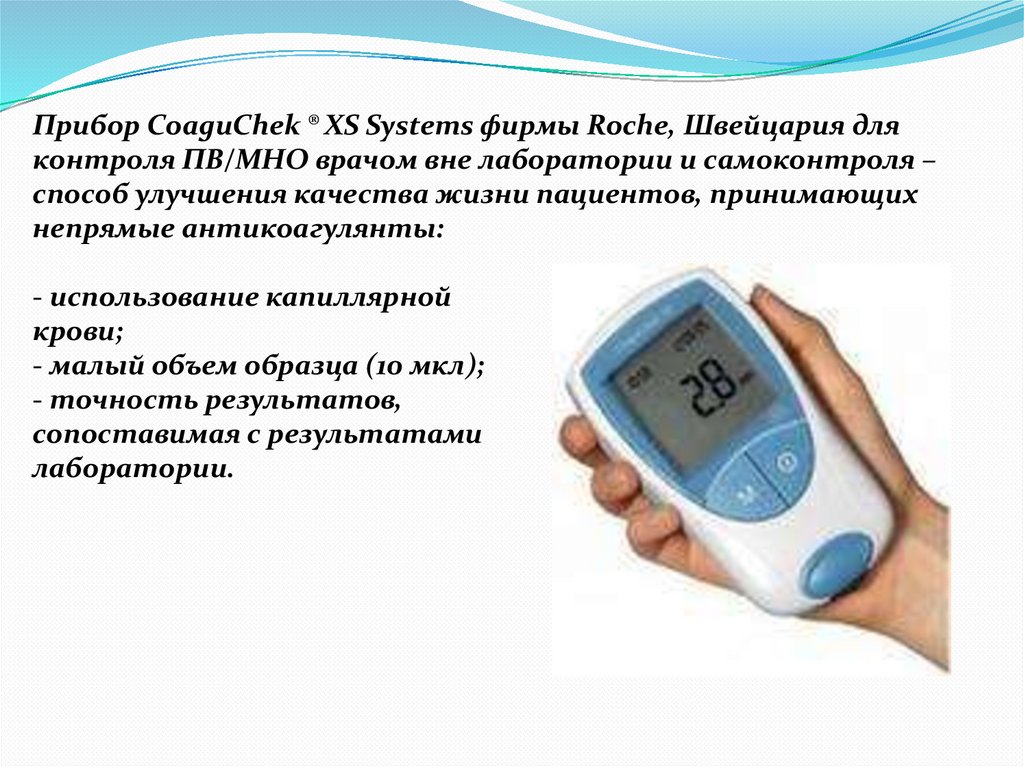
57.
Прибор CoaguChek ® XS Systems фирмы Roche, Швейцария дляконтроля ПВ/МНО врачом вне лаборатории и самоконтроля –
способ улучшения качества жизни пациентов, принимающих
непрямые антикоагулянты:
- использование капиллярной
крови;
- малый объем образца (10 мкл);
- точность результатов,
сопоставимая с результатами
лаборатории.
58.
ТЕСТ С ОПРЕДЕЛЕНИЕМ ОСТАТОЧНОЙ АКТИВНОСТИ Ф.Xa(«Анти Xa-активность»)
Применяется для:
1. контроля терапии НМГ в следующих ситуациях:
-у больных с почечной недостаточностью;
- у беременных
- у больных с ожирением
- у пожилых
2. контроля терапии НФГ при подозрении/выявлении
антифосфолипидного синдрома
59.
Принцип определения содержания гепарина в пробе сиспользованием хромогенного субстрата:
1. активность ф.Xa подавляется АТ пропорционально
содержанию гепарина в пробе.
2. остаточная активность ф.Xa определяется с помощью
хромогенного субстрата.
60.
Целевые значения теста при гепаринотерапии с цельюпрофилактики тромбоза – 0,2-0,4 анти Xa-ЕД/мл, с лечебной
целью – 1.0-1.2 анти Xa-ЕД/мл.
На результаты теста не оказывают влияние ПДФ, повышенная
концентрация Ф. VIII.
Реактивы для теста более стабильны, что делает его
технически надежнее, чем АЧТВ.
61.
АКТИВИРОВАННОЕ ВРЕМЯ СВЕРТЫВАНИЯ (АСТ, АВС-тест)Тест, разработанный P. Hattersley в 1966 г. применительно к
нуждам кардиоанестезиологии. Представляет собой ВСК,
ускоренное добавлением активатора (в современном исполнении
это – целит, каолин и стеклянные шарики).
Используется для контроля степени гипокоагуляции у больных,
которым проводится ИК, ЭКМО, альбуминовый диализ (MARS).
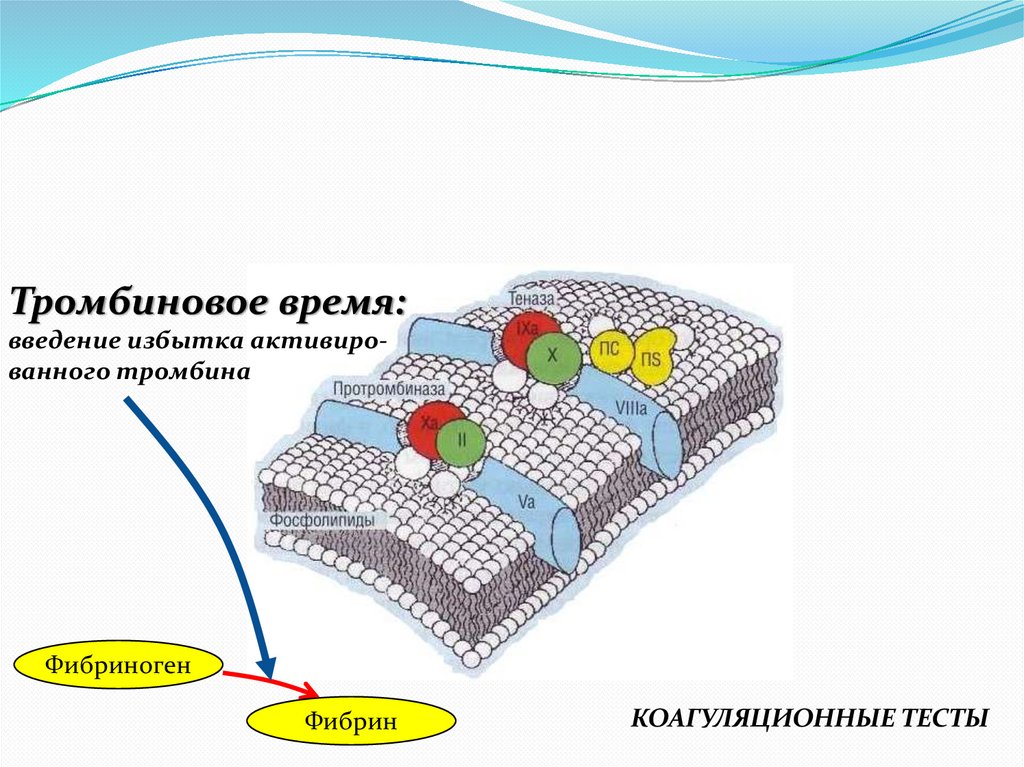
62.
Тромбиновое время:введение избытка активированного тромбина
Фибриноген
Фибрин
КОАГУЛЯЦИОННЫЕ ТЕСТЫ
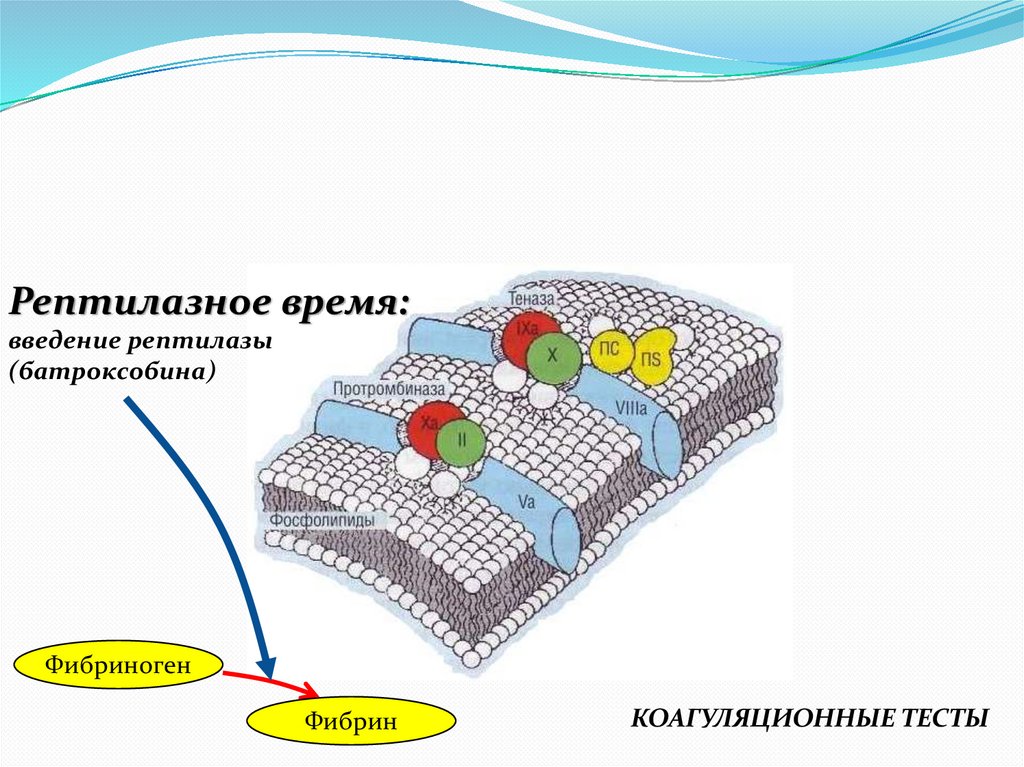
63.
Рептилазное время:введение рептилазы
(батроксобина)
Фибриноген
Фибрин
КОАГУЛЯЦИОННЫЕ ТЕСТЫ
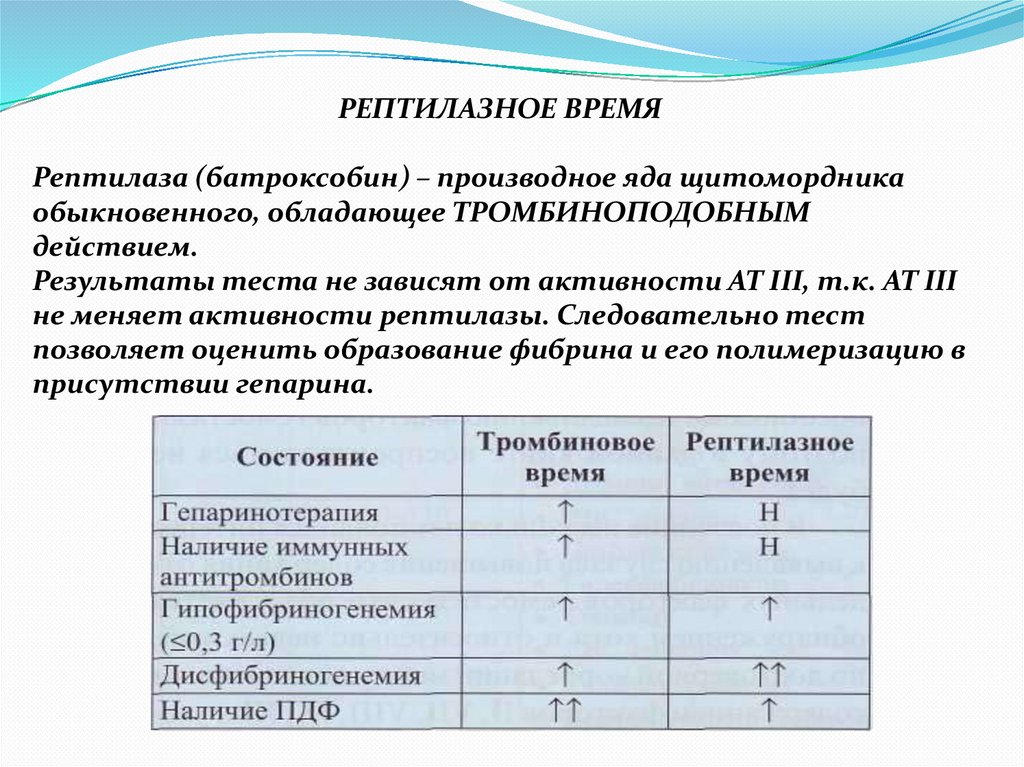
64.
РЕПТИЛАЗНОЕ ВРЕМЯРептилаза (батроксобин) – производное яда щитомордника
обыкновенного, обладающее ТРОМБИНОПОДОБНЫМ
действием.
Результаты теста не зависят от активности АТ III, т.к. АТ III
не меняет активности рептилазы. Следовательно тест
позволяет оценить образование фибрина и его полимеризацию в
присутствии гепарина.
65.
ТРОМБОЭЛАСТОГРАФИЯ66.
ТРОМБОЭЛАСТОГРАФИЯКоагуляционные методы исследуют лишь плазменное звено
системы гемостаза. Контрольной точкой любого
коагуляционного метода является момент выпадения фибрина
(образование сгустка).
Агрегатометрия оценивает состояние тромбоцитов.
В условиях in vivo плазменный и тромбоцитарный компоненты
гемостаза неразрывно связаны между собой.
ТЭГ (в ее современном исполнении – ТЭМ) - метод комплексной
оценки системы гемостаза, позволяющий охарактеризовать
процесс образования сгустка, его механические
характеристики, плотность, стабильность и процесс
фибринолиза.
67.
Тромбоэластограффирмы
Haemoscope
68.
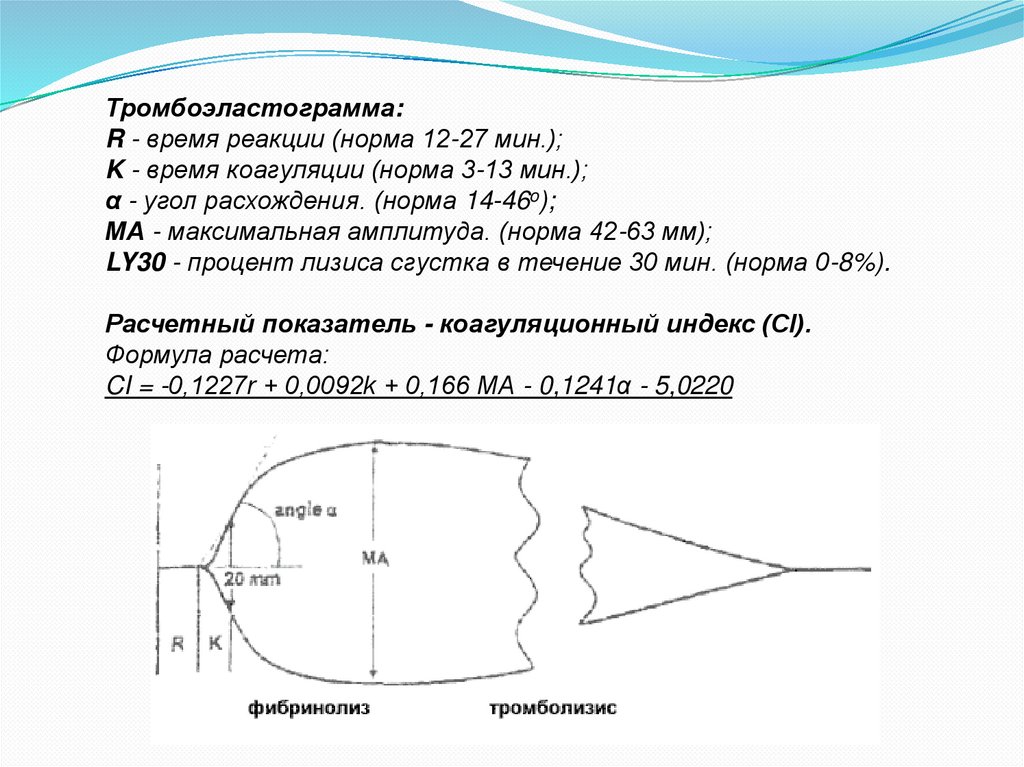
Тромбоэластограмма:R - время реакции (норма 12-27 мин.);
K - время коагуляции (норма 3-13 мин.);
α - угол расхождения. (норма 14-46o);
МА - максимальная амплитуда. (норма 42-63 мм);
LY30 - процент лизиса сгустка в течение 30 мин. (норма 0-8%).
Расчетный показатель - коагуляционный индекс (CI).
Формула расчета:
CI = -0,1227r + 0,0092k + 0,166 МА - 0,1241α - 5,0220
69.
Интерпретация результатов ТЭГ:70.
71.
Почему ТЭГ?1. комплексная оценка гемостаза
2. оперативность и портативность (в течение 20-30 минут, у
постели больного, в операционной)
3. простота возможность выполнения исследования дежурным
врачом в любое время суток)
4. выявление ГИПЕРКОАГУЛЯЦИОННЫХ состояний, к которым
традиционные коагуляционные методы малочувствительны
5. ориентировочная оценка состояния находящейся «в тени»
системы фибринолиза (возможность обоснованного назначения
антифибринолитиков)
6. возможность контроля эффективности проводимой
антиагрегантной терапии КЛОПИДОГРЕЛЕМ и АСПИРИНОМ.
72.
По результатам исследований, проведенных в НИИнейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва, алгоритм
трансфузионной терапии на основании результатов ТЭГ (по
сравнению с традиционными коагуляционными методами) у
нейрохирургических больных приводит к
4-хкратному снижению частоты трансфузии донорской СЗП
без ухудшения исходов операций.
(Л. А. Исраелян, В. В. Громова, А. Ю. Лубнин)
73.
Контроль эффективности терапии: Аспирин и Клопидогрель.Проводится ТЭГ в 4 этапа:
1. стандартная постановка исследования (определение МА).
2. проба с гепарином (устранение тромбин-индуцированной агрегации
тромбоцитов). Образуется сгусток, состоящий только из фибрина, т.к.
тромбоциты не агрегируют.
Разница МА в 1 и 2 пробах – вклад тромбоцитов в образование сгустка.
{Вместо тромбина на фибрин воздействуют «активатором F»}
74.
3. проба с гепарином + АДФ (рецепторы к АДФ блокируютсяКлопидогрелем). По увеличению МА в сравнении со второй пробой
оценивают способность тромбоцитов к АДФ-индуцированной
агрегации.
4. проба с гепарином + арахидоновая кислота (Аспирин блокирует
ЦОГ-1 – фермент, катализирующий превращение арахидоновой
кислоты в тромбоксан А2). Выводы аналогичны таковым в 3 пробе.
75.
ГЕПАРИНОТЕРАПИЯ76.
В 1975 году Bull и соавт. в своих работах чётко показали существующийширокий разброс реакций пациента на терапию гепарином . Они
доказали существование трёхкратной разницы в чувствительности и
четырёхкратную разницу в длительности эффекта гепарина в ответ
на заданную дозу (Bull, Korpman, Huse. Heparin therapy during the
extracorporeal circulation).
Современные протоколы терапии гепарином подразумевают контроль
и коррекцию дозы вводимого гепарина в зависимости от
индивидуальной реакции больного.
77.
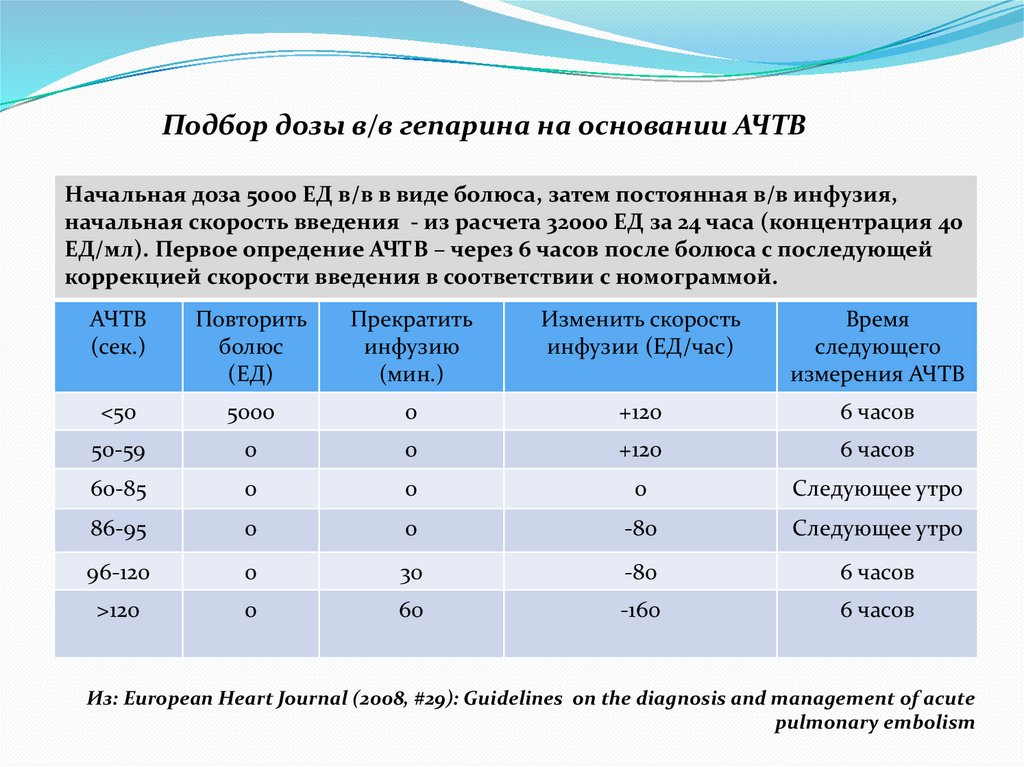
Подбор дозы в/в гепарина на основании АЧТВНачальная доза 5000 ЕД в/в в виде болюса, затем постоянная в/в инфузия,
начальная скорость введения - из расчета 32000 ЕД за 24 часа (концентрация 40
ЕД/мл). Первое опредение АЧТВ – через 6 часов после болюса с последующей
коррекцией скорости введения в соответствии с номограммой.
АЧТВ
(сек.)
Повторить
болюс
(ЕД)
Прекратить
инфузию
(мин.)
Изменить скорость
инфузии (ЕД/час)
Время
следующего
измерения АЧТВ
<50
5000
0
+120
6 часов
50-59
0
0
+120
6 часов
60-85
0
0
0
Следующее утро
86-95
0
0
-80
Следующее утро
96-120
0
30
-80
6 часов
>120
0
60
-160
6 часов
Из: European Heart Journal (2008, #29): Guidelines on the diagnosis and management of acute
pulmonary embolism
78.
Подбор дозы в/в гепарина на основании АЧТВНачальная доза 5000 ЕД в/в в виде болюса, затем постоянная в/в инфузия,
начальная скорость введения - из расчета 32000 ЕД за 24 часа (концентрация 40
ЕД/мл). Первое опредение АЧТВ – через 6 часов после болюса с последующей
коррекцией скорости введения в соответствии с номограммой.
АЧТВ
Изменение дозы
< 35 сек (менее, чем в 1.2 раза выше
контроля)
80 ЕД/кг в виде болюса; увеличить
скорость инфузии на 4 ЕД/кг/час
35-45 сек (в 1.2-1.5 раза выше контроля)
40 ЕД/кг в виде болюса; увеличить
скорость инфузии на 2 ЕД/кг/час
46-70 сек (в 1.5-2.3 раза выше контроля)
Без изменений
71-90 сек (в 2.3-3.0 раза выше контроля)
Снизить скорость инфузии на 2 ЕД/кг/час
>90 сек (более чем в 3.0 раза выше
контроля)
Прекратить инфузию на 1 час, затем
снизить скорость инфузии на 3 ЕД/кг/час
Из: European Heart Journal (2008, #29): Guidelines on the diagnosis and management of acute
pulmonary embolism
79.
НИЗКОМОЛЕКУЛЯРНЫЕ ГЕПАРИНЫ (НМГ)Продукты деполимеризации гепарина Na азотистой кислотой с
последующей хроматографической очисткой.
Дальтепарин Na (фрагмин)
Эноксапарин Na (клексан)
Надропарин Са (фраксипарин)
Активны в присутствии АТ III.
Действуют в большей степени на Ф. Xa (соотношение
антифакторной активности анти-Xa : анти-IIа = 4 : 1 (2.2 : 1 для
дальтепарина Na), тогда, как у гепарина – 1 : 1.
Антидотом и НМГ, и гепарина Na является протамина сульфат.
80.
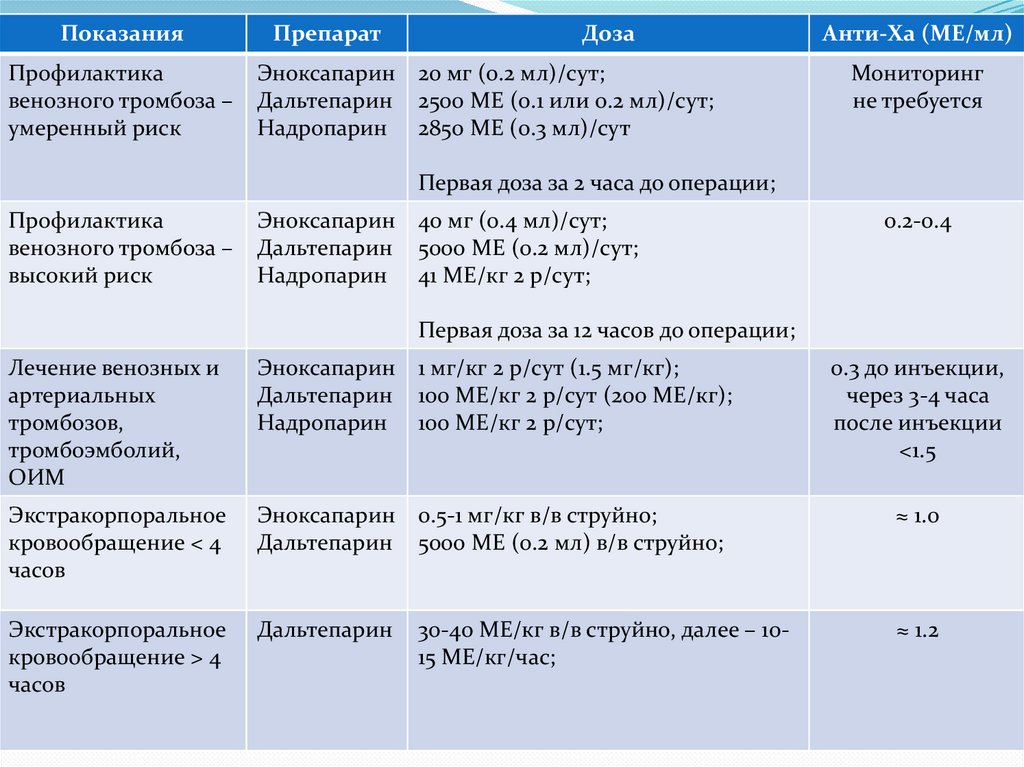
ПоказанияПрофилактика
венозного тромбоза –
умеренный риск
Препарат
Доза
Эноксапарин 20 мг (0.2 мл)/сут;
Дальтепарин 2500 МЕ (0.1 или 0.2 мл)/сут;
Надропарин 2850 МЕ (0.3 мл)/сут
Анти-Ха (МЕ/мл)
Мониторинг
не требуется
Первая доза за 2 часа до операции;
Профилактика
венозного тромбоза –
высокий риск
Эноксапарин 40 мг (0.4 мл)/сут;
Дальтепарин 5000 МЕ (0.2 мл)/сут;
Надропарин 41 МЕ/кг 2 р/сут;
0.2-0.4
Первая доза за 12 часов до операции;
Лечение венозных и
артериальных
тромбозов,
тромбоэмболий,
ОИМ
Эноксапарин 1 мг/кг 2 р/сут (1.5 мг/кг);
Дальтепарин 100 МЕ/кг 2 р/сут (200 МЕ/кг);
Надропарин 100 МЕ/кг 2 р/сут;
0.3 до инъекции,
через 3-4 часа
после инъекции
<1.5
Экстракорпоральное
кровообращение < 4
часов
Эноксапарин 0.5-1 мг/кг в/в струйно;
Дальтепарин 5000 МЕ (0.2 мл) в/в струйно;
≈ 1.0
Экстракорпоральное
кровообращение > 4
часов
Дальтепарин
≈ 1.2
30-40 МЕ/кг в/в струйно, далее – 1015 МЕ/кг/час;
81.
ФОНДАПАРИНУКС (АРИКСТРА)Синтетический ингибитор Ф. Ха.
Активен в присутствии АТ III.
Не оказывает влияния на Ф. IIa.
Не обладает антиагрегационным действием.
В стандартной дозе (2.5 мг 1 р/сут) не влияет на результаты
коагуляционных тестов (АЧТВ, ACT, ПВ/МНО).
Не вызывает перекрестных реакций с сывороткой больных ГИТ.
Дозирование:
1. профилактика венозного тромбоза – 2.5 мг/сут через 6 часов
послео операции.
2. лечение ТЭЛА:
5 мг/сут (масса тела <50 кг)
7.5 мг/сут (масса тела 50-100 кг)
10 мг/сут (масса тела >100 кг)
Из: European Heart Journal (2008, #29): Guidelines on the diagnosis and management of acute
pulmonary embolism
82.
ГЕПАРИНОРЕЗИСТЕНТНОСТЬ –несоответствие между вводимой дозой гепарина и степенью
удлинения АЧТВ.
Начальную форму гепаринорезистентности можно
заподозрить, если больному после введения болюса гепарина
требуется инфузия более 20 ЕД/кг/час для поддержания АЧТВ в
1.5-2 раза выше исходного.
Причина – снижение уровня АТ III в плазме ниже 30% при:
- лечении НФГ или НМГ
- нефротический синдром
- потребление при тромбозах или ДВС-синдроме
- тяжелые заболевания печени
- злокачественные новообразования
- прием оральных контрацептивов
83.
На заметку:Возможно ошибочное определение «гепаринорезистентности» при нарушении
правил забора (2 порция крови) и транспортировки проб крови на
исследование гемостаза (в несоответствующих этим целям контейнерам,
задержка по времени между забором и исследованием).
При этом происходит активация тромбоцитов, экспрессия PF 4 и
нейтрализация гепарина.
Специальные пробирки CTAD (citrate, theophyllin, adenosine, dipyridamole)
содержат антикоагулянт и антиагреганты, которые предотвращают
активацию тромбоцитов.
84.
ОСЛОЖНЕНИЯ при развитии гепаринорезистентности –РИКОШЕТНЫЕ ТРОМБОЗЫ.
ПОДТВЕЖДЕНИЕ ДИАГНОЗА – определение уровня АТ III
иммунохимическими методами(ELISA и др.), тестами с
хромогенными субстратами.
ЛЕЧЕНИЕ:
-СЗП (источник АТ III, протеинов С и S) на фоне
продолжающегося введения НФГ или перехода на НМГ;
- Антитромбин III человеческий.
85.
ГЕПАРИН-ИНДУЦИРОВАННАЯ ТРОМБОЦИТОПЕНИЯ *Развивается у 5% больных, получающих бычий гепарин и у 1% больных,
получающих свиной гепарин.
1) ГИТ 1 типа – не связана с образованием АТ
Число тромбоцитов снижается в течение первых 2 суток
гепаринотерапии, после чего начинает нормализовываться несмотря на
продолжение введения гепарина.
2) ГИТ 2 типа связана с образованием АТ к комплексу
гепарин-ТрФ 4. Эти АТ связываются с тромбоцитарными Re, после чего
макрофаги начинают удалять такие тромбоциты из кровеносного
русла.
Склонность к тромбозам при этом обусловлена:
- связыванием АТ с гепарансульфатом гликокаликса эндотелия,
активацией макрофагов, повреждением эндотелия и экспозицией ТФ;
- активацией тромбоцитов АТ и секрецией прокоагулянтов: тромбина,
серотонина, АДФ.
* Из: Mayo Clinic Cardiology. Concise Textbook. 3rd ed.
86.
ГИТ 2 типа характеризуется снижением числа тромбоцитов на 50% иболее через 5-10 дней после начала гепаринотерапии.
Возможен вариант быстрого развития (менее чем за 24 часа) – у больных
с предшествовавшей экспозицией гепарина за последние 3 месяца.
В 50% случаев развившаяся ГИТ 2 типа манифестирует тромбозами:
-ТГВ
- ТЭЛА
- гангрена конечности
- артериальные тромбозы (чаще в протезированных сегментах, реже – в
могзовых и коронарных сосудах)
Смертность при развитии ГИТ 2 типа – 20%, ампутации конечностей –
10%
87.
ДИАГНОСТИКА«Золотым стандартом» диагностики является Тест на высвобождение
14С-серотонина (специфичность приближается к 100%)
Другой метод – агрегатометрия с определением высвобождения из
гранул тромбоцитов АТФ, стимулированного АТ .
88.
ЛЕЧЕНИЕ-немедленная отмена ВСЕХ форм гепарина (НМГ могут перекрестно
реагировать с АТ), в т.ч. прекращение гепаринизации в/в катетеров;
- единственный радикальный метод лечения ГИТ – использование
прямых ингибиторов тромбина (ЛЕПИРУДИН, БИВАЛИРУДИН,
АГРОТРОБАН и ДАБИГАТРАН). НО – не имеют антидотов!!!
-по мере достижения устойчивого состояния гипокоагуляции и
повышении числа тромбоцитов свыше 100 тыс. – переход на непрямые
антикоагулянты;
-ФОНДАПАРИНУКС (АРИКСТРА) – ингибитор Ф.Xa (опосредованно через
АТIII). Не имеется документированных случаев развития ГИТ при
использовании Фондапаринукса, но он одобрен FDA только для
профилактики ГИТ.
89.
АНТИФОСФОЛИПИДНЫЙ СИНДРОМ (АФС) *Симптомокомплекс, в основе которого формирование АТ к ФЛ мембран
тромбоцитов, эндотелия.
Описан в 1986 Hughes и соавт. у больного СКВ (отсюда другое название АТ
– волчаночный антикоагулянт)
Выделяют первичный и вторичный АФЛ.
Вторичный (при заболеваниях, сопровождающихся активацией Влимфоцитов):
- СКВ (до 70% случаев), РА, синдром Шегрена и др. ревматические
заболевания;
- злокачественные новообразования;
-инфекции (инфекционный мононуклеоз, ВИЧ-инфекция, сифилис,
Varicella, Rubella) и некоторые паразитарные заболевания;
- прием КОК, хинидина, прокаинамида, изониазида, метил-ДОПА
Соотношение женщины: мужчины = 9:1
* Из: Mayo Clinic Cardiology. Concise Textbook. 3rd ed.
90.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗЭтиология не изучена (предполагаются латентное течение инфекций,
наследственность, связь с некоторыми антигенами MHC.
АФЛ антитела (антикардиолипиновые и др.) перекрестно реагируют с
ФЛ сосудистого эндотелия, гепарансульфатом, ТМ, вызывая активацию
эндотелия и высвобождение прокоагулянтных факторов, снижение
экспрессии антикоагулянтных, запускают механизмы апоптоза с
экспрессией ТФ.
Связываясь с тромбоцитами, АФЛ антитела стимулируют
высвобождение TxA2.
В плазме крови АТ инактивируют протеины C и S, образование комплекса
ТАТ
91.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ-ТГВ нижних конечностей. Из них приблизительно у 50% - ТЭЛА
- акушерская патология: рецидивирующие спонтанные аборты, поздние
токсикозы (преэклампсия, эклампсия), преждевременные роды
- артериальные тромбозы (до 50% - ОНМК и ТИА)
- ОИМ
- поражения клапанов (чаще митрального) – недостаточность или
стеноз АВ-отверстия, вегетации на клапанах.
- внутрипредсердные тромбы
- тромбозы почечных вен (с исходом в НС), печеночных вен (синдром
Бадда-Киари)
- кожные проявления – сетчатое ливедо, некрозы кожы, хронические
язвы
- тромбоцитопения
92.
ДИАГНОСТИКАДля постановки диагноза необходимо наличие 1 клинического критерия:
- артериальный и/или венозный тромбоз, подтвержденные
объективными методами;
- акушерская патология
и 1 лабораторного критерия:
- умеренные/высокие титры антикардиолипиновых IgM или IgG,
- волчаночный антикоагулянт, выявленный 2 и более раз с интервалом в
6 месяцев
93.
ЛЕЧЕНИЕНепрямые антикоагулянты под контролем МНО (2.0-2.9)
Малые дозы аспирина (75 мг/сут)
У беременных – Гепарин 5000 ЕД 2-3 р/день + Аспирин в малых дозах
94.
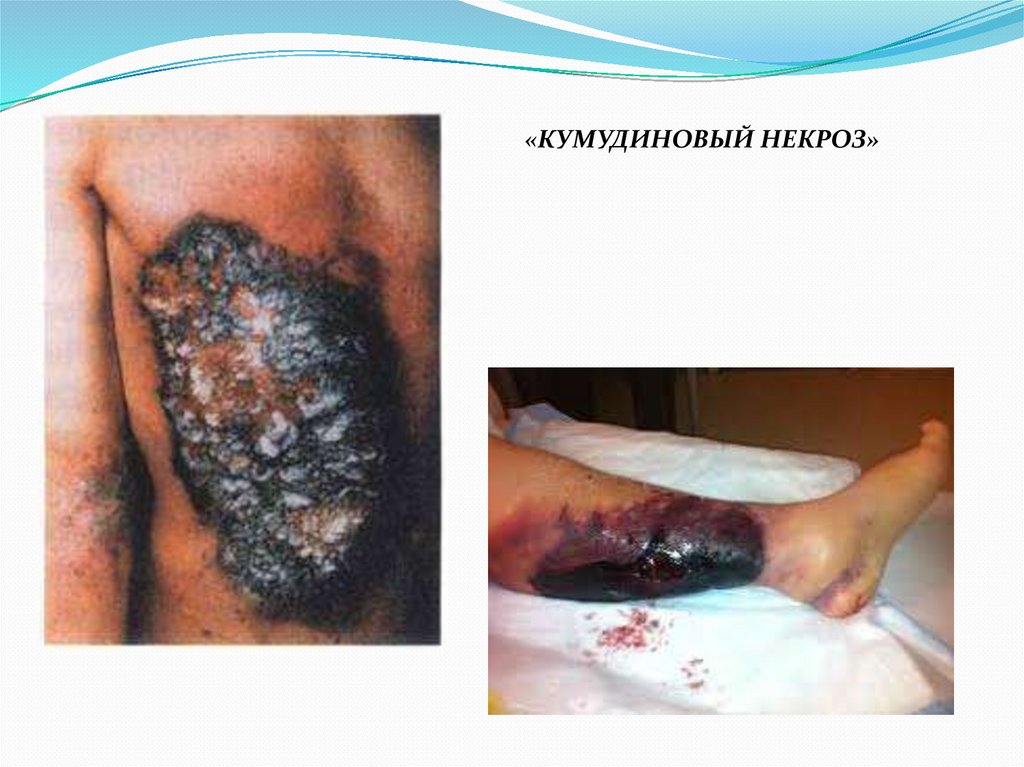
«КУМУДИНОВЫЙ НЕКРОЗ»95.
«КУМУДИНОВЫЙ НЕКРОЗ»Самое тяжелое осложнение терапии непрямыми антикоагулянтами,
связанное с возникновением тромбоза подкожных сосудов и развитием
некроза тканей.
Происходит при начале терапии непрямыми антикоагулянтами без
«прикрытия» гепарином.
Обусловлен более быстрым снижением активности Протеина С и S по
сравнению с факторами II, VII, IX, X у больных с исходно низкой
активностью Протеина С и S.
Частота – 33.5 на 1о0 тыс. больных, леченых варфарином (Dr. Judith K.
Jones MD: Estimation of the frequency of warfarin-associated necrosis in a large inpatient record-linked database)
ЛЕЧЕНИЕ:
прямые антикоагулянты + СЗП (как источник Протеина С и S).
96.
ЛИТЕРАТУРА:1. В.В. Долгов, П.В. Свирин. Лабораторная диагностика
нарушений гемостаза. «Триада», 2005
2. А.И. Воробьев. Руководство по гематологии. Т. 1, 2.
«Медицина», 1985.
3. «Анестезиология и реаниматология» №3, 2009. Стр. 24-30
4. «Анестезиология и реаниматология» №5, 2009. Стр. 28-32
5. «Вестник РУДН» 3 (31) 2005. Стр. 83-87
6. Ф. Хенсли. Анестезиология в кардиохирургии;
7. Hoffman. Hematology: Basic Principles and Practice, 5th ed.
8. Mayo Clinic Cardiology. Concise Textbook. 3rd ed.
9. www.rmj.ru. АФЛ: клиника, диагностика, лечение. Насонов Е.Л.
10. www.bloodanalyzer.ru/haemoscope
97.
Каскад активацииплазменного гемостаза
XIIa
КК
ВМК
XIa
ТФ
ТФ
VII
VIIa
XI
IX
X
V
+
+
XIII
IIa
+
Фибриноген
XIIIa
Фибрин
VIII
XII
98.
Внешний путь активацииXIIa
КК
XII
ВМК
XIa
ТФ
ТФ
VII
VIIa
XI
IX
Внутренний путь
активации
X
Va
+
+
XIII
IIa
Фибриноген
+
VIIIa
XIIIa
Фибрин
Общий путь
активации
99.
1-я фаза – инициация процессасвертывания крови:
Внешний путь активации
ТФ
ТФ
VII
VIIa
X
Xa
II
IIa
100.
2-я фаза – усиление процессасвертывания крови
Внешний путь активации
ТФ
ТФ
VII
VIIa
X
V
+
Va
Xa
+
VIIIa
II
IIa
+
Тромбо
циты
VIII
101.
2-я фаза – усиление процессасвертывания крови
Внешний путь активации
XIa
ТФ
ТФ
VII
VIIa
IX
X
V
+
IXa
XI
Va
Xa
+
VIIIa
II
IIa
+
+
Тромбо
циты
VIII
+
102.
3-я фаза – распространение процессасвертывания крови
Внешний путь активации
XIa
ТФ
ТФ
VII
VIIa
XI
IX
X
V
+
XIII
IIa
+
+
Фибриноген
XIIIa
Фибрин
Тромбоциты
VIII
+
103.
XIIaКК
XII
ВМК
XIa
XI
IX
Внутренний путь
активации
IIa
104.
XIIaКК
XII
ВМК
XIa
XI
IX
Внутренний путь
активации
V
+
XIII
IIa
Фибриноген
+
XIIIa
Фибрин
Тромбоциты
VIII
105.
Внешний путь активацииXIIa
КК
XII
ВМК
XIa
ТФ
ТФ
VII
VIIa
XI
IX
Внутренний путь
активации
X
Va
+
+
XIII
IIa
Фибриноген
+
VIIIa
XIIIa
Фибрин
Общий путь
активации
























































 medicine
medicine








