Similar presentations:
Ввоз лекарственных средств на территорию РФ и вывоз лекарственных средств с территории РФ. Лекция 1
1.
Лекция 1Ввоз лекарственных средств на
территорию РФ и вывоз
лекарственных средств с
территории РФ
кафедра управления и экономики фармации
2.
Общие положенияВвоз и вывоз ЛС – элемент обращения ЛС
Глава 9
Федерального закона от 12.04.2010 №61
«Об обращении лекарственных средств»
Правила ввоза ЛС
для медицинского применения
ЛС и ИЛП для целей
обращения на
территории РФ
Группы ЛС, ввоз которых
регламентируется отдельным
постановлением Правительства
ЛП для оказания
гуманитарной помощи
или помощи при
чрезвычайных
ситуациях
ЛП, содержащие
НСиПВ и их
прекурсоры
Сильнодействующие и
ядовитые вещества,
не являющиеся
прекурсорами НСиПВ
3.
Порядок ввоза ЛС регламентируется:25.06.2023
Постановление Правительства РФ от 1.06.2021 г. № 853 «Об утверждении Правил ввоза
лекарственных средств для медицинского применения в Российскую Федерацию»;
Постановление Правительства РФ от 21.03.2011 г. № 181
«О порядке ввоза в Российскую Федерацию и вывоза из Российской Федерации наркотических
средств, психотропных веществ и их прекурсоров»
Постановление Правительства РФ от 5.03.2020 г. № 230
«О ввозе в Российскую Федерацию конкретной партии незарегистрированных лекарственных
препаратов, содержащих наркотические средства или психотропные вещества, для оказания
медицинской помощи по жизненным показаниям конкретного пациента или группы пациентов»;
Приказ Министерства здравоохранения РФ от 25.08.2021 г. № 880н
Постановление Правительства РФ от 16.03.1996 г. № 278
«О порядке ввоза в Российскую Федерацию и вывоза из Российской Федерации сильнодействующих
и ядовитых веществ, не являющихся прекурсорами наркотических средств и психотропных веществ»
«Об утверждении Административного регламента Министерства здравоохранения Российской
Федерации по предоставлению государственной услуги по выдаче заключений (разрешительных
документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или)
незарегистрированных лекарственных средств…»
3
4.
Ввоз конкретной партии ЛПЗарегистрированные
в ГРЛС
приобретенные
физическими лицами за
пределами Российской
Федерации и
предназначенные для
личного использования
25.06.2023
Незарегистрированные в
ГРЛС
Проведение
экспертизы ЛС
для регистрации
Проведение
клинических
исследований
для оказания
медицинской помощи
по жизненным
показаниям
конкретного пациента,
«Круг добра»
4
5.
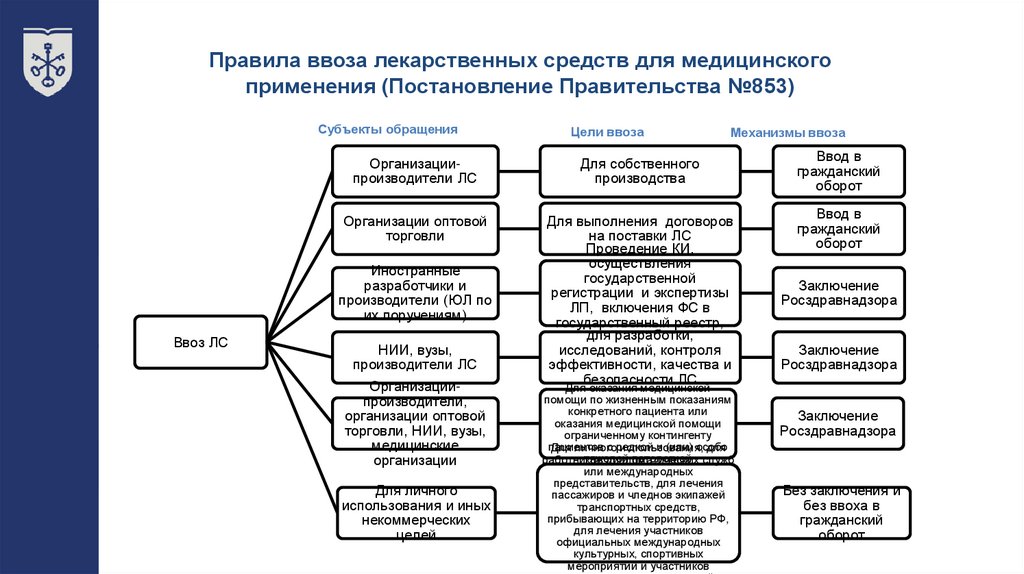
Правила ввоза лекарственных средств для медицинскогоприменения (Постановление Правительства №853)
Субъекты обращения
Механизмы ввоза
Организациипроизводители ЛС
Для собственного
производства
Организации оптовой
торговли
Для выполнения договоров
на поставки ЛС
Проведение КИ,
осуществления
государственной
регистрации и экспертизы
ЛП, включения ФС в
государственный реестр,
для разработки,
контроль
качества
исследований, контроля
эффективности, качества и
безопасности ЛС
Иностранные
разработчики и
производители (ЮЛ по
их поручениям)
Ввоз ЛС
Цели ввоза
НИИ, вузы,
производители ЛС
Организациипроизводители,
организации оптовой
торговли, НИИ, вузы,
медицинские
организации
Для личного
использования и иных
некоммерческих
целей
Для оказания медицинской
помощи по жизненным показаниям
конкретного пациента или
оказания медицинской помощи
ограниченному контингенту
пациентов
с редкой
и (или) особо
Для личного
использования,
для
тяжелой
патологией служб
работников
дипломатических
или международных
представительств, для лечения
пассажиров и чледнов экипажей
транспортных средств,
прибывающих на территорию РФ,
для лечения участников
официальных международных
культурных, спортивных
мероприятий и участников
Ввод в
гражданский
оборот
Ввод в
гражданский
оборот
Заключение
Росздравнадзора
Заключение
Росздравнадзора
Заключение
Росздравнадзора
Без заключения и
без ввоха в
гражданский
оборот
6.
При прибытии ЛС в РФ в таможенныеорганы РФ представляются:
• документы соответствия качества;
• в отдельных случаях разрешительный
документ на ввоз партии (на основании
заявления ЮЛ).
! Рассмотрение МЗ РФ заявления не более 5
раб. дней
25.06.2023
6
7.
Ввоз ЛП для личного использования инекоммерческих целей
- Запрещен ввоз фальсифицированных,
недоброкачественных, контрафактных
ЛП;
- При ввозе СДиЯВ – подтверждающие
документы/их копии.
25.06.2023
7
8.
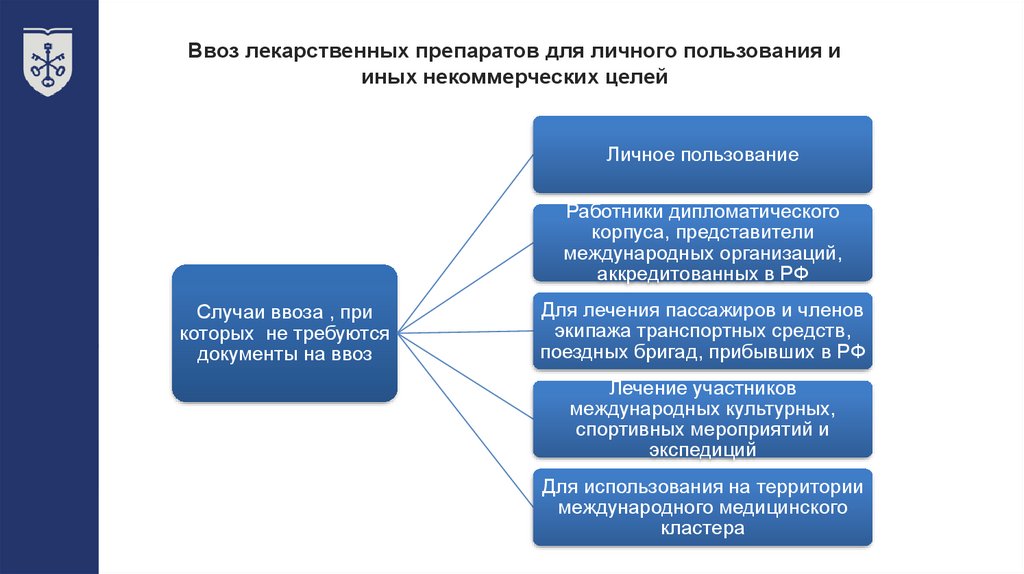
Ввоз лекарственных препаратов для личного пользования ииных некоммерческих целей
Личное пользование
Работники дипломатического
корпуса, представители
международных организаций,
аккредитованных в РФ
Случаи ввоза , при
которых не требуются
документы на ввоз
Для лечения пассажиров и членов
экипажа транспортных средств,
поездных бригад, прибывших в РФ
Лечение участников
международных культурных,
спортивных мероприятий и
экспедиций
Для использования на территории
международного медицинского
кластера
9.
Порядок получения заключения дляввоза ЛС на территорию РФ
Группы ЛС, для ввоза которых требуется заключение МЗ РФ
ЛС, предназначенные
для КИ
ЛС для разработки,
исследований контроля
эффективности,
качества и
безопасности ЛС
ЛП для оказания медицинской помощи
по жизненным показаниям для
конкретного пациента, контингента
«Круг добра»
Заявление и пакет электронных документов →Единый портал государственных и
муниципальных услуг (ЕПГУ)
В течение 5 раб. дней заключение поступает в личный кабинет ЕПГУ
10.
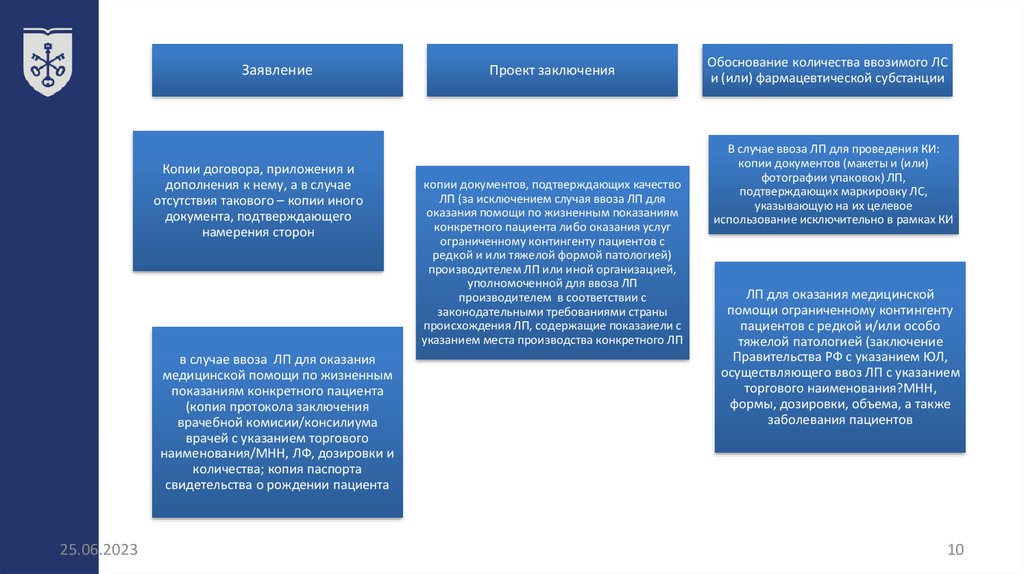
ЗаявлениеКопии договора, приложения и
дополнения к нему, а в случае
отсутствия такового – копии иного
документа, подтверждающего
намерения сторон
в случае ввоза ЛП для оказания
медицинской помощи по жизненным
показаниям конкретного пациента
(копия протокола заключения
врачебной комисии/консилиума
врачей с указанием торгового
наименования/МНН, ЛФ, дозировки и
количества; копия паспорта
свидетельства о рождении пациента
25.06.2023
Проект заключения
копии документов, подтверждающих качество
ЛП (за исключением случая ввоза ЛП для
оказания помощи по жизненным показаниям
конкретного пациента либо оказания услуг
ограниченному контингенту пациентов с
редкой и или тяжелой формой патологией)
производителем ЛП или иной организацией,
уполномоченной для ввоза ЛП
производителем в соответствии с
законодательными требованиями страны
происхождения ЛП, содержащие показаиели с
указанием места производства конкретного ЛП
Обоснование количества ввозимого ЛС
и (или) фармацевтической субстанции
В случае ввоза ЛП для проведения КИ:
копии документов (макеты и (или)
фотографии упаковок) ЛП,
подтверждающих маркировку ЛС,
указывающую на их целевое
использование исключительно в рамках КИ
ЛП для оказания медицинской
помощи ограниченному контингенту
пациентов с редкой и/или особо
тяжелой патологией (заключение
Правительства РФ с указанием ЮЛ,
осуществляющего ввоз ЛП с указанием
торгового наименования?МНН,
формы, дозировки, объема, а также
заболевания пациентов
10
11.
25.06.2023• МЗ РФ ведет реестр выданных
заключений.
• Организации, осуществившие ввоз ЛП для
оказания медицинской помощи по
жизненным показаниям конкретного
пациента, а для оказания медицинской
помощи ограниченному контингенту
пациентов с редкой и (или) особо тяжелой
патологией, в течение 10 рабочих дней со
дня получения ЛП уведомляют об этом
МЗ РФ в форме электронного документа.
11
12.
Ввоз наркотических средств и психотропныхвеществ и их прекурсоров на территорию РФ с
территорий государств-членов Евразийского
экономического союза
Юридические лица, имеющие лицензию на внешнеторговую деятельность и
лицензию на оборот наркотических средств и психотропных веществ и их
прекурсоров
ГУ
П
Наркотические
средства и
психотропные
вещества списка I, II,
Прекурсоры списка I и
таблицы I списка IV
Ю
Л
Психотропные
вещества списка III
Прекурсоры таблицы
II, III списка IV
13.
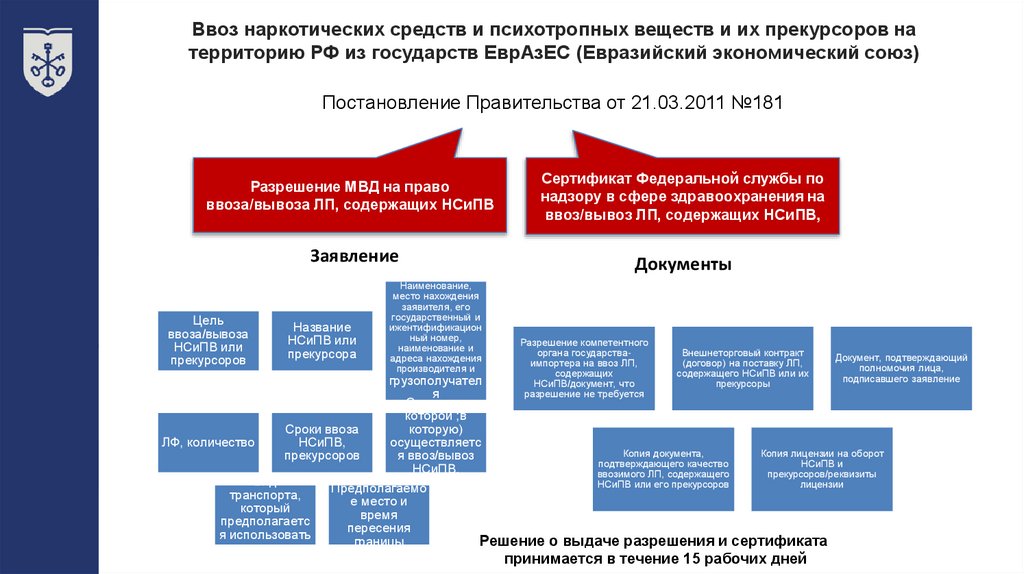
Ввоз наркотических средств и психотропных веществ и их прекурсоров натерриторию РФ из государств ЕврАзЕС (Евразийский экономический союз)
Постановление Правительства от 21.03.2011 №181
Разрешение МВД на право
ввоза/вывоза ЛП, содержащих НСиПВ
Заявление
Цель
ввоза/вывоза
НСиПВ или
прекурсоров
Название
НСиПВ или
прекурсора
Наименование,
место нахождения
заявителя, его
государственный и
ижентифификацион
ный номер,
наименование и
адреса нахождения
производителя и
Сертификат Федеральной службы по
надзору в сфере здравоохранения на
ввоз/вывоз ЛП, содержащих НСиПВ,
Документы
Разрешение компетентного
органа государстваимпортера на ввоз ЛП,
содержащих
НСиПВ/документ, что
разрешение не требуется
Внешнеторговый контракт
(договор) на поставку ЛП,
содержащего НСиПВ или их
прекурсоры
Документ, подтверждающий
полномочия лица,
подписавшего заявление
грузополучател
я
Страна из
которой ;в
которую)
Сроки ввоза
осуществляетс
НСиПВ,
ЛФ, количество
Копия документа,
Копия лицензии на оборот
я ввоз/вывоз
прекурсоров
подтверждающего качество
НСиПВ и
НСиПВ,
ввозимого ЛП, содержащего
прекурсоров/реквизиты
Вид
прекурсоров
НСиПВ
или
его
прекурсоров
лицензии
Предполагаемо
транспорта,
е место и
который
время
предполагаетс
пересения
я использовать
границы
Решение о выдаче разрешения и сертификата
при ввозе
принимается в течение 15 рабочих дней
14.
Ввоз наркотических средств и психотропныхвеществ и их прекурсоров на территорию РФ с
территорий государств, не входящих в
Евразийский экономический союз
Юридические лица, имеющие лицензию на внешнеторговую деятельность и
лицензию на оборот наркотических средств и психотропных веществ и их
прекурсоров
Наркотические
МГ
У
средства и
психотропные
вещества списка I, II,
Прекурсоры таблицы I
списка IV
Ю
Л
Психотропные
вещества списка III
Прекурсоры
таблицы II, III
списка IV
Разовая лицензия Министерства промышленности и торговли РФ
Разрешение МВД на право
ввоза/вывоза ЛП, содержащих НСиПВ
Сертификат Федеральной службы по
надзору в сфере здравоохранения на
ввоз/вывоз ЛП, содержащих НСиПВ,
15.
Ввоз незарегистрированных наркотических средств ипсихотропных веществ и их прекурсоров на территорию РФ
Ввозятся незарегистрированные НСиПВ, включенные в перечень заболеваний и состояний,
для оказания медицинской помощи по жизненным показаниям конкретного пациента или группы
пациентов, который утверждается МЗ РФ
Эпилепсия
Эпилептически
й статус
Паллиативная
помощь
Диазепин, мидазолам, клобазам, лоразепам, фенобарбитал в различных ЛФ
Ввоз таких ЛП осуществляет ФГУП «Московский эндокринный завод»
по разрешительным документам для зарегистрированных НСиПВ
(разрешение МВД, сертификат Федеральной службы по надзору в сфере здравоохранения)
16.
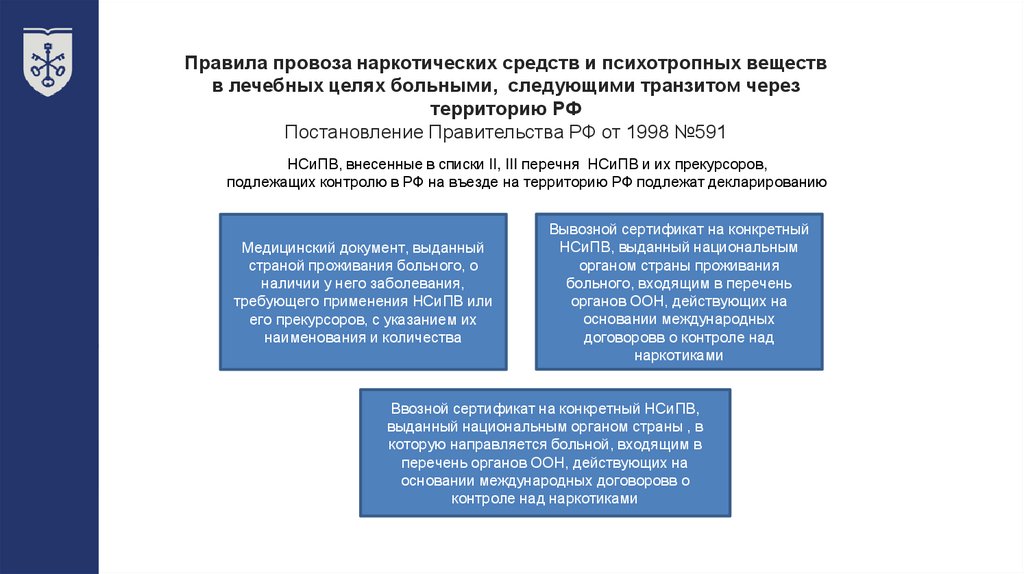
Правила провоза наркотических средств и психотропных веществв лечебных целях больными, следующими транзитом через
территорию РФ
Постановление Правительства РФ от 1998 №591
НСиПВ, внесенные в списки II, III перечня НСиПВ и их прекурсоров,
подлежащих контролю в РФ на въезде на территорию РФ подлежат декларированию
Медицинский документ, выданный
страной проживания больного, о
наличии у него заболевания,
требующего применения НСиПВ или
его прекурсоров, с указанием их
наименования и количества
Вывозной сертификат на конкретный
НСиПВ, выданный национальным
органом страны проживания
больного, входящим в перечень
органов ООН, действующих на
основании международных
договоровв о контроле над
наркотиками
Ввозной сертификат на конкретный НСиПВ,
выданный национальным органом страны , в
которую направляется больной, входящим в
перечень органов ООН, действующих на
основании международных договоровв о
контроле над наркотиками
17.
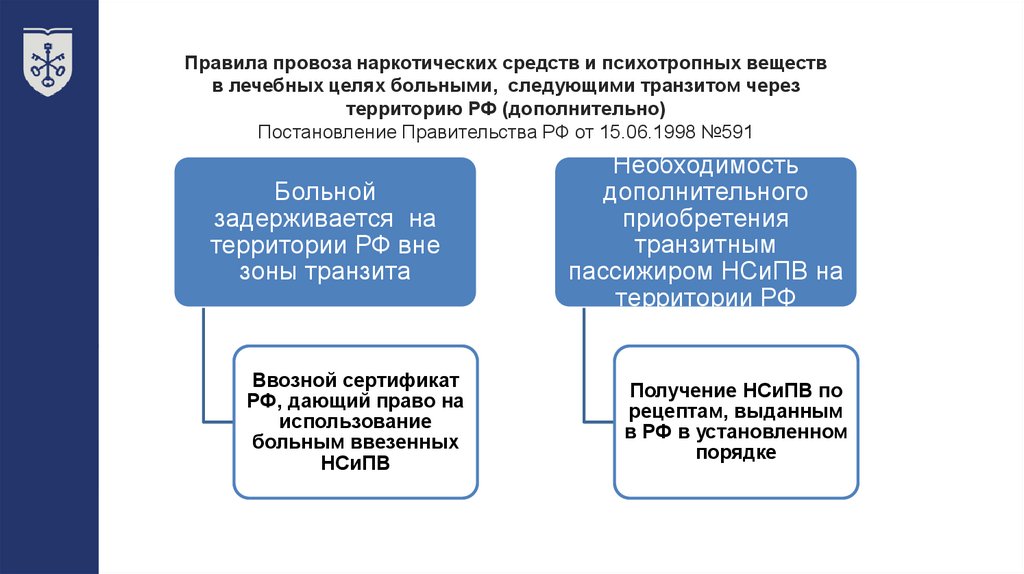
Правила провоза наркотических средств и психотропных веществв лечебных целях больными, следующими транзитом через
территорию РФ (дополнительно)
Постановление Правительства РФ от 15.06.1998 №591
Больной
задерживается на
территории РФ вне
зоны транзита
Ввозной сертификат
РФ, дающий право на
использование
больным ввезенных
НСиПВ
Необходимость
дополнительного
приобретения
транзитным
пассижиром НСиПВ на
территории РФ
Получение НСиПВ по
рецептам, выданным
в РФ в установленном
порядке
18.
Порядок ввоза и вывоза ядовитых и сильнодействующих ЛПдля личного пользования и иных некоммерческих целей
Лицензия на ввоз сильнодействующих и ядовытых
веществ, не являющихся прекурсорами НСиПВ
Выдается Министерством промышленности и
торговли РФ
Разрешение Федеральной службы по надзору в сфере здравоохранения
Письмо-запрос
Сведения о наличии
лицензии на производство ЛС
или осуществление
фармацевтической
деятельности
Копия контракта на поставку
Ходатайство органа
здравоохранения,
подтверждающего
целесообразность ввоза
сильнодействующих и
ядовитых веществ
Письменное обязательство
заявителя в территориальный
орган МВД РФ отчета о
фактическом ввозе в РФ и
вывозе из РФ
сильнодействующих и
ядовитых веществ
Нотариально заверенные
копии учредительных
документов экспортера
(импортера)
19.
Ввоз на территорию РФ лекарственных препаратовдля оказания гуманитарной помощи
ЛП, ввозимые на территорию РФ,
должны быть зарегистрированы и
включены в государственный
реестр ЛС для медицинских
средств
Ввоз осуществляется при
наличии разрешения,
выданного МЗ РФ
Срок действия разрешения
– 1 год с даты выдачи
20.
Ввоз медицинской техники, медицинскиеизделия
Ввоз осуществляет
производитель
МИ/уполномоченный
представитель
Ввоз только
зарегистрированных
МИ
Разрешение на ввоз
разовое
(Росздравнадзор)
Срок действия 6
месяцев
21.
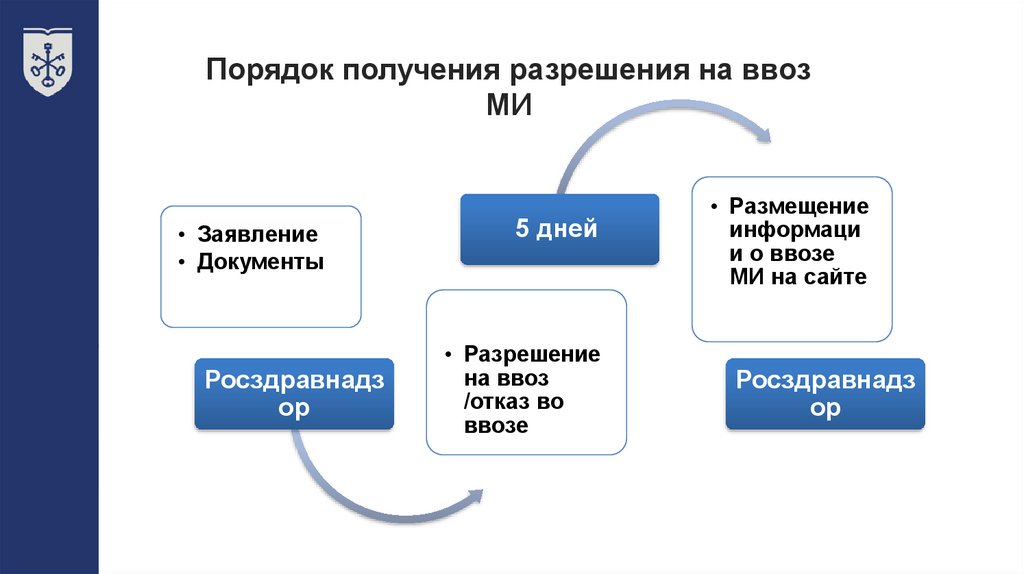
Порядок получения разрешения на ввозМИ
• Заявление
• Документы
Росздравнадз
ор
5 дней
• Разрешение
на ввоз
/отказ во
ввозе
• Размещение
информаци
и о ввозе
МИ на сайте
Росздравнадз
ор
22.
Ввод лекарственных средств,иммунобиологических ЛП в гражданский
оборот
Зарегистрированные ЛС, ввозимые на территории РФ должны быть
введены в гражданский оборот.
Ввод в гражданский оборот – это процесс оценки соответствия
качества ввозимых ЛС и их соответствия требованиям,
установленным при их государственной регистрации.
Результатом оценки соответствия является выдача/отказ в
выдаче разрешения на ввод в гражданский оборот ЛС и ИБЛП
Федеральная служба по надзору в сфере здравоохранения
Личный кабинет организации-импортера в автоматизированной
информационной системе
Постановление Правительства от 26.11.2019 №1510
23.
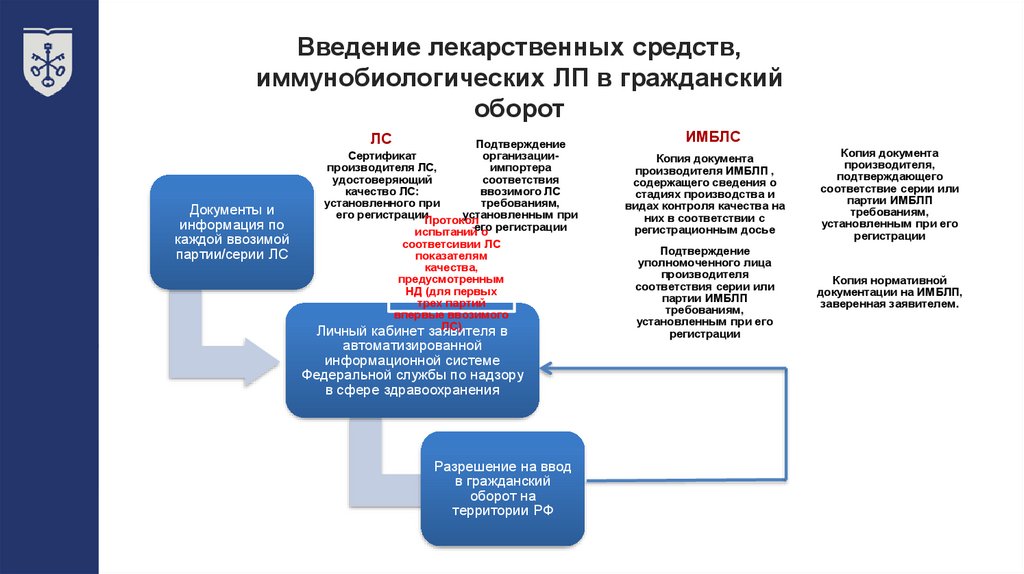
Введение лекарственных средств,иммунобиологических ЛП в гражданский
оборот
Документы и
информация по
каждой ввозимой
партии/серии ЛС
ЛС
Подтверждение
Сертификат
организациипроизводителя ЛС,
импортера
удостоверяющий
соответствия
качество ЛС:
ввозимого ЛС
установленного при
требованиям,
его регистрацииПротокол
установленным при
испытанийего
о регистрации
соответсивии ЛС
показателям
качества,
предусмотренным
НД (для первых
трех партий
впервые ввозимого
ЛС)
Личный кабинет заявителя
в
автоматизированной
информационной системе
Федеральной службы по надзору
в сфере здравоохранения
Разрешение на ввод
в гражданский
оборот на
территории РФ
ИМБЛС
Копия документа
производителя ИМБЛП ,
содержащего сведения о
стадиях производства и
видах контроля качества на
них в соответствии с
регистрационным досье
Копия документа
производителя,
подтверждающего
соответствие серии или
партии ИМБЛП
требованиям,
установленным при его
регистрации
Подтверждение
уполномоченного лица
производителя
соответствия серии или
партии ИМБЛП
требованиям,
установленным при его
регистрации
Копия нормативной
документации на ИМБЛП,
заверенная заявителем.
24.
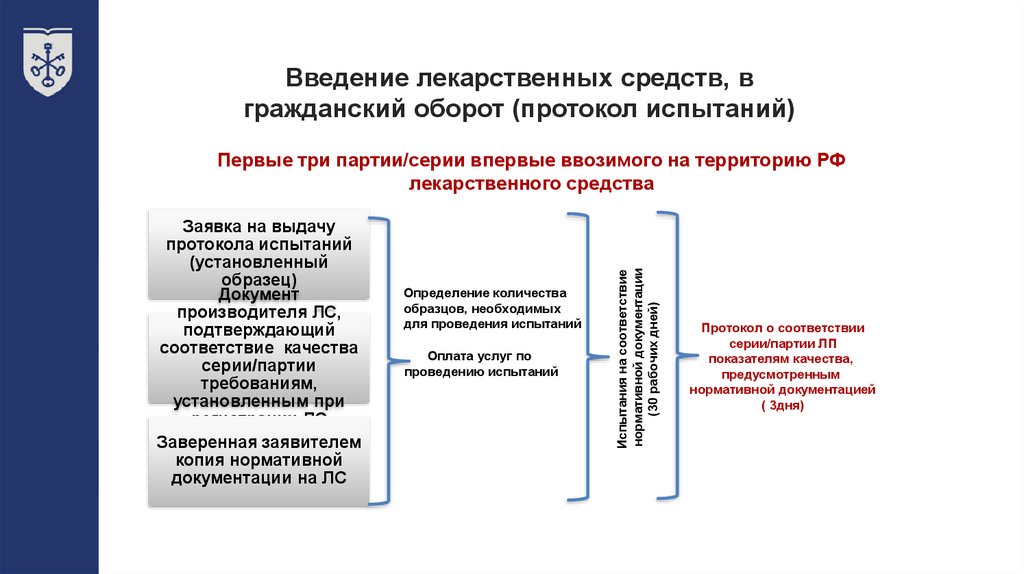
Введение лекарственных средств, вгражданский оборот (протокол испытаний)
Заявка на выдачу
протокола испытаний
(установленный
образец)
Документ
производителя ЛС,
подтверждающий
соответствие качества
серии/партии
требованиям,
установленным при
регистрации ЛС
Заверенная заявителем
копия нормативной
документации на ЛС
Определение количества
образцов, необходимых
для проведения испытаний
Оплата услуг по
проведению испытаний
Испытания на соответствие
нормативной документации
(30 рабочих дней)
Первые три партии/серии впервые ввозимого на территорию РФ
лекарственного средства
Протокол о соответствии
серии/партии ЛП
показателям качества,
предусмотренным
нормативной документацией
( 3дня)
25.
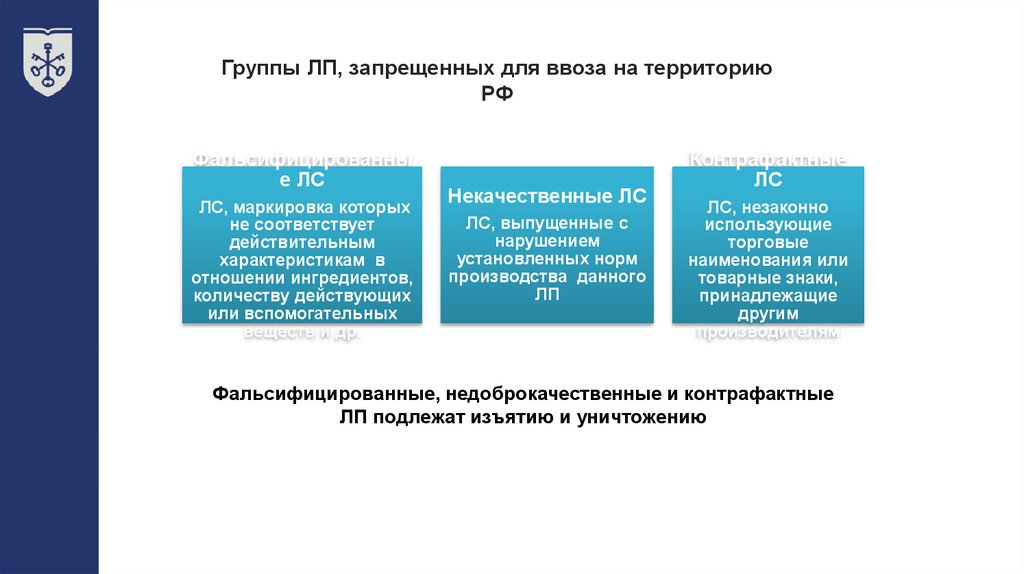
Группы ЛП, запрещенных для ввоза на территориюРФ
Фальсифицированны
е ЛС
ЛС, маркировка которых
не соответствует
действительным
характеристикам в
отношении ингредиентов,
количеству действующих
или вспомогательных
веществ и др.
Некачественные ЛС
ЛС, выпущенные с
нарушением
установленных норм
производства данного
ЛП
Контрафактные
ЛС
ЛС, незаконно
использующие
торговые
наименования или
товарные знаки,
принадлежащие
другим
производителям
Фальсифицированные, недоброкачественные и контрафактные
ЛП подлежат изъятию и уничтожению
26.
До конца 2024 г. разрешен ввоз в РФ и обращениезарегистрированных ЛП в упаковках, предназначенных для
обращения в иностранных государствах, если:
• - существует дефектура или риск дефектуры такого ЛП в
связи с антироссийскими санкциями,
• - при этом ввозимые лекарства соответствуют требованиям,
установленным при их регистрации, кроме требований к
первичной и вторичной упаковке,
• - но на вторичной (потребительской) упаковке ввезенных
ЛП есть самоклеящаяся этикетка на русском языке.
Пример: «Амоксиклав 2X» в дозировке 875 мг + 125 мг в
форме таблеток, зарегистрирован в Белоруссии.
25.06.2023
26
27.
25.06.202327
28.
Гражданка Израиля собирается приехать вРоссию, у неё подтверждённый диагноз СДВГ,
в качестве ЛП назначен Аддералл (содержит
амфетамин), ввоз которого в Россию
запрещён. Можно ли ввозить Аддералл для
личного использования? Какие для этого
необходимы документы? Есть ли конкретные
ограничения по количеству ввозимого
лекарства?
25.06.2023
28

















 economics
economics law
law








