Similar presentations:
Летняя практика по генетике. Генетический аппарат клетки
1.
Летняя практика по генетикеГенетический аппарат клетки
2.
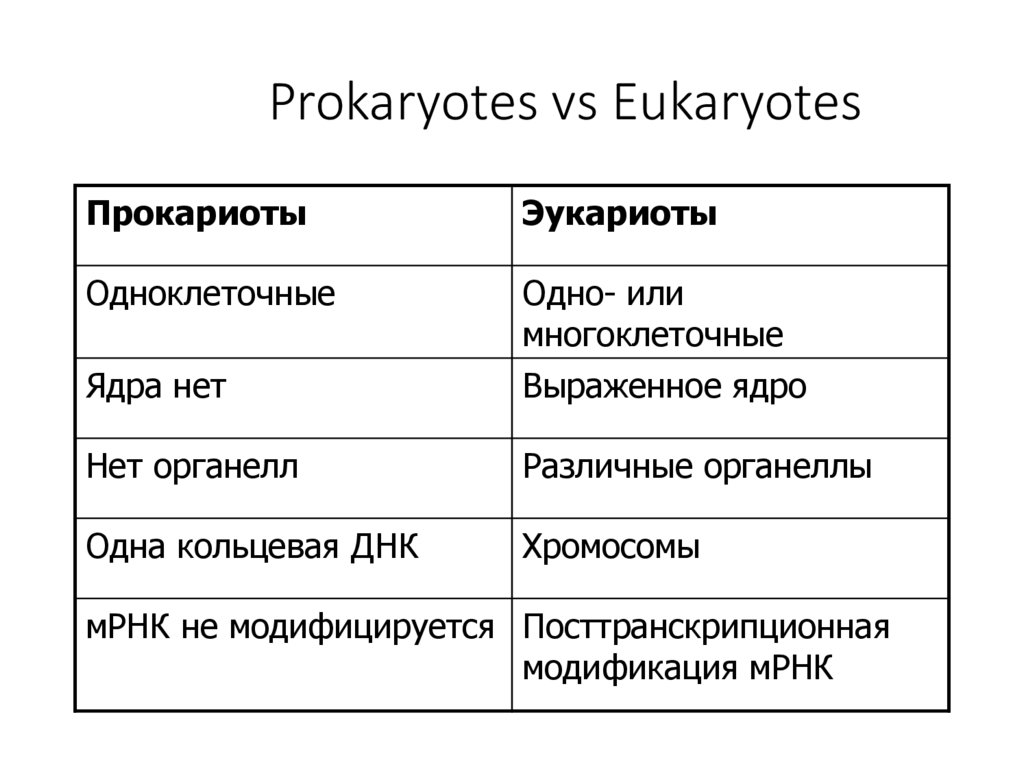
Prokaryotes vs EukaryotesПрокариоты
Эукариоты
Одноклеточные
Ядра нет
Одно- или
многоклеточные
Выраженное ядро
Нет органелл
Различные органеллы
Одна кольцевая ДНК
Хромосомы
мРНК не модифицируется Посттранскрипционная
модификация мРНК
3.
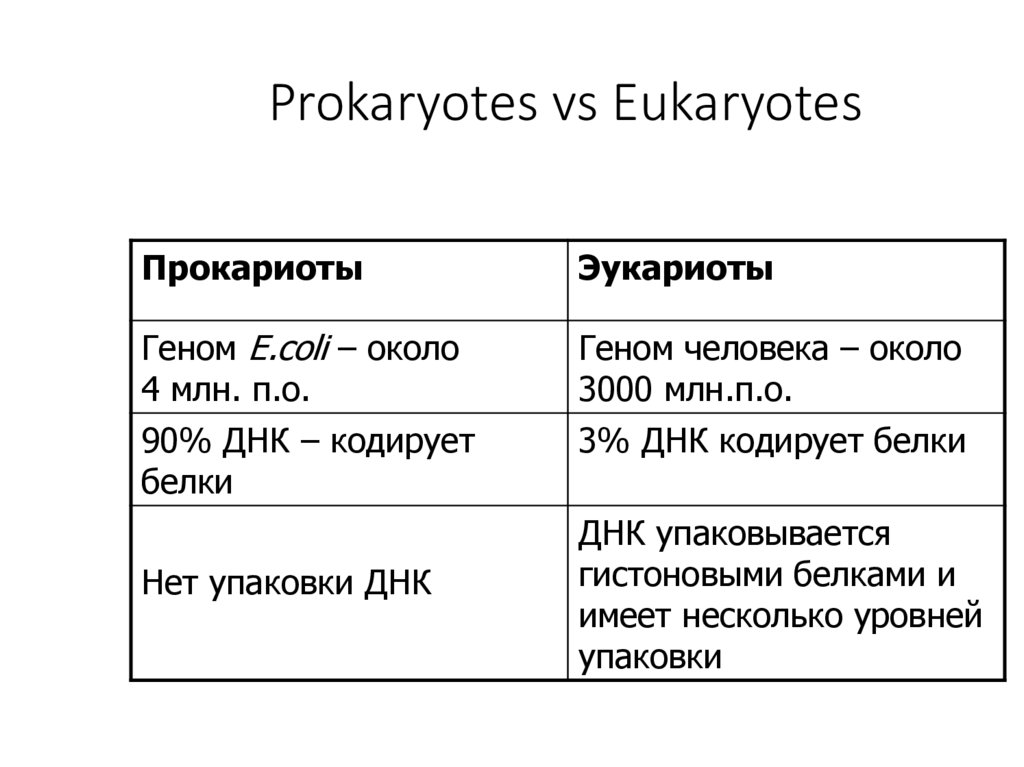
Prokaryotes vs EukaryotesПрокариоты
Эукариоты
Геном E.coli – около
4 млн. п.о.
90% ДНК – кодирует
белки
Геном человека – около
3000 млн.п.о.
3% ДНК кодирует белки
Нет упаковки ДНК
ДНК упаковывается
гистоновыми белками и
имеет несколько уровней
упаковки
4.
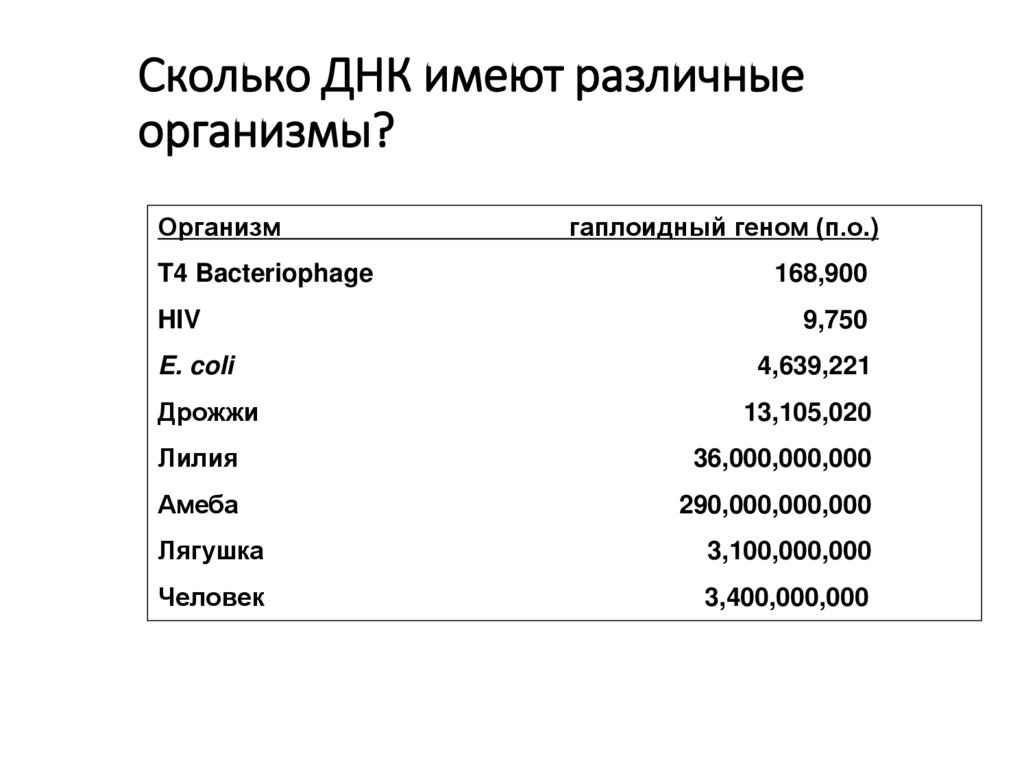
Сколько ДНК имеют различныеорганизмы?
Организм
T4 Bacteriophage
HIV
гаплоидный геном (п.о.)
168,900
9,750
E. coli
4,639,221
Дрожжи
13,105,020
Лилия
36,000,000,000
Амеба
290,000,000,000
Лягушка
3,100,000,000
Человек
3,400,000,000
5.
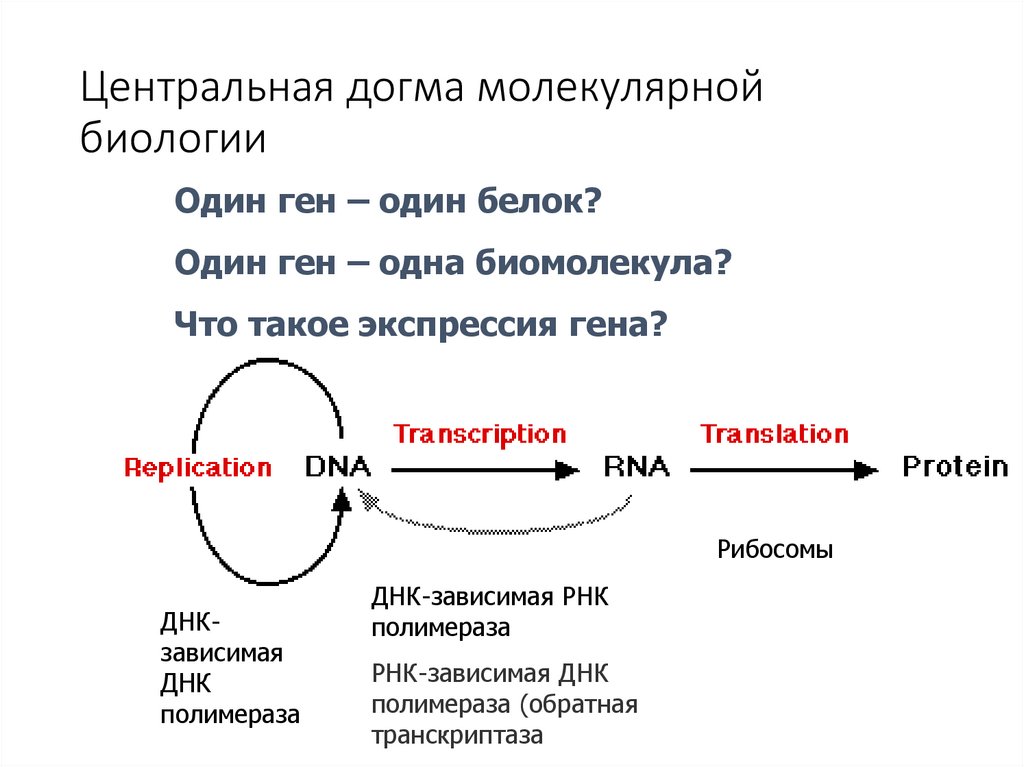
Центральная догма молекулярнойбиологии
Один ген – один белок?
Один ген – одна биомолекула?
Что такое экспрессия гена?
Рибосомы
ДНКзависимая
ДНК
полимераза
ДНК-зависимая РНК
полимераза
РНК-зависимая ДНК
полимераза (обратная
транскриптаза
6.
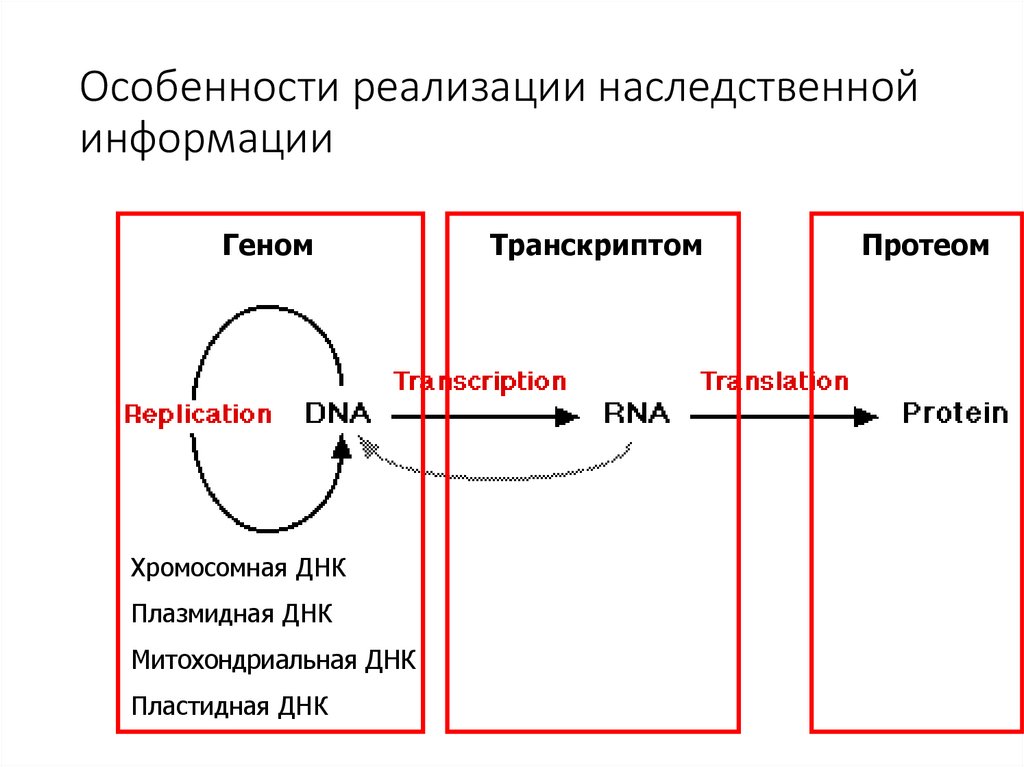
Особенности реализации наследственнойинформации
Геном
Хромосомная ДНК
Плазмидная ДНК
Митохондриальная ДНК
Пластидная ДНК
Транскриптом
Протеом
7.
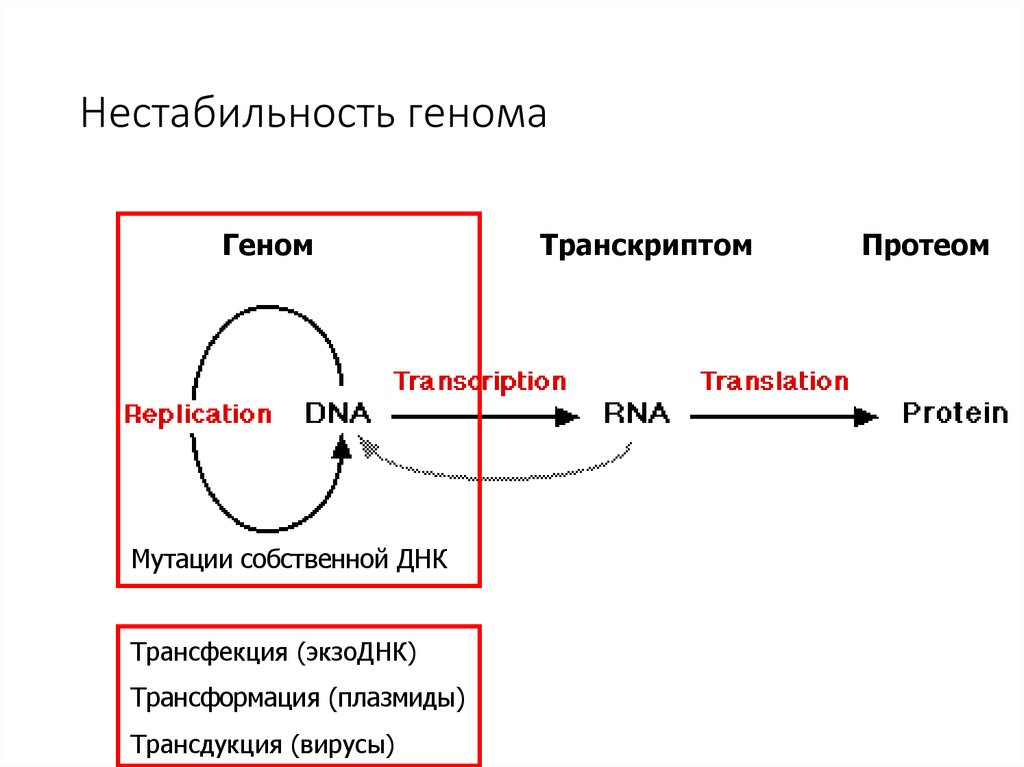
Нестабильность геномаГеном
Мутации собственной ДНК
Трансфекция (экзоДНК)
Трансформация (плазмиды)
Трансдукция (вирусы)
Транскриптом
Протеом
8.
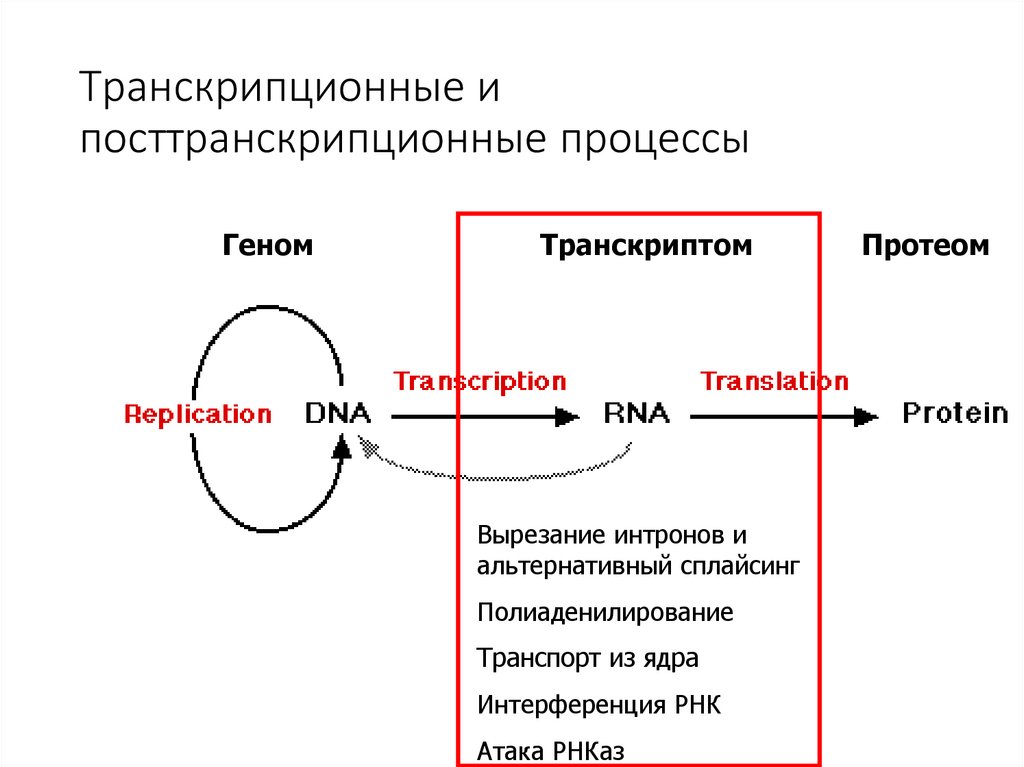
Транскрипционные ипосттранскрипционные процессы
Геном
Транскриптом
Вырезание интронов и
альтернативный сплайсинг
Полиаденилирование
Транспорт из ядра
Интерференция РНК
Атака РНКаз
Протеом
9.
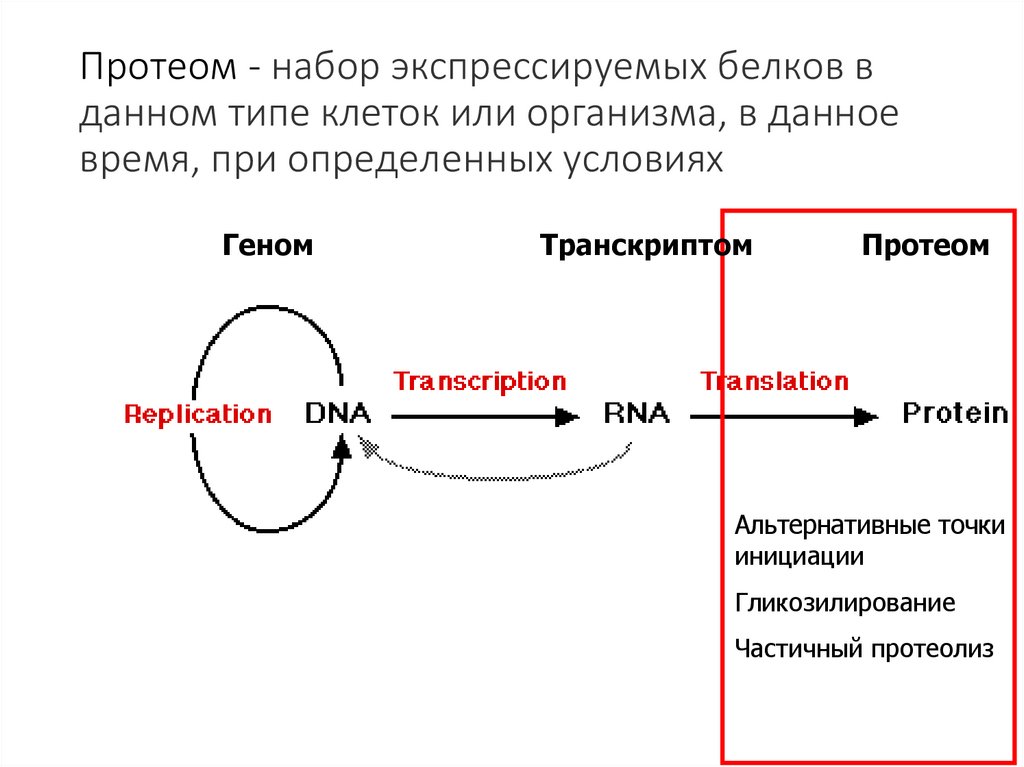
Протеом - набор экспрессируемых белков вданном типе клеток или организма, в данное
время, при определенных условиях
Геном
Транскриптом
Протеом
Альтернативные точки
инициации
Гликозилирование
Частичный протеолиз
10.
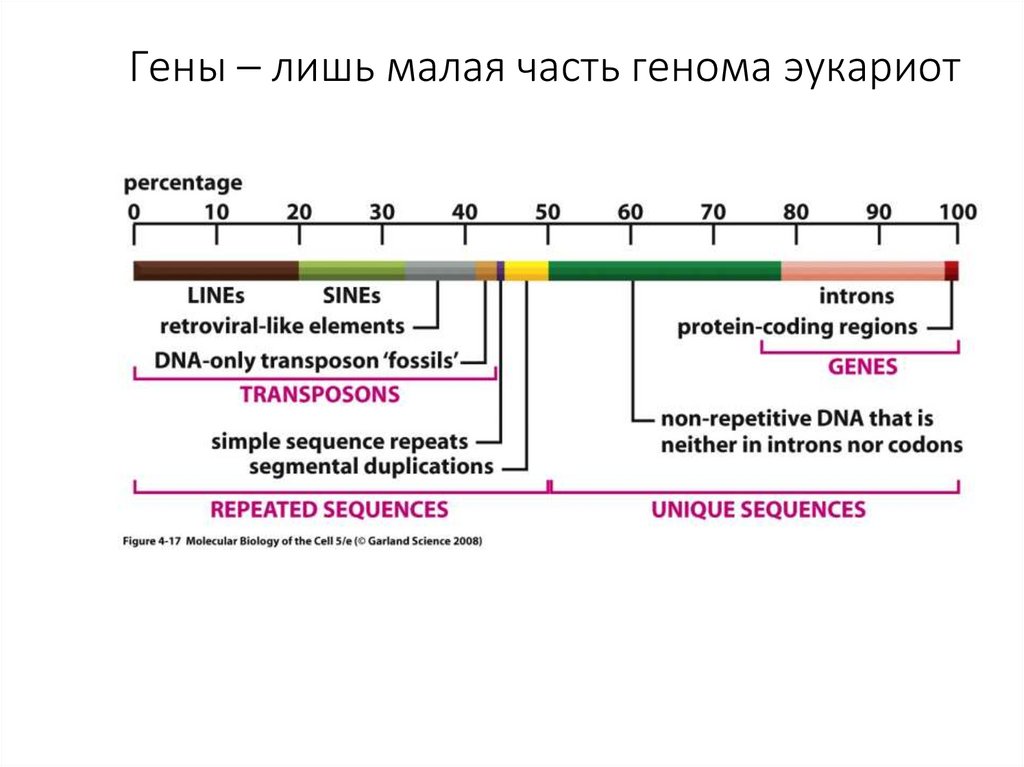
Гены – лишь малая часть генома эукариот11.
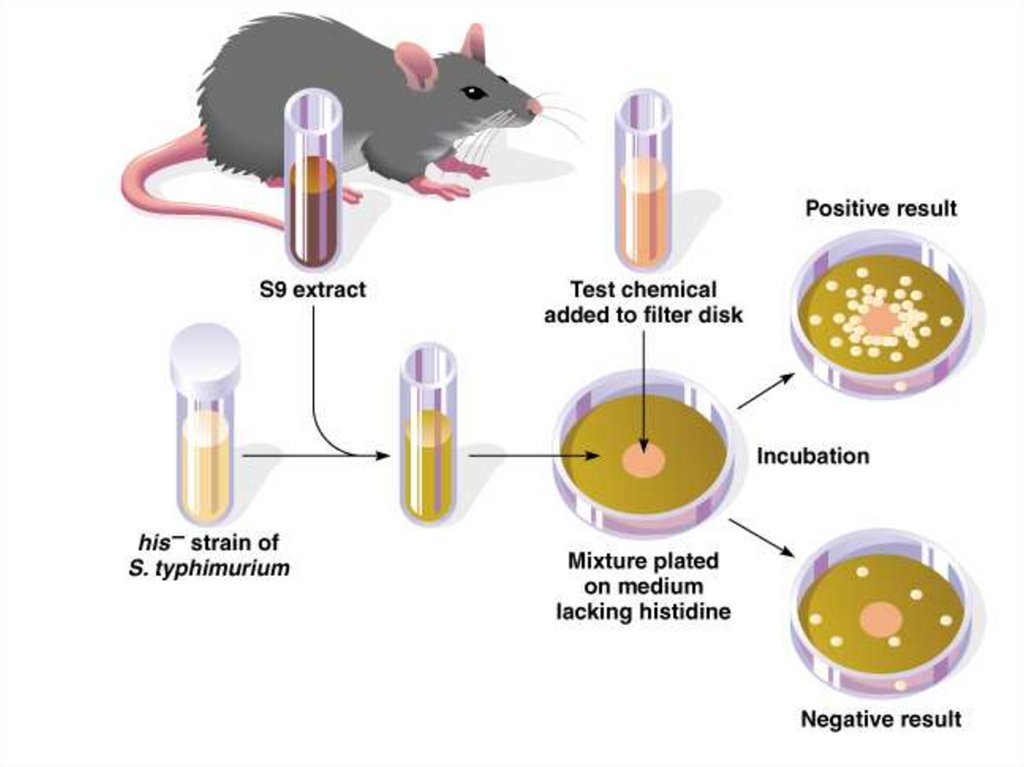
Тест Эймса – генетическийтест для оценки
мутагенности веществ
12.
13.
• Исследование мутагенности вещества проводится на этапедоклинического изучения его безопасности
• Изучение мутагенности на млекопитающих требует усилий,
затрат и времени, в то время как ТЭ позволяет быстро и недорого
отобрать возможные мутагены для их дальнейшего изучения
• Тест Эймса учитывает генные мутации к прототрофности по
гистидину
14.
Тест-объект• Гистидинзависимые ауксотрофные
штаммы Salmonella Typhimurium
• Штаммы несут мутацию замены
оснований (ТА 100 и ТА 102) или сдвига
рамки считывания (ТА 98)
гистидинового оперона
• Делеция гена uvrB приводит к
нарушению эксцизионной репарации
• Мутация rfa увеличивает
проницаемость клеточной стенки
• Плазмида rKM101 кодирует
устойчивость к ампицилину
• В целом повышение чувствительности
ТЭ идет за счет конструирования новых
штаммов
15.
Протокол эксперимента• В расплавленный полужидкий агар вносят суспензию бактерий,
раствор испытуемого вещества (возможен вариант с дисками),
активирующую смесь
• Смесь наслаивают на нижний селективный агар в чашки
• Инкубируют при 37°С 48 часов и учитывают количество колоний
ревертантов от ауксотрофности по гистидину к прототрофности
• Если вещество мутагенно, количество ревертантов на опытных
чашках превышает их количество в контоле
16.
17.
Методы молекулярнойбиологии
Выделение ДНК
18.
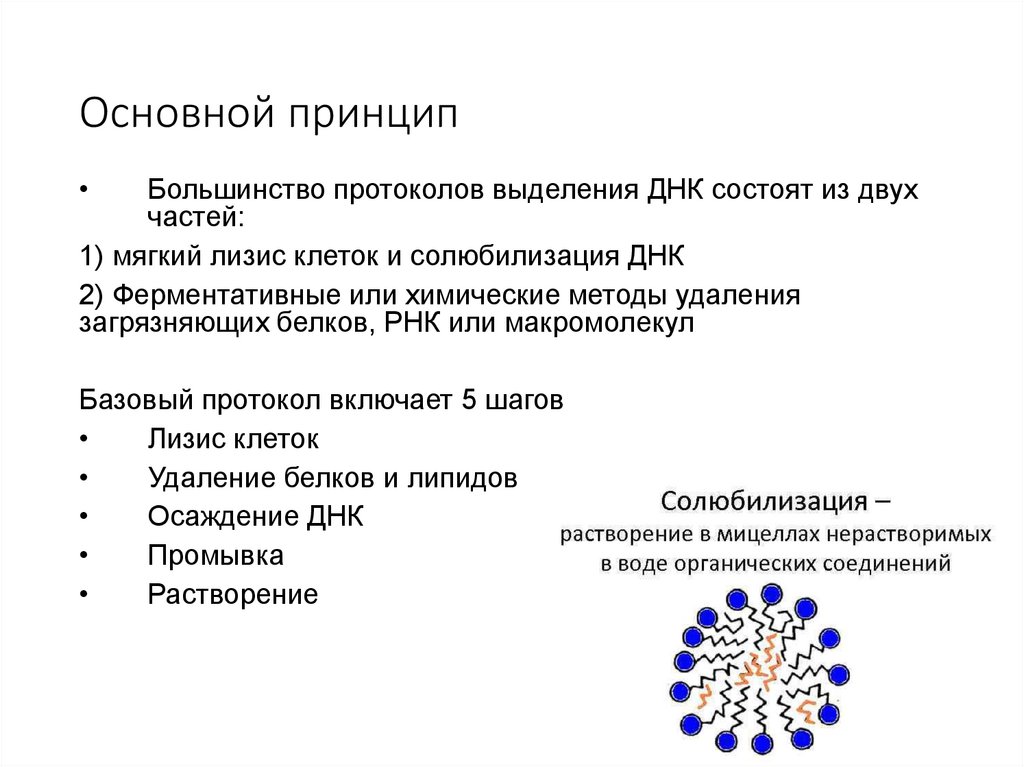
Основной принципБольшинство протоколов выделения ДНК состоят из двух
частей:
1) мягкий лизис клеток и солюбилизация ДНК
2) Ферментативные или химические методы удаления
загрязняющих белков, РНК или макромолекул
Базовый протокол включает 5 шагов
Лизис клеток
Удаление белков и липидов
Осаждение ДНК
Промывка
Растворение
19.
20.
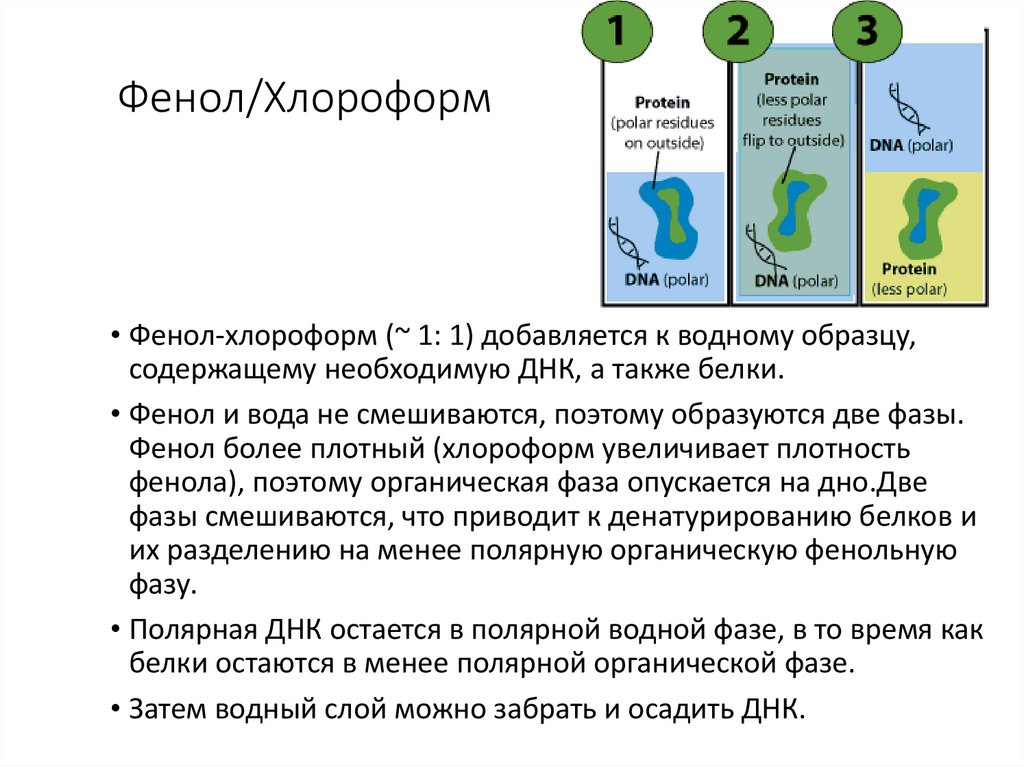
Фенол/Хлороформ• Фенол-хлороформ (~ 1: 1) добавляется к водному образцу,
содержащему необходимую ДНК, а также белки.
• Фенол и вода не смешиваются, поэтому образуются две фазы.
Фенол более плотный (хлороформ увеличивает плотность
фенола), поэтому органическая фаза опускается на дно.Две
фазы смешиваются, что приводит к денатурированию белков и
их разделению на менее полярную органическую фенольную
фазу.
• Полярная ДНК остается в полярной водной фазе, в то время как
белки остаются в менее полярной органической фазе.
• Затем водный слой можно забрать и осадить ДНК.
21.
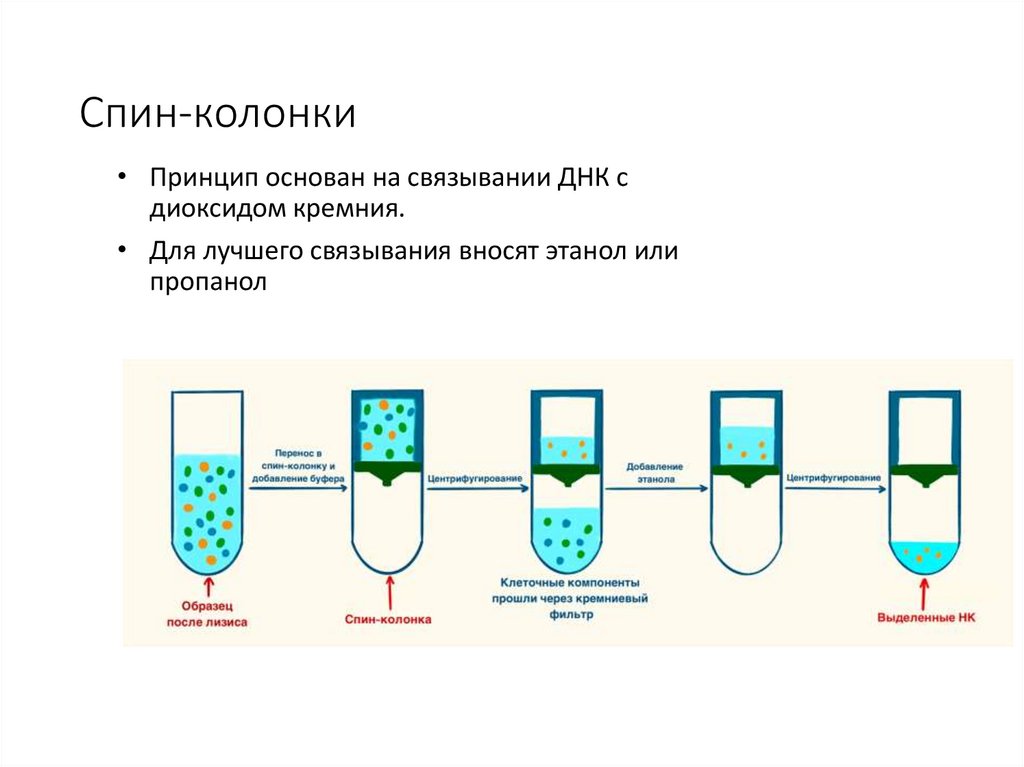
Спин-колонки• Принцип основан на связывании ДНК с
диоксидом кремния.
• Для лучшего связывания вносят этанол или
пропанол
22.
Оценка качествавыделенной ДНК
23.
• Наличие примесных белков (с помощьюспектрофотометра)
• Целостность молекул (с помощью
электрофореза в агарозном геле)
24.
Спектрофотометрия• Измеряют оптическую плотность раствора ДНК при длине волны
260 нм. Нуклеиновые кислоты (НК) поглощают УФ излучение в
области 240–290 нм с максимумом при 260 нм
• Аминокислоты триптофан, тирозин и фенилаланин имеющих
максимум поглощения при 280 нм
• Для чистых образцов ДНК соотношение оптических плотностей
полученных при измерении 260 нм и 280 нм должно быть более
1,8
• По известной оптической плотности раствора можно рассчитать
концентрацию (мкг/мкл) по специальным формулам
25.
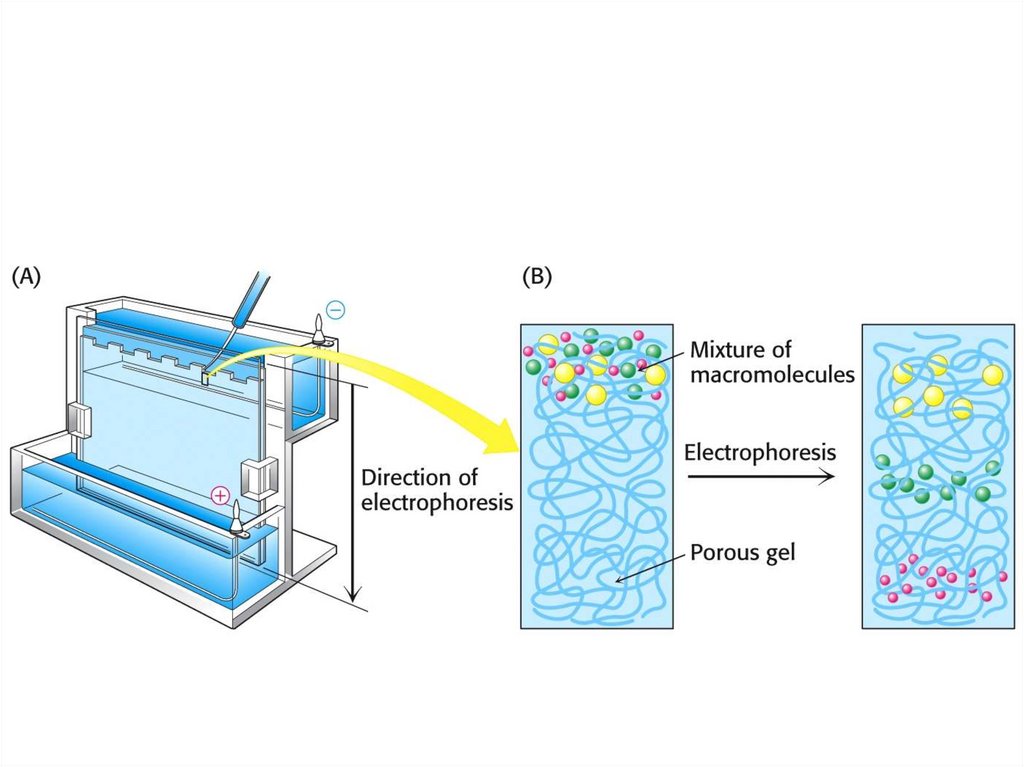
Принципы электрофорезаЭлектрофорез-это перенос
заряженных частиц (белки и
нуклеотиды) в буферном
растворе или в плотной среде
(подложка) под воздействием
электрического поля.
Используется для разделения
макромолекул
26.
Принципы электрофореза:Заряд частиц
• Когда заряженные
молекулы помещаются в
электрическое поле, они
мигрируют в
направлении либо
положительного (анод),
либо отрицательного
(катод) полюса в
зависимости от их заряда.
26
27.
28.
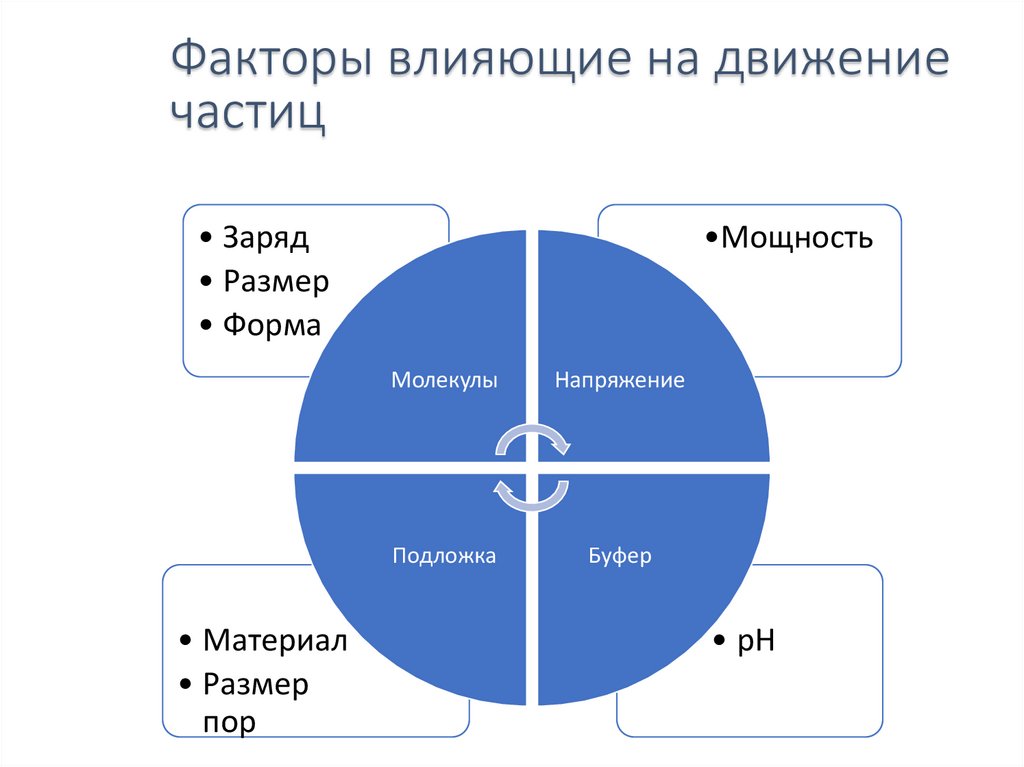
Факторы влияющие на движениечастиц
• Заряд
• Размер
• Форма
• Материал
• Размер
пор
•Мощность
Молекулы
Напряжение
Подложка
Буфер
• pH
29.
Электрофорез белков30.
Электрофорез в денатурирующих условиях -SDS-PAGE электрофорез ( sodium
dodecylsulphate-polyacrylamide gel
electrophoresis)
• Белки, в отличие от ДНК, не имеют постоянного
соотношения размер:заряд
• В электрическом поле некоторые будут двигаться
к положительному, а некоторые к
отрицательному полюсу, а некоторые не будут
двигаться, потому что они нейтральны
• Заряд зависит от первичной структуры (от
аминокислотного состава)
• Подвижность также будет зависеть и от
вторичной и третичной структуры
• Используют денатурирующие условия – чтобы
разделять белки только по их размеру
31.
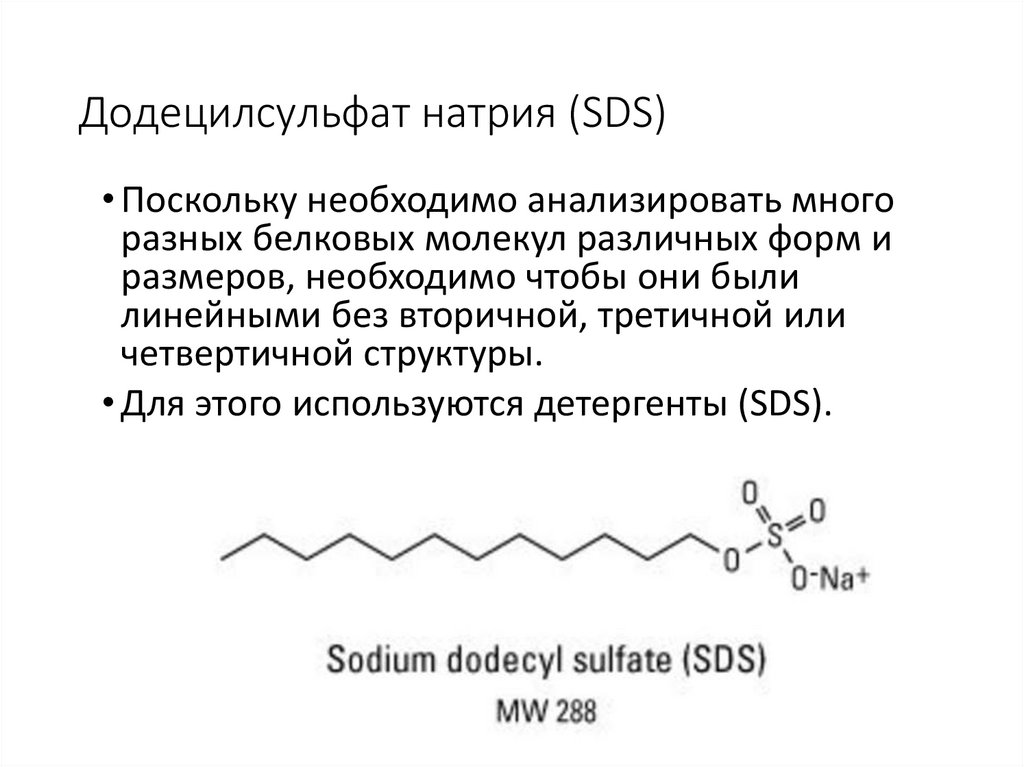
Додецилсульфат натрия (SDS)• Поскольку необходимо анализировать много
разных белковых молекул различных форм и
размеров, необходимо чтобы они были
линейными без вторичной, третичной или
четвертичной структуры.
• Для этого используются детергенты (SDS).
32.
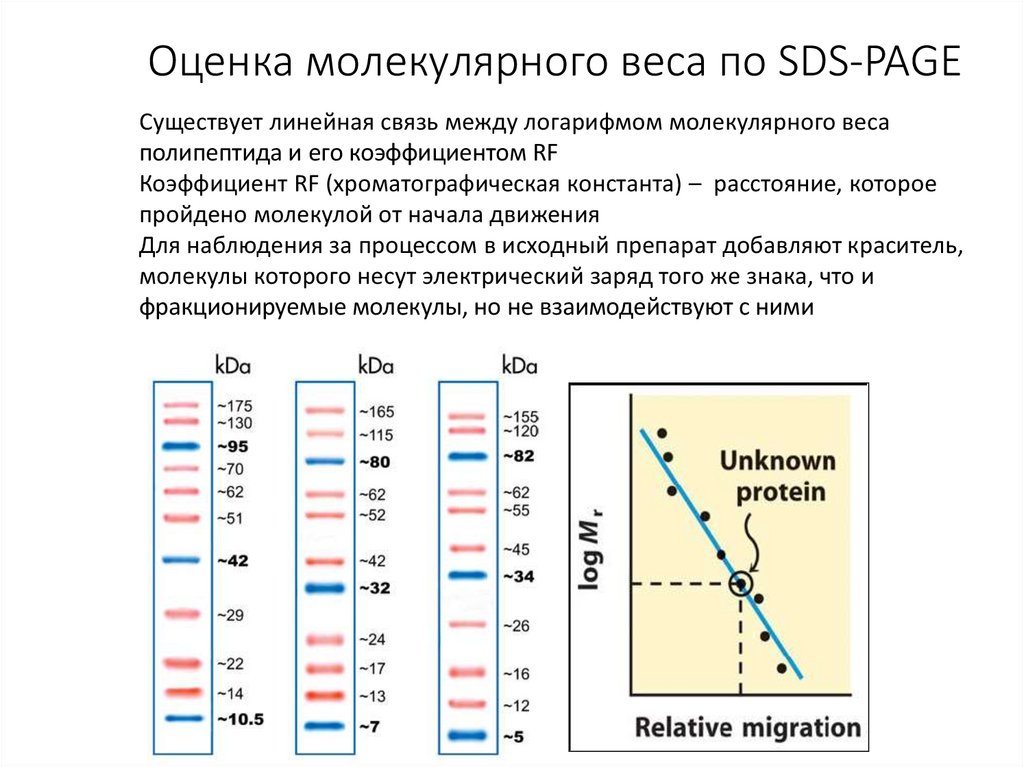
Оценка молекулярного веса по SDS-PAGEСуществует линейная связь между логарифмом молекулярного веса
полипептида и его коэффициентом RF
Коэффициент RF (хроматографическая константа) – расстояние, которое
пройдено молекулой от начала движения
Для наблюдения за процессом в исходный препарат добавляют краситель,
молекулы которого несут электрический заряд того же знака, что и
фракционируемые молекулы, но не взаимодействуют с ними
33.
Электрофорезнуклеиновых кислот
34.
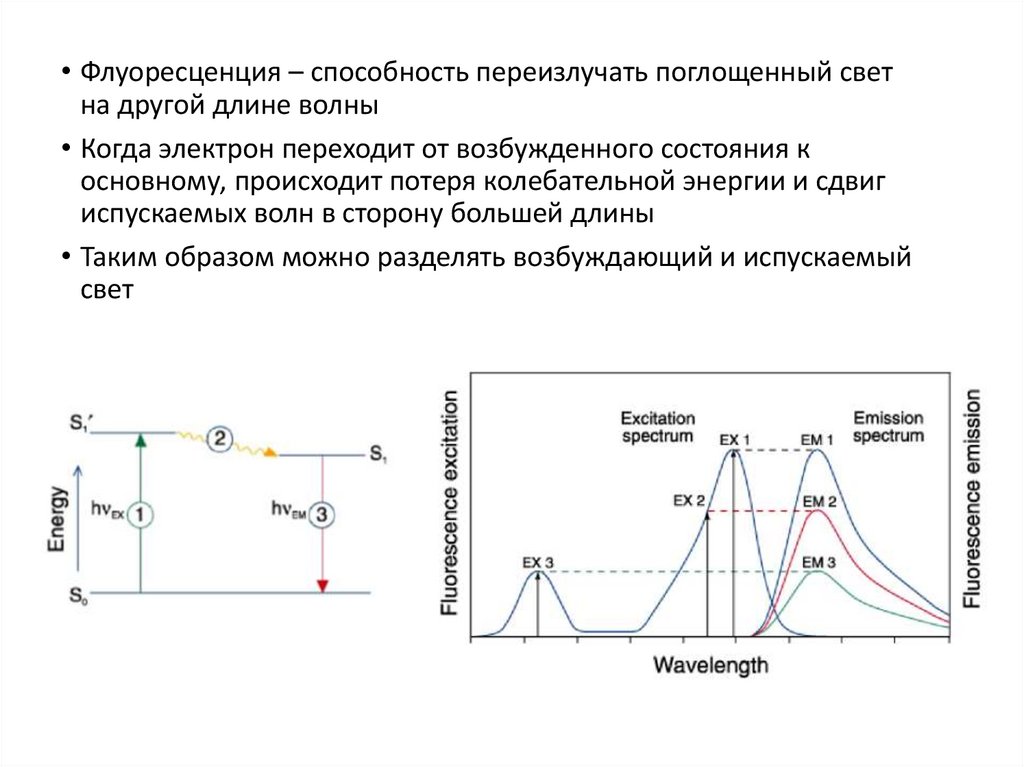
• Флуоресценция – способность переизлучать поглощенный светна другой длине волны
• Когда электрон переходит от возбужденного состояния к
основному, происходит потеря колебательной энергии и сдвиг
испускаемых волн в сторону большей длины
• Таким образом можно разделять возбуждающий и испускаемый
свет
35.
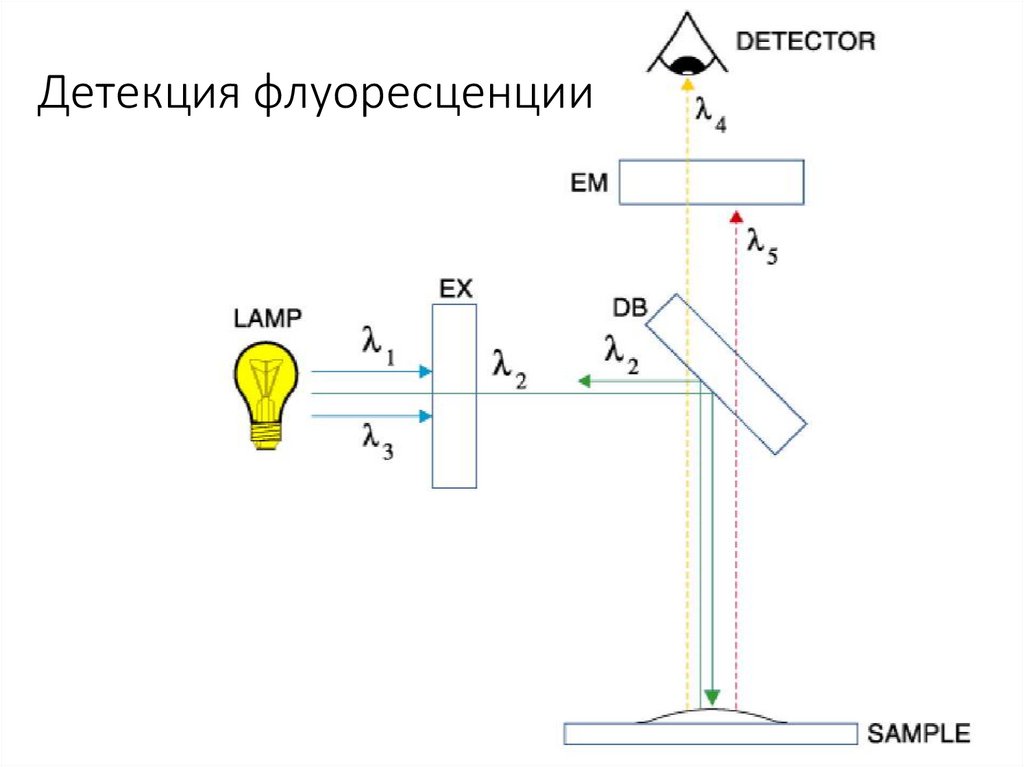
Детекция флуоресценции36.
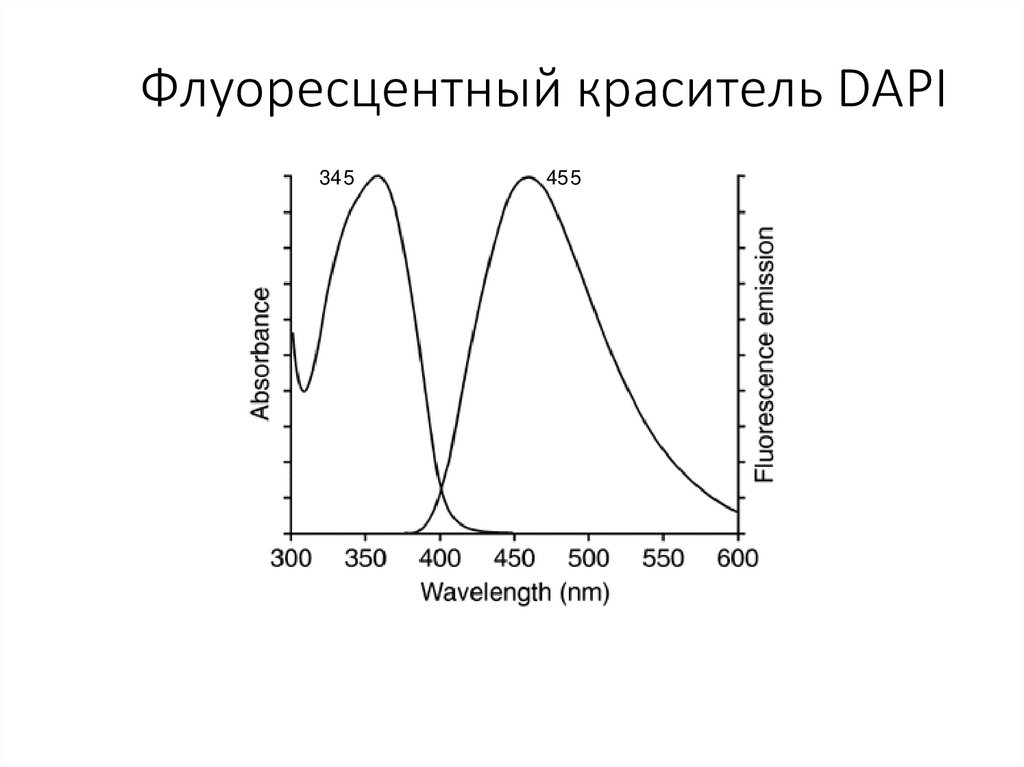
Флуоресцентный краситель DAPI345
455
37.
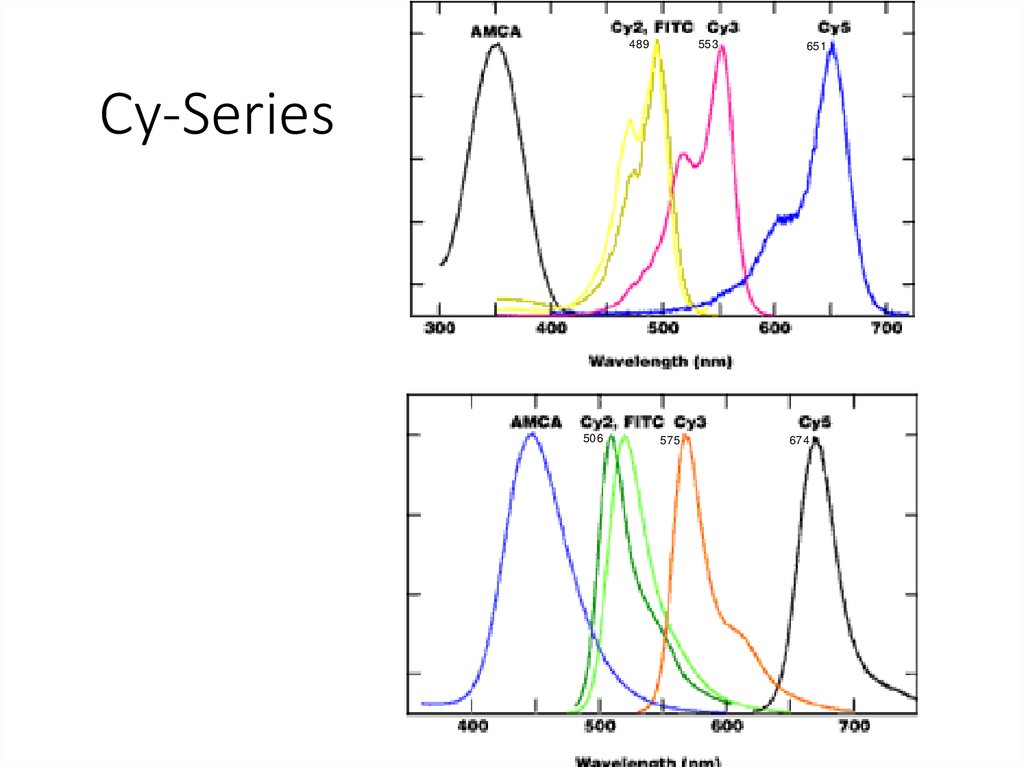
489553
651
Cy-Series
506
575
674
38.
Жизнеспособность (Live/Dead)39.
Дифференциальное окрашивание40.
Дифференциальное окрашивание41.
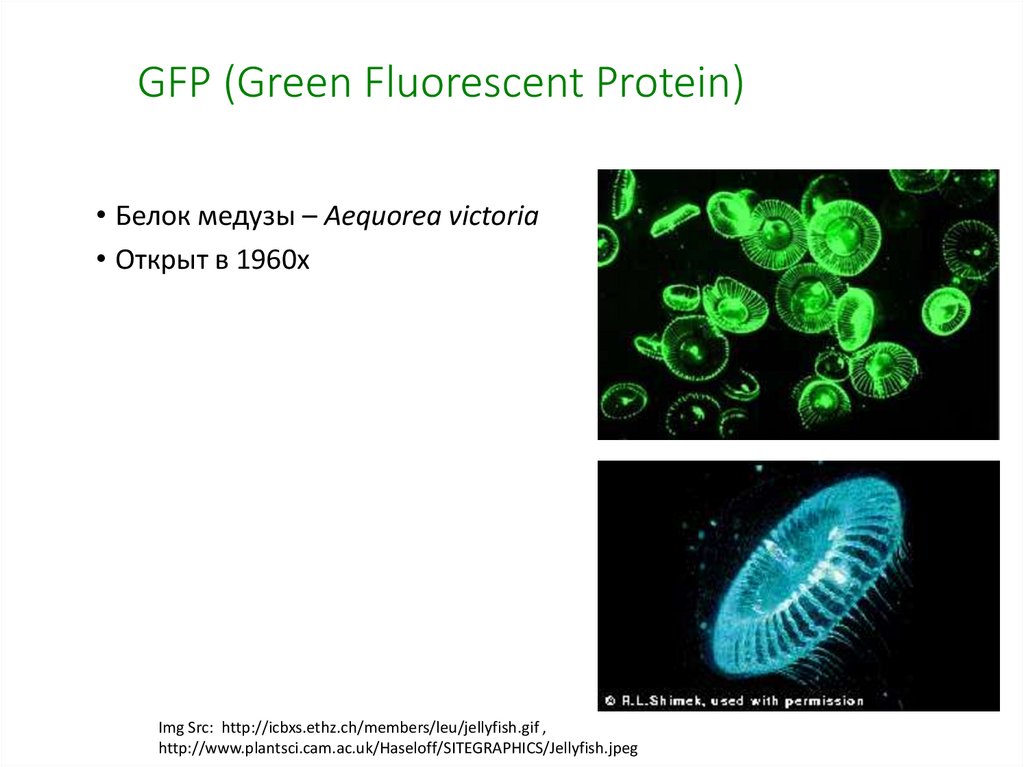
GFP (Green Fluorescent Protein)• Белок медузы – Aequorea victoria
• Открыт в 1960х
Img Src: http://icbxs.ethz.ch/members/leu/jellyfish.gif ,
http://www.plantsci.cam.ac.uk/Haseloff/SITEGRAPHICS/Jellyfish.jpeg
42.
Nobel Prize 2008• В 2008, трое ученых получили Нобелевскую премию за открытие
и разработку методов использования GFP
43.
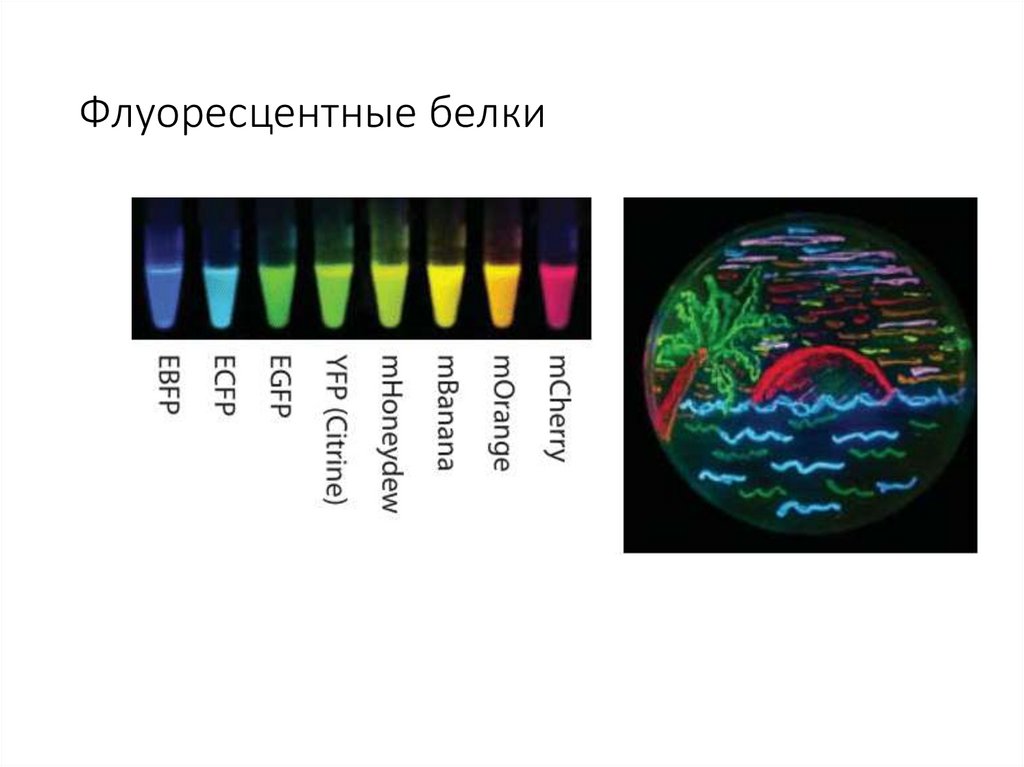
Флуоресцентные белки44.
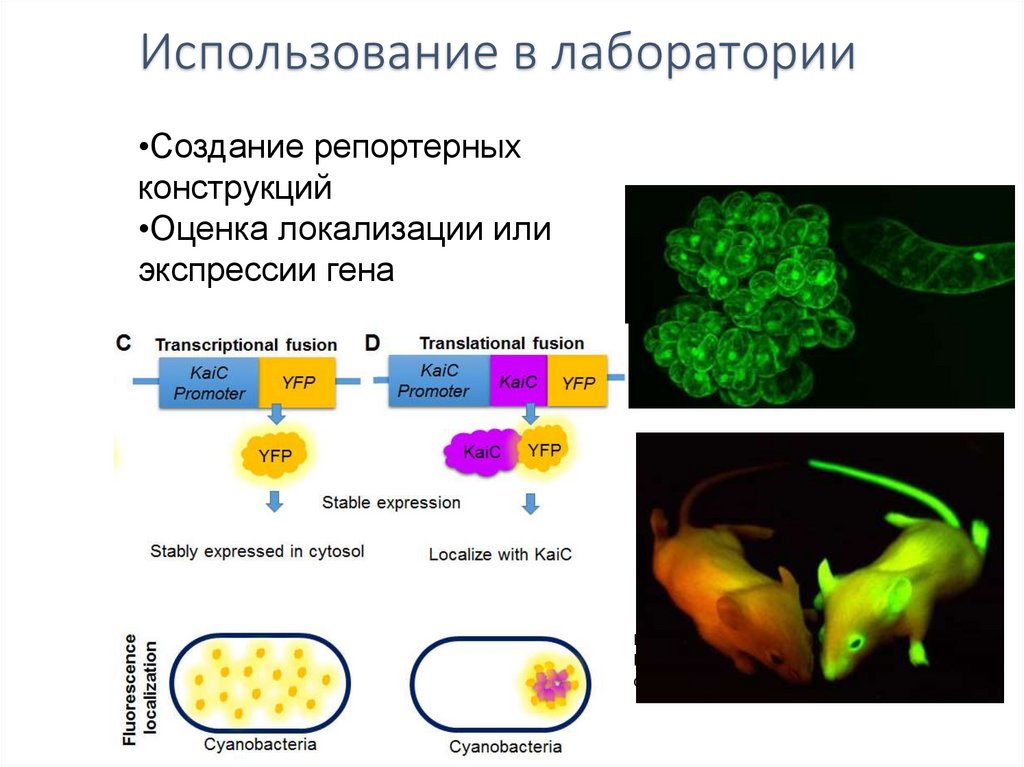
Использование в лаборатории•Создание репортерных
конструкций
•Оценка локализации или
экспрессии гена
Img Src:
http://www.mshri.on.ca/nagy/graphics/GFP%20mi
ce.jpg
45.
Transgenic Art46.
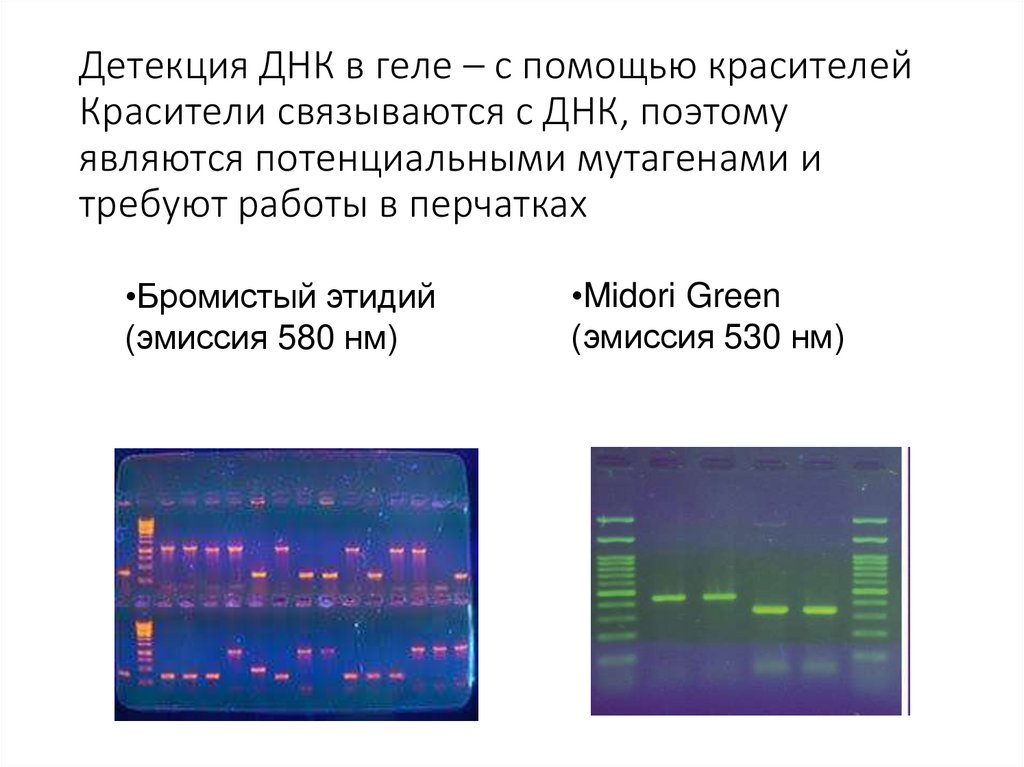
Детекция ДНК в геле – с помощью красителейКрасители связываются с ДНК, поэтому
являются потенциальными мутагенами и
требуют работы в перчатках
•Бромистый этидий
(эмиссия 580 нм)
•Midori Green
(эмиссия 530 нм)
47.
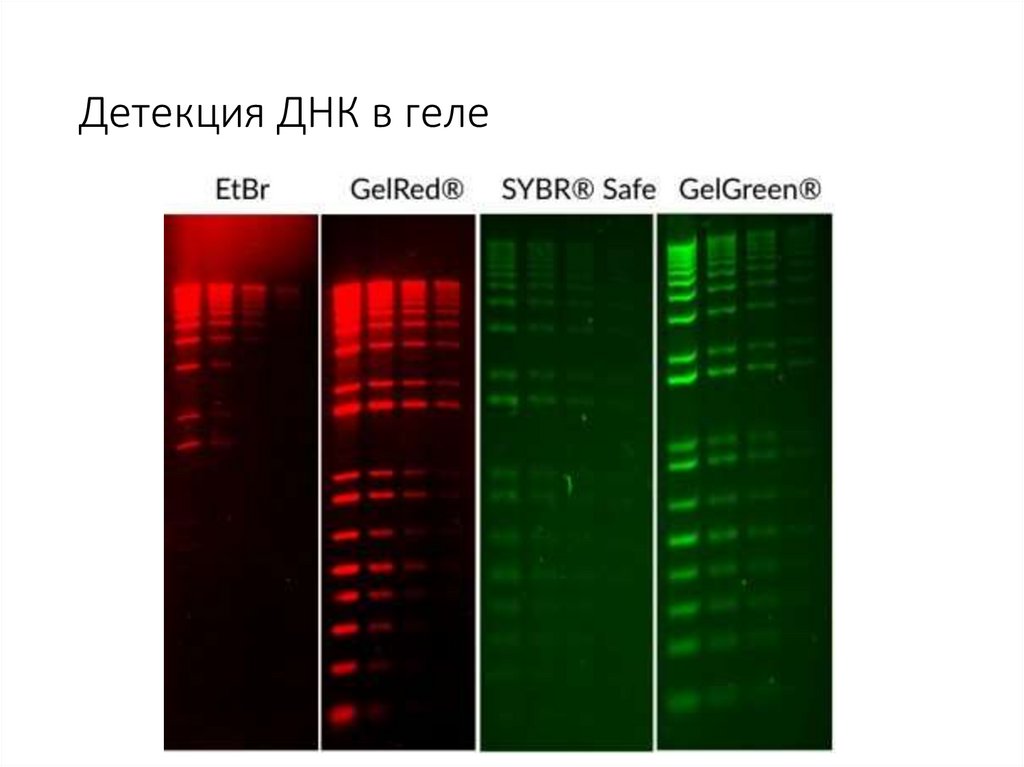
Детекция ДНК в геле48.
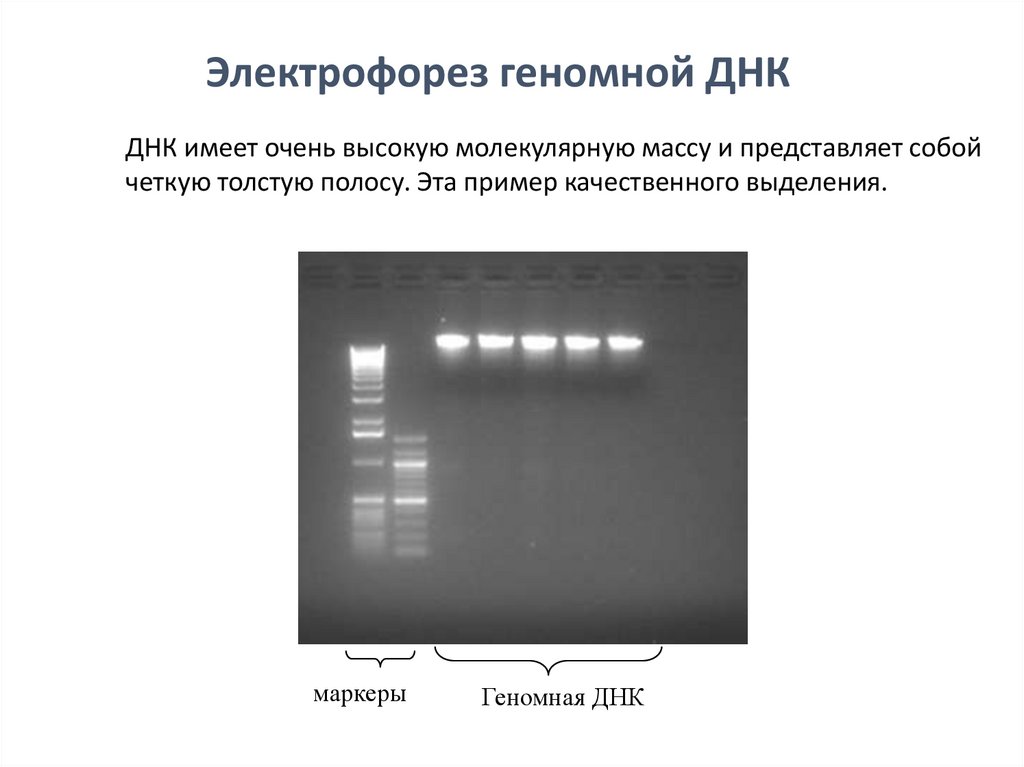
Электрофорез геномной ДНКДНК имеет очень высокую молекулярную массу и представляет собой
четкую толстую полосу. Эта пример качественного выделения.
маркеры
Геномная ДНК
49.
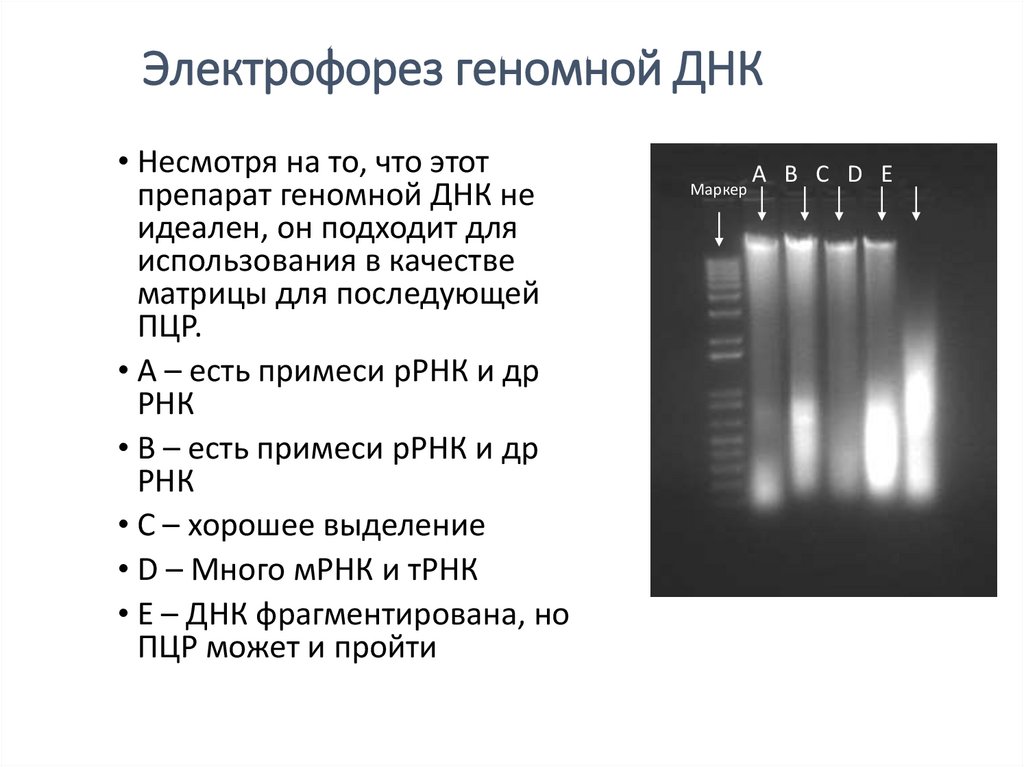
Электрофорез геномной ДНК• Несмотря на то, что этот
препарат геномной ДНК не
идеален, он подходит для
использования в качестве
матрицы для последующей
ПЦР.
• A – есть примеси рРНК и др
РНК
• B – есть примеси рРНК и др
РНК
• C – хорошее выделение
• D – Много мРНК и тРНК
• E – ДНК фрагментирована, но
ПЦР может и пройти
Маркер
A B C D E
50.
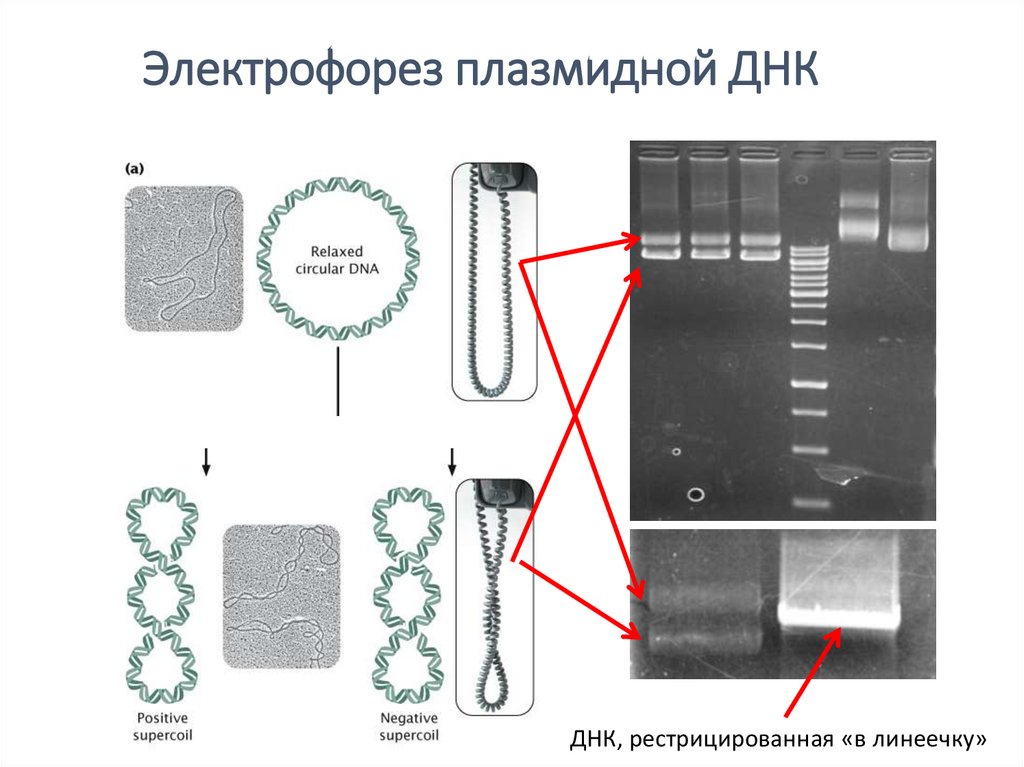
Электрофорез плазмидной ДНКМаркер
A B C D E
ДНК, рестрицированная «в линеечку»
51.
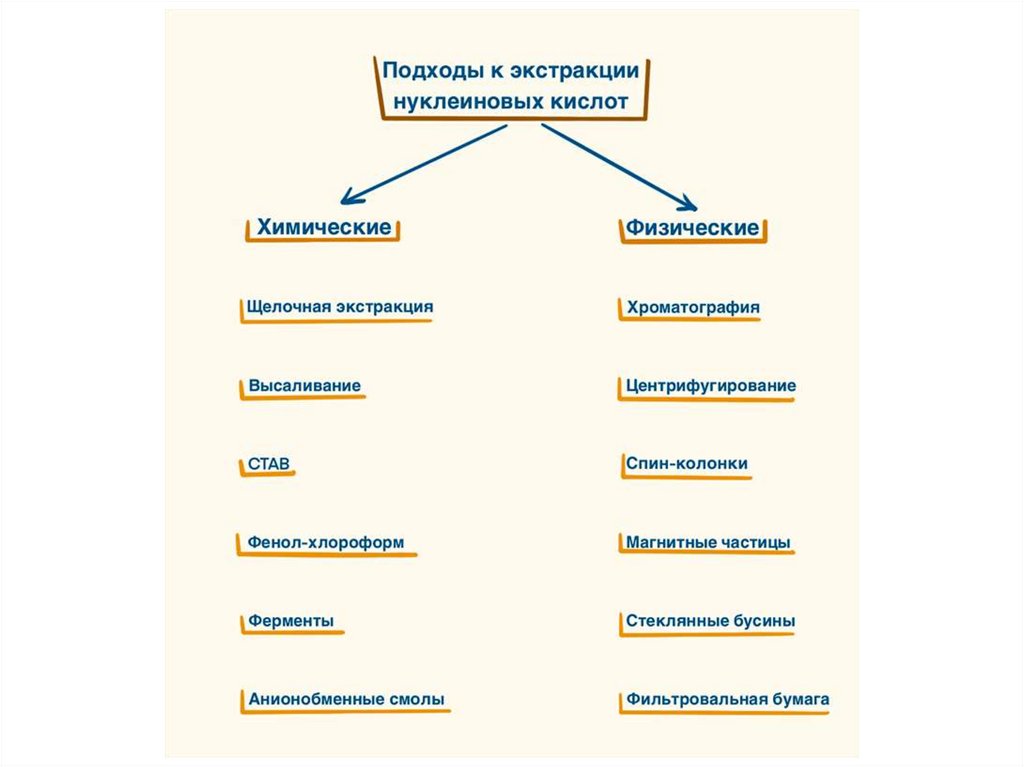
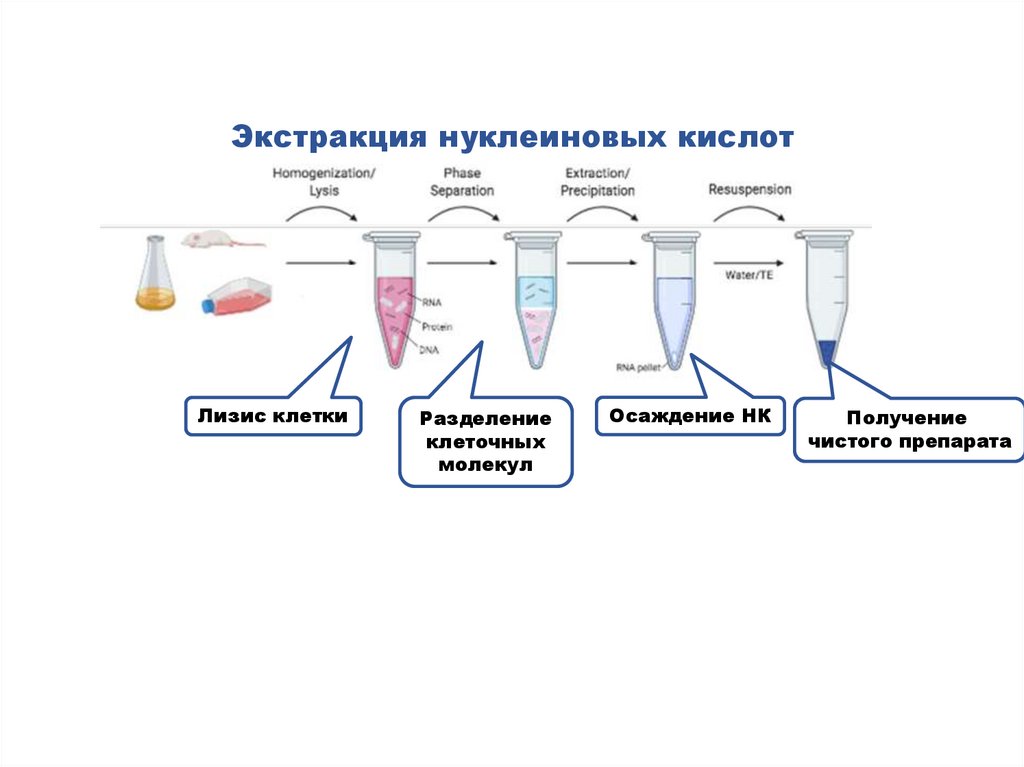
Экстракция нуклеиновыхкислот
52.
Экстракция нуклеиновых кислотЛизис клетки
Разделение
клеточных
молекул
Осаждение НК
Получение
чистого препарата
53.
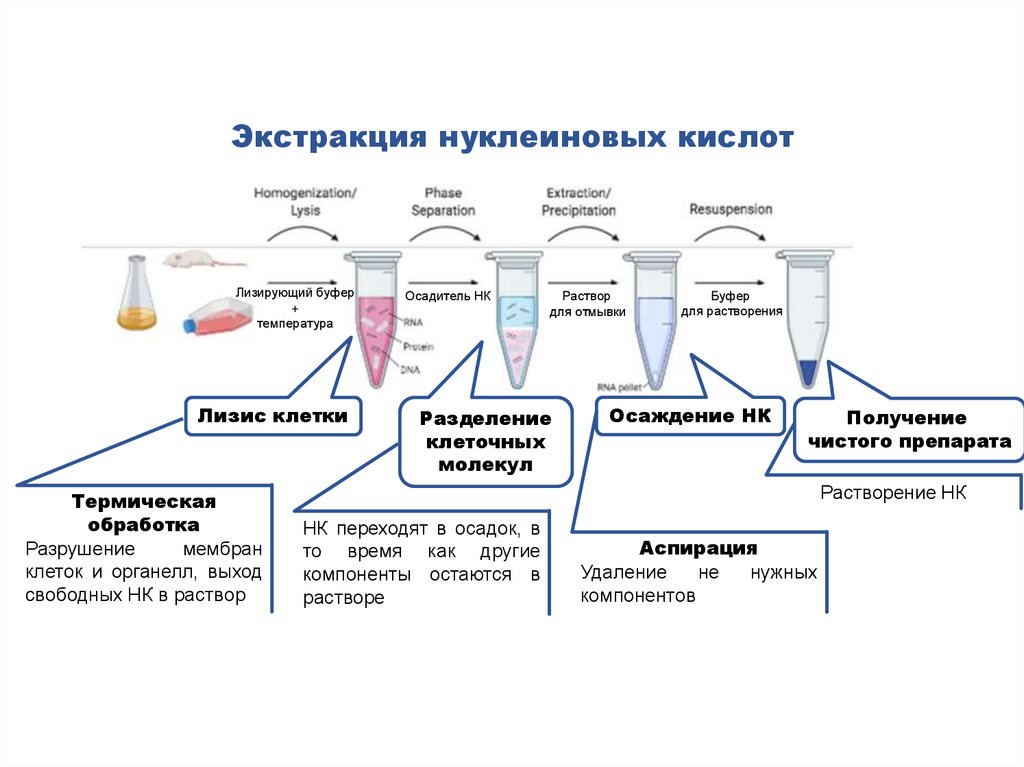
Экстракция нуклеиновых кислотЛизирующий буфер
+
температура
Лизис клетки
Термическая
обработка
Разрушение
мембран
клеток и органелл, выход
свободных НК в раствор
Осадитель НК
Раствор
для отмывки
Разделение
клеточных
молекул
Буфер
для растворения
Осаждение НК
Получение
чистого препарата
Растворение НК
НК переходят в осадок, в
то время как другие
компоненты остаются в
растворе
Аспирация
Удаление
не
нужных
компонентов
54.
ПЦР – полимеразнаяцепная реакция
55.
Полимеразная цепная реакция (ПЦР)изобретена в 1983 году американским
биохимиком Кэри Муллисом
В 1985 года начало использования
термостабильной
ДНК-полимеразы
Taq (Thermophilus aquaticus) и Bst
(Geobacillus stearothermophilus). Позднее
было обнаружено, что полимераза Bst
непригодна для ПЦР
В 1993 году Кэри Муллис получил за
это Нобелевскую премию по химии
56.
Polymerase Chain Reaction (PCR)Позволяет получить множество копий
последовательности ДНК
В качестве матрицы нужны очень малые количества
ДНК
Синтезируемый фрагмент задается парой
праймеров – синтетических олигонуклеотидов
Требует термостабильную ДНК полимеразу,
дезоксирибонуклеотиды (dNTP)
57.
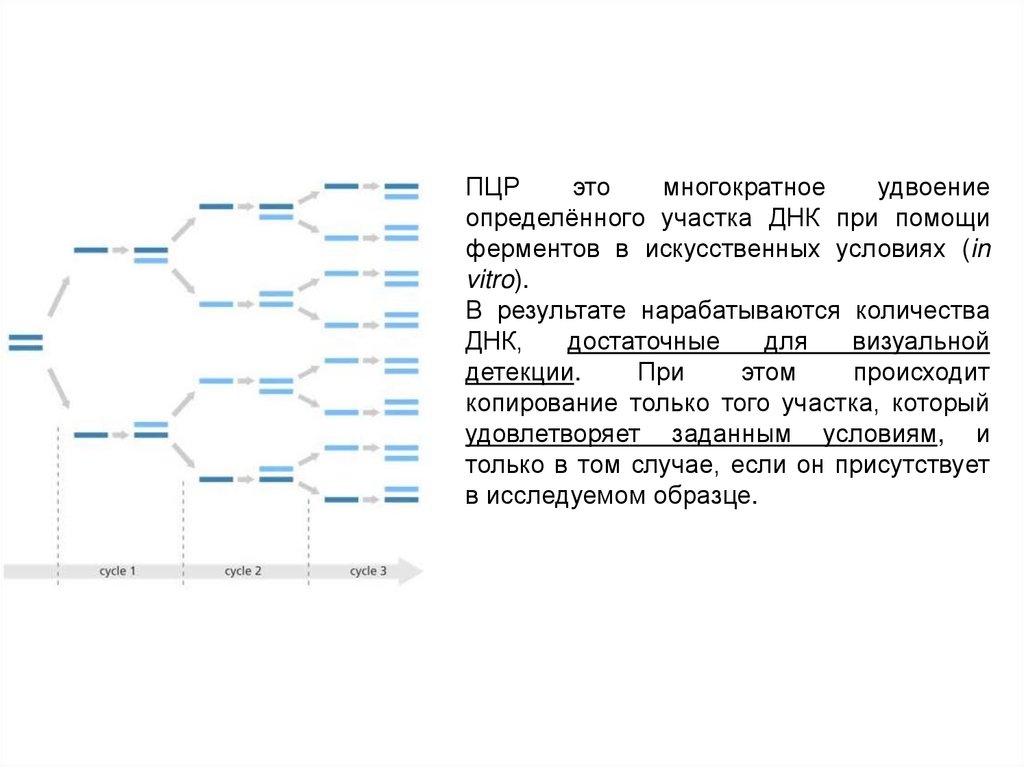
ПЦРэто
многократное
удвоение
определённого участка ДНК при помощи
ферментов в искусственных условиях (in
vitro).
В результате нарабатываются количества
ДНК,
достаточные
для
визуальной
детекции.
При
этом
происходит
копирование только того участка, который
удовлетворяет заданным условиям, и
только в том случае, если он присутствует
в исследуемом образце.
58.
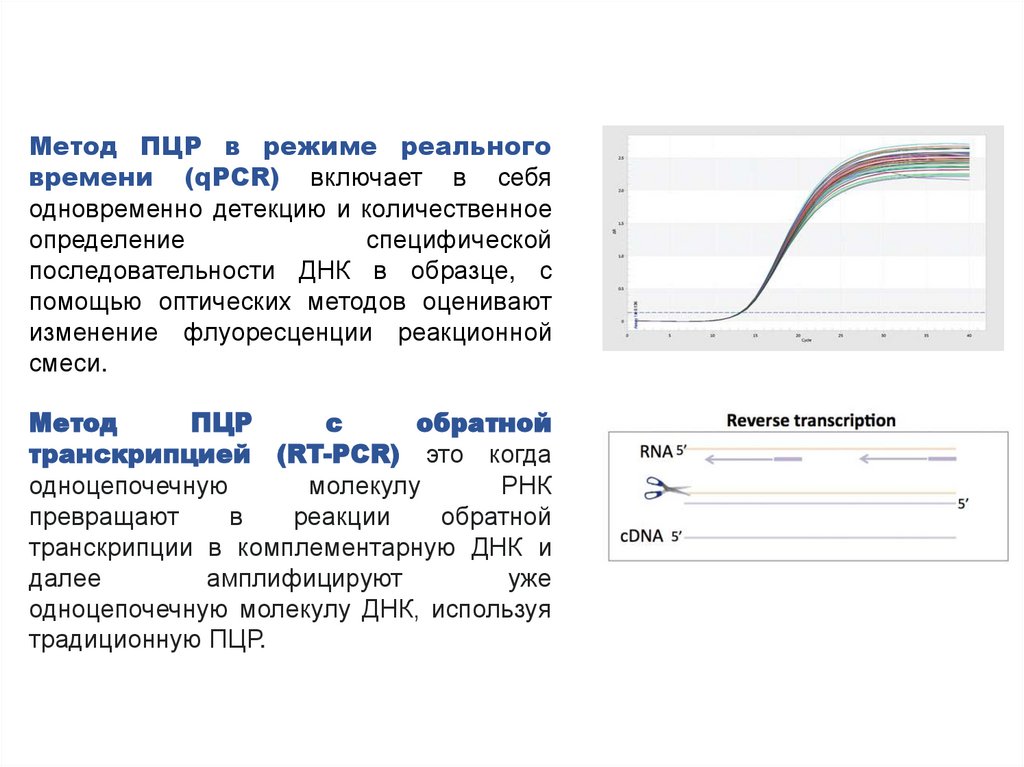
Метод ПЦР в режиме реальноговремени (qPCR) включает в себя
одновременно детекцию и количественное
определение
специфической
последовательности ДНК в образце, с
помощью оптических методов оценивают
изменение флуоресценции реакционной
смеси.
Метод
ПЦР
с
обратной
транскрипцией (RT-PCR) это когда
одноцепочечную
молекулу
РНК
превращают
в
реакции
обратной
транскрипции в комплементарную ДНК и
далее
амплифицируют
уже
одноцепочечную молекулу ДНК, используя
традиционную ПЦР.
59.
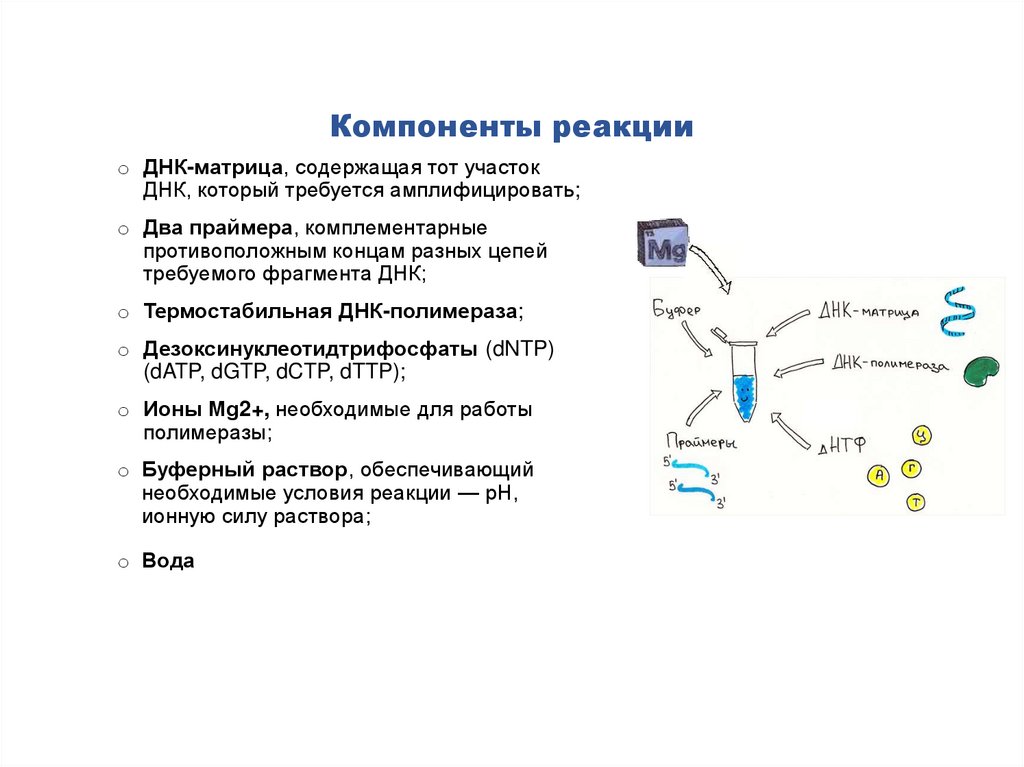
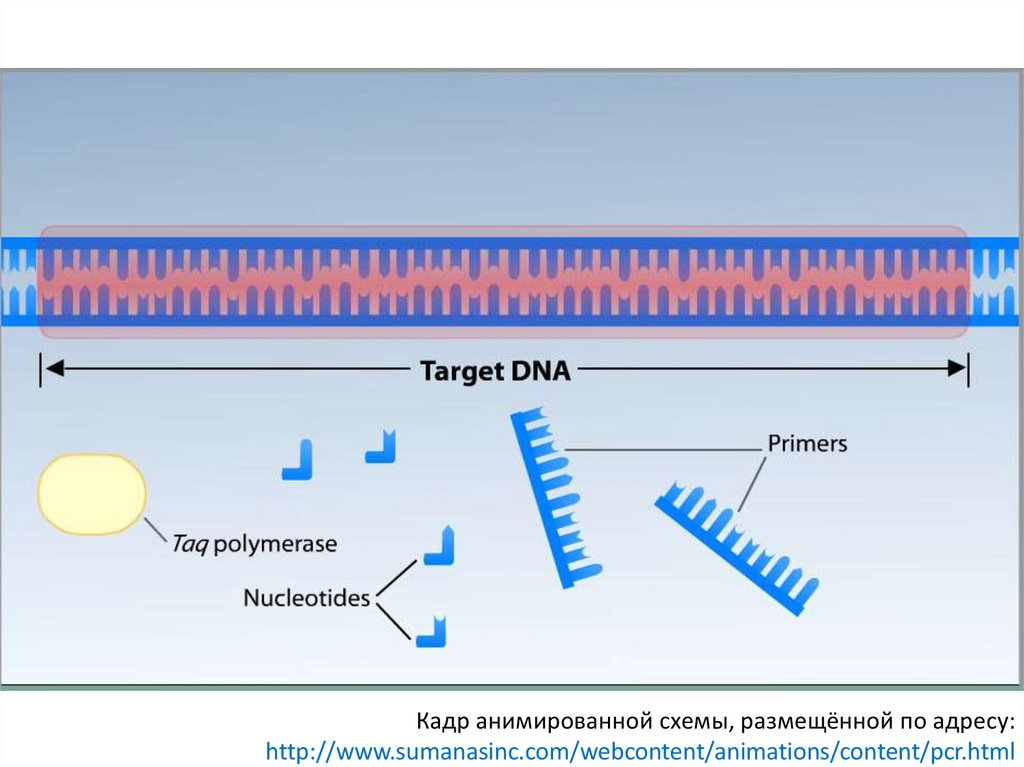
Компоненты реакцииo ДНК-матрица, содержащая тот участок
ДНК, который требуется амплифицировать;
o Два праймера, комплементарные
противоположным концам разных цепей
требуемого фрагмента ДНК;
o Термостабильная ДНК-полимераза;
o Дезоксинуклеотидтрифосфаты (dNTP)
(dATP, dGTP, dCTP, dTTP);
o Ионы Mg2+, необходимые для работы
полимеразы;
o Буферный раствор, обеспечивающий
необходимые условия реакции — рН,
ионную силу раствора;
o Вода
60.
Термостабильная ДНК-полимеразаTaq-полимераза
Q5-полимераза
Rfu-полимераза
1000 п.н. в мин
2000 п.н. в мин
500 п.н. в мин
1 ошибка на 1000
1 ошибка на 280 т.п.о.
1 на 1300 т.п.о.
Обладают корректирующей
экзонуклеазной активностью от 3' до 5'
61.
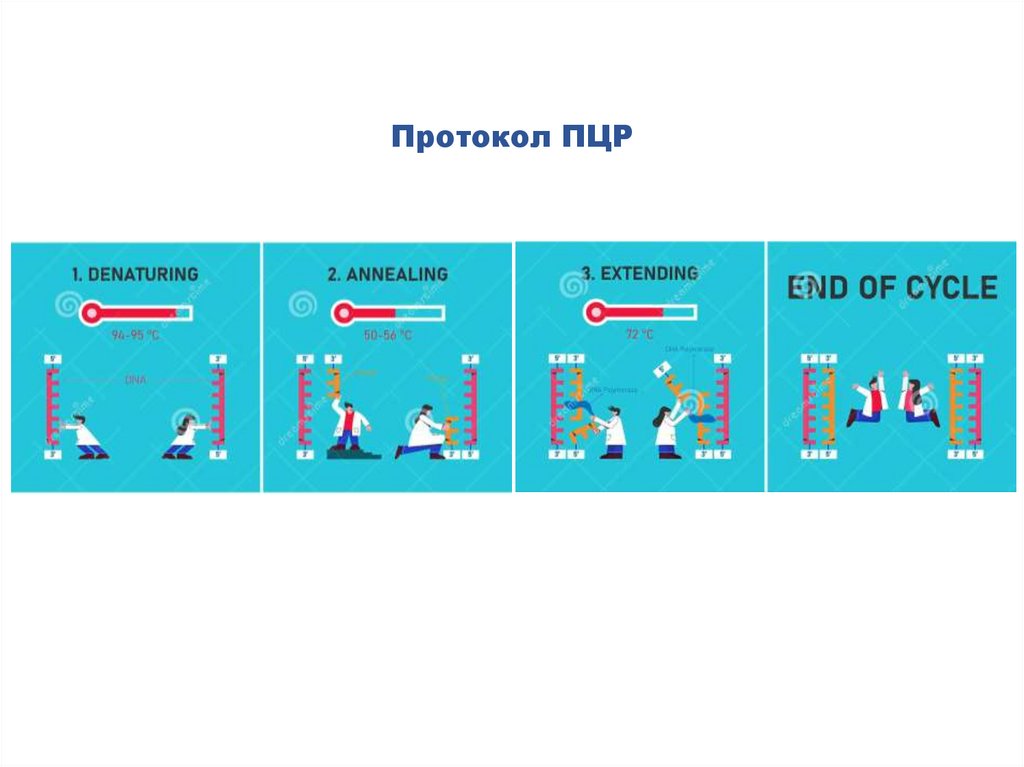
Протокол ПЦР62.
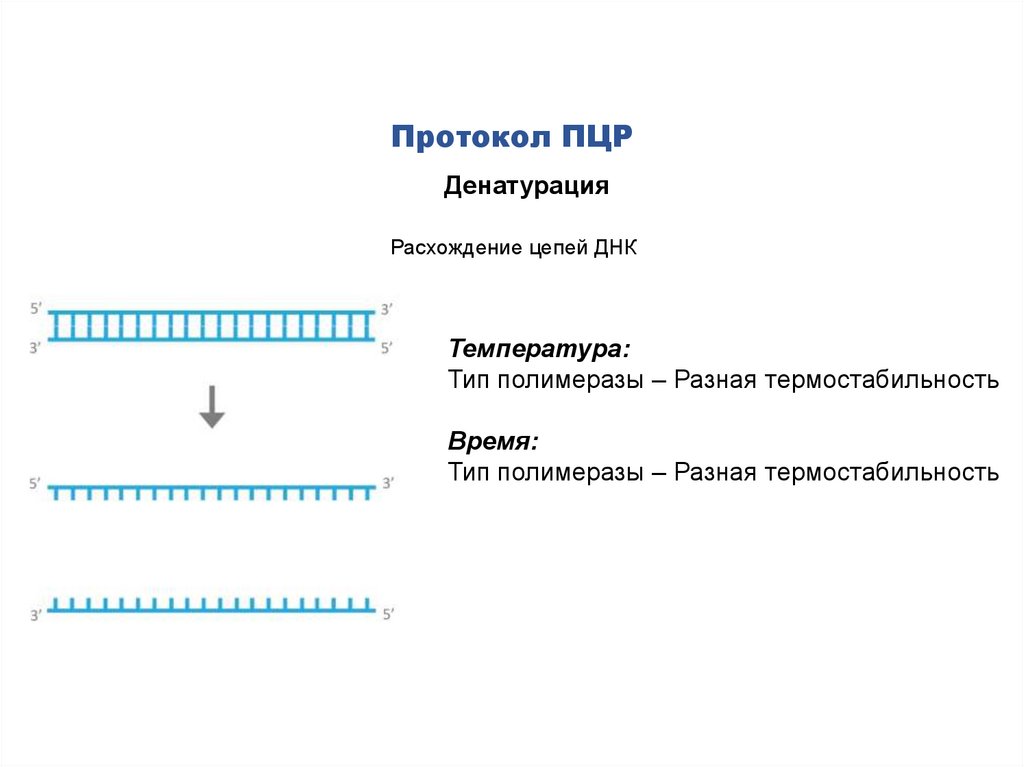
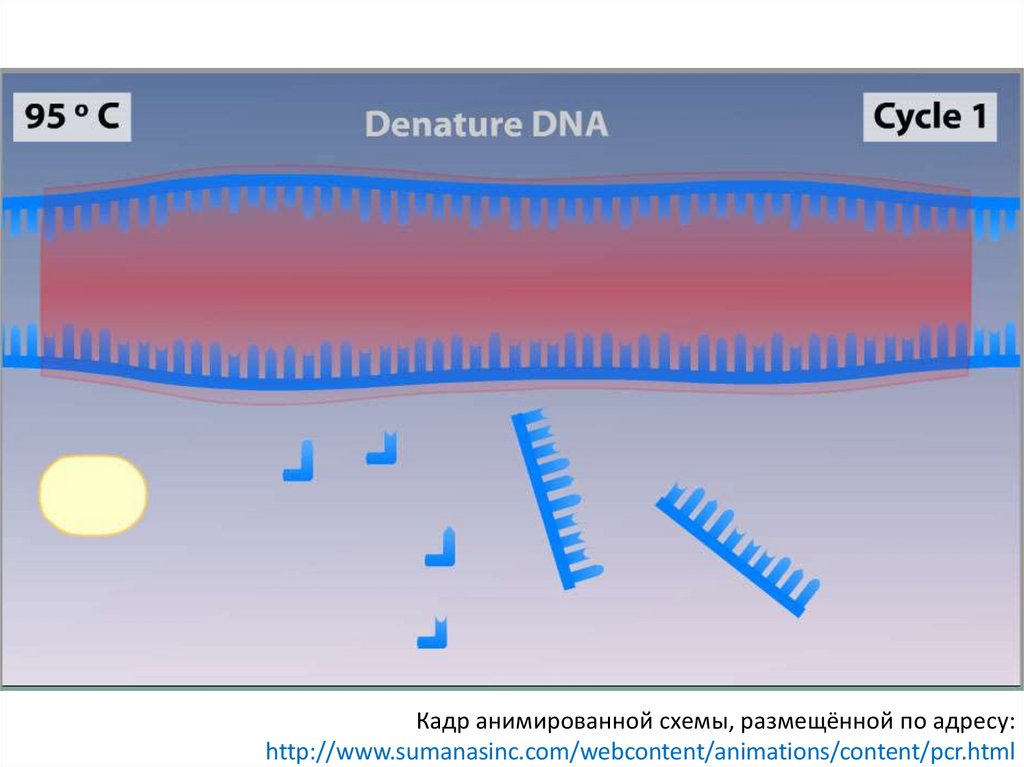
Протокол ПЦРДенатурация
Расхождение цепей ДНК
Температура:
Тип полимеразы – Разная термостабильность
Время:
Тип полимеразы – Разная термостабильность
63.
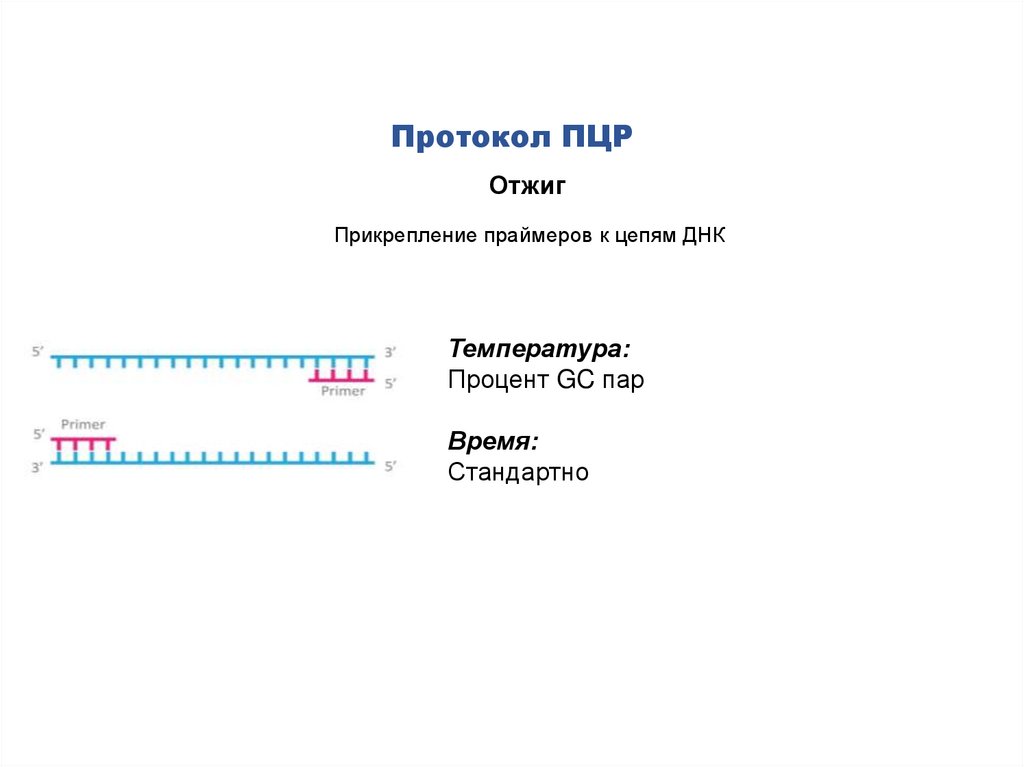
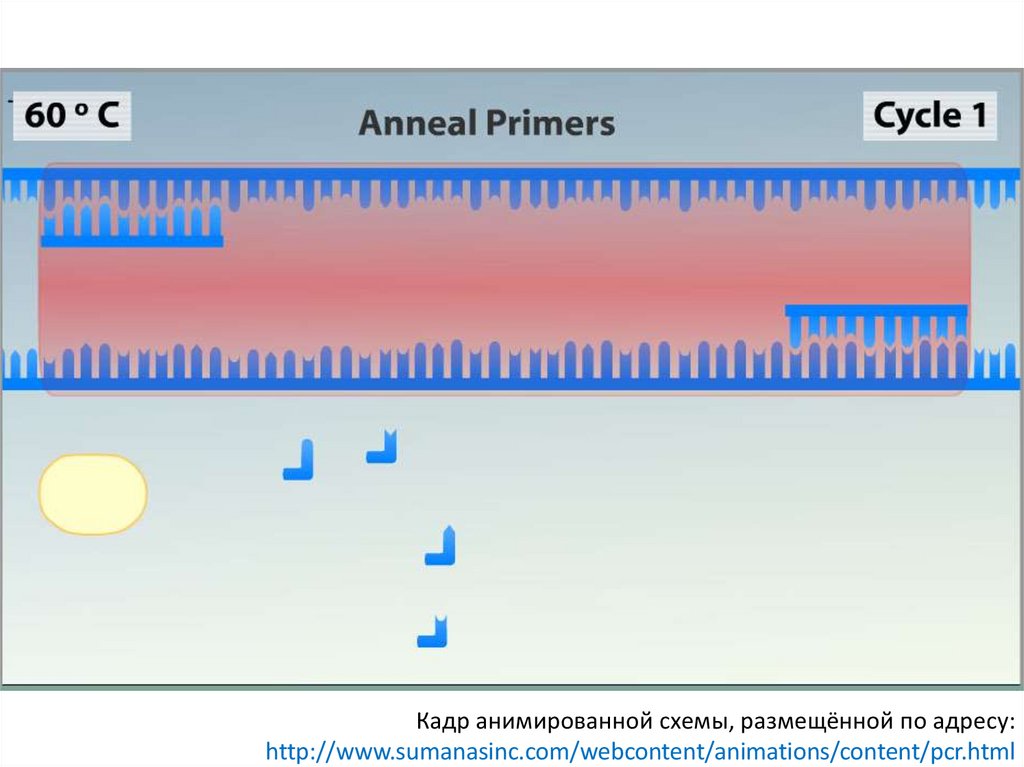
Протокол ПЦРОтжиг
Прикрепление праймеров к цепям ДНК
Температура:
Процент GC пар
Время:
Стандартно
64.
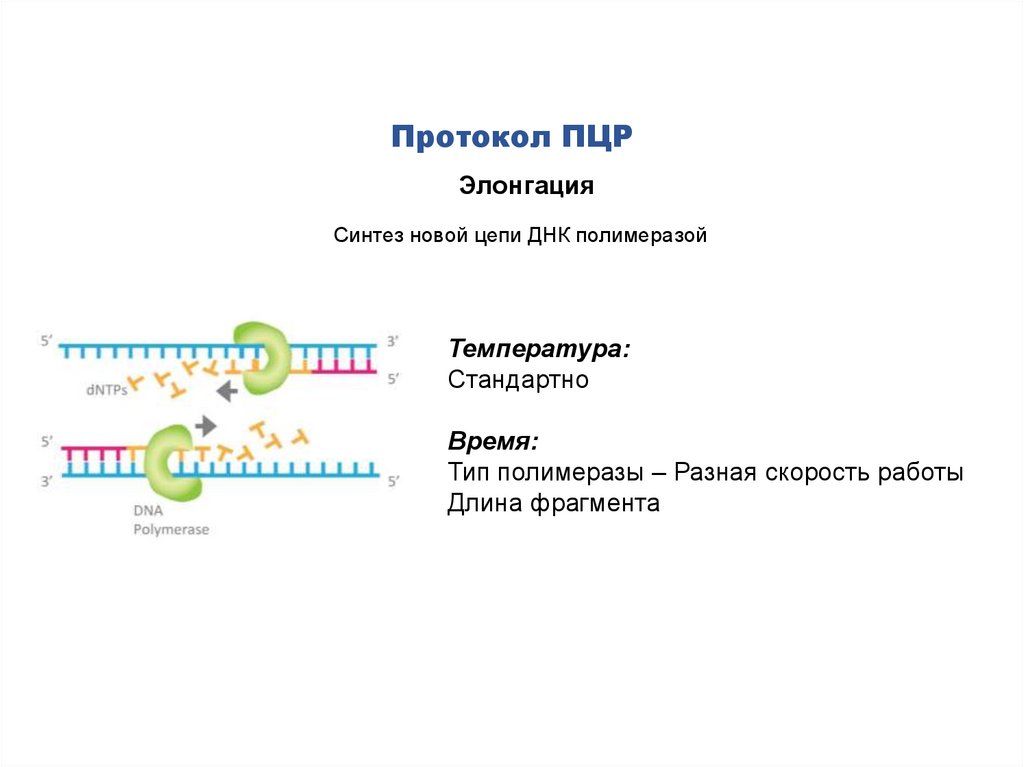
Протокол ПЦРЭлонгация
Синтез новой цепи ДНК полимеразой
Температура:
Стандартно
Время:
Тип полимеразы – Разная скорость работы
Длина фрагмента
65.
Протокол ПЦРКонец цикла
Получение двух одинаковых цепей ДНК
Температура:
Время:
66.
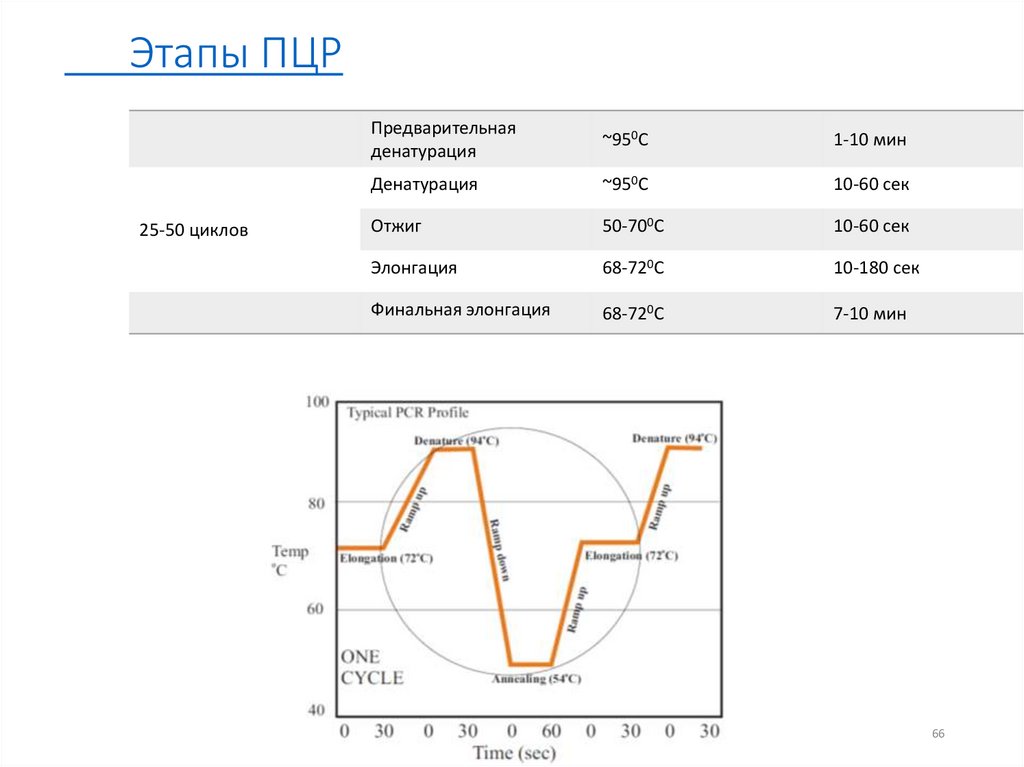
Этапы ПЦР25-50 циклов
Предварительная
денатурация
~950C
1-10 мин
Денатурация
~950C
10-60 сек
Отжиг
50-700C
10-60 сек
Элонгация
68-720C
10-180 сек
Финальная элонгация
68-720C
7-10 мин
66
67.
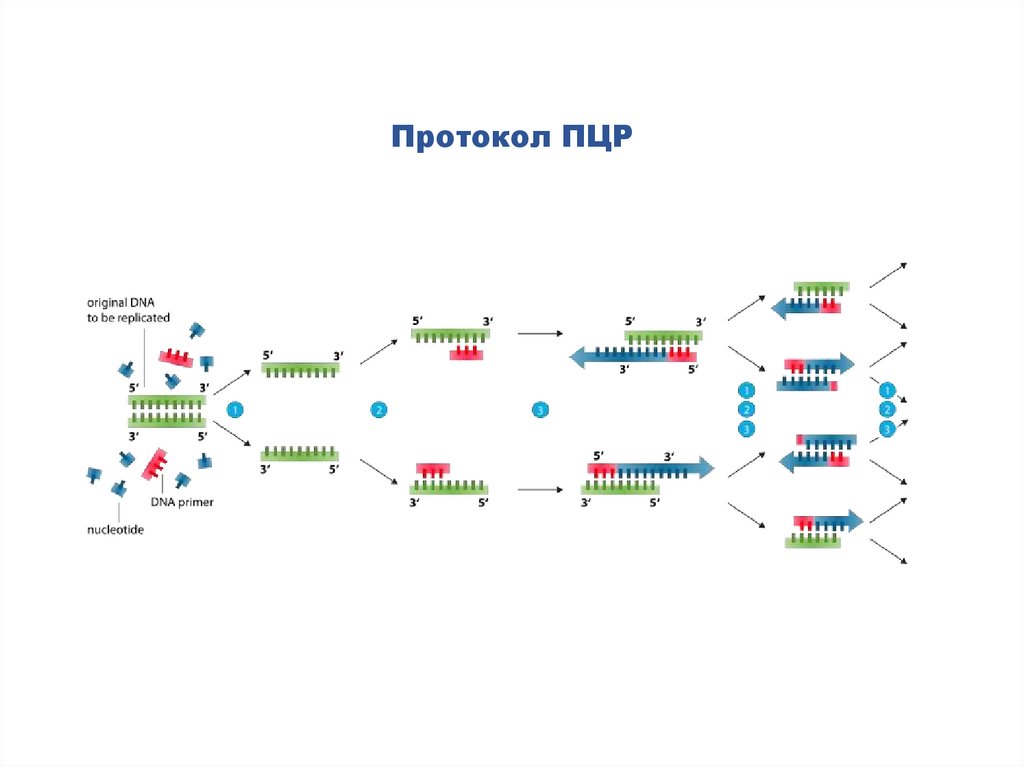
Протокол ПЦР68.
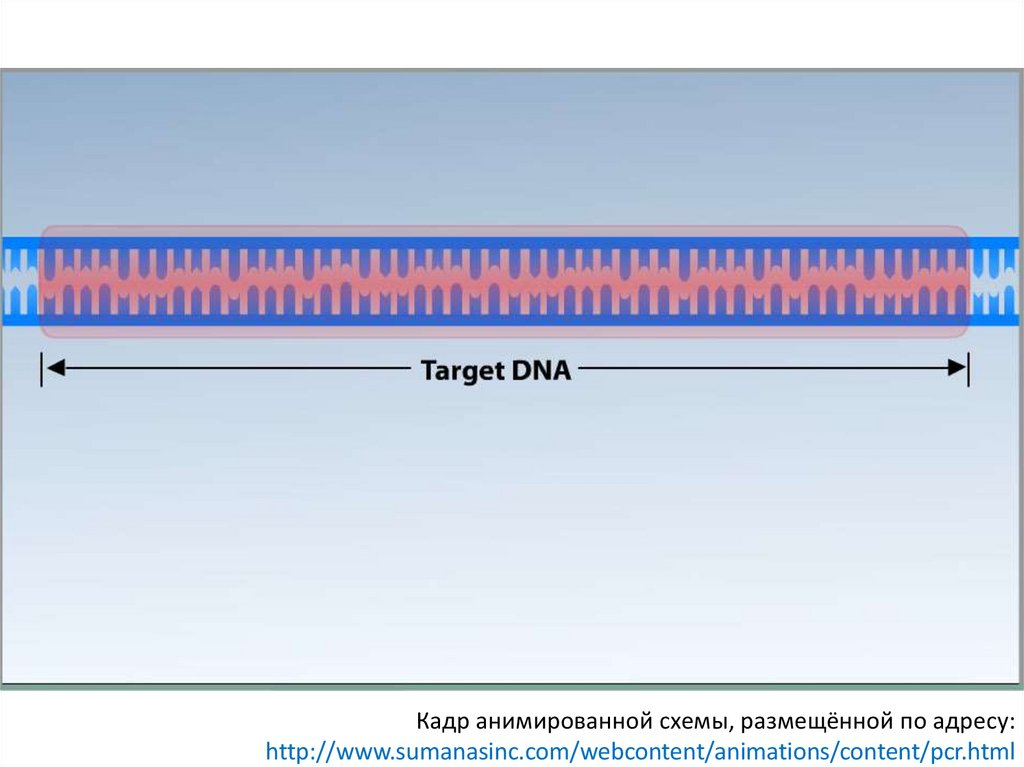
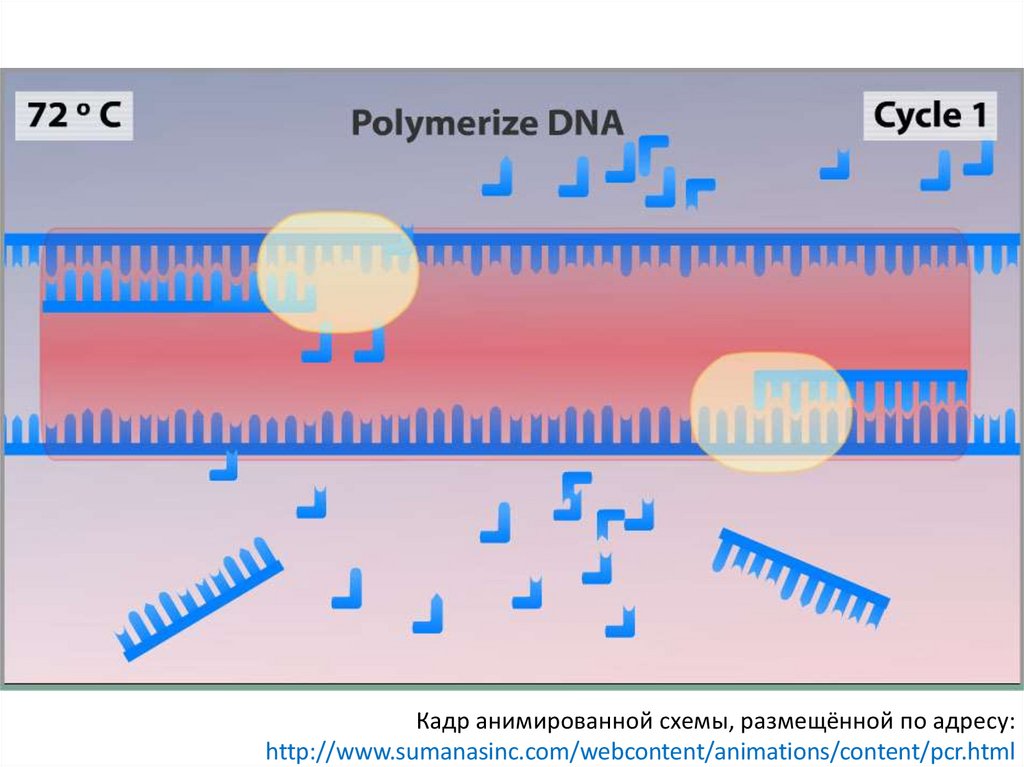
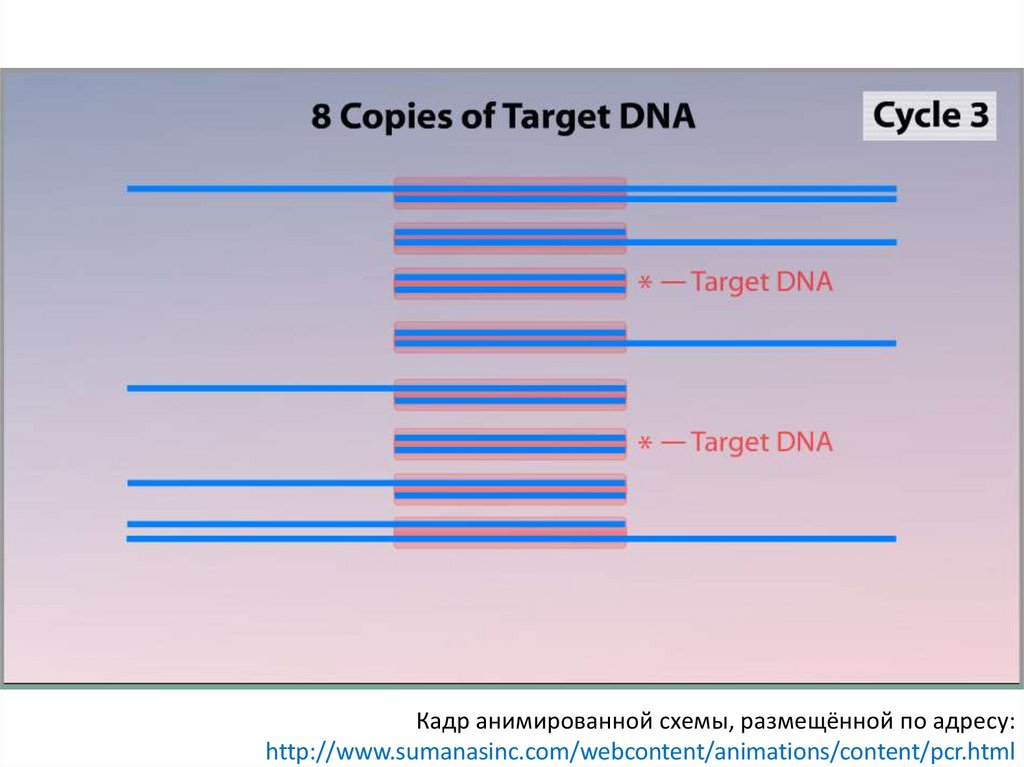
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
69.
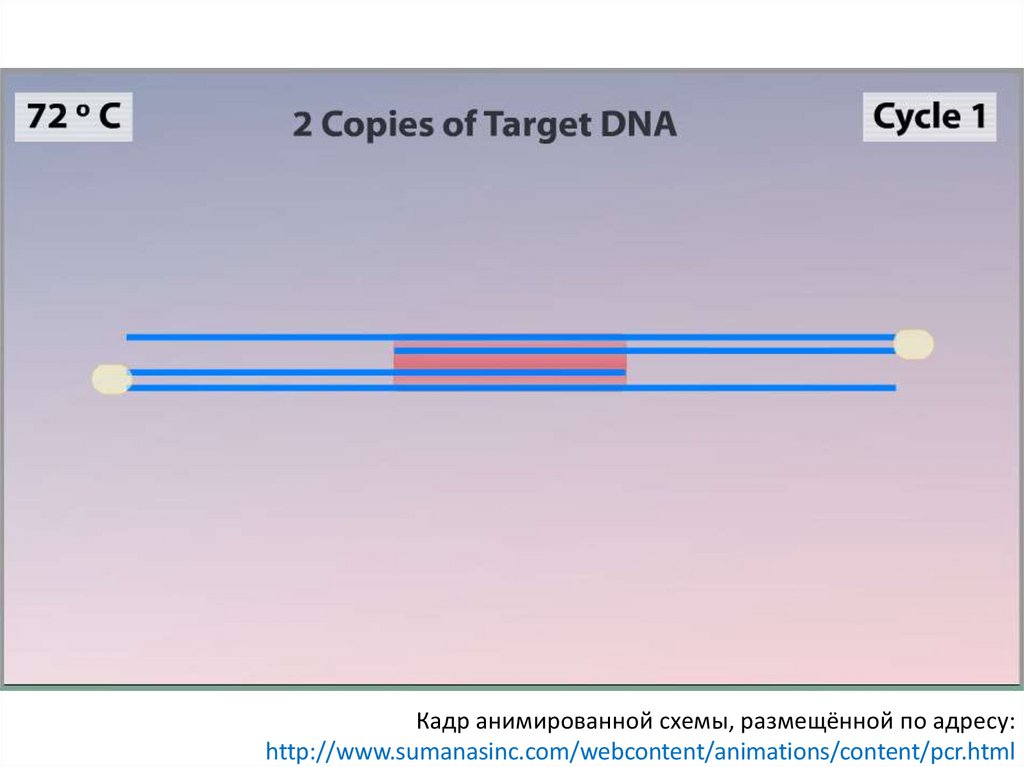
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
70.
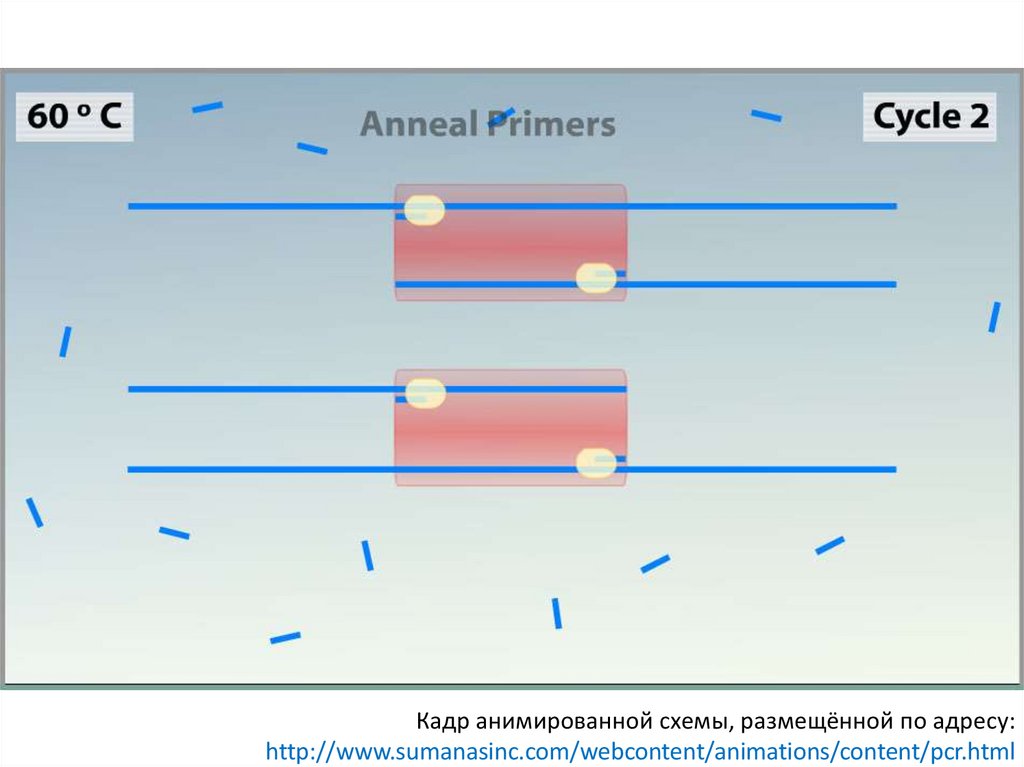
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
71.
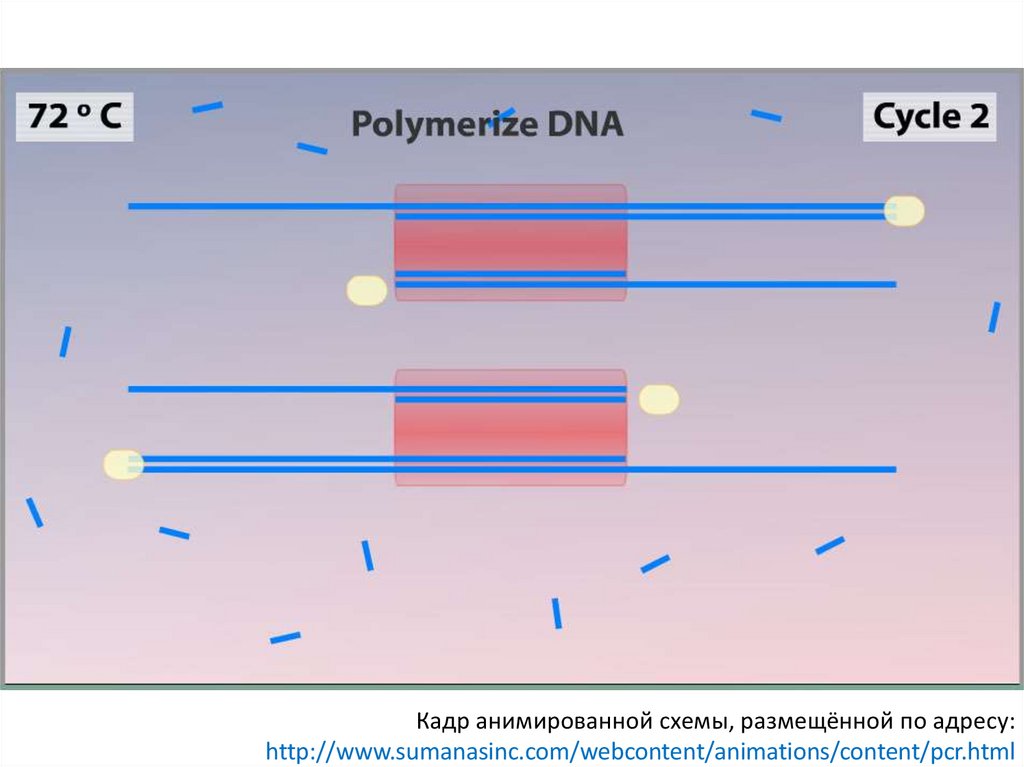
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
72.
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
73.
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
74.
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
75.
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
76.
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
77.
Кадр анимированной схемы, размещённой по адресу:http://www.sumanasinc.com/webcontent/animations/content/pcr.html
78.
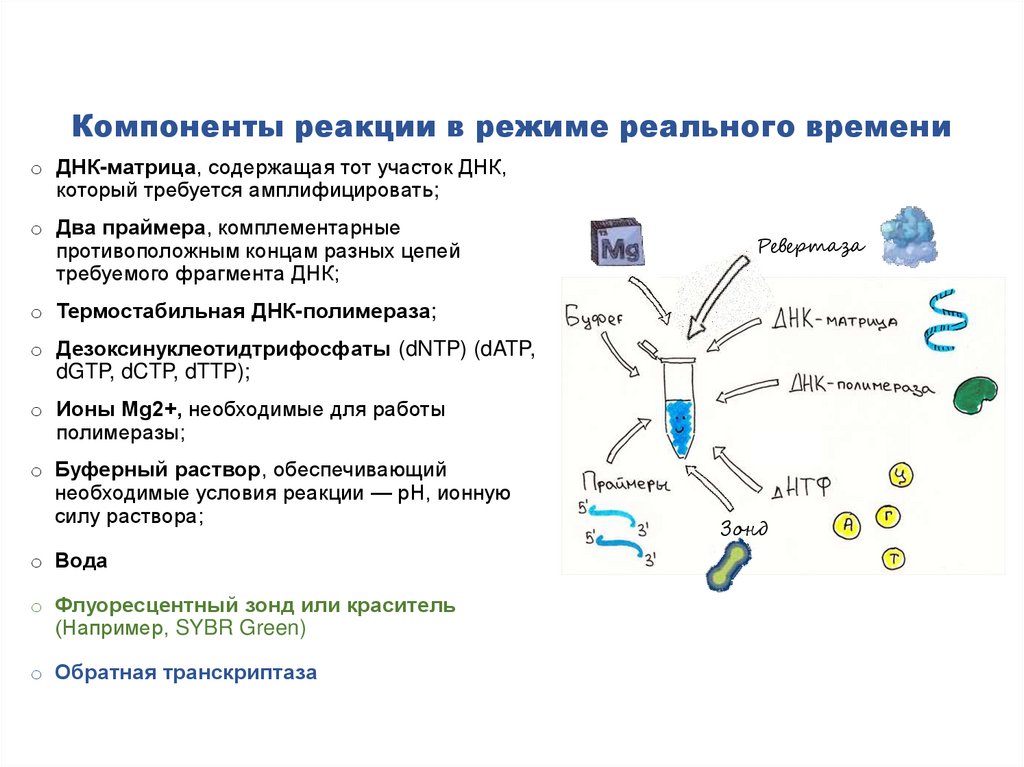
Компоненты реакции в режиме реального времениo ДНК-матрица, содержащая тот участок ДНК,
который требуется амплифицировать;
o Два праймера, комплементарные
противоположным концам разных цепей
требуемого фрагмента ДНК;
Ревертаза
o Термостабильная ДНК-полимераза;
o Дезоксинуклеотидтрифосфаты (dNTP) (dATP,
dGTP, dCTP, dTTP);
o Ионы Mg2+, необходимые для работы
полимеразы;
o Буферный раствор, обеспечивающий
необходимые условия реакции — рН, ионную
силу раствора;
o Вода
o Флуоресцентный зонд или краситель
(Например, SYBR Green)
o Обратная транскриптаза
Зонд
79.
Системы детекции продуктов ПЦР1.
2.
Неспецифичные
интеркалирующие красители (SYBR Green и др.)
Специфичные
линейные разрушаемые пробы (TaqMan)
«молекулярные маячки» (beacons)
примыкающие пробы
79
80.
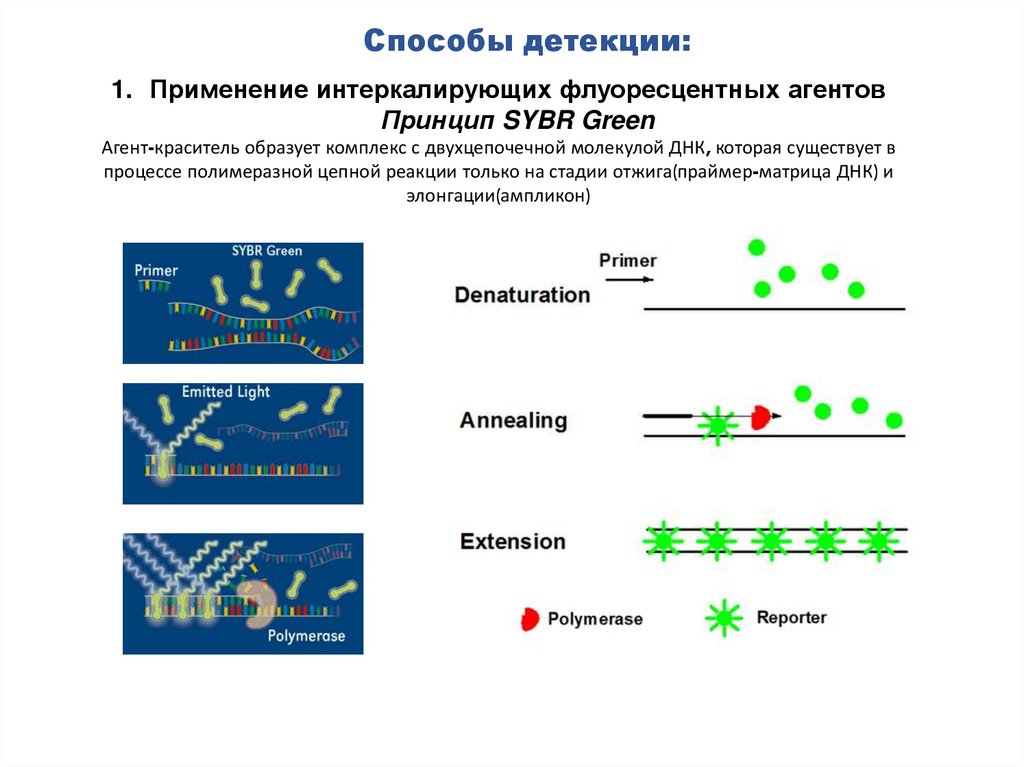
Способы детекции:1. Применение интеркалирующих флуоресцентных агентов
Принцип SYBR Green
Агент-краситель образует комплекс с двухцепочечной молекулой ДНК, которая существует в
процессе полимеразной цепной реакции только на стадии отжига(праймер-матрица ДНК) и
элонгации(ампликон)
81.
82.
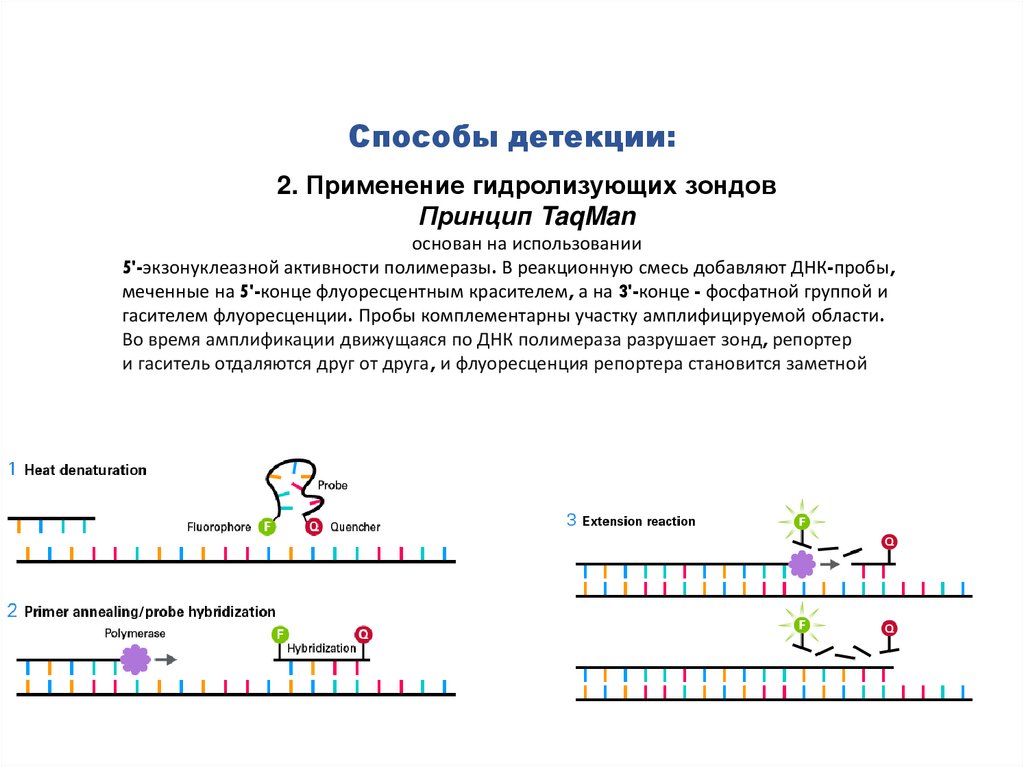
Способы детекции:2. Применение гидролизующих зондов
Принцип TaqMan
основан на использовании
5'-экзонуклеазной активности полимеразы. В реакционную смесь добавляют ДНК-пробы,
меченные на 5'-конце флуоресцентным красителем, а на 3'-конце - фосфатной группой и
гасителем флуоресценции. Пробы комплементарны участку амплифицируемой области.
Во время амплификации движущаяся по ДНК полимераза разрушает зонд, репортер
и гаситель отдаляются друг от друга, и флуоресценция репортера становится заметной
83.
84.
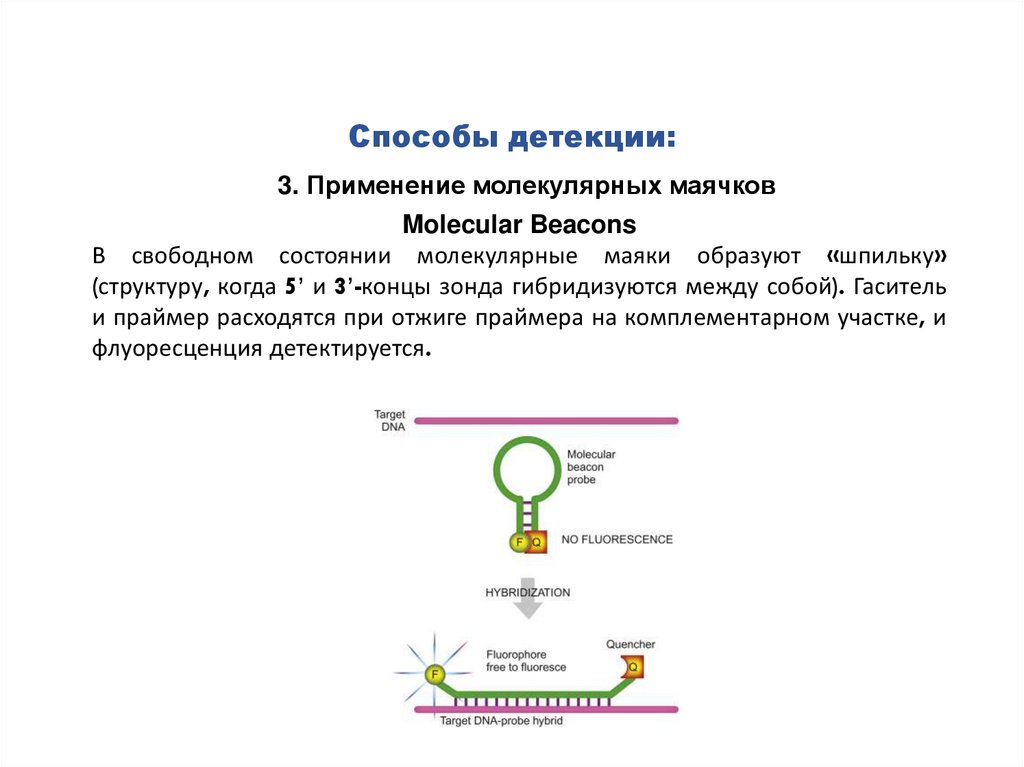
Способы детекции:3. Применение молекулярных маячков
Molecular Beacons
В свободном состоянии молекулярные маяки образуют «шпильку»
(структуру, когда 5’ и 3’-концы зонда гибридизуются между собой). Гаситель
и праймер расходятся при отжиге праймера на комплементарном участке, и
флуоресценция детектируется.
85.
86.
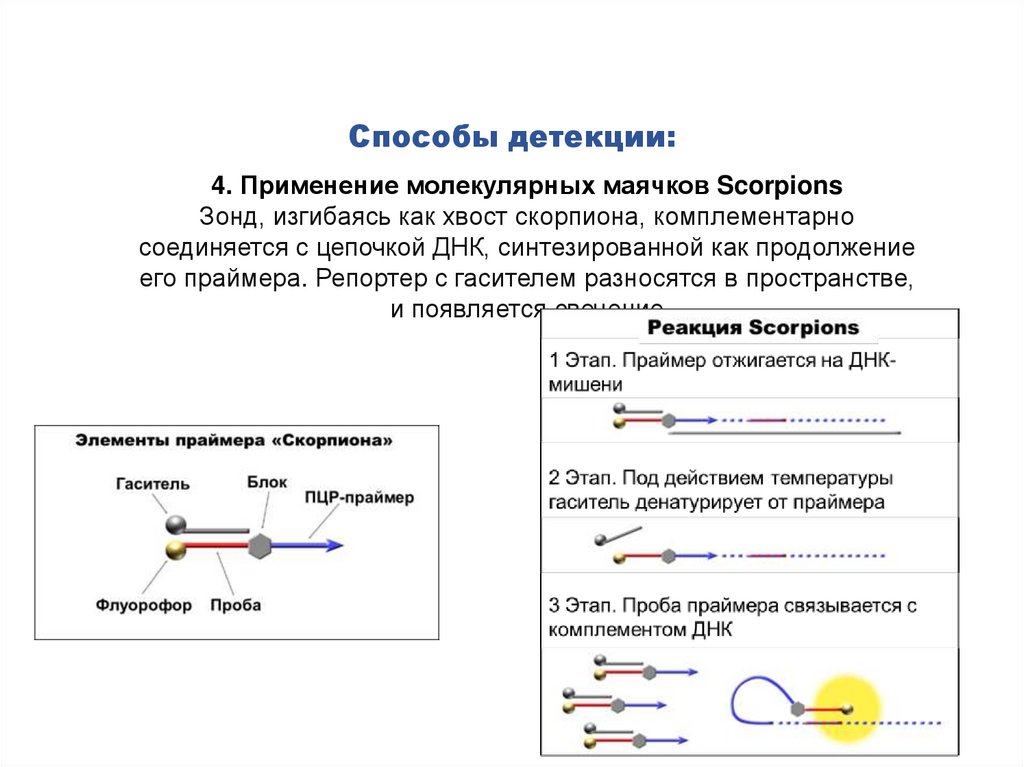
Способы детекции:4. Применение молекулярных маячков Scorpions
Зонд, изгибаясь как хвост скорпиона, комплементарно
соединяется с цепочкой ДНК, синтезированной как продолжение
его праймера. Репортер с гасителем разносятся в пространстве,
и появляется свечение
87.
88.
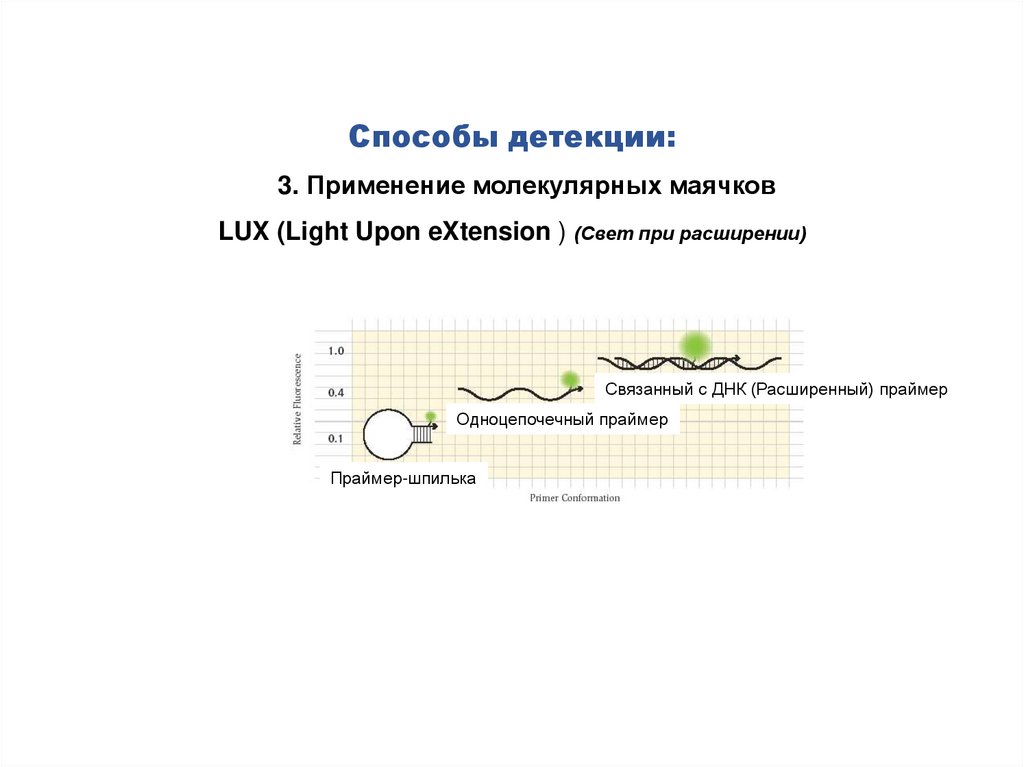
Способы детекции:3. Применение молекулярных маячков
LUX (Light Upon eXtension ) (Свет при расширении)
Связанный с ДНК (Расширенный) праймер
Одноцепочечный праймер
Праймер-шпилька
89.
90.
Протокол ПЦРАнализ результата
Флуоресценция
Стационарная фаза
Экспоненциальная фаза
Базовая линия
Начальная фаза
Число ПЦР циклов
91.
Протокол ПЦР92.
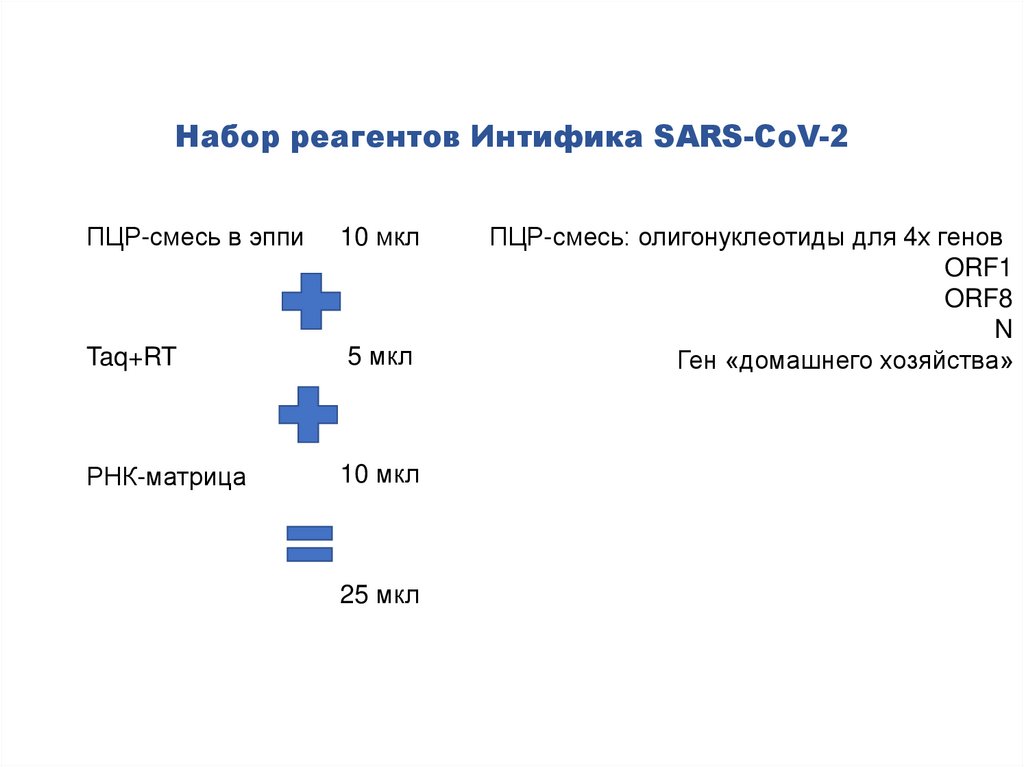
Набор реагентов Интифика SARS-CoV-2ПЦР-смесь в эппи
10 мкл
Taq+RT
5 мкл
РНК-матрица
10 мкл
25 мкл
ПЦР-смесь: олигонуклеотиды для 4х генов
ORF1
ORF8
N
Ген «домашнего хозяйства»



























 biology
biology








