Similar presentations:
Готовимся к ЕГЭ. Алканы
1.
Готовимся к ЕГЭАлканы
Куратова Инна Ивановна
2. Предмет изучения органической химии. Теория химического строения
СхНУ – углеводороды – этосоединения, состоящие из двух
элементов – углерода и водорода
СН4 – метан
С2Н4 - этилен
С2Н2 - ацетилен
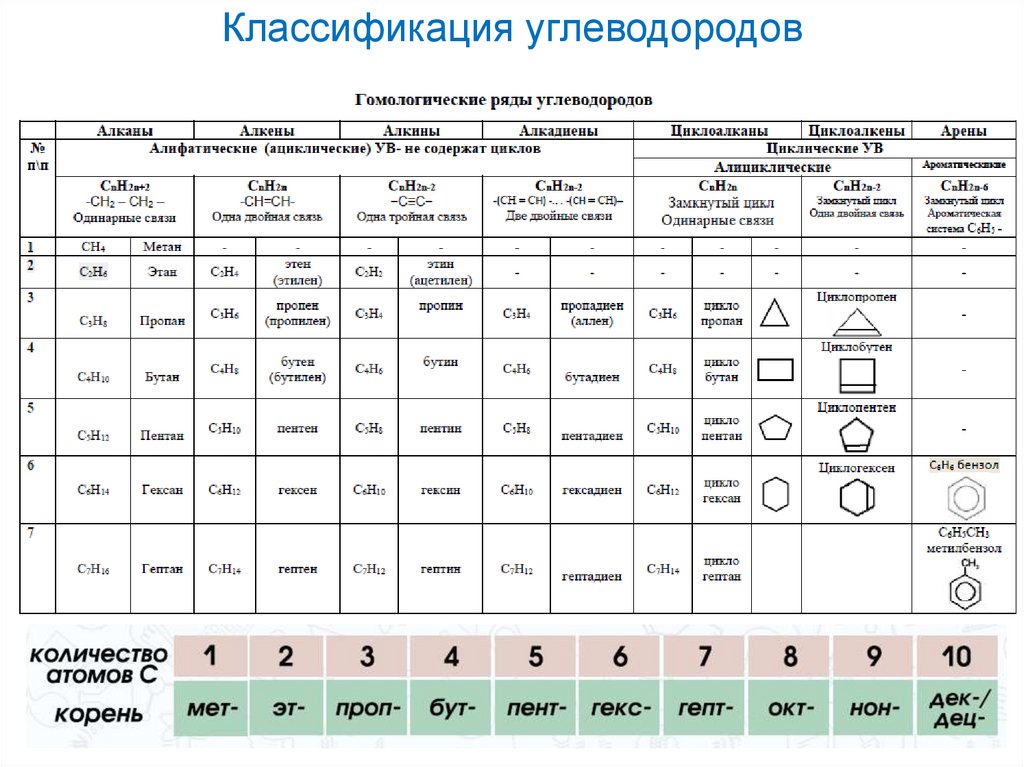
3. Классификация углеводородов
4.
АЛКАНЫ - углеводороды, вмолекулах которых атомы связаны
одинарными связями и которые
соответствуют общей формуле
СnH2n+2
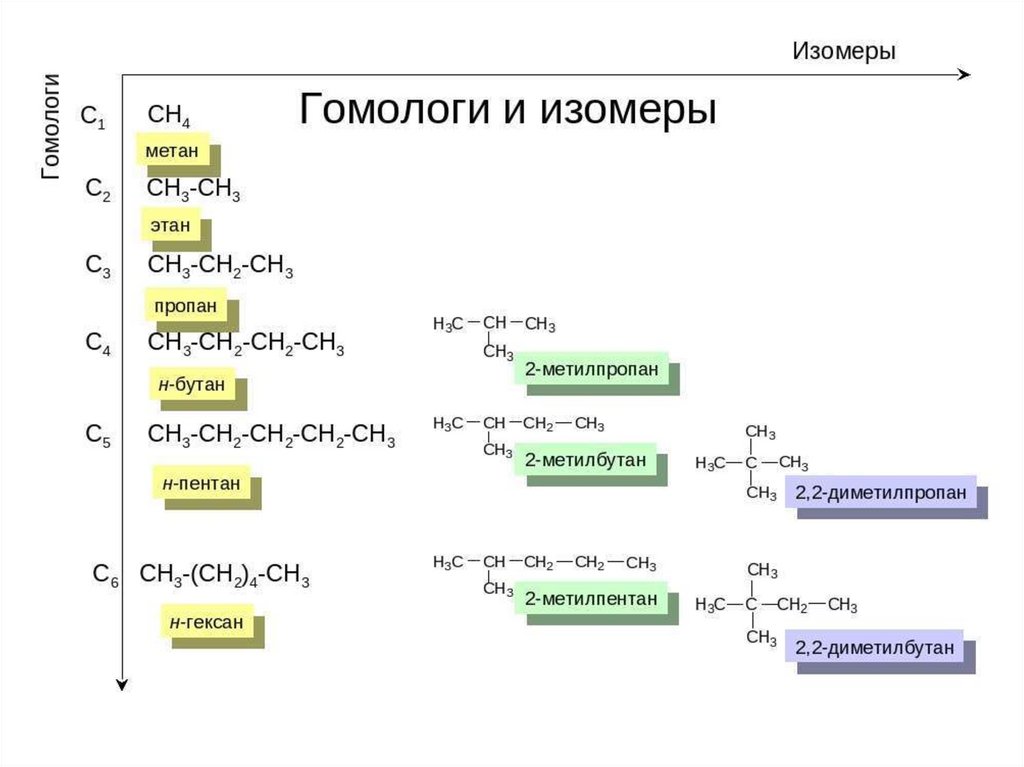
5. Гомологи. Гомологический ряд.
Гомологический ряд – это рядсоединений сходных по строению
(тип углеродного скелета, вид,
количество и расположение
заместителей и кратных связей и
т.д.) и по химическим свойствам
(т.е. соединений одного класса) и
отличающиеся друг от друга на
одну или несколько групп CH2
(гомологическую разность)
Гомологи- это вещества сходные
по строению и химическим
свойствам, и отличающиеся друг
от друга на одну или несколько
групп CH2 (гомологическую
разность)
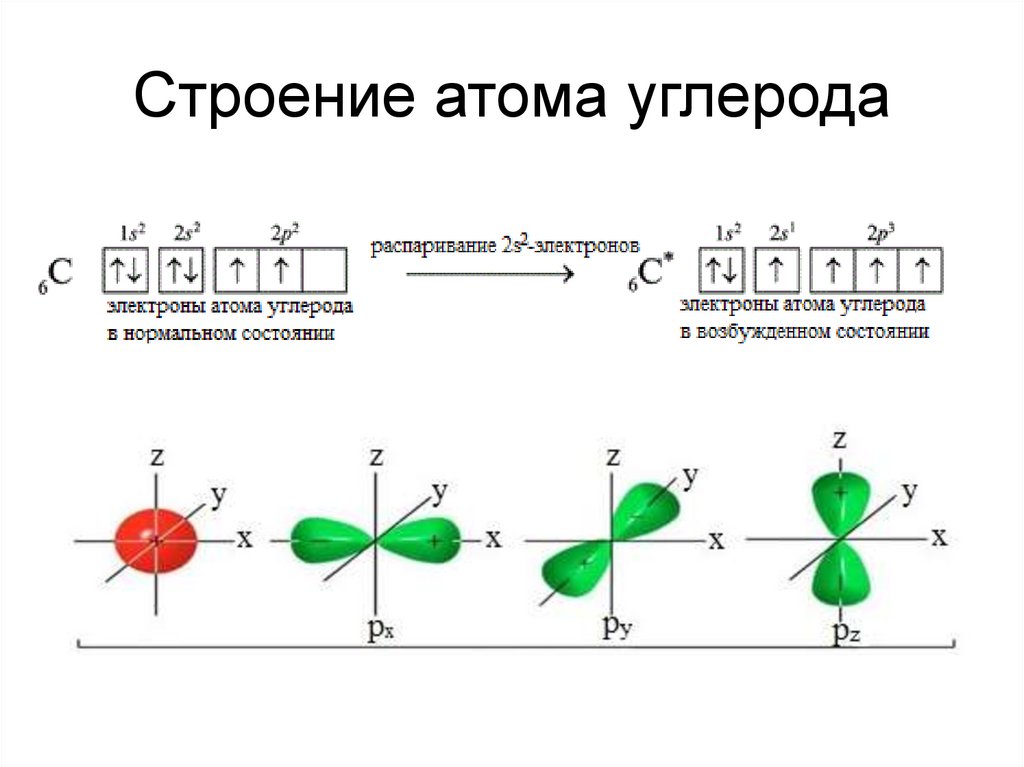
6. Строение атома углерода
7.
Гибридизация – изменение формы иэнергии различных орбиталей одного
атома, приводящее к образованию
одинаковых по форме и энергии
(гибридных) орбиталей
Виды
гибридизации
SP
3
SP
2
SP
8.
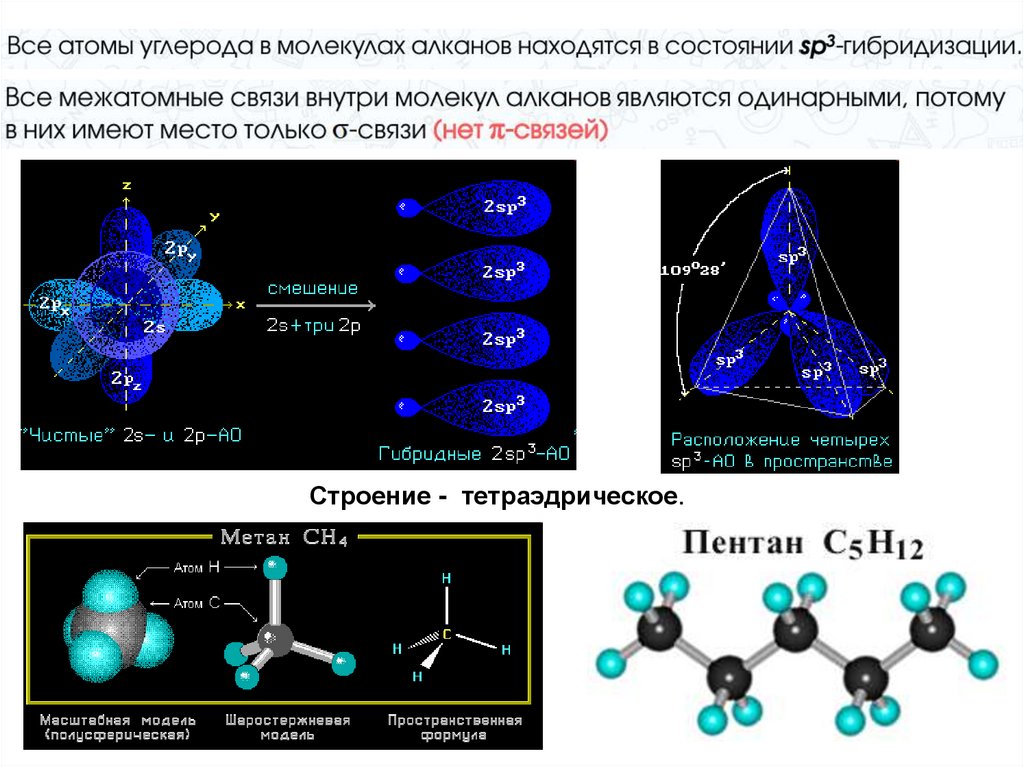
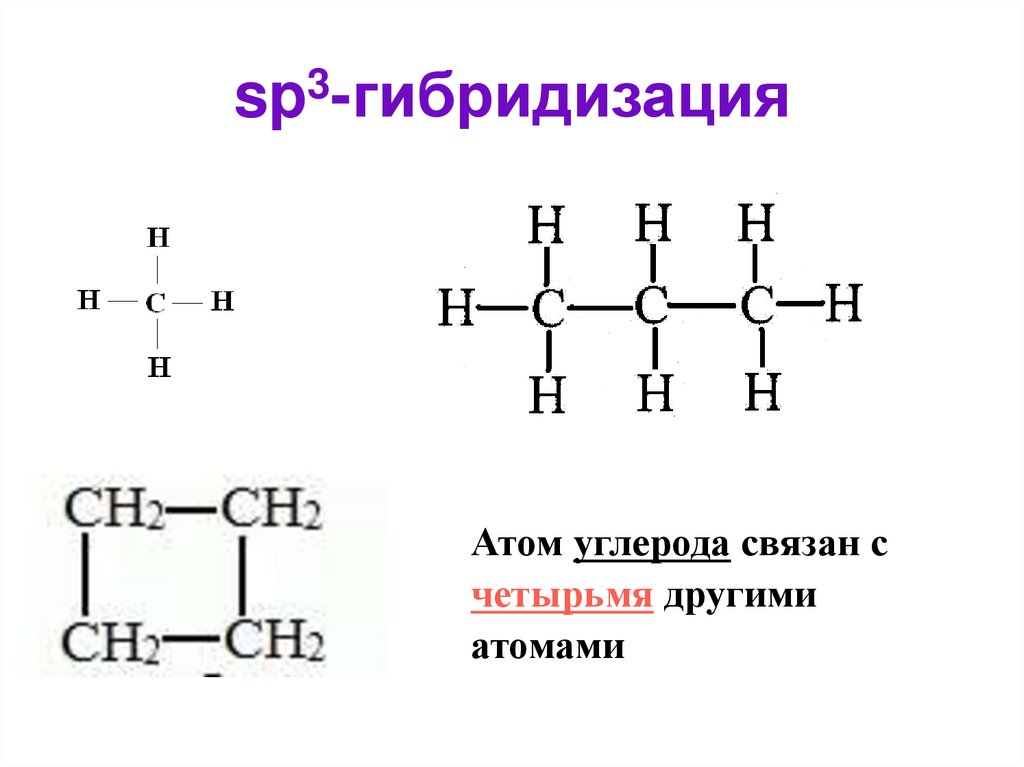
Строение - тетраэдрическое.9. sp3-гибридизация
Атом углерода связан счетырьмя другими
атомами
10. Типы углеродных атомов
11. Номенклатура
1.Чтобы назвать алкан линейного(нормального, н-) строения, нужно найти
число атомов углерода в основной цепи,
по этому числу выбрать корень и добавить
к нему суффикс «ан»
СН3 –СН2 – СН3
СН3 – СН2 – СН2 – СН2 – СН2 – СН2
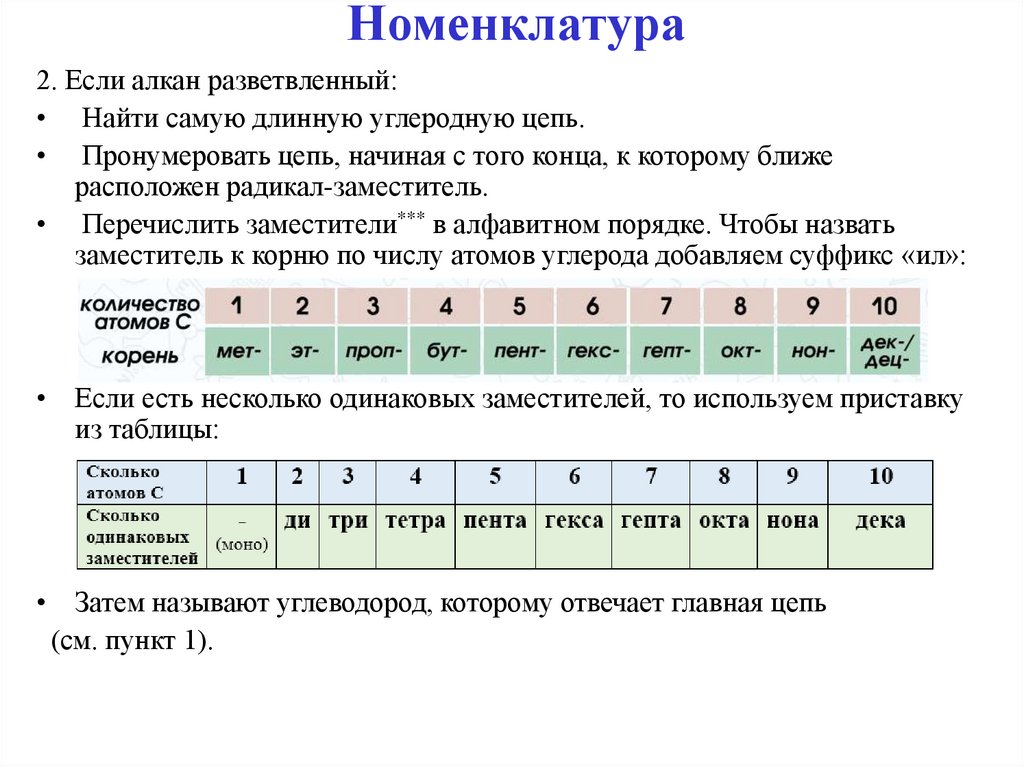
12. Номенклатура
2. Если алкан разветвленный:• Найти самую длинную углеродную цепь.
• Пронумеровать цепь, начиная с того конца, к которому ближе
расположен радикал-заместитель.
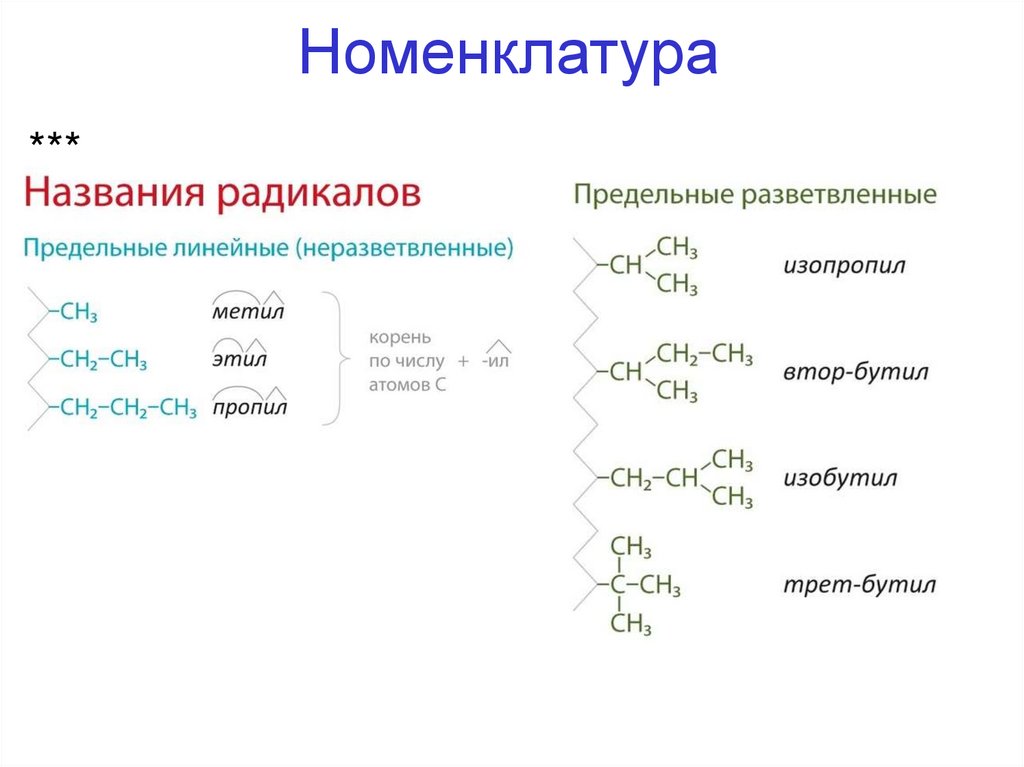
• Перечислить заместители*** в алфавитном порядке. Чтобы назвать
заместитель к корню по числу атомов углерода добавляем суффикс «ил»:
• Если есть несколько одинаковых заместителей, то используем приставку
из таблицы:
• Затем называют углеводород, которому отвечает главная цепь
(см. пункт 1).
13. Номенклатура
***14. Изомерия
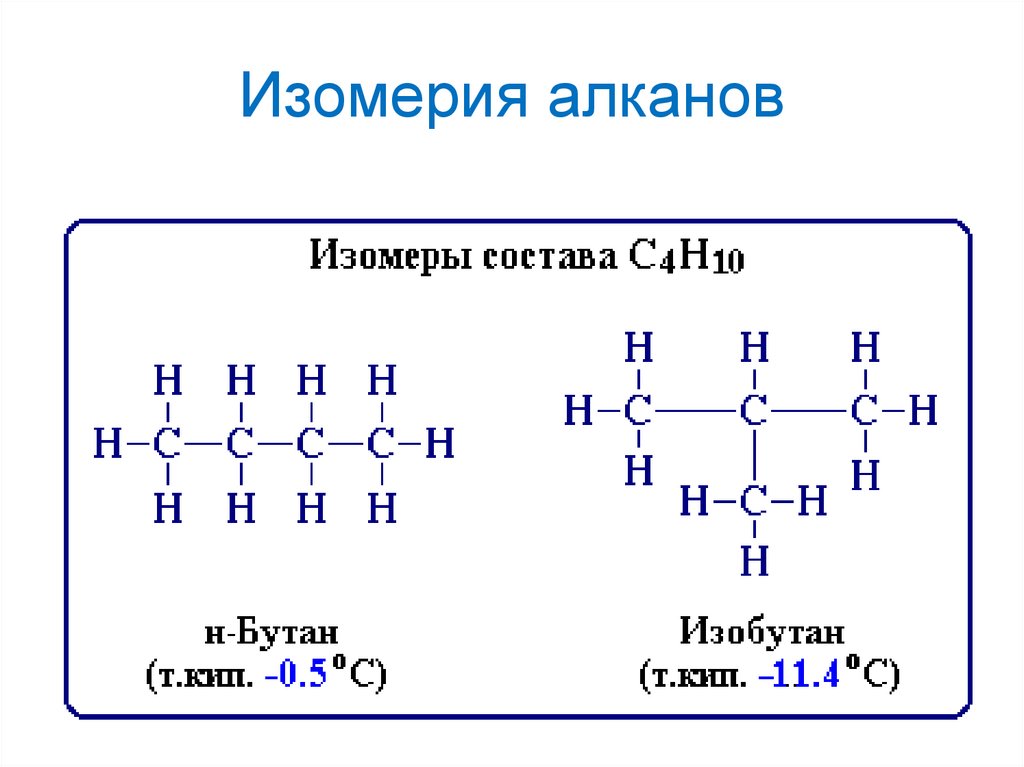
Изомерия – явление существования изомеров.Изомеры – химические соединения, имеющие
одинаковый качественный и количественный состав, но
отличающиеся строением молекул, физическими и
химическими свойствами.
Для алканов характерна структурная изомерия:
- Изомерия углеродного скелета.
Структурные изомеры – соединения одинакового качественного и
количественного состава, отличающиеся порядком связывания атомов, то
есть химическим строением.
15. Изомерия алканов
16.
17.
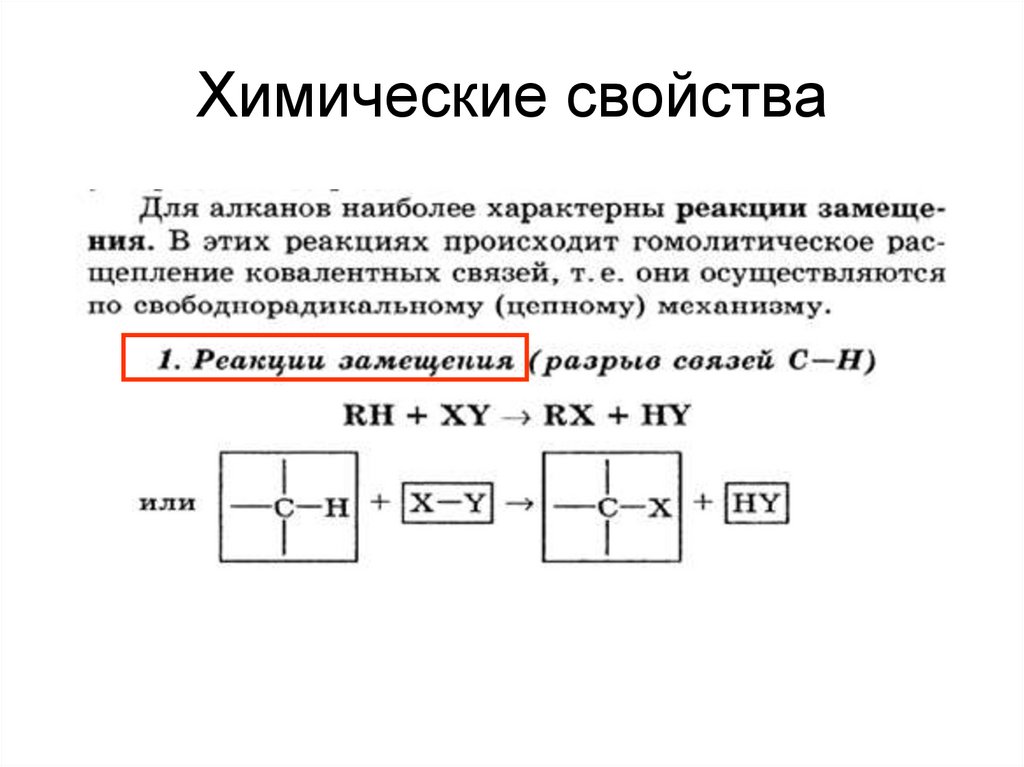
18. Химические свойства алканов
1. Реакции замещениягалогенирования,
нитрования- Реакция Коновалова,
2.
Реакции окисления
горение,
каталитическое окисление
конверсия метана с образованием синтез газа
3. Реакции отщепления
реакция дегидрирования,
реакция дегидроциклизации (ароматизации).
4. Термические превращения алканов
пиролиз, разложение на простые вещества
получение ацетилена из метана,
крекинг,
5. Реакция перегруппировки
реакция изомеризации
19. Химические свойства
20.
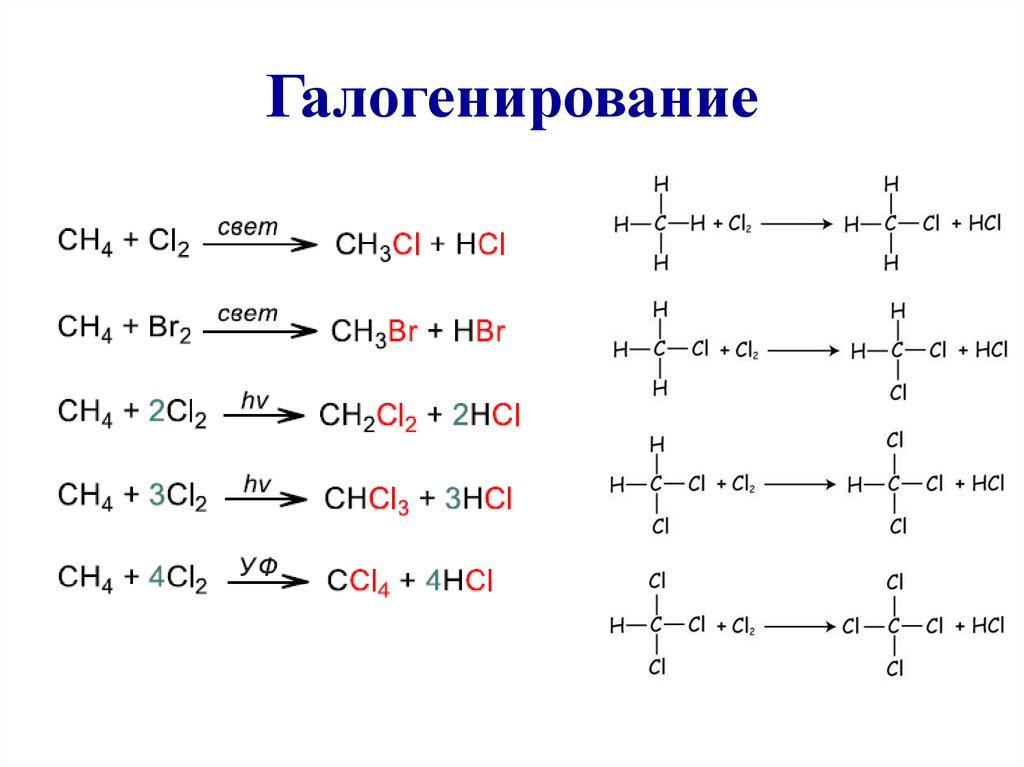
I. Реакции замещения1) Галогенирование – реакция радикального замещения.
Протекает на свету или при повышенной температуре. Йод
практически не взаимодействует. Реакция со фтором протекает
очень бурно. На практике применяют только хлорирование и
бромирование.
Условие реакции можно указать: «hv», «свет», «УФ»,
«облучение», «t».
Суть реакции: один или несколько атомов водорода замещаются
на атом галогена. (Реакция экзотермическая)
СН3- СH3 + Br2 hv→
СН3- СH3 + Cl2 hv→
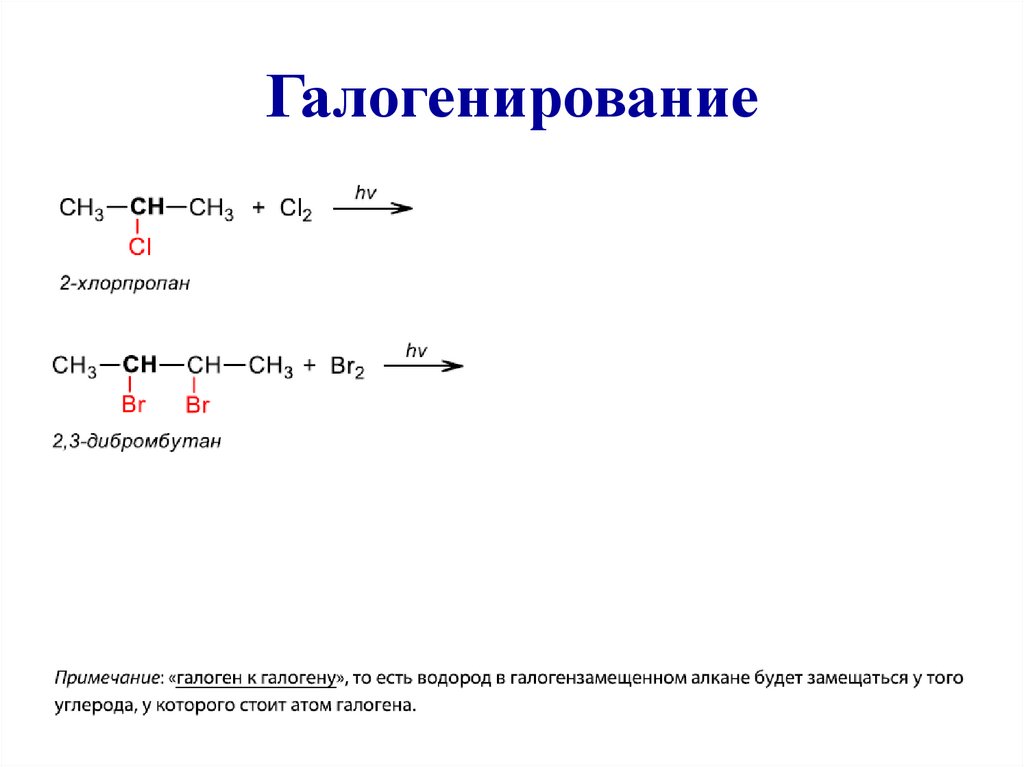
21. Галогенирование
22.
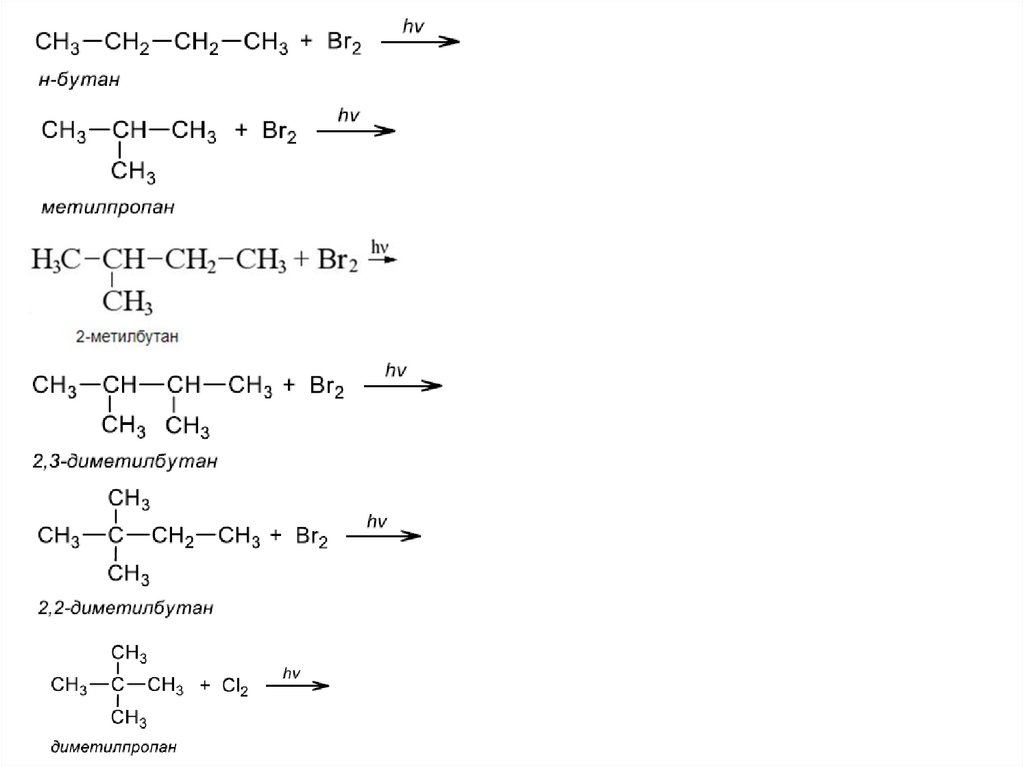
I. Реакции замещения1) Галогенирование – реакция радикального замещения
н – бутан + Br2 hv→
метилпропан + Br2 hv→
2-метилбутан + Br2 hv→
2,3 -диметилбутан + Br2 hv→
2,2 -диметилбутан + Br2 hv→
диметилпропан +Cl2 hv→
23.
ХИМИЧЕСКИЕ СВОЙСТВАI. Реакции замещения
1) Галогенирование – реакция радикального
замещения
24.
25. Галогенирование
26.
2) Реакция нитрования – реакция радикальногозамещения атома водорода нитрогруппой (реакция
М. И. Коновалова).
Для нитрования используется разбавленная азотная кислота при t =
1400 С при повышенном или нормальном давлении
CH4 + HNO3 ----T →
(HO-NO2)
CH3––CH3 + HNO3 ----T →
(HO-NO2)
27. Механизм реакции замещения
28. II. Окисление
В обычных условиях алканы устойчивы кдействию кислорода и окислителей.
1.Горение.
При поджигании на воздухе алканы горят
(полное окисление)
CH4 + O2 ---T →
C5H12 + O2 ----T →
29. Применение АЛКАНОВ
• Газообразные алканы - ценноетопливо
• Жидкие алканы – основа в
изготовлении косметики,
медикаментов; разные
растворители, моторное и
ракетное топливо и т. д.
• Твердые алканы –
изготовление свечей, пропитка
бумаги и т. д.
• Сырье для нефтехимических
производств
30. Литература
• А. С. Егоров, Г. Х. Аминова, химия,экспресс – репетитор для подготовки к
ЕГЭ, стр. 168 – 172
• А. С. Егоров, репетитор по химии, стр.
494 – 506
• О. С. Габриелян и др., химия 10 класс,
профильный уровень, § Алканы (см.
оглавление)

















 chemistry
chemistry








