Similar presentations:
Платиновые элементы (VIII-X)
1.
ПЛАТИНОВЫЕ ЭЛЕМЕНТЫ2.
РутенийРодий
Палладий
Осмий
Иридий
Платина
3.
Платиновые элементы – блестящиесеребристо-белые металлы (осмий –
синевато-серый). Самый тугоплавкий
осмий, у него самая высокая плотность –
22,7 г/см3. Обладают высокой
пластичностью – больше у платины и
палладия.
4.
ОсмийОткрыт в 1804 году английским химиком
Смитсоном Теннантом. Назван от др.греч.
ὀσμή (запах), по резко пахнущему летучему оксиду
OsO4 (напоминает озон).
Получение:
Из соли — перосмата натрия, который
восстанавливают водородом при 120 °C :
Na2[OsO2(OH)4] + 3H2 = 2NaOH + Os + 4H2O
OsO4+ 4H2= Os + 4H2O
5.
РодийОткрыт в 1803 году английским химиком Уильямом
Волластаном. Назван от др.греч.
ῥόδον (роза), соединения родия (III) имеют глубокий
тёмно-красный цвет.
Получение:
Из соли — перосмата натрия, который
восстанавливают водородом при 120 °C :
2RhCl3 + 3H2 = 2Rh + 6HCl
6.
ПалладийОткрыт в 1803 году английским химиком Уильямом
Волластаном. Назван по имени астероида Паллада,
открытого в 1802 году.
Получение:
Из соли — сульфида палладия:
PdS + H2 = Pd + H2S
Pd(NO3)2= Pd + 2NO2+ O2
7.
РутенийОткрыт профессором Казанского
университета Карлом Клаусом в 1844 году
из уральской платиновой руды.
Получение:
RuO2 + 2H2 = Ru + 2H2O
8.
ИридийИридий был открыт в 1803 году английским
химиком Смитсоном Теннантом одновременно с
осмием.
Получение:
3(NH4)2[IrCl6] = 2N2 + 2NH3 + 18HCl + 3Ir
(NH4)2[IrCl6] + 2Н2 = 2NH3 + 6HCl + Ir
9.
ПлатинаИзвестна с давних времен в Южной Америке.
В 1748 году испанский математик и мореплаватель А. де
Ульоа первым привез на европейский континент образцы
самородной платины. Впервые в чистом виде платина
получена английским химиком У. Волластоном в 1803 г.
Получение:
3(NH4)2[PtCl6] = 2N2 + 2NH3 + 18HCl + 3Pt
(NH4)2[PtCl6] = 2HCl + 2NH3 + 2Cl2 + Pt
200 oC
600 oC
H2[PtCl6] + 2HCOOH + 3Na2CO3 = 6NaCl + 5CO2 + 3H2O + 3Pt
10.
Химические свойства металлов1. Окисление кислородом
Os + 2O2 = OsO4 (200оС) Ru+ O2 = RuO2 (400 oC)
2Rh+ 3O2 2Rh2O3
Ir + O2 IrO2
2Pd + O2 (1 атм) = 2PdO
Pt + O2 ≠
2. Окисление фтором
Ru+ 3F2 = RuF6 Os + 3F2= OsF6 Pt + 3F2= PtF6
2Rh + 5F2= 2RhF5
2Ir + 5F2= 2IrF5
Pd + 2F2= PdF4
3. При Т > 1000 oC реагируют с S, Se, Te, P, Si, C, B
(кроме азота)
Pd + S = PdS Ir+ 3P = IrP3 Ru+ Si= RuSi
4.Растворяют Н2, не реагируя.
11.
5.Не растворяются в кислотах и щелочах6. Взаимодействие с кислотами-окислителями
Pd + 4HNO3(конц) = Pd(NO3)2 + 2NO2 + 2H2O
3Pt + 4HNO3+ 18HCl = 3H2[PtCl6] + 4NO + 8H2O
Ru, Rh, Os, Ir + HNO3+ HCl ≠
Pt+ 2HNO3+ 4HCl + Cl2= H2[PtCl6] + 2NO2+ 2H2O
Аналогично для Rh, Ir
7. Щелочное окисление
Ru+ 3NaNO3+ 2NaOH (ж) = Na2RuO4+ 3NaNO2+ H2O
Аналогично для Os
Ir+ 2NaNO3+ 2NaOH (ж)= Na2IrO3+ 2NaNO2+ 2H2O
аналогично для Rh
2Rh + 3BaO2 = Rh2O3+ 3BaO
Аналогично для Ir
12.
Применение металлов1. Pt, Rh, Ir - изготовлениехимическойпосуды,
аппаратуры, термопар, электродов
2. Pt, Pd, Rh - производство катализаторов
3. Pd - глубокая очистка водорода
4. Pt – создание лекарственных препаратов
5. Ru, Ir – нанесение защитных покрытий
6. Pd - создание датчиков, сенсоров
7. Ir, Ru, Os – изготовление сверхтвердых,
инертных и износостойких инструментов
8. Pt, Rh, Ir – изготовление ювелирных изделий
13.
Высшие с.о. Ru, Os1. Получение
Os + 2O2 = OsO4
Na2RuO4+ Cl2 = RuO4 + 2NaCl
2. Соединения Os (VIII)
OsO4 + 2KOH = K2[OsO4(OH)2] перосмат
OsO4 + 2NaF = Na2[OsO4F2]
OsO4 + F2= Os2O3F2 + ½O2
OsO4 + NH3+ KOH = K[OsO3N]
3. Окислительные свойства
2OsO4+ C2H5OH + 5KOH = 2K2[OsO2(OH)4] + CH3COOK
2RuO4+ 4KOH = 2K2RuO4 + O2 + 2H2O сильный окислитель
3K2RuO4+ HNO3= 2KRuO4+ RuO2+ 4KNO3+ 2H2O
Диспропорционирование: Ru6+ → Ru7+ + Ru4+
14.
Соединения Ru, Os(IV)1. Галогениды:
Известны RuF4, RuCl4, OsF4, OsCl4, OsBr
4Ru+ 2Cl2 + 2KCl = K2[RuCl6] (t)
OsCl4 + 2KCl = K2[OsCl6]
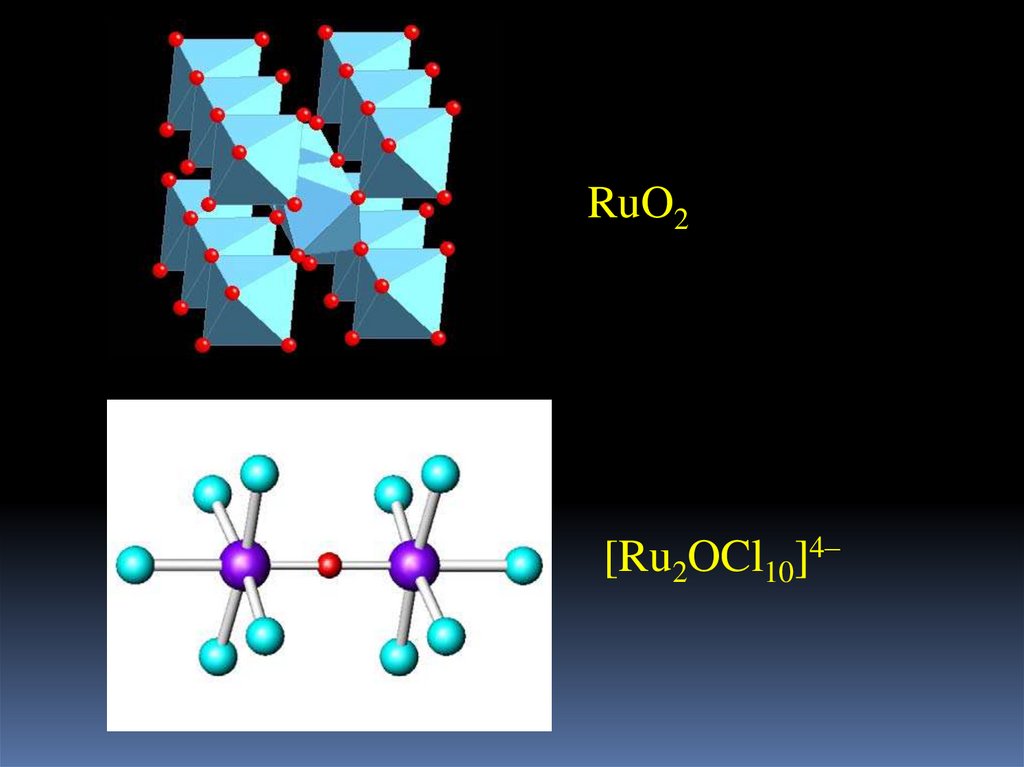
RuO4+ 14HCl + 4KCl = K4[Ru2OCl10] + 7H2O + 4Cl2
темно-красный
2. Оксиды RuO2, OsO2
RuO2: темно-синий, t.разл. = 1200 оС
OsO2: светло-коричневый, t.разл. = 600 оС
Ru+ O2= RuO2 (400 oC)
OsO4+ H2= OsO2+ 2H2O (25 oC)
3. Кислородные соединения
RuO2+ SrCO3= SrRuO3 (700 oC)
2K4[Ru2OCl10] + 6H2SO4+ 16H2O = [Ru4O6(H2O)12](SO4)2 +
4K2SO4+ 20HCl
15.
RuO2[Ru2OCl10]4–
16.
Низшие с.о. Ru, Os1. Галогениды: известны MX3 (кроме OsF3), MX2
(кроме MF2)
2Ru + Cl2= 2RuCl3
2RuO4+ 16HI (aq) = 2RuI3+ 5I2+ 8H2O
2RuO4 + 16HCl (к) + 6KCl = 2K3[RuCl6] + 5Cl2+ 8H2
2. Комплексы Ru, Os (III) все–октаэдры,
низкоспиновые
RuCl3·3H2O + 2NaCl = Na2[RuCl5(H2O)] + 2H2O
красный
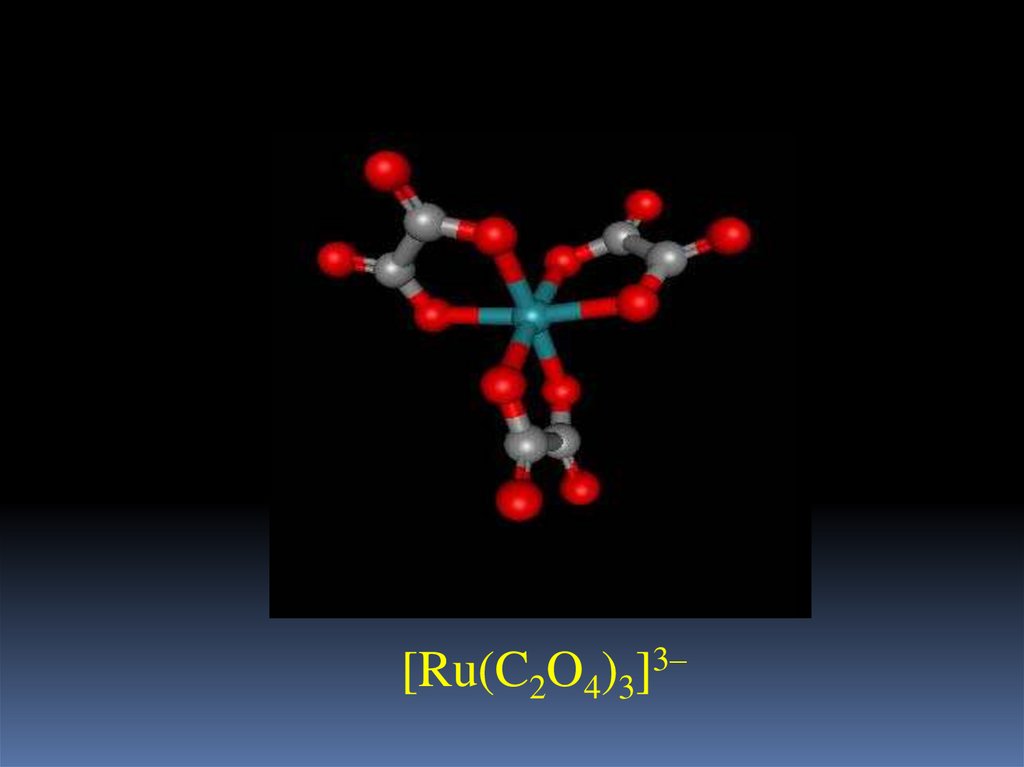
RuCl3·3H2O + 3H2C2O4 = H3[Ru(C2O4)3] + 3HCl + 3H2O
темно-зеленый
2K2[OsO2(OH)4]+ 16HCl(к) + 2KCl = 2K3[OsCl6] +
12H2O + 3Cl2
17.
[Ru(C2O4)3]3–18.
Высшие с.о. Rh, Ir1. Соединения Rh, Ir (VI,V)
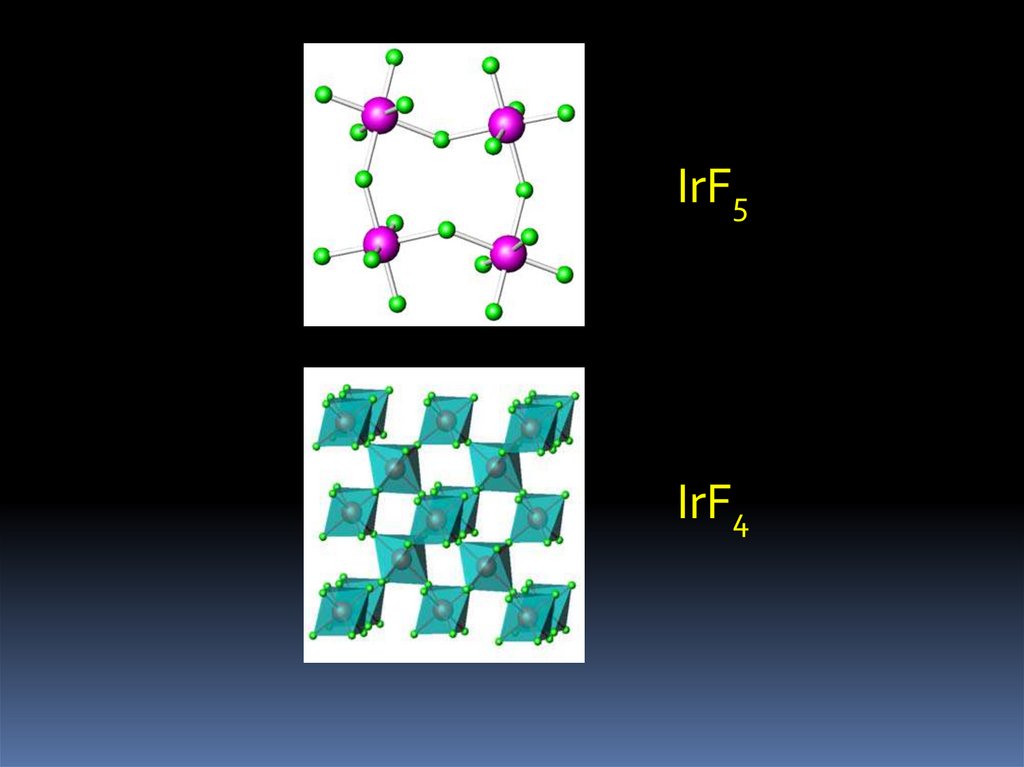
Известны RhF6, IrF6, RhF5, IrF5
RhF6 = RhF5 + ½F2 (120 oC)
5IrF6+ Ir = 6IrF5 (350 oC)
2IrF6+ H2O = 2IrO2·2H2O + O2+ 12HF
RhF6 + 3Cl2= 2RhF6+ 6ClF
2. Соединения Rh, Ir (IV)
Известны RhF4, IrF4, IrO2 (единственный оксид Ir)
IrO2+ 4HCl + 2KCl = K2[IrCl6] + 2H2O
темно-красный
(NH4)2[IrCl6] + 2H2 = Ir+ 2NH3+ 6HCl
K2[IrCl6] + 2KI = K3[IrCl6] + ½I2
Rh (IV) очень сильный окислитель
19.
IrF5IrF4
20.
Низшие с.о. Rh, Ir1. Получение:
2RhCl3·3H2O + 4CH3COOH = [Rh2(CH3COO)4]·2H2O +
+ 6HCl + 3H2O (метанол, t)
RhCl3·3H2O + 2PPh3 = [RhCl(PPh3)2] + 3H2O + Cl2
(этанол, t)
K3[IrCl6] + CO + 2PPh3 = [IrCl(CO)(PPh3)2] + 3KCl + Cl2
2. Все комплексы Rh (II) имеют остов Rh24+
3. Все комплексы Rh (I), Ir (I) квадратные
[IrCl(CO)(PPh3)2] + I2= [IrCl(I)2(CO)(PPh3)2]
4. Карбонилы
2RhCl3·3H2O + 6CO = Rh2(CO)4Cl2+ 2COCl2+ 6H2O
21.
Соединения Pd, Pt(IV)1.Основные с.о. Pd, Pt +2, +4. Известен PtF6 - фторокислитель
PtF6+ O2= O2[PtF6]
Pt5+
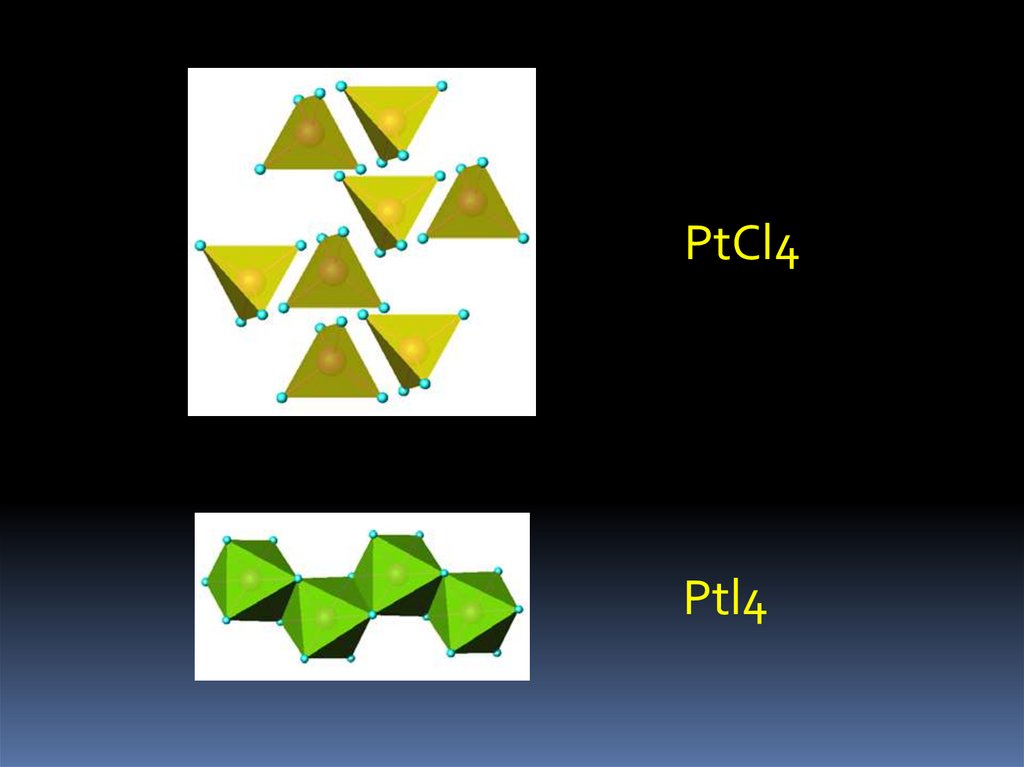
2. Галогениды. Известны PdF4, PtX4
Pt + 2Cl2= PtCl4 (300 oC)
красно-коричневый
PtCl4+ 5H2O = [PtCl4(H2O)2]·3H2O
3. Оксиды PdO2, PtO2
PtCl4+ 4KOH + (n–2)H2O = PtO2·nH2O + 4KCl
оранжевый
K2[PtCl6] + 2Na2CO3= PtO2+ 4NaCl + 2KCl + 2CO2
коричневый
PtO2·2H2O + 2NaOH = Na2[Pt(OH)6]
PtO2·2H2O + 6HCl (к) = H2[PtCl6] + 4H2O
22.
PtCl4Ptl4
23.
Соединения Pd, Pt (II)1. Галогениды. Известны все МХ2, кромеPtF2
Pd + Cl2 = PdCl2 (500 oC) т.пл. = 680 oC
PtCl4 = PtCl2+ Cl2 (400 oC) т.пл. = 580 oC
PdCl2+ 2HCl = H2[PdCl4]
H2[PtCl6] + SO2+ 2H2O = H2[PtCl4] + H2SO4+ 2HCl
PdCl2+ CO + H2O = Pd + CO2+ 2HCl
24.
2. ОксидыPdO т.разл. = 900 оС, PtO т.разл. = 350 оС
PdCl2 + 4NaNO3 → PdO+ Na2O + 2NaCl + 2N2+ 5O2
PdCl2+ 2KOH = Pd(OH)2+ 2KCl
амфотерен
Pd(OH)2+ 2HClO4+ 2H2O = Pd(ClO4)2·4H2O
Pd(OH)2+ 2KOH = 2[Pd(OH)4]
квадратные комплексы
H2[PtCl4] + 4KOH = PtO·2H2O + 4KCl + H2O
25.
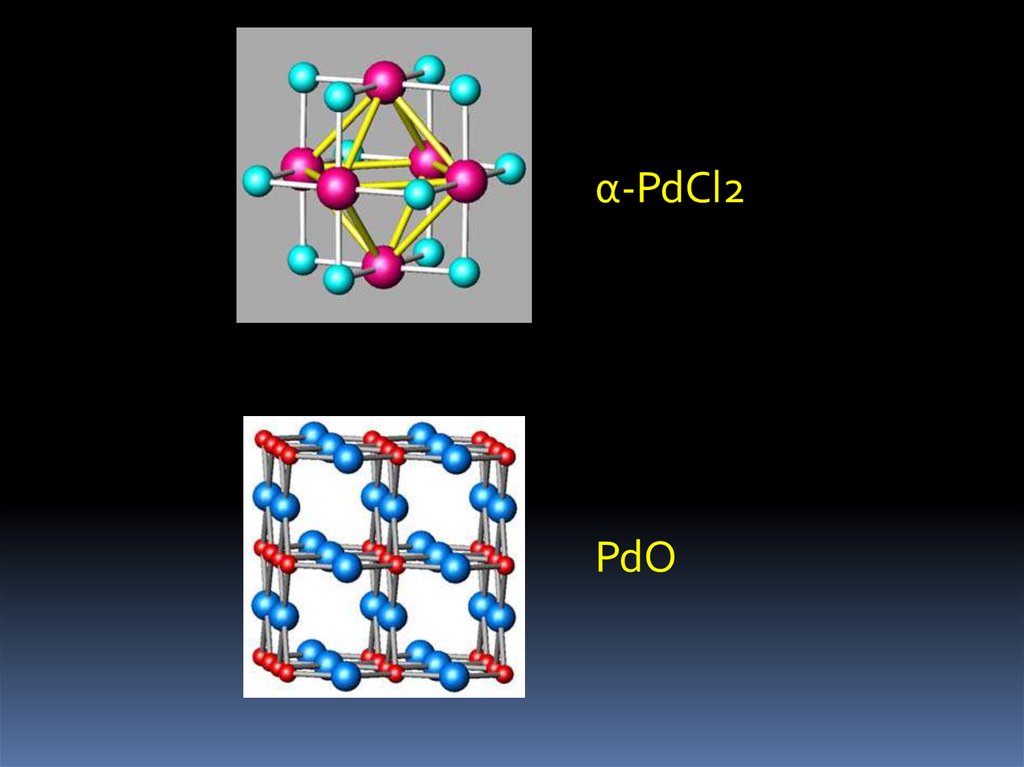
α-PdCl2PdО




















 chemistry
chemistry








