Similar presentations:
Галогенопроизводные углеводородов
1.
Тема: Галогенопроизводныеуглеводородов
Вопросы:
1. Номенклатура галогенопроизводных
углеводородов.
2. Способы получения.
3. Химические свойства.
4. Применение.
2.
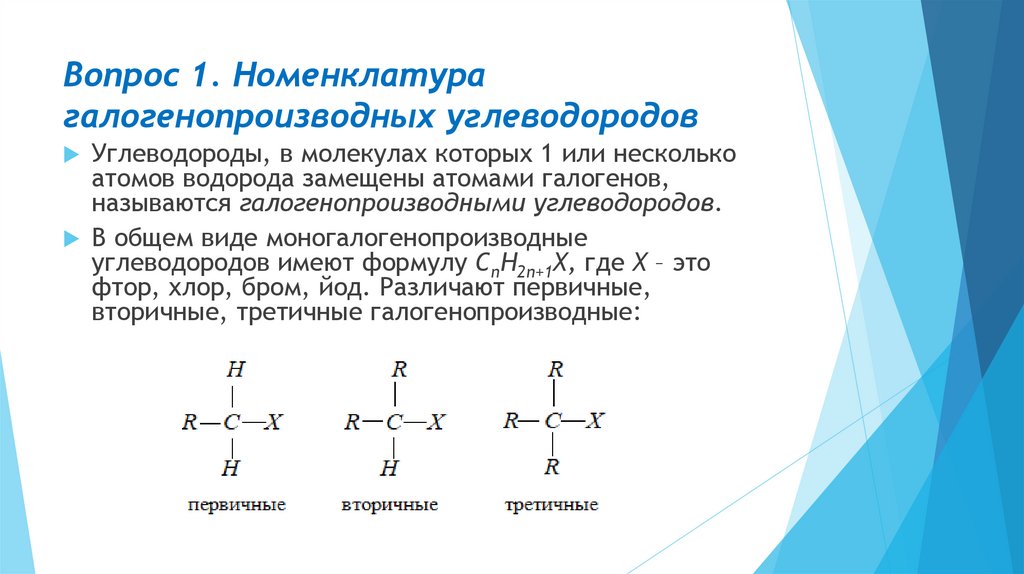
Вопрос 1. Номенклатурагалогенопроизводных углеводородов
Углеводороды, в молекулах которых 1 или несколько
атомов водорода замещены атомами галогенов,
называются галогенопроизводными углеводородов.
В общем виде моногалогенопроизводные
углеводородов имеют формулу CnH2n+1X, где Х – это
фтор, хлор, бром, йод. Различают первичные,
вторичные, третичные галогенопроизводные:
3.
Названиягалогенопроизводных
составляют
из
названий
соответствующих
углеводородов, добавляя название галогена, при этом для сложных галогенопроизводных
перед названием указывается положение галогена в углеводородной цепи.
Например:
СH3–CH(Cl)–CH2–CH3 –2-хлорбутан;
СH3–CH(Cl)–CH(СН3)–CH3 –2-хлор-3 метилбутан.
Вопрос 2. Способы получения
1. Хлорирование алканов (см. свойства алканов).
2. Хлорирование алкенов при повышенной температуре:
СН2═СН2+Сl2 →CH2═СН–Cl (хлорэтен, хлористый винил) +HCl.
3. Замещение гидроксильной группы на галогены:
а) R–O–H + HCl R–Cl + H2O;
б) R–O–H + PCl5 (пентахлорид фосфора) → R–Cl + POCl3 +HCl;
в) R–O–H + SOCl → R–O–SOCl + HCl → R–Cl + SO2.
4.
Вопрос 3. Химические свойства1. Каталитическое гидрирование:
R–Cl + H2 → R–H + HCl.
2. Гидролиз в щелочной или кислой среде:
а) R–Cl + H2O → R–OH + HCl;
б) СH3–CHCl2 + H2O → СH3–CO(H) (уксусный альдегид) + 2HCl;
в) СH3–CCl3 + 2H2O → СH3–COOH (уксусная кислота) + 3HCl;
г) СH2Cl–CH2Cl + 2H2O → СH2OH–CH2OH (этиленгликоль) + 2HCl.
3. Получение простых эфиров действием алкоголятов щелочных металлов:
CH3–CH2–Br + Na–O–CH3 → CH3–CH2–O–CH3 + NaBr
метилэтиловый эфир.
5.
4. Образование аминов при взаимодействии с аммиаком:СH3I + 2NH3 → CH3–NH2 + NH4I.
Могут быть получены также вторичные и третичные амины.
5. Образование нитрилов при взаимодействии с солями синильной кислоты:
CH3Cl + KCN → CH3CN (ацетонитрил) + KCl.
6. Получение сложных эфиров взаимодействием с солями органических кислот:
C2H5I + CH3–COOAg → CH3–C(O)–O–C2H5+ AgI.
ацетат серебра
7. Реакция Вюрца (получение алканов):
СH3– I + 2Na + CH3–CH(CH3)–I → CH3–CH(CH3)–CH3+2NaI.
6.
Вопрос 4. ПрименениеСH2Cl2 (хлористый метил)
растворителя и хладоагента.
применяют
СHCl3 (хлороформ) применяют
растворителя и хладоагента. Ядовит.
также
в
качестве
в
качестве
СCl4 (четыреххлористый углерод) является хорошим
растворителем жиров, масел, каучука, полимерных смол. Не
горюч.
СH2(Cl)–CH2(Cl) (дихлорэтан) применяют при производстве
винилхлорида, этилендиамина, этиленгликоля и др. Хороший
растворитель органического стекла. Ядовит.





 chemistry
chemistry








