Similar presentations:
Интервенционная хирургия
1.
Интервенционнаяхирургия
2.
Интервенционная хирургия(эндоваскулярная хирургия, рентгенохирургия,
интервенционная радиология) –
молодое и перспективное направление современной
медицины.
Возникла как альтернатива открытому хирургическому
вмешательству.
Это приоритетное направление миниинвазивных
вмешательств.
Особенность малоинвазивной хирургии – ее высокая
эффективность, и относительная безопасность,
сопоставимая с терапевтическими методами лечения
3.
Главная особенность эндоваскулярнойхирургии- все вмешательства
производятся чрескожным доступом под
контролем методов лучевой визуализации
(ультразвук, рентген, КТ, МРТ) с
использованием специальных
инструментов.
Контроль осуществляется при помощи
ангиографического аппарата в
специальной рентгенооперационной.
4.
Преимущества интервенционной хирургиии:малая инвазивность метода,
уменьшением послеоперационных осложнений,
уменьшением летальности и сроков
госпитализации, что в целом улучшает результаты
лечения и уменьшает затраты на лечение.
В большинстве случаев для выполнения вмешательств
не требуется общий наркоз — выполняется только
местное обезболивание в точке пункции, что
позволяет выполнять вмешательства даже пациентам
с тяжёлыми сопутствующими заболеваниями. Так как
после вмешательства не остаётся
послеоперационной раны и швов.
5.
Основные направления интервенционнойхирургии:
эндоваскулярные,
эндобронхиальные,
эндобилиарные,
эндоуринальные,
диагностическая пункция (биопсия молочной
железы, печени, простаты и щитовидной железы
под контролем УЗИ),
эндоэзофагеальные,
чреcкожное дренирование кист и абсцессов,
чрескожные операции на костях и суставах.
6.
Осложнения эндоваскулярныхвмешательств разделяют на:
• связанные с введением местных анестетиков
(аллергия)
• связанные с введением контраста (аллергия,
ангиоспазм, нефропатия)
• связанные с местом пункции (кровотечения,
гематомы, псевдоаневризмы, фистулы)
• связанные с внутрисосудистой манипуляцией
(перфорация, диссекция, тромбоз)
7.
История развитияИзначально эндоваскулярная техника создавалась
исключительно для диагностических целей.
Однако получение феноменальных результатов
лечения позволило этому ей занять обособленную
нишу в современных медицинских технологиях.
Благодаря достижениям эндоваскулярной хирургии
появились альтернативы таким методам
традиционной хирургии как коронарное
шунтирование, каротидная эндартерэктомия и
клипирование аневризм.
8.
За 400 лет до н. э. люди научились придавать изогнутую форму трубкам изполого тростника и использовали их на трупах для изучения анатомии и
функции клапанов сердца.
1711 г. - голландский физиолог Хальс провел первую катетеризация полости
сердца у лошади с помощью трубок из латуни, стекла и гусиной трахеи.
1844 г. - французский физиолог Клод Бернар через сонную артерию ввел
термометр в левый желудочек лошади для записи внутрисердечного
давления. Ввел термин «катетеризация сердца» и использовал
катетеры для записи внутрисердечного давления у животных.
1870 г. - Adolph Fick предложил методику инвазивного измерения
сердечного выброса.
1895 г. - В. Рентген открыл Х- лучи.
1896 г. - Хашек и Линденталь получили изображение сосудов
ампутированной кисти путем введения в них ртути.
9.
1896 г. - В. М. Бехтерев предсказал открытие ангиографии.«...Раз стало известно, что некоторые растворы не пропускают лучи
Рентгена, то сосуды мозга могут быть заполнены ими и
сфотографированы in situ».
Однако понадобилось более тридцати лет, чтобы эти смелые
предположения были реализованы на практике.
Интервенционная радиология возникла и развивалась на
основе ангиографии
1929 г. - год возникновения интервенционной хирургии, когда интерн
медицинского университета W. Forssman в эксперименте на себе впервые в мире
провел мочеточниковый катетер через локтевую вену в полость правого
предсердия, доказав тем самым безопасность введения катетера в живое сердце
человека. Через два года он описал первую в истории ангиокардиографию, выполненную
на самом себе. За эти опыты на себе он был немедленно уволен из клиники в городе
Эберсвальд (Германия) и лишен на всю жизнь возможности заниматься кардиологией.
10.
В 1941 г. Курнанд и Ричардс впервыеиспользовали сердечный катетер как
диагностический инструмент, чтобы определить
функциональное состояние сердца.
И только в 1956 г., спустя 27 лет после W. Forssman,
ученые из США Курнанд и Ричардс были
номинированы на Нобелевскую премию
«за открытие, связанное с катетеризацией
сердца и патологическими изменениями в
системе кровообращения»
В 1953 г. S. Seldinger предложил пункционный
доступ в артерию, которым пользуются до сих
пор.
11.
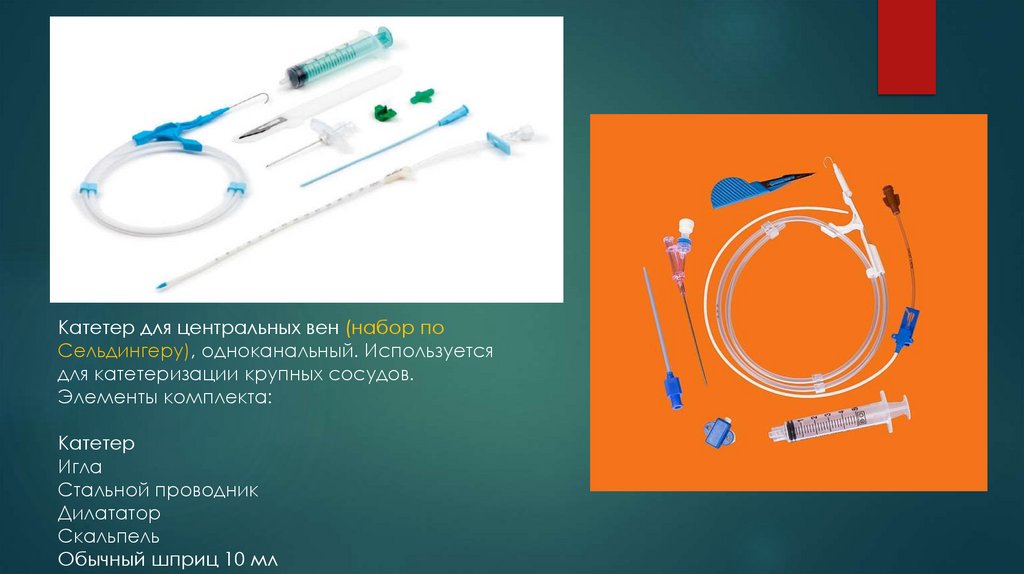
Катетер для центральных вен (набор поСельдингеру), одноканальный. Используется
для катетеризации крупных сосудов.
Элементы комплекта:
Катетер
Игла
Стальной проводник
Дилататор
Скальпель
Обычный шприц 10 мл
12.
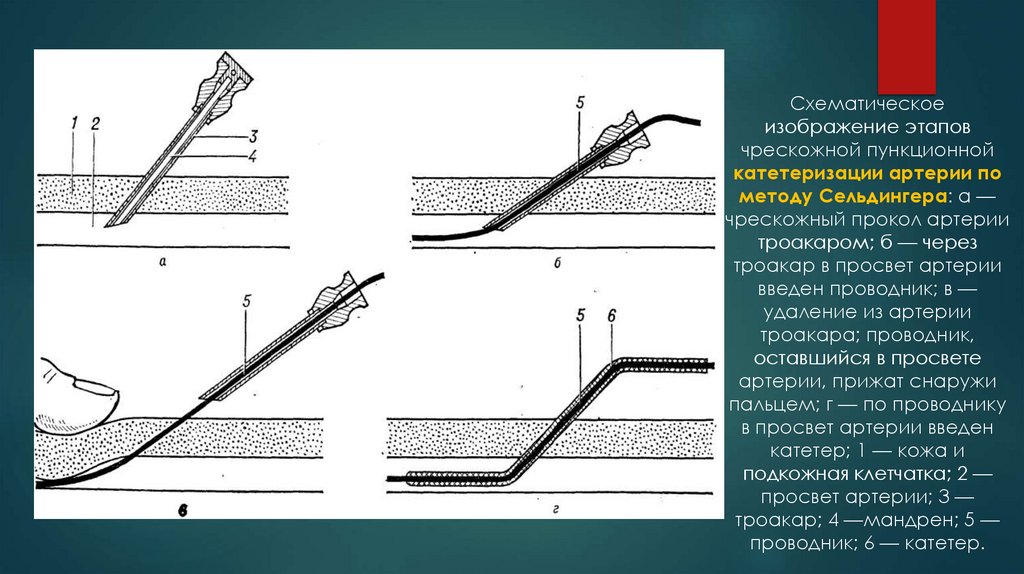
Схематическоеизображение этапов
чрескожной пункционной
катетеризации артерии по
методу Сельдингера: а —
чрескожный прокол артерии
троакаром; б — через
троакар в просвет артерии
введен проводник; в —
удаление из артерии
троакара; проводник,
оставшийся в просвете
артерии, прижат снаружи
пальцем; г — по проводнику
в просвет артерии введен
катетер; 1 — кожа и
подкожная клетчатка; 2 —
просвет артерии; 3 —
троакар; 4 —мандрен; 5 —
проводник; 6 — катетер.
13.
В 1958 г. Соунс впервые зафиксировалрентгеноконтрастное изображение коронарных
артерий на кинопленку при выполнении аортографии
у больного с поражением аортального клапана.
Предложил собственную методику диагностической
коронарной ангиографии и сконструировал
несколько моделей соответствующих катетеров.
В. П. Демихов в начале 50-х годов XX в. разработал
методики маммарно-коронарного анастомоза в
эксперименте на собаках, и его работы послужили
основанием для внедрения В. И. Колесовым подобной
операции в клиническую практику.
В 1964 г. Ч. Доттер и М. Джадкинс
предложили новый транскатетерный метод
восстановления атеросклеротически
суженных и окклюзированных
периферических артерий.
14.
1974 г.- Андреас Грюнтциг выполнил первую процедуру периферическойангиопластики.
В 1976 г. он представил результаты экспериментальных работ по коронарной
баллонной ангиопластике на животных, однако они получили мало отзывов .
В 1976 г. R. Myler и Андреас Грюнтциг решили сотрудничать в поисках эффективного и
безопасного способа выполнения коронарной баллонной ангиопластики.
В 1977 г. с участием Андреас Грюнтциг, R. Myler и Е. Наппа в Сан-Франциско была
выполнена первая интраоперационная коронарная баллонная
ангиопластика под местной анестезией (ТЛБАП), таким образом началась эра
коронарной ангиопластики.
Андреас Грюнтциг создал однопросветный, а затем двухпросветный баллонные
катетеры и разработал показания к применению баллонной ангиопластики
коронарных артерий.
15.
16.
В СССР первую селективнуюкоронарографию выполнили в 1971 г. Ю.
С. Петросян и Л. С. Зингерман в Институте
сердечно-сосудистой хирургии им. А. Н.
Бакулева АМН СССР, в дальнейшем
опубликовав в 1974 г. первую в стране
монографию по коронарографии.
Первую процедуру коронарной
баллонной ангиопластики в 1982 г.
выполнили И. X. Рабкин и А. М. Абугов
во Всесоюзном научном центре хирургии.
И. X. Рабкин и соавт. в дальнейшем
выпустили монографию по
рентгеноэндоваскулярной хирургии, где
подробно описали технику выполнения
процедуры.
17.
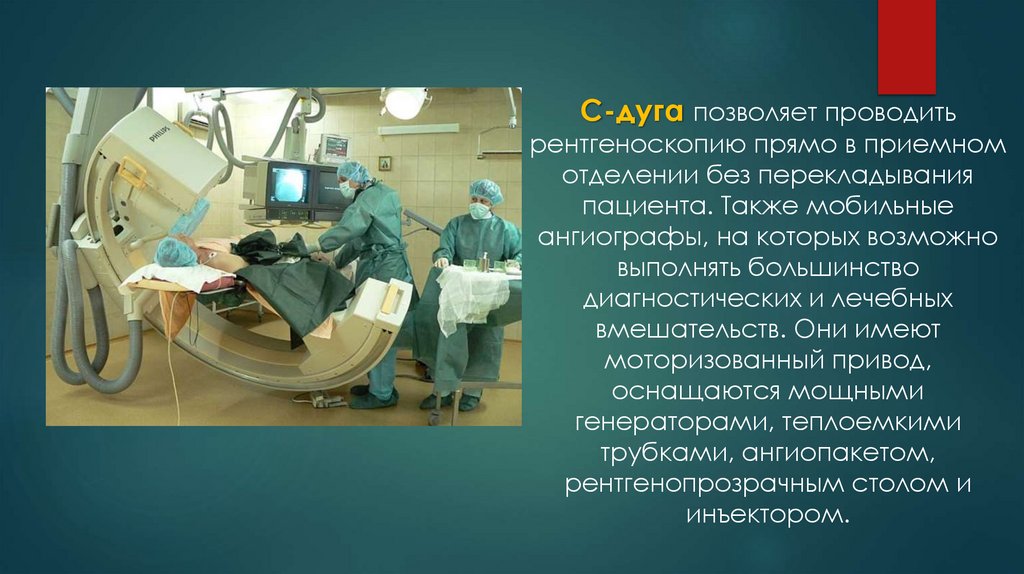
С-дуга позволяет проводитьрентгеноскопию прямо в приемном
отделении без перекладывания
пациента. Также мобильные
ангиографы, на которых возможно
выполнять большинство
диагностических и лечебных
вмешательств. Они имеют
моторизованный привод,
оснащаются мощными
генераторами, теплоемкими
трубками, ангиопакетом,
рентгенопрозрачным столом и
инъектором.
18.
Типы вмешательствБаллонная ангиопластика
• Стентирование
• Эмболизация
• Химиоэмболизация
• Установка внутрисосудистых фильтров
• Удаление тромбов
• Адресное введение лекарственных средств
19.
химиоэмболизация опухолей печени(с использованием микросфер, которые
выделяют химиопрепарат);
• радиочастотная абляция злокачественных
новообразований печени;
• стентирование вены при обструкции
опухолевого генеза;
• наложение нефростом
20.
• имплантация в вену специальных фильтров сцелью профилактики тромбоэмболии;
установка венозных и артериальных
инфузионных порт-систем
(для проведения последующей химиотерапии);
дренажирование и стенирование желчных
протоков
(проводят при опухолях желчных протоков).
21.
Суть методаВмешательства выполняют врачи-рентгенохирурги или
эндоваскулярные хирурги.
В большинстве случаев для выполнения эндоваскулярного
вмешательства не требуется наркоз, выполняется только
местное обезболивание в точке пункции (прокола
сосуда).Однако, в определенных случаях наркоз проводится. Это
позволяет выполнять вмешательства даже пациентам с тяжелыми
сопутствующими заболеваниями, которым противопоказано
традиционное хирургическое лечение. Так как после
вмешательства не остается послеоперационной раны и швов, в
большинстве случаев пациенты могут быть выписаны из
стационара через 1-3 дня после операции.
Операционный риск, болевой синдром, время восстановления, по
сравнению с традиционной хирургией, существенно снижены.
22.
Область примененияМетоды эндоваскулярной хирургии применяются в:
• Кардиологии: (ишемическая болезнь сердца, острый инфаркт
миокарда)
• Нейрохирургии: (Аневризма, Мальформация, Фистула,
Атеросклероз, Тромбоз)
• Сосудистой хирургии: (облитерирующий атеросклероз, окклюзии
периферических артерий, тромбоэмболия лёгочной артерии,
абдоминальный ишемический синдром)
• Гепатологии: (цирроз печени, первичный и метастический рак
печени).
• Также эндоваскулярная методика используется при лечении
болезней крови, вазоренальной гипертензии, фибромиомы матки,
аденоме простаты и многих других болезнях, до недавнего
времени предполагавших серьёзное хирургическое
вмешательство.
23.
Хорошо зарекомендовали себя такие методыэндоваскулярной хирургии как баллонная
ангиопластика и имплантация эндопротеза
(стента) — стентирование, эмболизация и
установка других (кроме стентов)
внутрисосудистых устройств.
Метод баллонной ангиопластики и
стентирования позволяет восстанавливать
проходимость суженых или закупоренных
сосудов, что является основной причиной таких
заболеваний как ишемическая болезнь сердца,
атеросклероз артерий нижних конечностей и
др.
24.
Цертофикс Трио Пед: набор стрехканальным катетером для постановки
по методу Сельдингера с возможностью
ЭКГ-контроля положения катетера
25.
26.
27.
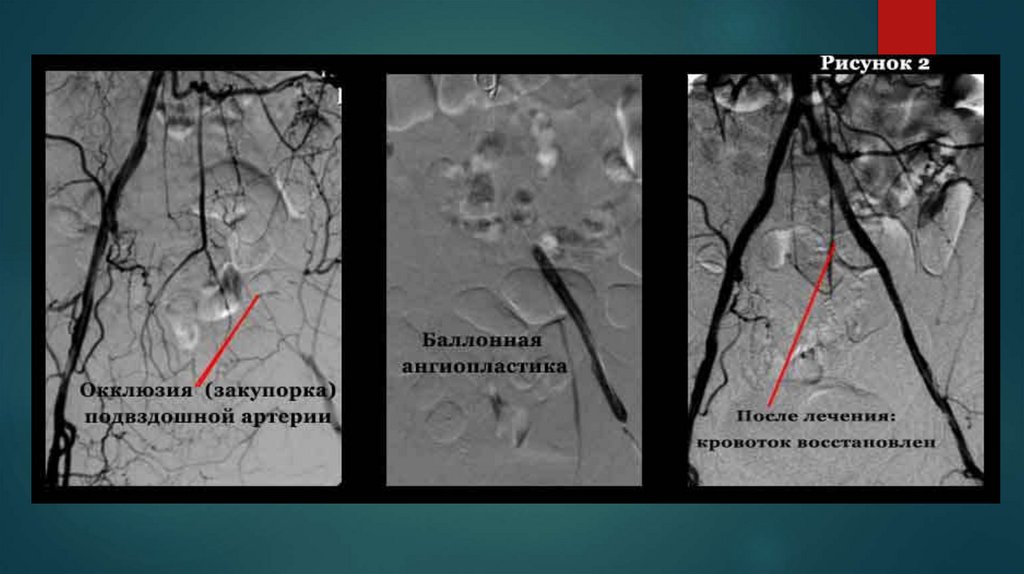
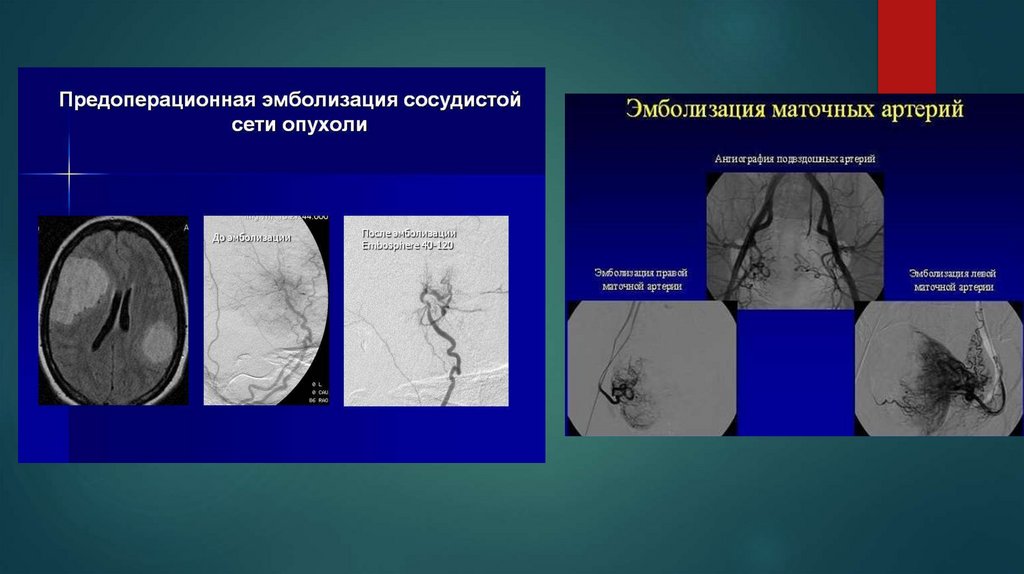
Эмболизация, напротив, применяется дляокклюзирования (закупорки) сосудов. Этот метод
широко используется в лечении больных с
кровотечениями различной локализации, в лечении
варикоцеле, тазового варикоза, миом матки,
синдрома портальной гипертензии, в комплексном
лечении опухолей. Установка внутрисосудистых
устройств (кава-фильтров, стент-фильтров и пр.)
является эффективным методом лечения при ряде
заболеваний или профилактики осложнений.
28.
29.
Лечение метастаз и опухолей печениПо данным ВОЗ, первичный рак печени входит в десять наиболее часто
встречающихся злокачественных опухолей. По результатам вскрытий, метастазы
рака в печень обнаруживаются у 20—70% онкологических больных. Синхронные
или метахронные метастазы в печень выявляются у 50% больных, перенесших
резекцию рака толстой кишки. У половины этих пациентов отсутствует
поражение опухолью других органов и именно метастазы в печень являются
причиной смерти.
Единственным методом, позволяющим добиться длительной выживаемости при
злокачественном новообразовании печени, является хирургическая резекция
печени (иногда трансплантация). Диагностика определяет что полное удаление
образования возможно у 6—14% пациентов, а остальные проходят лишь
паллиативное лечение. Рецидив рака в течение трех-пяти лет после резекции
печени имеется у 75—90% пациентов, из них вторичную резекцию выполняют не
более чем в 10% случаев.
Из выше сказанного очевидно, что паллиативное лечение требуется в 75%
случаях со злокачественными опухолями печени. К сожалению, традиционные
методы лечения, как химиолучевая терапия, при злокачественных опухолях
печени недостаточно эффективны. Поиск более эффективных методов влияния
на метастатический процесс явились стимулом к внедрению внутрисосудистых
вмешательств с помощью интервенционной радиологии.
30.
Рентгеноэндоваскулярные вмешательства при опухолях печени• артериальные методы: химиоинфузия в печеночную артерию,
эмболизация, химиоэмболизация, радиоэмболизация;
• внутрипорталъные методы: масляная химиоэмболизация,
механическая эмболизация воротной вены.
Работа внутриартериальной терапии имеет следующий механизм питание опухолей печени на 90—93% происходит за счет
артериальной крови, в то время как не пораженная паренхима
печени имеет двойное кровоснабжение: 75% из воротной вены и
только 25% из печеночной артерии.
За счет этого как внутриартериальная химиотерапия, так и
артериальные методы воздействия вызывают разрушительное
влияние на опухоль при малых повреждениях здоровых тканей
печени.
Чем ближе к опухоли удается установить катетер, тем сильнее
противоопухолевое воздействие и меньше патологического влияния
получает здоровая ткань паренхимы печени.
31.
Масляная химиоэмболизация (МХЭПА)В печеночную артерию вводят смесь в виде суспензии или эмульсии
химиопрепарата с масляным контрастным веществом (Lipiodol,
Франция), с последующим выполнением окклюзии печеночной
артерии или без нее, а также ХЭПА с микросферами,
элиминирующими химиопрепараты: DEB (drug-eluting beads).
Ферромагнитная эмболизация с гипертермией. В артерии,
питающие опухоль печени, селективно вводят суспензию твердого
ферромагнетика (гексаферрит бария) в липиодоле,
одновременно создавая локальное магнитное поле вокруг
новообразования.
Частицы ферромагнетика намагничиваются и селективно
задерживаются в опухоли. Через 1—3 дня производят воздействие
токами СВЧ для нагревания опухолевой ткани до 43—43,5° С в
течение 5—45 мин. Метод предполагает получение синергичного
эффекта эмболизации и локальной гипертермии; сеансы
последней периодически повторяют.
32.
Внутрипорталъная терапия новообразований печени носит, как правило,вспомогательный характер и проводится для усиления эффекта
артериального воздействия или используется как метод адъювантной
терапии.
МХЭВВ. Предложена и используется как дополнение к ХЭПА или для
адъювантной химиотерапии. Как правило, осуществляется путем
чрескожной чреспеченочной пункции воротной вены под ультразвуковым
контролем (УЗК), но может быть использована и интраоперационная
катетеризация пупочной вены для лечения неоперабельных опухолей. Она
заключается в многократном введении суспензии цитостатика в липиодоле
без последующего механического окклюзирования ветвей v. portae.
Применяется в случаях, когда в дальнейшем планируется большая по
объему резекция печени. Пункцию осуществляют чрескожно под УЗК.
Выполняют механическое окклюзирование одной из долевых ветвей (обычно
правой) воротной вены, что вызывает викарную гипертрофию
контралатеральной доли печени. За счет этого снижается риск
послеоперационной печеночной недостаточности. Резекцию печени
выполняют через 20—40 суток после ЭВВ.


























 medicine
medicine








