Similar presentations:
Основні технологічні процеси очистки води
1.
Національний університет імені Тараса ШевченкаОРГАНІЗАЦІЯ ГОСПОДАРЧО-ПИТНОГО
ВОДОПОСТАЧАННЯ
Укладач:
доцент І.М. Байсарович
2.
Лекція: Основні технологічні процеси очистки води.План лекції: Основні технологічні процеси очистки води
Основні технологічні процеси очистки води.
Пом’якшення, знесолення та опріснення.
Стабілізація та дегазація води.
Вилучення заліза, марганцю, силіцію, фтору.
2
3.
Лекція: Основні технологічні процеси очистки води.Основні технологічні процеси очистки води
1. Пом’якшення, знесолення та опріснення.
Пом’якшенням води називається процес, що призводить до зниження
жорсткості води, тобто зменшення концентрації кальцієвих і магнієвих солей.
Існує кілька методів зниження жорсткості:
термічний метод;
реагентні методи;
метод іонного обміну.
3
4.
Лекція: Основні технологічні процеси очистки води.Термічний метод, який ґрунтується на нагріванні води,
дистиляції її чи виморожуванні.
Термічне пом’якшення води методом нагрівання базується на
зсуві вуглекислотної рівноваги в бік утворення карбонату кальцію.
Зміщення рівноваги відбувається в результаті зниження
розчинності вуглекислого газу за підвищення температури.
Кип’ятінням можна повністю усунути вуглекислий газ і відповідно
набагато знизити карбонатно-кальцієву жорсткість.
4
5.
Лекція: Основні технологічні процеси очистки води.2+
2+
Реагентні методи, за яких іони Ca
реагентами практично в нерозчинні сполуки.
і Mg зв’язуються різними
Як реагенти використовуються вапно, кальцинована сода, їдкий натр,
тринатрій фосфат, гідроксид барію тощо. Вапно є одним із дешевих реагентів.
5
6.
Лекція: Основні технологічні процеси очистки води.Метод іонного обміну, який ґрунтується
на фільтруванні води через
+
спеціальні матеріали, які замінюють іони Na і H зі свого складу на іони Ca 2+ і
Mg 2+ з води.
+
Іонний метод ґрунтується на використанні деяких твердих, практично
не розчинних у воді мінералів іонітів, які мають властивість обмінювати іони
зі свого складу на іони з розчину. При цьому речовини, які обмінюють
катіони називаються катіонітами, а аніони – аніонітами. В основі
іонообмінного процесу лежать хімічні реакції, які проходять на зовнішніх і
внутрішніх поверхнях іонітів. Обмін іонів відбувається в еквівалентних
кількостях. Рівновага встановлюється дуже швидко. Ступінь обміну
протягом перших декількох секунд досягає 90-98%.
Катіоніти бувають слабко кислотні і сильно кислотні. У слабко
кислотних катіонітів обмінна властивість за pH менше 7 дуже знижується,
тому їх раціонально використовувати за умови, коли pH середовища не
нижче 7. В нашій країні найбільш поширеним є катіоніт сульфовугілля, який
готується шляхом обробки кам’яного вугілля сірчаною кислотою.
6
7.
Лекція: Основні технологічні процеси очистки води.Знесолення та опріснення води.
Процес усунення солей з води залежно від ступеня їх вилучення
називається знесоленням чи опрісненням. При знесоленні концентрація
розчинених солей знижується до межі, близької до вмісту їх у
дистильованій воді, а при опрісненні – до концентрації, яка допустима
при використанні води для господарсько-питних потреб (мінералізація до
1000 мг/дм3, сульфати менше 500 мг/дм3, хлориди менше 350 мг/дм3).
Опріснення може бути здійсненим як із зміною агрегатного стану
води (дистиляція, виморожування), так і без його зміни (електродіаліз,
зворотний осмос чи гіперфільтрація, іонний обмін, екстракція води у
вигляді кристалізаційної води кристалогідратів та ін.).
7
8.
Лекція: Основні технологічні процеси очистки води.Стабілізація та дегазація води.
Стабільність є одним із основних показників якості води, вона
характеризує її властивість не виділяти з розчину і не розчиняти карбонат
кальцію. Порушення стабільності води може зумовлюватися присутністю
агресивної вуглекислоти чи кисню, низьким pH, перенасиченням води
карбонатом кальцію чи гідроксидом магнію, підвищеною концентрацією
сульфатів чи хлоридів.
Якість води, яка пройшла очисні споруди, не можна вважати
задовільною, якщо при проходженні далі по системі вона забарвлюється чи
дає осад.
Для усунення вуглекислотної агресивності застосовуються реагентний і
фільтраційний методи. Як реагенти і
матеріали-наповнювачі фільтрів
використовуються відповідно їдкий натр, сода, вапно, крейда чи мармур,
доломіт. Стабілізація води зводиться до зв’язування вуглекислоти.
Для боротьби з нестабільністю води, яка призводить до відкладання
солей на поверхні трубопроводів, застосовують її підкислення, карбонізацію
димовими газами (рекарбонізацію) тощо.
8
9.
Лекція: Основні технологічні процеси очистки води.Дегазація води. Найбільш часто доводиться усувати з води корозійно
активну вуглекислоту, кисень, H2S, які зумовлюють чи підсилюють корозію
металів, а також бетону. Наявність цих газів у воді в багатьох випадках
негативно впливає на якість продукції та стан обладнання. До цього слід додати
й неприємний запах, що надає воді H2S. Існують фізичні та хімічні методи
дегазації.
Фізичні методи дегазації ґрунтуються на властивості розчинених у воді
газів виділятися при збільшенні поверхні контакту води з повітрям чи при
створенні умов, що забезпечують мінімальну розчинність газів у воді.
9
10.
Лекція: Основні технологічні процеси очистки води.Аерування використовується для газів, парціальний тиск яких у повітрі
близький до нуля (СО2, H2S). Технологічні способи аерування – дощування і
фонтанування.
Кисень через значний парціальний тиск у повітрі шляхом аерації усунути
не можна.
Хімічні методи дегазації ґрунтуються на хімічному зв’язуванні
розчинених газів певною речовиною. Для усунення О2 використовують
фільтрування води через речовини, які окиснюються (наприклад, стальна
стружка), а також обробку води сульфатом натрію чи сірчанистим газом.
10
11.
Лекція: Основні технологічні процеси очистки води.15
11
12.
Лекція: Основні технологічні процеси очистки води.Для усунення з води H2S хімічними методами його окиснюють киснем
повітря чи хлором. Крім того, може бути використано взаємодію
сірководню з гідроксидом заліза
12
13.
Лекція: Основні технологічні процеси очистки води.Вилучення заліза, марганцю, силіцію, фтору.
Вибір методу вилучення заліза залежить від форми вмісту заліза у воді.
Вилучення заліза здійснюється такими методами: аеруванням, вапнуванням,
хлоруванням, коагулюванням, катіонуванням, а також за допомогою
каталізаторів.
При вилученні заліза з підземних вод, які звичайно містять закисне
залізо (Fe2+) в іонній формі, використовують аерування; при вилученні заліза
з поверхневих вод, де воно міститься у вигляді колоїдів і завислих речовин –
коагулюванням. Вапнування і катіонування застосовують у тих випадках,
коли треба вилучити залізо і зробити воду м’якою. Дуже часто
використовують комбіновані методи вилучення заліза.
13
14.
Лекція: Основні технологічні процеси очистки води.Суть процесу вилучення заліза з води аеруванням полягає в тому,
що двовалентне Fe2+ переходить у Fe3+ і утворюється гідроксид заліза,
який випадає в осад. Аеруванням з води вилучається бікарбонат заліза,
який є нестійкою сполукою, що легко гідролізується у воді.
Вапнування і хлорування часто проводяться додатково до аерації або
ж замість неї. Для прикладу зазначимо, що східна частина міста Берлін
(ФРН) постачається алювіальними водами р. Шпреє. Якість води є доброю,
але в ній міститься 7 мг/дм3 заліза, яке усувається шляхом аерування
води. Залізо окиснюється і випадає в осад.
Часто необхідний ефект окиснення досягається без додавання вапна
лише хлоруванням дозами 13 мг/дм3 Cl, після чого вода фільтрується через
піщані фільтри.
14
15.
Лекція: Основні технологічні процеси очистки води.Залізо, яке знаходиться у воді у вигляді колоїдів, тонко дисперсних і
комплексних органічних сполук, вилучається обробкою води коагулянтами
(сульфатом амонію тощо).
Метод катіонного обміну дозволяє повністю звільнити воду від солей
заліза. Найбільш часто використовується Н- чи Na-катіонітова схема з
використанням будь-яких катіонітових матеріалів.
Вилучення заліза з води за допомогою каталізаторів надає можливість
швидкого окиснення закисного заліза навіть за низьких значень pH.
Встановлено, що навіть у присутності каталізаторів за pH 5,0-5,5 окиснення
заліза відбувається майже миттєво. Як каталізатор при окисненні
використовують або ж подрібнений піролюзит (MnO2 nH2O), або ж “чорний
пісок”. Останній – це кварцовий пісок, вкритий плівкою оксидів марганцю
(має чорний колір).
15
16.
Лекція: Основні технологічні процеси очистки води.Вилучення марганцю з води відбувається вапнуванням чи аеруванням з
подальшим фільтруванням через контактні фільтри, катіонуванням і за
допомогою біологічних методів. Воду після вапнування чи аерування
фільтрують через контактні фільтри, які заповнено піролюзитом або ж
“чорним піском”. Під дією кисню повітря чотиривалентний марганець
піролюзиту окиснюється до семивалентного.
Марганець вилучається з води до 0,01-0,1 мг/дм3 при фільтруванні через
Н-катіоніти. Але у зв’язку з тим, що під час фільтрування усуваються також
інші катіони, які знаходяться у воді, цей метод з економічного погляду не
виправдовує себе.
Біологічний спосіб вилучення марганцю ґрунтується на використанні
бактерій, які поглинають Mn у процесі життєдіяльності. Бактерії, що відмерли,
утворюють на тілі фільтра пористу масу, збагачену MnO2.
16
17.
Лекція: Основні технологічні процеси очистки води.Для вилучення силіцію з води в даний час використовують
магнезіальне вилучення силіцію осадженням чи фільтруванням, обмін
катіонів, а також обробку вапном, солями заліза й алюмінію, соляною
чи сірчаною кислотою.
Повністю вилучити кремнієву кислоту з води можна шляхом
пропускання її через іонітові фільтри. Як іонообмінний матеріал
використовуються сильно лужні аніоніти.
17
18.
Лекція: Основні технологічні процеси очистки води.Вилучення фтору і фторування води.
3
Концентрація фтору в питній воді, яка перевищує 1,5 мг/дм, викликає у
людей специфічне ураження зубів. Воно отримало назву “плямиста емаль”. А у
людей, які користуються водою з концентрацією фтору, яка перевищує 3-5
мг/дм3, окрім “плямистої емалі” зубів виявляються зміни в кістках скелета, у
дітей частіше спостерігається недокрів’я та рахіт, є дані щодо несприятливого
впливу підвищення концентрацій F на функціональний стан серцево-судинної
й нервової системи тощо.
3
При використанні для пиття води з низьким вмістом F (<0,5 мг/дм ) у
сукупності з іншими факторами (нераціональне харчування, несприятливі
умови праці та побуту) спостерігається поширення захворювання на карієс
зубів.
Вважають, що оптимальна концентрація F у воді має становити 0,7-1,2
3
3
мг/дм, гранично-допустима норма – 1,5 мг/дм.
18
19.
Лекція: Основні технологічні процеси очистки води.Отже, вилучення надлишків F з природних вод, як і фторування вод з
малим його вмістом, є заходами однаково важливими. Методи, які
використовують для вилучення фтору з води поділяються на дві групи:
реагентні та фільтраційні. В їх основі лежать процеси сорбції.
Реагентні методи ґрунтуються на сорбції фторид-іона свіжими осадами
гідроксидів магнію чи алюмінію.
При введенні солей магнію (сульфатів чи хлоридів) у воду утворюється
малорозчинний
гідроксид магнію, який добре сорбує фтор. Оскільки
утворення гідроксиду відбувається ефективно за рН води близько 10,2-10,3 у
воду частіше за все додають вапно. Цим методом звичайно користуються при
вилученні фтору з поверхневих вод, при освітленні та пом’якшенні води.
19
20.
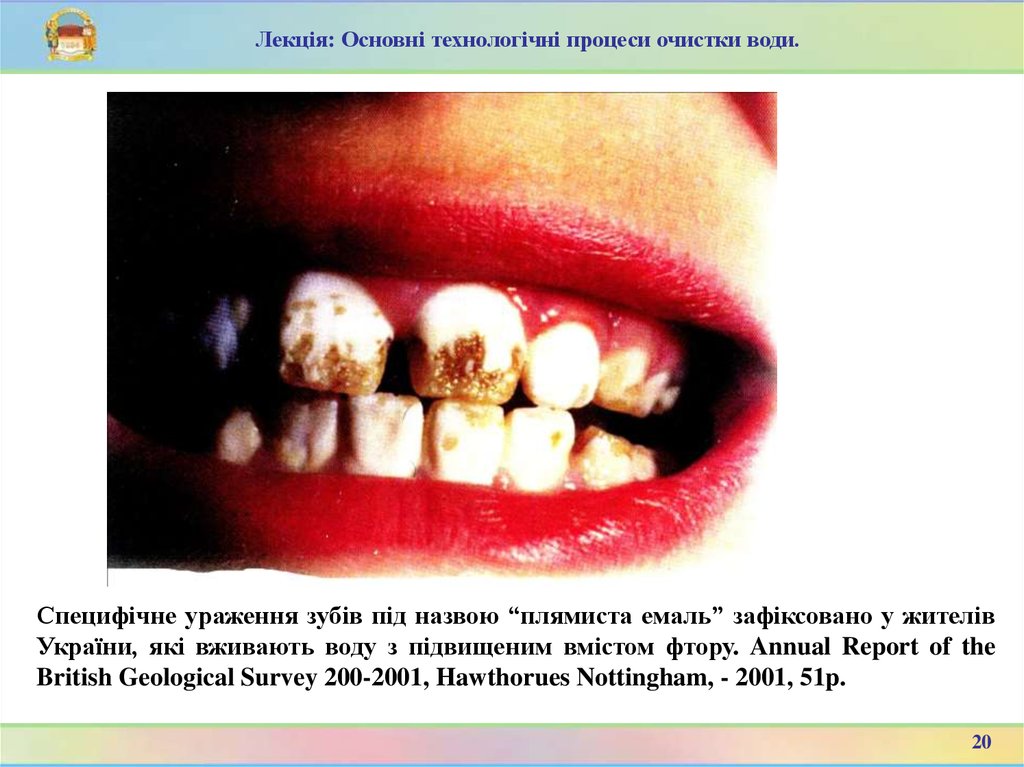
Лекція: Основні технологічні процеси очистки води.Специфічне ураження зубів під назвою “плямиста емаль” зафіксовано у жителів
України, які вживають воду з підвищеним вмістом фтору. Annual Report of the
British Geological Survey 200-2001, Hawthorues Nottingham, - 2001, 51p.
20
21.
Лекція: Основні технологічні процеси очистки води.Для підземних вод, яким не потрібно освітлення, важливими є
фільтраційні методи. Вони полягають у фільтруванні води через гранульовані
матеріали, які здатні сорбувати фтор.
В наш час в якості сорбентів практичного значення набули активований
оксид алюмінію та гідроксилопатит. Підвищення вмісту іонів фтору у воді
(фторування) досягається введенням в неї речовин, які містять фтор. Зараз
найбільш поширеними є реагенти вітчизняного виробництва: фторид натрію,
кремнієфтористоводнева і фтористоводнева кислоти. Усі вони мають однакову
протикорозійну реакцію. Реагенти, які містять фтор, додаються у воду або у
вигляді сухого порошку, або ж у вигляді розчину.
21
22.
Лекція: Основні технологічні процеси очистки води.Перелік посилань
1. Хільчевський В.К. Водопостачання і водовідведення. Гідроекологічні
аспекти.: ВЦ Київський університет, 1999. - 319 с.
2. Хільчевський В.К., Горєв Л.М., Пелешенко В.І. Методи очистки вод. - К.,
1993.
3. Питьева К.Е. Гидрогеохимические аспекты охраны геологической
среды. М.: Наука, 1984. - 221 с.
4. Водні ресурси України: екологічний та соціальний виміри: Матеріали
круглого столу, проведеного Центром Соціального Прогнозування. К.: ВіРА "Інсайт", 2003. - 126 с.
5. Яцик А.В. Водогосподарська екологія: у 4 т., 7 кн. - К.: Генеза, 2004. Т.4, кн. 6-7. -680с.
6. Annual Report of the British Geological Survey 200-2001, Hawthorues
Nottingham, - 2001, 51p.
22





















 industry
industry