Similar presentations:
Условия протекания ферментативных реакций
1.
Условия протеканияферментативных
реакций
2.
Что такоеферменты?
Ферменты или энзимы[1] (от лат.
fermentum, греч.ζύμη, ἔνζυμον —
закваска) — обычно белковые молекулы
или молекулы РНК (рибозимы) или их
комплексы, ускоряющие
(катализирующие) химические реакции в
живых системах. Реагенты в реакции,
катализируемой ферментами,
называются субстратами, а
получающиеся вещества — продуктами.
3.
Условияпротекания
ферментативных
реакций
Отличительной особенностью
реакций, протекающих в живых
организмах, является также то, что их
скорости и механизмы во многом
зависят от условий, влияющих на
фермент. Рассмотрим воздействие на
ферментативные реакции
температуры, pH и эффекторов.
4.
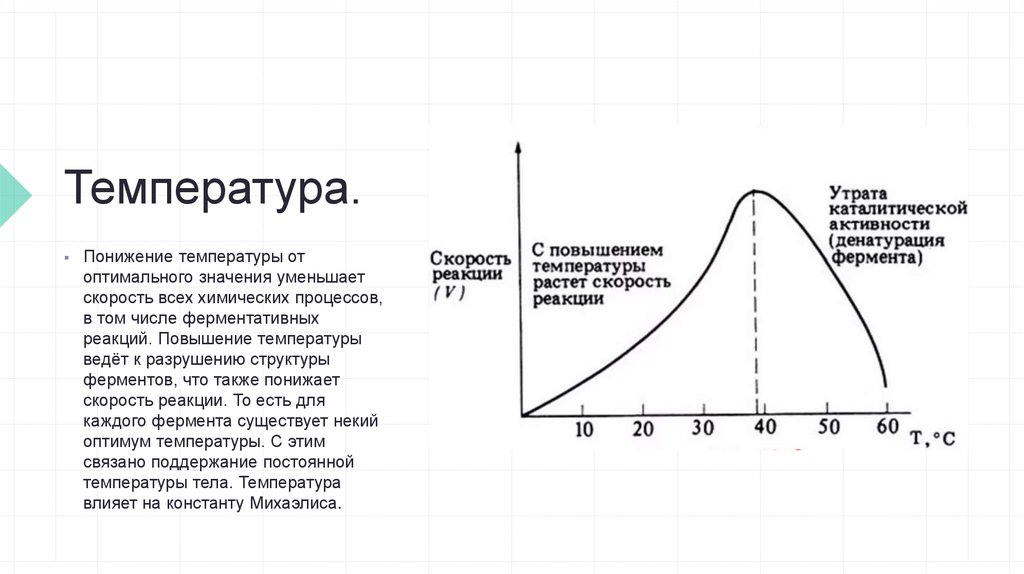
Температура.Понижение температуры от
оптимального значения уменьшает
скорость всех химических процессов,
в том числе ферментативных
реакций. Повышение температуры
ведёт к разрушению структуры
ферментов, что также понижает
скорость реакции. То есть для
каждого фермента существует некий
оптимум температуры. С этим
связано поддержание постоянной
температуры тела. Температура
влияет на константу Михаэлиса.
5.
pH.Структура фермента и ферментсубстратного комплекса создаётся за счёт
электростатического взаимодействия
различных атомов. Избыточное количество
протонов в среде влечёт нарушение этих
структур (из-за протонирования
аминокислот), что уменьшает скорость
ферментативной реакции при отхождении
от оптимального значения рН. С этим
связано поддержание постоянного pH в
тканях организма. рН влияет на константу
равновесия.
6.
Эффекторы.Эффекторы – вещества, взаимодействующие
с ферментом и ускоряющие или
замедляющие его деятельность. Активаторы
ускоряют работу фермента, а ингибиторы
замедляют. Ингибиторы делятся на
обратимые и необратимые. Необратимые
портят фермент, уменьшая его концентрацию.
Обратимые ингибиторы обратимо
связываются с ферментом, но различными
механизмами. Конкурентные ингибиторы
занимают активный центр фермента вместо
субстрата, не претерпевая превращений и
мешая образованию фермент-субстратного
комплекса.
7.
При этом они смещают равновесие в сторонуфермента и субстрата (влево), увеличивая константу
Михаэлиса. Добавляя больше субстрата, эффект
ингибирования может исчезнуть, то есть
максимальная скорость реакции не изменяется.
Бесконкурентный ингибитор связывается с ферментсубстратным комплексом, стабилизируя это
состояние, что также меняет константу равновесия –
уменьшает, но во столько же раз уменьшает
максимальную скорость реакции. Неконкурентные
ингибиторы связываются с ферментом и ферментсубстратным комплексом, мешая каталитическому
акту, но при этом не меняя константу равновесия, а
просто понижая максимальную скорость реакции.
8.
Таким образом константуМихаэлиса-Ментен меняют те
ферменты, чьё действие зависит
от концентрации субстрата, и
наоборот. Аллостерические
ингибиторы связываются с
ферментом, мешая тому
связываться с субстратом. В
рамках уравнения МихаэлисаМентен этот случай из-за своей
сложности не рассматривается.




 biology
biology








