Similar presentations:
Общие принципы извлечения металлов из руд. Обогащение руд
1.
Общие принципыизвлечения металлов из руд.
Обогащение руд
2.
Извлечение металлов из руд делится на 2 этапа:I) Обогащение руды – отделение ценной металлосодержащей
массы от пустой бесполезной породы.
II) Выделение металла одним из доступных методов в
зависимости от типа руды и требований по чистоте
металла.
3.
Методы обогащения руды• Обогащение руды — совокупность методов
разделения минералов друг от друга по разнице их
физических и/или химических свойств. Химический
состав компонентов руды при этом не изменяется.
• Сначала идёт подготовка руды к которой
относят дробление и измельчение руды, грохочение .
• Различают следующие методы обогащения
руд: рудоразборка (ручной метод), гравитационное
обогащение (отделение за счёт разницы в плотности),
магнитная сепарация и флотация (отделение за счёт
разной смачиваемости флотирующим веществом).
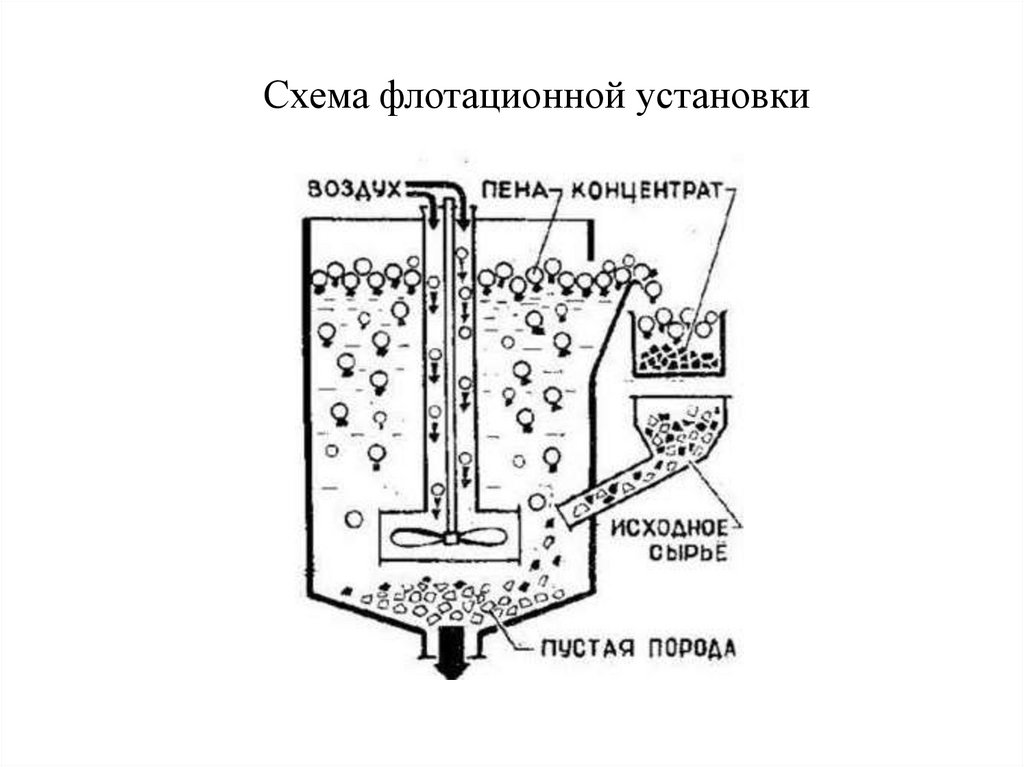
• Флотация является одним из самых широкоиспользуемых
методов обогащения руд.
4.
Схема флотационной установки5.
Теория по восстановлению руд• Различные виды встречающегося в природе минерального
сырья, пригодного для получения металлов в
промышленном масштабе, называются рудами (обыно
оксиды или сульфиды металлов).
• В основе всех методов выделения металлов из руд лежит
восстановление их по уравнению
• Men+ + nе- → Me0,
• где n – валентность металла.
• В качестве восстановителей применяют графит, оксид
углерода (II) СО↑, водород, активные металлы,
электрический ток и др.
• Существуют следующие способы получения металлов из
руд.
• 1)пирометаллургические − карботермический,
металлотермический;
• 2)электрометаллургические;
• 3)гидрометаллургические
6.
Карботермический способвосстановление оксидов металлов углеродом или оксидом углерода
СО при высоких температурах:
Cu2O +C→2Cu +CO ↑
куприт
В доменных печах в качестве восстановителя применяют оксид
углерода (II) СО:
Fe2O3 +3CO ↑ →2Fe +3CO2 ↑
Гематит
Для некоторых металлов карботермические реакции не дают
металла, а вместо этого дают карбид металла . Такое наблюдается
для титана, который вместо этого переводят в хлорид по реакции:
2FeTiO₃ + 7Cl₂ + 6C → 2TiCl₄ + 2FeCl₃ + 6CO . Карбиды также могут
образоватся при высокотемпературной обработке Cr2O3 углеродом.
По этой причине в качестве восстановителя используется
алюминий.
7.
Металлотермический способв качестве восстановителей используют более активные металлы
при высоких температурах (Al, Mg, Ca и др.). Этим методом можно
получать титан, уран, ванадий:
TiCl4 + 2Mg →Ti + 2MgCl2
Металлотермия, как правило, дороже, чем восстановление
углеродом, и применяется в тех случаях, когда использование
углерода невозможно или приводит к загрязнению
карбидами. Например, для реакции:
Cr2O3 + 3CO = 2Cr+3CO2, ΔG ° = 274,6 кДж/моль. То есть реакция
не может протекать даже при довольно высоких температурах, в то
время как алюмотермия легко осуществима.
Металлотермию используют для производства некоторых цветных и
редких металлов. Металлотермическому восстановлению
подвергаются: оксиды, фториды, хлориды металлов и изредка
сложные смеси оксидов и галогенидов, или непосредственно руды.
8.
Виды металлотермииРазличают несколько видов металлотермических процессов:
внепечные, в которых теплота реакций достаточна для
восстановления и расплавления перерабатываемых материалов,
электропечные, в которых часть теплоты обеспечивается
электронагревом,
вакуумные, в которых основные реакции проходят в вакууме из-за
высокой летучести некоторых компонентов.
Частными случаями металлотермии
являются алюмотермия и магнийтермия. Как восстановители
применяют также кремний , барий, натрий, литий, лантан и др.
Выбор металла-восстановителя определяется экономической
целесообразностью и термодинамическими показателями. Для
определения возможности металлотермической реакции и расчёта
температуры равновесия между металлом, кислородом и
соответствующим оксидом используются диаграммы Эллингема
(график зависимости изменения свободной энергии
Гиббса процесса от температуры для различных реакций).
9.
Восстановление водородомпроводится, как правило, тогда, когда необходимо получить
сравнительно чистый металл. Водород используется, например, для
получения чистого железа, вольфрама из WO3, рения из
NH4ReO4, осмия из (NH4)2OsCl6 и др.
К пирометаллургии относят обычно и хлорную металлургию.
Сущность метода заключается в хлорировании сырья в присутствии
восстановителя или без него и дальнейшей переработке полученных
хлоридов металлов, например:
TiO2 + C + 2Cl2↑ = TiCl4 + CO2↑
TiCl4 + 2Mg = Ti + 2MgCl2
Преимуществами метода хлорирования являются: высокая скорость
процесса, полнота использования сырья, возможность разделения
большого числа компонентов за счет различной летучести и
термической устойчивости хлоридов.
10.
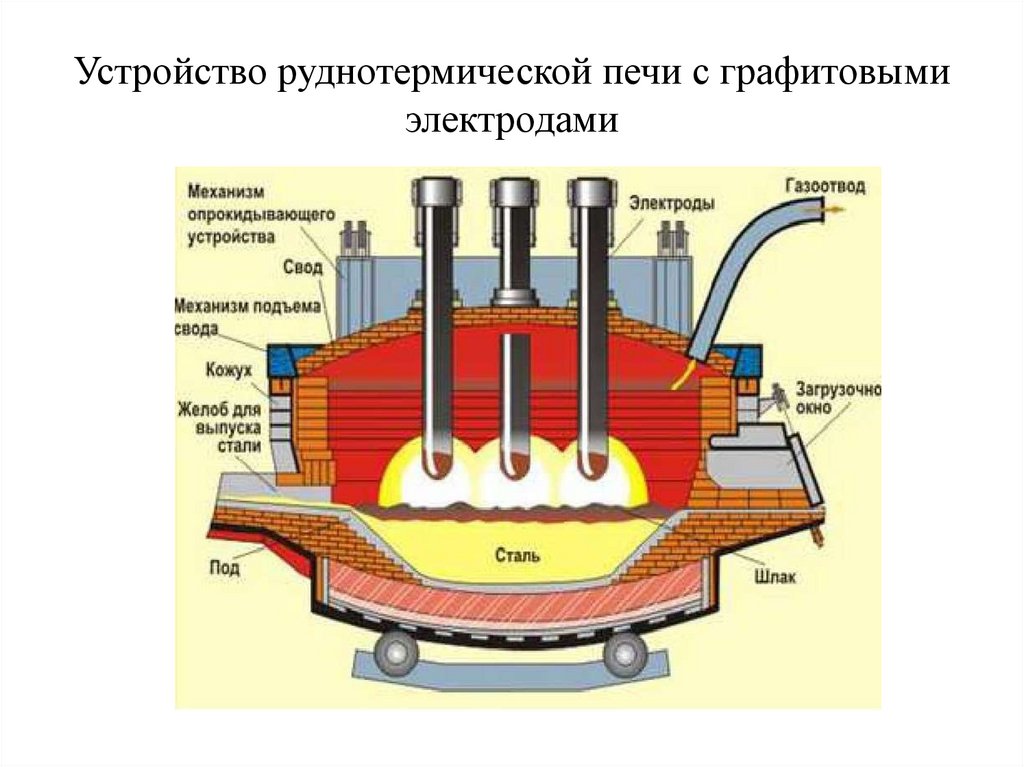
ЭлектрометаллургияТехнология, основанная на применении электрической энергии для
восстановления металлов.
Электрометаллургия включает процессы получения металлов
методами электротермии и электролиза.
В первом случае электрический ток служит источником создания
высоких температур (например, выплавка стали в электропечах); во
втором – используется для непосредственного выделения металлов
из соединений.
Такие активные металлы, как K, Na, Са, Mg, Al и др., получают
электролизом расплавов их соединений. Например, при электролизе
расплава хлорида натрия получают металлический натрий и
газообразный хлор:
расплав соли NaCl, анод С (графит):
(−) К: Na+ + е- → Na0 − восстановление,
(+) А: 2Cl− − 2е- → Cl2↑ − окисление.
11.
Устройство руднотермической печи с графитовымиэлектродами
12.
Гидрометаллургиятехнология, осуществляющая получение металлов из руд с помощью водных растворов
специальных реагентов (кислот, щелочей, солей), которые переводят металлы из
нерастворимого в руде состояния в водорастворимое. Далее металл из водных растворов
выделяют либо восстановлением его более активным металлом, либо электролизом
Например, рассмотрим получение меди:
CuO(т) + H2SO4(ж) = CuSO4(ж) + H2O(ж)
Из полученного раствора медь можно выделить, например, восстановлением железом:
CuSO4 + Fe = Cu + FeSO4










 chemistry
chemistry geography
geography








