Similar presentations:
Комплексные удобрения: аммофос, нитрофос, нитроаммофос, нитрофоска, нитроаммофоска
1.
Комплексные удобрения:аммофос, нитрофос,
нитроаммофос, нитрофоска,
нитроаммофоска
2.
Комплексные удобрения (сложные и смешанные) имеют ряд преимуществ перед простымиудобрениями. При рассеве таких удобрений затрачивается меньше времени и труда, чем при раздельном внесении в почву простых удобрений. Кроме того, применение комплексных удобрений
позволяет распределить полезные элементы в почве более равномерно.
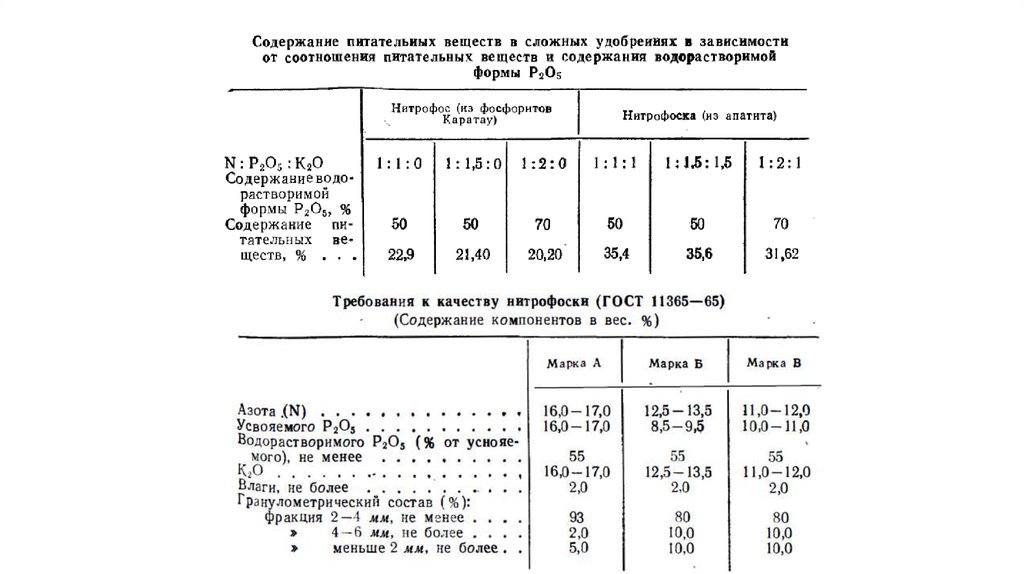
Комплексные удобрения изготавливают с разнообразным соотношением основных питательных
элементов: азота, фосфора и калия, применительно к различным почвам, сельскохозяйственным
культурам и условиям применения удобрений. Возможны следующие соотношения питательных
веществ в удобрении:
Множество промышленных способов производства твердых сложных удобрений, используемых в
настоящее время, можно разделить на две основные группы.
1) Способы, основанные на азотнокислотном разложении природных фосфатов с последующей
переработкой полученных растворов и суспензий в готовый продукт -сложные удобрения типа
нитрофоса и нитрофоски.
2) Способы, базирующиеся на использовании фосфорной кислоты, дающие удобрения типа
нитроаммофоски и диаммонитфоски (или аммофоса и диаммофоса).
3.
Разложение фосфатов азотной кислотой.Содержащиеся в фосфатах примеси - карбонаты кальция и магния, окислы железа, алюминия и редких
земель и фторид кальция также взаимодействуют с азотной кислотой с образованием нитратов:
Окислы железа и алюминия разлагаются также в1ощеляющейся фосфорной кислотой с образованием
не растворимых в воде фосфатов, что приводит к потере Р2O5:
Поэтому фосфаты, содержащие больше 12 % Fe2O 3 (по отношению к Р2O5), считаются пригодными к
химической переработке только после предварительного обогащения. Присутствие в фосфатах Al2O 3
не так вредно, как Fe2O 3, однако также нежелательно, так как это приводит к загрязнению раст вора
фосфорной кислоты (вытяжки). Выделяющийся фтористый водород взаимодействует с кремневой
4.
Для полного разложения природных фосфатов процесс необходимо вести в присутствиистехнометрическои нормы азотнои кислоты, взятой из расчета на СаО в апатите или на СаО и MgO в
фосфоритах. Если количество азотной кислоты меньше стехиометрического и соответствует реакциям:
то первая из этих реакций будет проходить только при концентрации исходной азотной кислоты не
ниже 60 % . Вторая реакция в обычных условиях практически не идет.
5.
Выделение фтора из азотнокислотной вытяжкиПри обработке природных фосфатов азотной кислотой большая часть фтора, содержащегося в фосфатах,
переходит в раствор, называемый азотнокислотной вытяжкой, в виде кремнефтористоводородной
кислоты H2[SiF6] . Присутствие примесей фтористых соединений затрудняет переработку раствора,
понижает концентрацию Р2О5 в конечных продуктах, затрудняет процессы фильтрации и кристаллизации.
Фтор из раствора выделяют с помощью добавляемой к нему натриевой соли. При введении натриевой
соли в количестве 300% от стехиометрического 80-85% фтора, содержащегося в растворе, осаждается в
виде кремнефторида натрия Na2SiF6 .
Выделение редкоземельных элементов
В апатитовом концентрате содержится 0,9-0,95% редкоземельных элементов цериевой группы (церий, лантан и
др.). Выделение редкоземельных элементов из раствора, полученного в результате разложения апатитового
концентрата азотной кислотой, основано на малой растворимости фосфатов редкоземельных э.тементов в
слабокислых растворах (рН = 2-2,5). С повышением температуры при одной и той же степени нейтрализации
раствора растворимость их понижается 42. Следовательно, при более высоких температурах (60-80°) осаждение
фосфатов редкоземельных элементов начинается из более кислых растворов (pH 2-2,5) .
6.
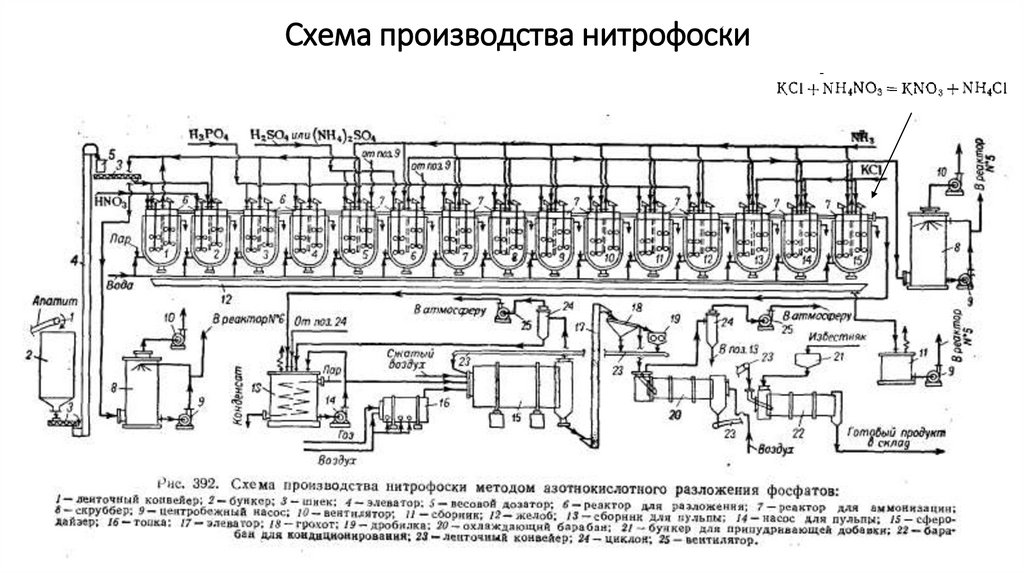
Схема производства нитрофоски7.
Карбонатный способЭтот способ заключается в нейтрализации азотнокислотной вытяжки вначале аммиаком, а затем
аммиаком и двуокисью углерода
Разложение апатитового концентрата производят только азотной
кислотой. В четвертый реактор вводят стабилизирующую добавку с
целью предотвращения ретроградации Р2O5, при нейтрализации
вытяжки до рН = 8,5-9, по реакции:
8.
Сульфатный способОтличие этих способов от карбонатного состоит в том, что с помощью сульфат-иона можно связать
большее количество кальция, так что оставшегося кальция не хватит для образования
дикальнийфосфата, и часть Р2О5 останется в водорастворимой форме. С карбонатом кальция эта форма
несовместима из-за малого значения рН. При введении в реакционную массу серной кислоты процесс
может быть представлен следующими суммарными реакциями:
Фосфорнокислый способ
Вымораживание кальциевой
селитры
9.
10.
Аммофос:Триаммонийфосфат в качестве удобрения не применяют, так как он представляет собой неустойчивую
соль, из которой при температуре около 30 °С выделяется аммиак:
Диаммонийфосфат более устойчив, чем триам:-.1онийфосфат, однако при температуре около 70 °С он
также начинает выделять аммиак:
В диам,1онийфосфате отношение N: P20s более благоприятно для растений, чем в
моноаммонийфосфате.
11.
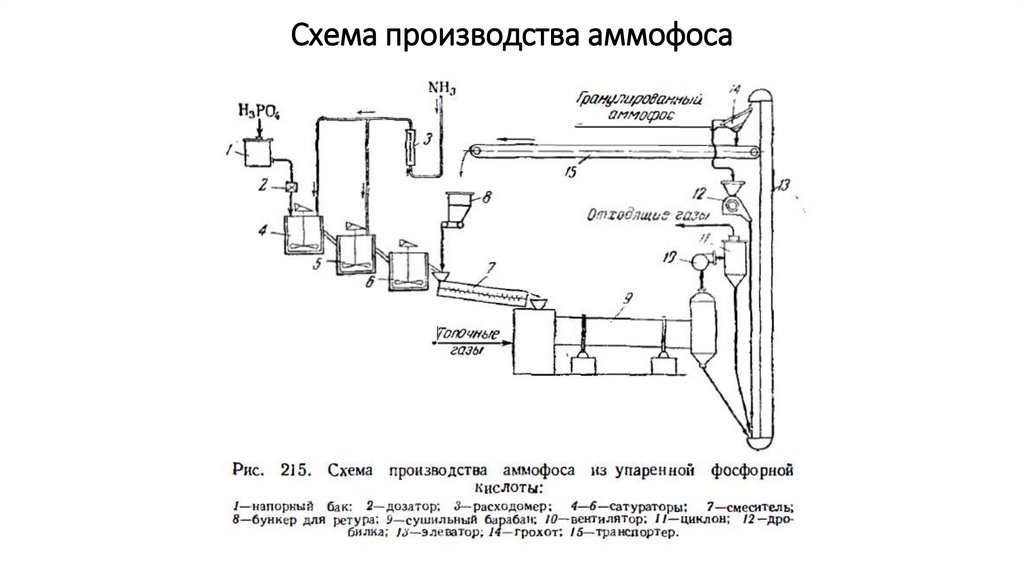
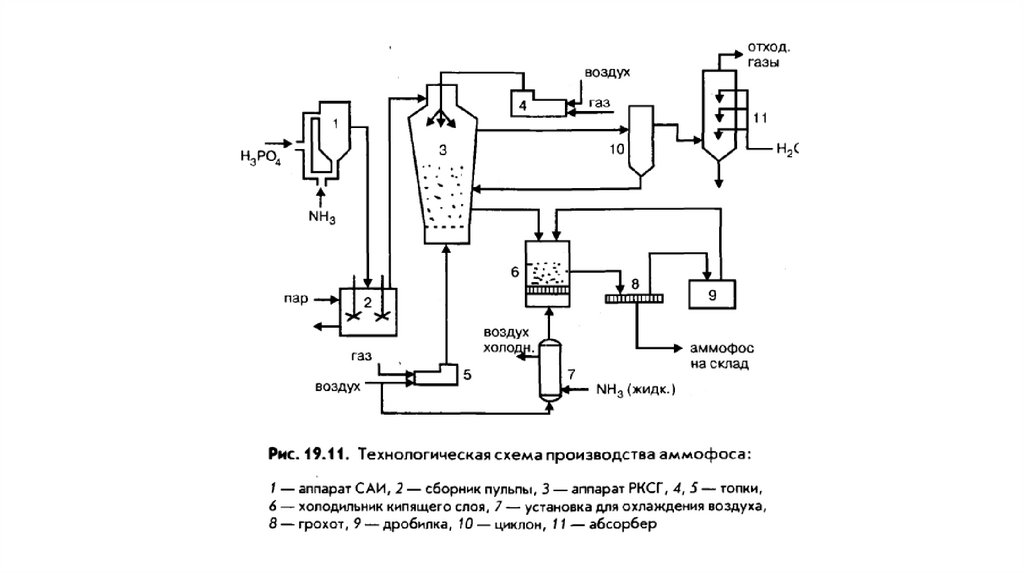
Схема производства аммофоса12.
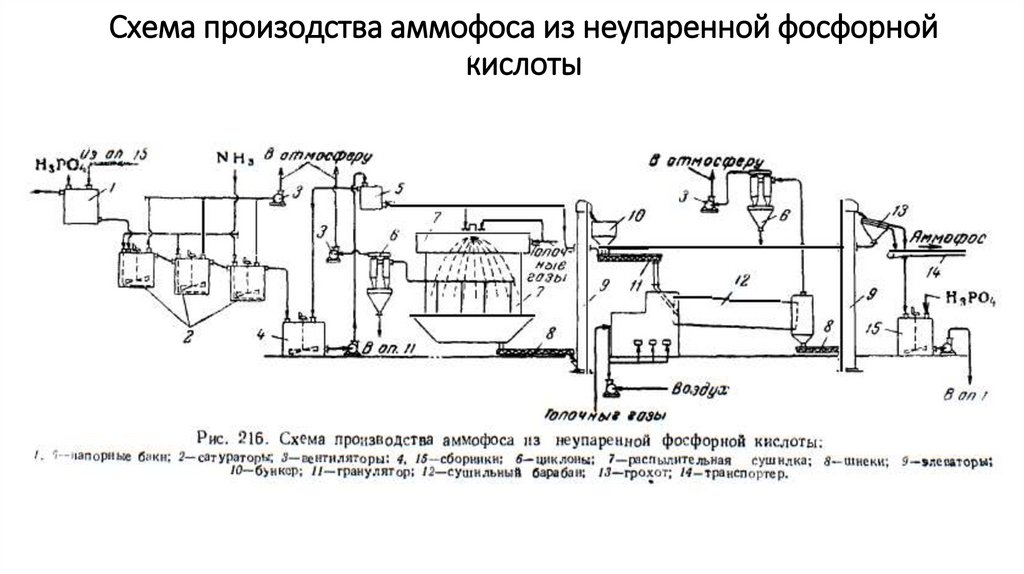
Схема произодства аммофоса из неупаренной фосфорнойкислоты
13.
14.
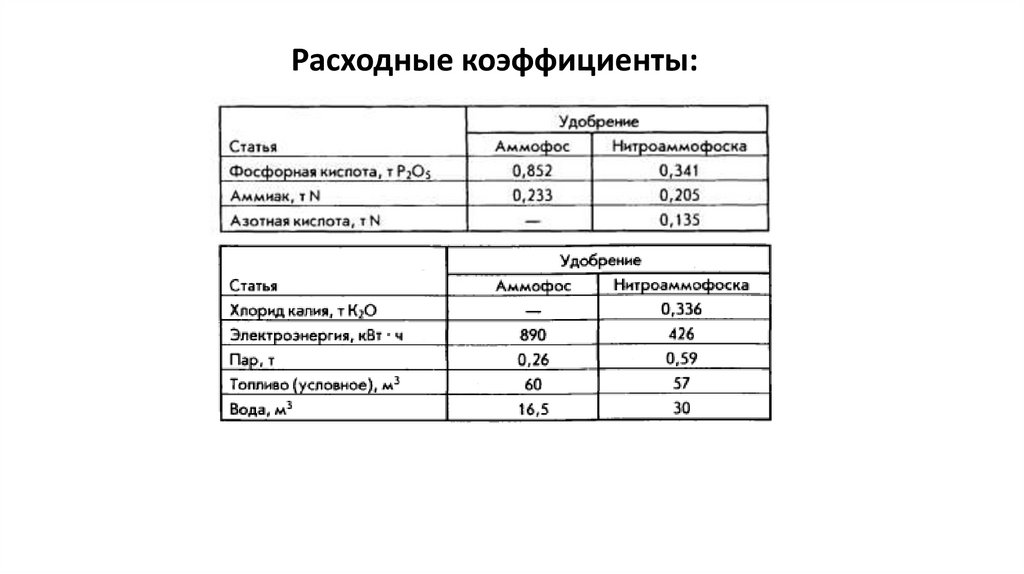
НитроаммофоскаНитроаммофоска представляет тройное (N+P+K) сложное комплексное удобрение и содержит в своей
основе моноаммонийфосфат, нитрат аммония, нитрат калия и хлорид аммония. Присутствие двух
последних солей снижает гигроскопичность продукта и улучшает его физические свойства. В
зависимости от соотношения питательных веществ нитроаммофоску выпускают двух марок: марки А
(1:1:1) и марки В (1:1,5:1,5). Нитроаммофоска может быть получена двумя методами: азотно кислотным
разложением фосфатов и нейтрализацией смеси фосфорной и азотной кислот аммиаком. В обоих случа
ях для введения в состав продукта калийного компонента в реакционную смесь в процессе производства
добавляют хлорид калия. Наиболее распространенный метод производства нитро аммофоскинейтрализация.
1 стадия: Нейтрализация фосфорной и азотной кислот аммиаком с образованием, соответственно,
моноаммонийфосфата и нитрата аммония:
2. Обменная реакция вводимого в систему и растворяющегося в плаве хлорида калия с нитратом
аммония:










 chemistry
chemistry industry
industry








