Similar presentations:
Электроотрицательность химических элементов
1.
Тема:Электроотрицательность
химических элементов
2. Вспомните:
На какие две группы приняторазделять все химические
элементы?
3. Подумайте:
По какому основномупризнаку химические
элементы делятся на
металлы и неметаллы?
4.
С точки зрения теории строенияатомов принадлежность элементов
к металлам и неметаллам
определяется способностью их
атомов отдавать или
присоединять электроны при
химических реакциях.
5. Следовательно,
Наиболее сильнымиметаллическими свойствами
обладают те элементы, атомы
которых легко отдают
электроны.
6.
Неметаллические свойстваособенно выражены у тех
элементов, атомы которых
энергично присоединяют
электроны
7.
Для характеристики способностиатомов присоединять или
отдавать электроны в химии
используют понятие……………….
8.
Электроотрицательность9. Запиши определение в тетрадь
Свойство атомов данного элементаоттягивать на себя электроны от
атомов других элементов в
соединениях называют
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ
10. Зная численное значение электроотрицательности элемента, можно судить о его принадлежности к металлам или неметаллам.
У металлов ЭО меньше двухусловных единиц
У неметаллов ЭО больше двух
у.е.
11. Задание
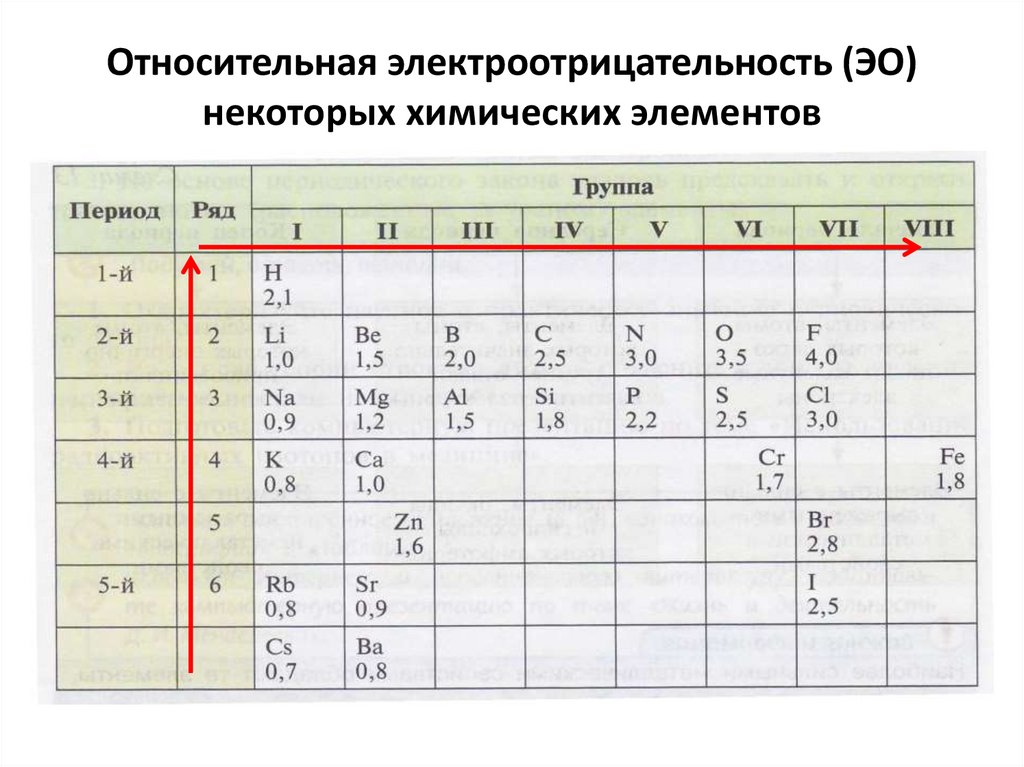
Изучи таблицу и назовиэлемент с наиболее
выраженными
неметаллическими свойствами.
12. Относительная электроотрицательность (ЭО) некоторых химических элементов
13. Важно знать! Изменение электроотрицательности (ЭО) химических элементов:
• В периодах электроотрицательность (ЭО)увеличивается слева направо.
• В главных подгруппах (А-группах)
электроотрицательность (ЭО)
увеличивается снизу вверх.
14. Ряд химических элементов, расположенных в соответствии с уменьшением их электроотрицательности (ЭО)
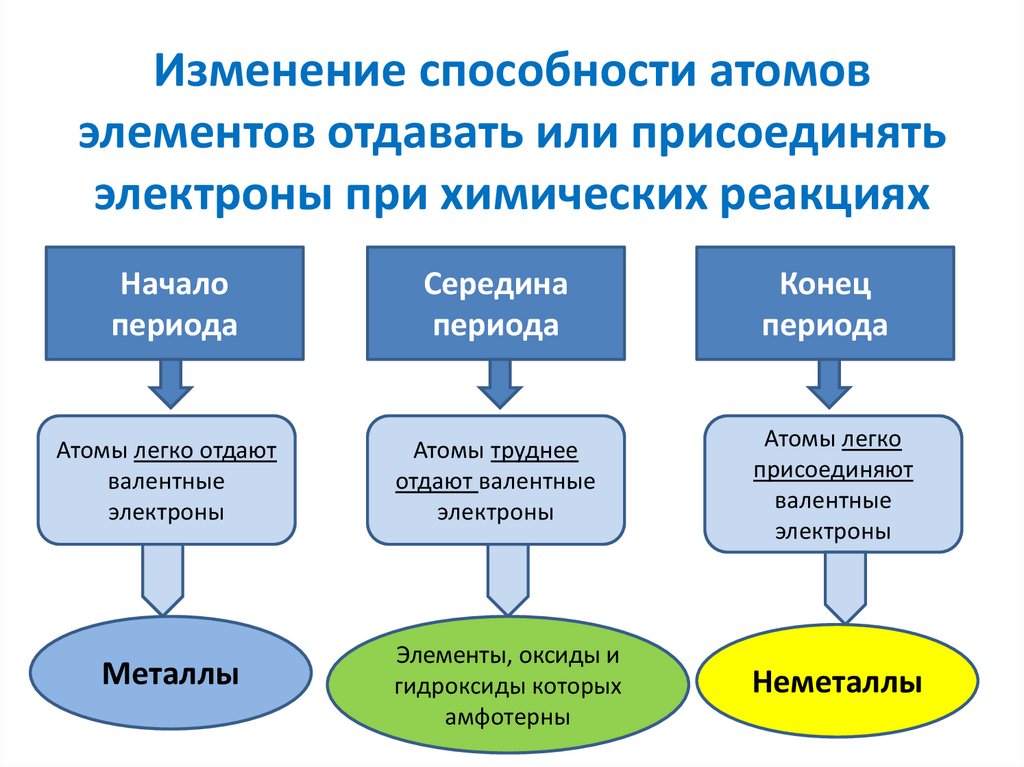
• F → O → N → CI → Br → I → S → C → Si →P → H15. Изменение способности атомов элементов отдавать или присоединять электроны при химических реакциях
Началопериода
Середина
периода
Конец
периода
Атомы легко отдают
валентные
электроны
Атомы труднее
отдают валентные
электроны
Атомы легко
присоединяют
валентные
электроны
Металлы
Элементы, оксиды и
гидроксиды которых
амфотерны
Неметаллы
16. Выполни тест:
В ряду C – N – O – Fэлектроотрицательность:
1)
2)
3)
4)
увеличивается
уменьшается
не изменяется
изменяется периодически
17. Важно понять!
При образовании химической связиэлектроны переходят или смещаются к
атомам элементов, обладающих
большей электроотрицательностью.
Например
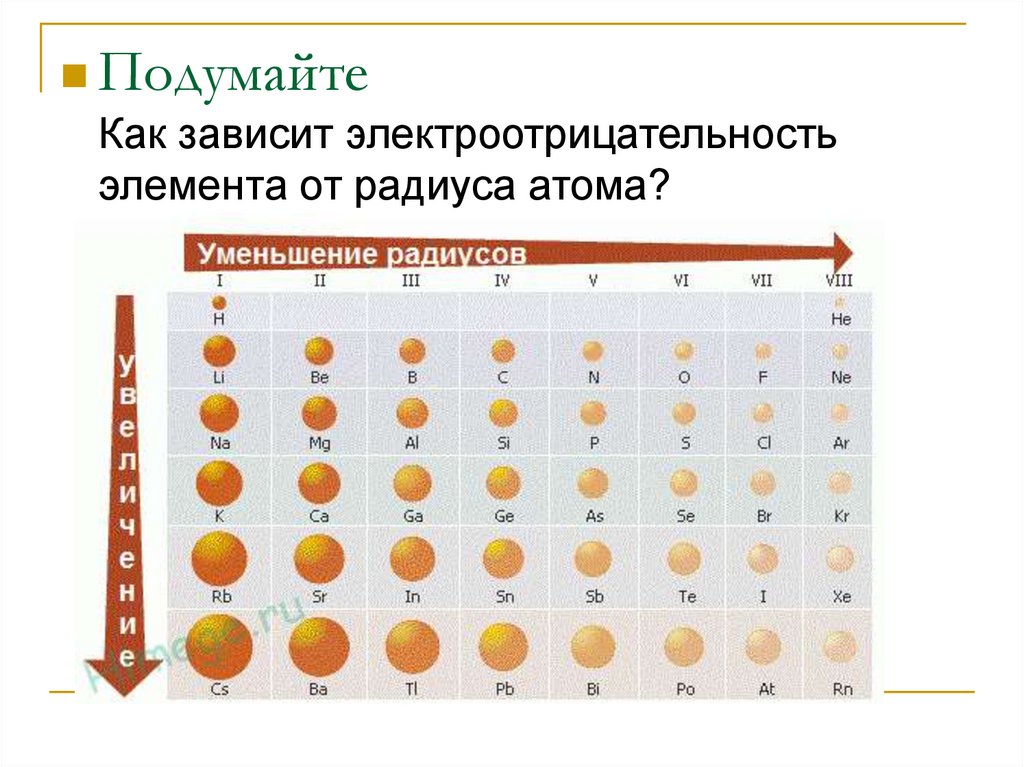
18. Подумайте Как зависит электроотрицательность элемента от радиуса атома?
19. Выводы:
• Электроотрицательность (ЭО) – это важноесвойство атомов химических элементов.
• Зная электроотрицательность (ЭО)
элемента, можно определить его
принадлежность к металлам или
неметаллам.
• Зная положение элемента в периодической
таблице можно определить, какой из
элементов имеет большую или меньшую
электроотрицательность (ЭО).
20. Подумай и ответь:
А. Cs Б. H В. Br Г. F Д. O1) Какой из элементов имеет наименьшую
электроотрицательность?
2) Какой из элементов имеет наибольшую
электроотрицательность?
3) Какой элемент имеет на внешнем энергетическом
уровне один электрон?
4) Какой элемент имеет на внешнем энергетическом
уровне семь электронов?
5) Какой элемент является металлом?
21.
Проверьсвои ответы:
1) А
2) Г
3) А, Б
4) В, Г
5) А
22. Атомы благородных газов (инертных) имеют завершённый (устойчивый) внешний энергетический уровень. Атомы других элементов
пытаютсяприобрести конфигурацию ближайшего
благородного газа и перейти в наиболее
устойчивое состояние.
Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь
23. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы
24.
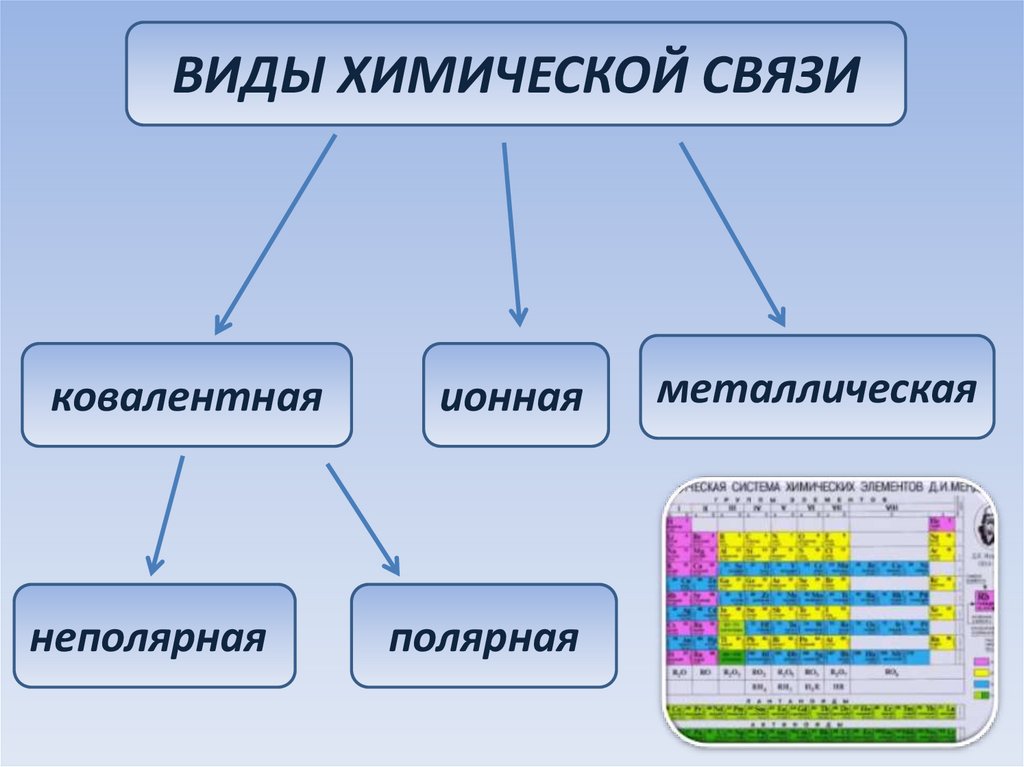
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИковалентная
неполярная
ионная
полярная
металлическая
25.
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
26.
Металлическая –в простых веществах-металлах
Al
Na
Ba
Fe
Mg
27.
Ионнаяв сложных веществах,
состоящих из атомов
металлов и неметаллов:
Na2O, KOH, MgCl2 , BaSO4,
LiBr
28.
Ковалентная неполярнаяв простых веществах –
неметаллах
O2 N2 H2 S8 P O3
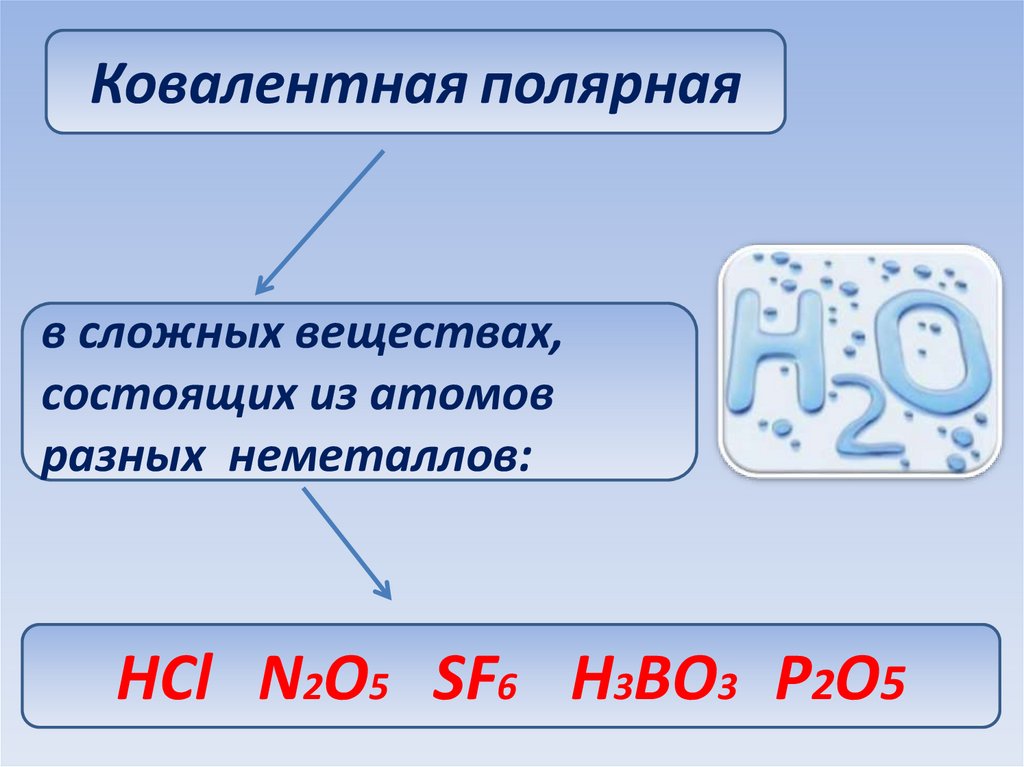
29.
Ковалентная полярнаяв сложных веществах,
состоящих из атомов
разных неметаллов:
НСl N2O5 SF6 H3BO3 Р2О5
30.
Определите вид химическойсвязи в каждом из данных
соединений
H2S
N2
LiCl
BaO
Ca(NO3)2
Pb
F2
31. Домашнее задание
Проработать презентацию, записать ивыучить конспект;
Выпишите отдельно формулы веществ с
ковалентной полярной и неполярной
связями, ионной связью:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl,
O3, CO2, SO3, CCl4, F2.


























 chemistry
chemistry








