Similar presentations:
Исследование ферментационной активности бутирилхолинэстеразы на фоне внутривенного введения генетически модифицированных МСК
1.
Исследование ферментационнойактивности бутирилхолинэстеразы на
фоне внутривенного введения
генетически модифицированных МСК
Институт фундаментальной
медицины и биологии
Кафедра генетики
Выпускная квалификационная работа
Ахмет Маржан Пайызханкызы
Научный руководитель
Преподаватель, б.с.
Тазетдинова Лейсан Газинуровна
2.
ВведениеБутирилхолинэстераза (БуХЭ) – сериновая гидролаза,
способна связываться с разнообразными токсинами,
ингибируя ацетилхолинэстеразу.
БуХЭ обнаруживается практически во всех органах и
тканях млекопитающих и человека, а именно в тканях
желудочно-кишечного тракта, печени и органах
дыхательной системы и в сыворотке крови.
Высокая реакционная способность ингибирования
токсинов, делает БуХЭ человека перспективным
кандидатом стать биологическим антидотом, действующего
направлено на множества фосфорорганических ядов.
Препаративное и промышленное получение
рекомбинантной БуХЭ, достаточных для инъекционного
введения, затруднено из-за ее низкой экспрессии.
2/13
3.
Цель работы и решаемые задачи:3/13
Цель работы:
Анализ ферментационной активности бутирилхолинэстеразы на фоне внутривенного
введения генетически модифицированных мезенхимных стволовых клеток из
жировой ткани крысы, экспрессирующих бутирилхолинэстеразу в хвостовую вену.
Задачи:
1.
Получить в препаративных количествах плазмидную ДНК pRc/CMV-hBCHE, содержащую нуклеотидную
последовательность гена рекомбинантного белка бутирилхолинэстеразы (БуХЭ);
2.
Провести рестрикционный анализ выделенной плазмидной конструкции pRc/CMV-hBCHE;
3.
Провести генетическую модификацию кМСК-ЖТ и HEK293T плазмидной ДНК, кодирующей БуХЭ
(pRc/CMV-hBCHE) и контрольной плазмидой pEGFP-N2, экспрессирующих ген улучшенного зеленого
флуоресцентного белка EGFP;
4.
Провести оценку эффективности трансфекции культур клеток по флуоресценции контрольных образцов,
трансфицированных плазмидой pEGFP-N2;
5.
Анализ ферментационной активности бутирилхолинэстеразы в плазме крыс на фоне введения в
хвостовую вену крысы кМСК-ЖТ-hBCHE in vivo.
4.
Клеточные линииHEK293T
4/13
кМСК-ЖТ
В работе использовались: мезенхимные стволовые клетки из
жировой ткани крысы (кМСК-ЖТ), клетки почки эмбриона
человека (HEK293T)
4
5.
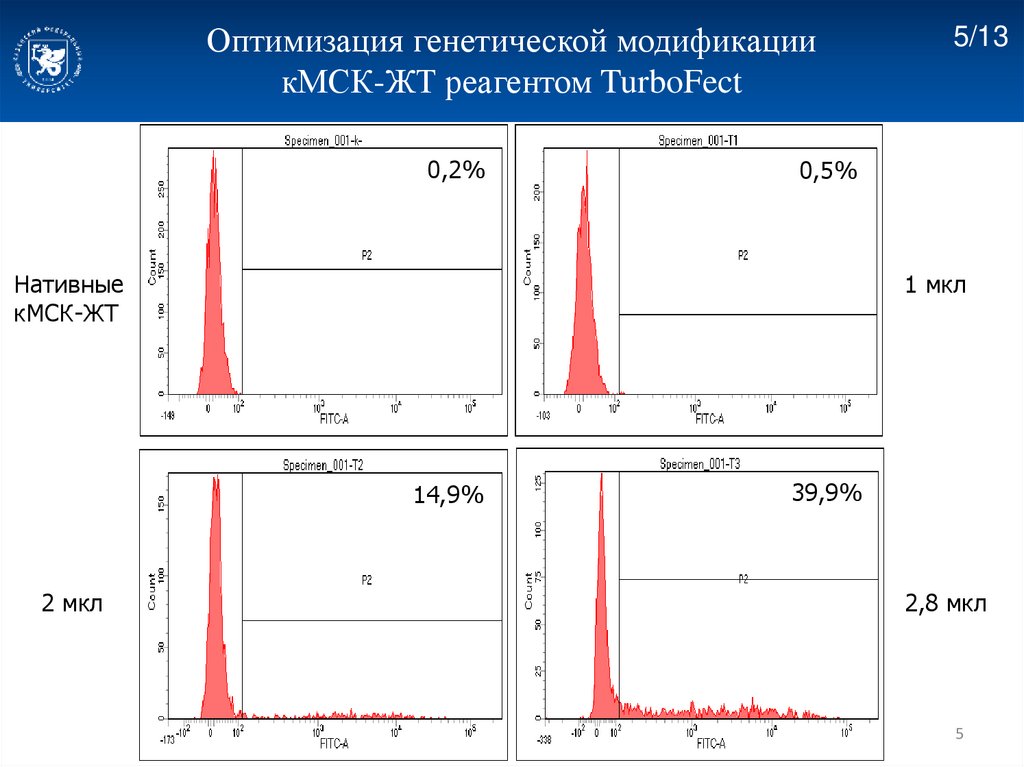
Оптимизация генетической модификациикМСК-ЖТ реагентом TurboFect
0,2%
0,5%
Нативные
кМСК-ЖТ
1 мкл
14,9%
2 мкл
5/13
39,9%
2,8 мкл
5
6.
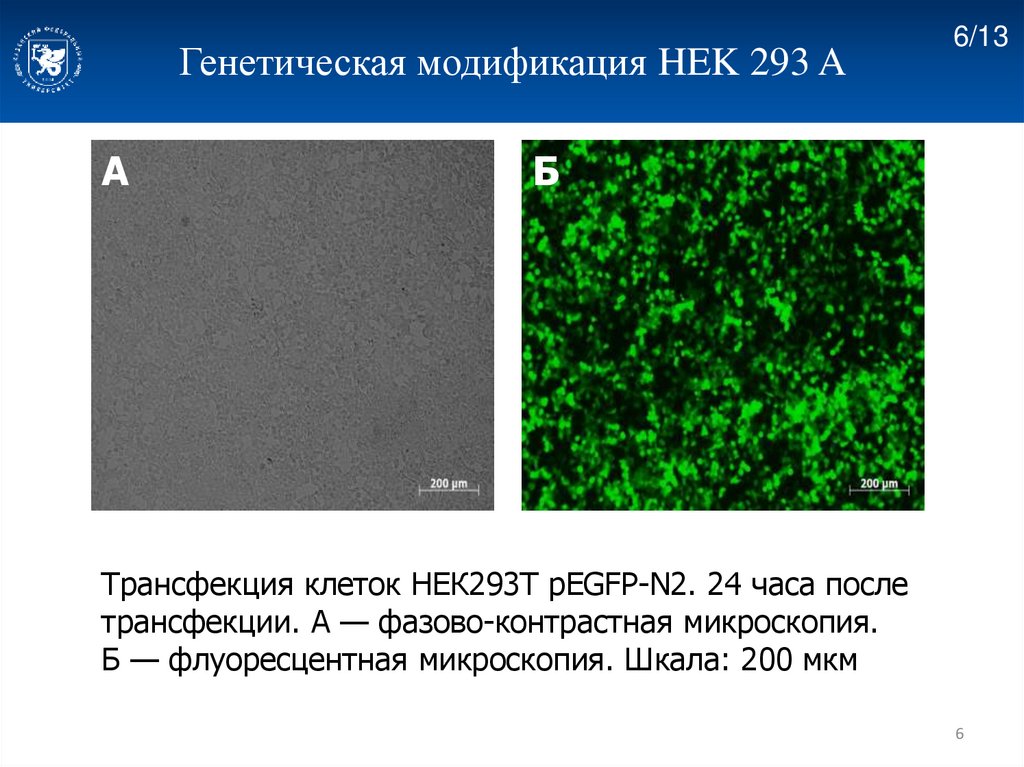
Генетическая модификация HEK 293 AА
6/13
Б
Трансфекция клеток НЕК293T pEGFP-N2. 24 часа после
трансфекции. А — фазово-контрастная микроскопия.
Б — флуоресцентная микроскопия. Шкала: 200 мкм
6
7.
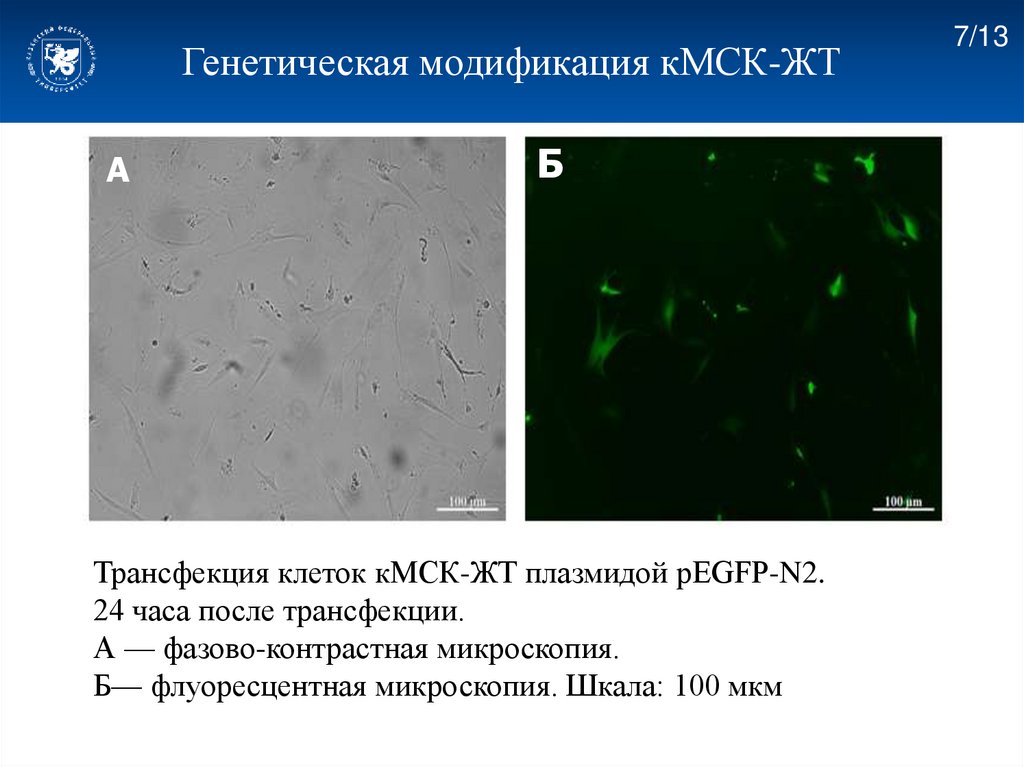
Генетическая модификация кМСК-ЖТА
Б
Трансфекция клеток кМСК-ЖТ плазмидой pEGFP-N2.
24 часа после трансфекции.
А — фазово-контрастная микроскопия.
Б— флуоресцентная микроскопия. Шкала: 100 мкм
7/13
8.
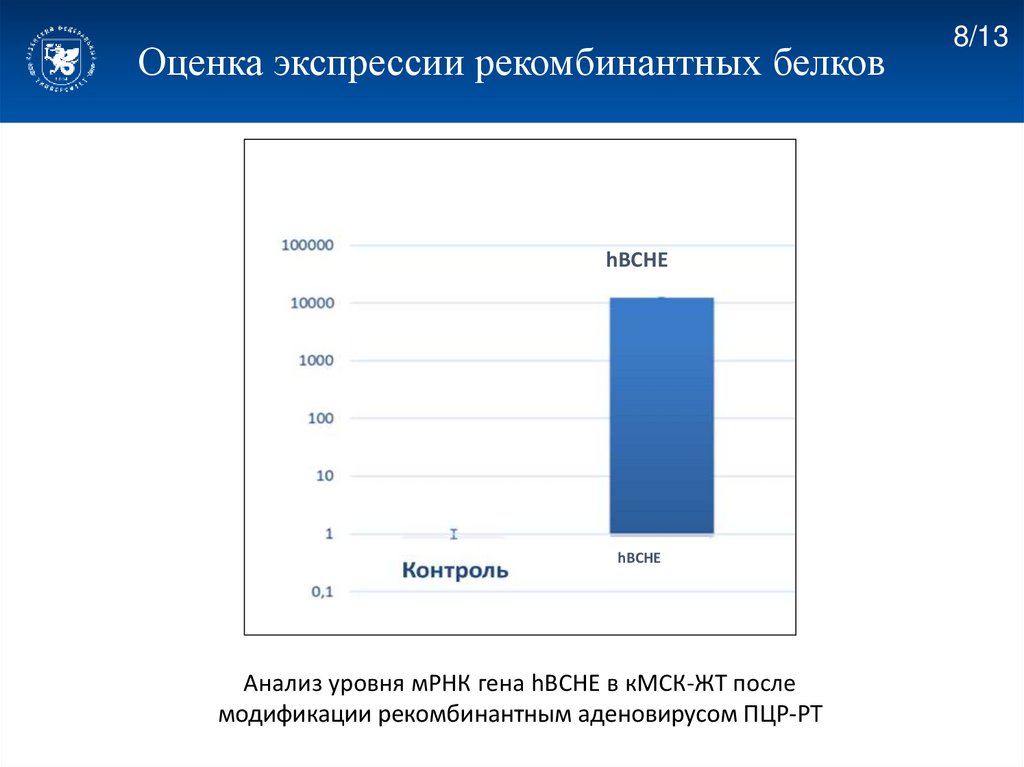
Оценка экспрессии рекомбинантных белковhBCHE
hBCHE
Анализ уровня мРНК гена hBCHE в кМСК-ЖТ после
модификации рекомбинантным аденовирусом ПЦР-РТ
8/13
9.
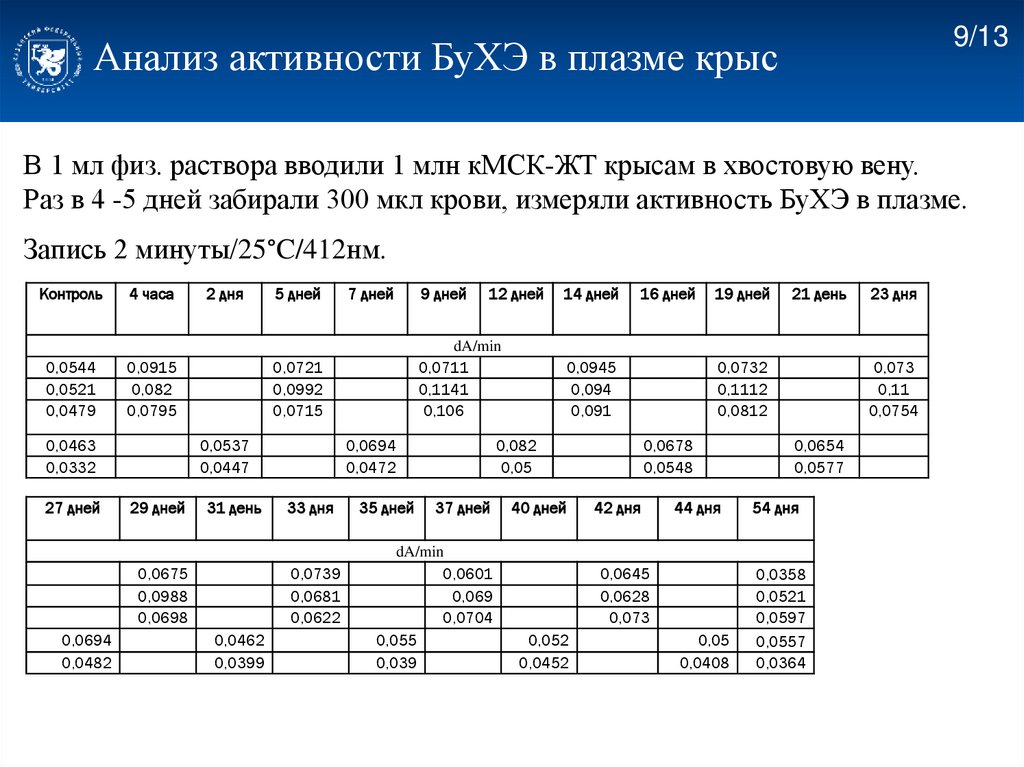
9/13Анализ активности БуХЭ в плазме крыс
В 1 мл физ. раствора вводили 1 млн кМСК-ЖТ крысам в хвостовую вену.
Раз в 4 -5 дней забирали 300 мкл крови, измеряли активность БуХЭ в плазме.
Запись 2 минуты/25°C/412нм.
Контроль
0,0544
0,0521
0,0479
4 часа
0,0915
0,082
0,0795
0,0463
0,0332
27 дней
2 дня
0,0537
0,0447
29 дней
7 дней
31 день
12 дней
0,0694
0,0472
33 дня
0,0739
0,0681
0,0622
0,0462
0,0399
9 дней
dA/min
0,0711
0,1141
0,106
0,0721
0,0992
0,0715
0,0675
0,0988
0,0698
0,0694
0,0482
5 дней
35 дней
14 дней
16 дней
0,0945
0,094
0,091
0,082
0,05
37 дней
dA/min
0,0601
0,069
0,0704
0,055
0,039
40 дней
19 дней
0,0732
0,1112
0,0812
0,0678
0,0548
42 дня
23 дня
0,073
0,11
0,0754
0,0654
0,0577
44 дня
54 дня
0,05
0,0408
0,0358
0,0521
0,0597
0,0557
0,0364
0,0645
0,0628
0,073
0,052
0,0452
21 день
10.
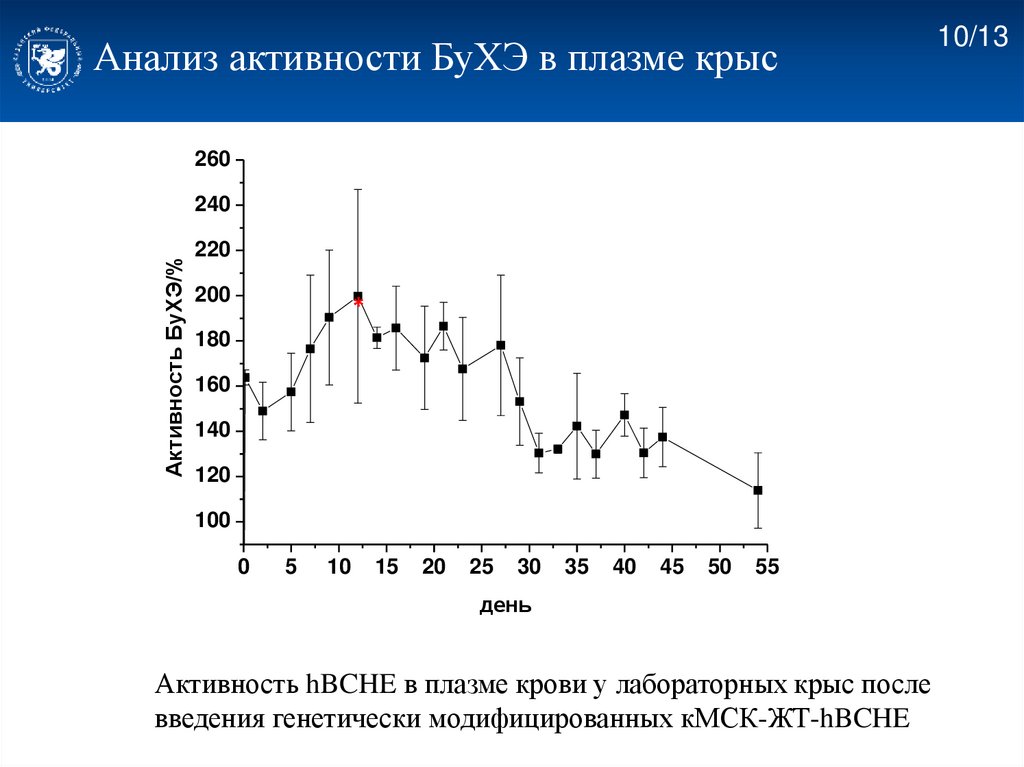
Анализ активности БуХЭ в плазме крыс260
Активность БуХЭ/%
240
220
200
*
180
160
140
120
100
0
5
10
15
20
25
30
35
40
45
50
55
день
Активность hBCHE в плазме крови у лабораторных крыс после
введения генетически модифицированных кМСК-ЖТ-hBCHE
10/13
11.
Выводы11/13
1.
Были выделены мезенхимные стволовые клетки из жировой ткани
крысы;
2.
Проведена трансфекция кМСК-ЖТ, и HEK293T плазмидной ДНК,
кодирующей
БуХЭ
и
контрольной
плазмидой
pEGFP-N2,
экспрессирующей ген улучшенного зеленого флуоресцентного белка
EGFP;
3.
Проведена оценка эффективности трансфекции культур клеток по
флуоресценции контрольных образцов, трансфицированных плазмидой
pEGFP-N2. Показана низкая эффективность метода электропорации для
трансфекции мононуклеарных клеток плазмидными конструкциями;
4.
Был проведен ферментационный анализ БуХЭ в плазме крови крыс.
Активность фермента сохранялась на протяжении более 50 дней.
12.
Спасибо за внимание!12
13.
Благодарности13/13
• научный руководитель, преподаватель, б.с. Тазетдинова Л.Г.:
• проф., чл.-кор. АН РТ, докт. биол. наук Ризванов А.А.
• ст. преподаватель каф. генетики, к.б.н., Соловьева В.В.
• в помощи проведении in vivo исследований Зуевой И.В.
• рецензент, ст. преподаватель к.б.н. Гараниной Е.Е. за объективную
рецензию выпускной квалификационной работы
• Всем преподавателям и сотрудникам кафедры Генетики ИФМиБ КФУ







 medicine
medicine








