Similar presentations:
Структурная организация белка. Тема 4
1.
601-8009
370
13
Тема 4 .
Структурная
организация белка
2.
Структурная организация белкаВыяснение структурной организации белков считается одной из главных проблем современной
биохимии. Оно имеет важное научно-практическое значение для понимания огромного разнообразия
функций белков, выполняемых ими в живых организмах.
Белковые молекулы представляют собой продукт полимеризации 20 различных мономерных молекул
(аминокислот), соединенных не хаотично, а в строгом соответствии с кодом белкового синтеза.
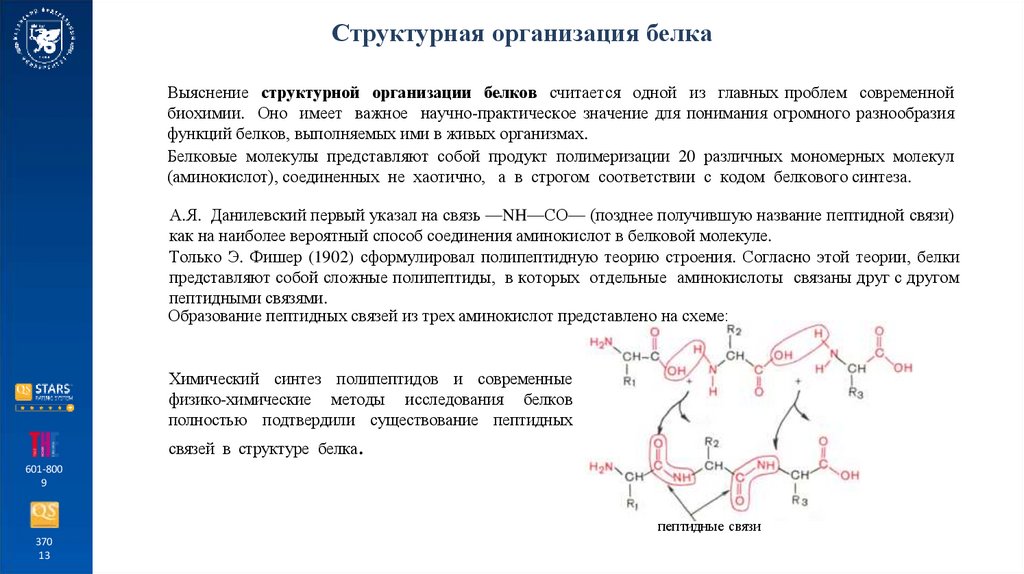
А.Я. Данилевский первый указал на связь —NH—СО— (позднее получившую название пептидной связи)
как на наиболее вероятный способ соединения аминокислот в белковой молекуле.
Только Э. Фишер (1902) сформулировал полипептидную теорию строения. Согласно этой теории, белки
представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом
пептидными связями.
Образование пептидных связей из трех аминокислот представлено на схеме:
Химический синтез полипептидов и современные
физико-химические методы исследования белков
полностью подтвердили существование пептидных
связей в структуре белка.
601-800
9
пептидные связи
370
13
3.
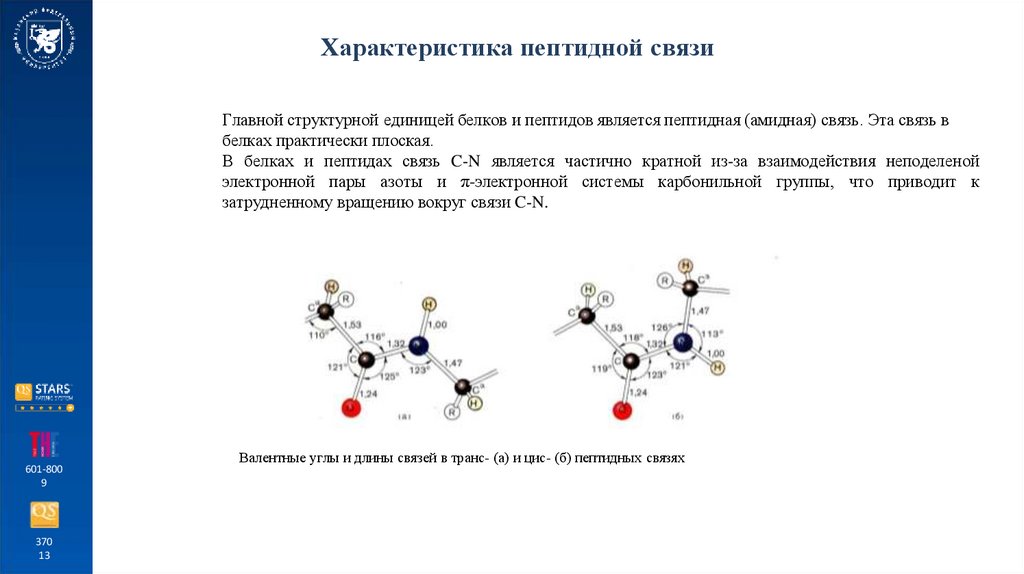
Характеристика пептидной связиГлавной структурной единицей белков и пептидов является пептидная (амидная) связь. Эта связь в
белках практически плоская.
В белках и пептидах связь C-N является частично кратной из-за взаимодействия неподеленой
электронной пары азоты и π-электронной системы карбонильной группы, что приводит к
затрудненному вращению вокруг связи C-N.
601-800
9
370
13
Валентные углы и длины связей в транс- (а) и цис- (б) пептидных связях
4.
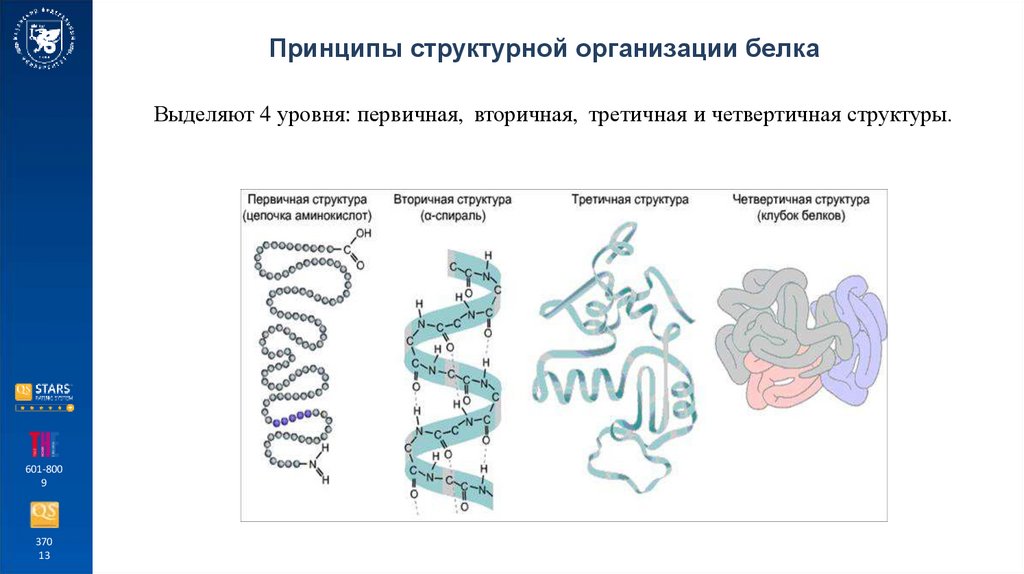
Принципы структурной организации белкаВыделяют 4 уровня: первичная, вторичная, третичная и четвертичная структуры.
601-800
9
370
13
5.
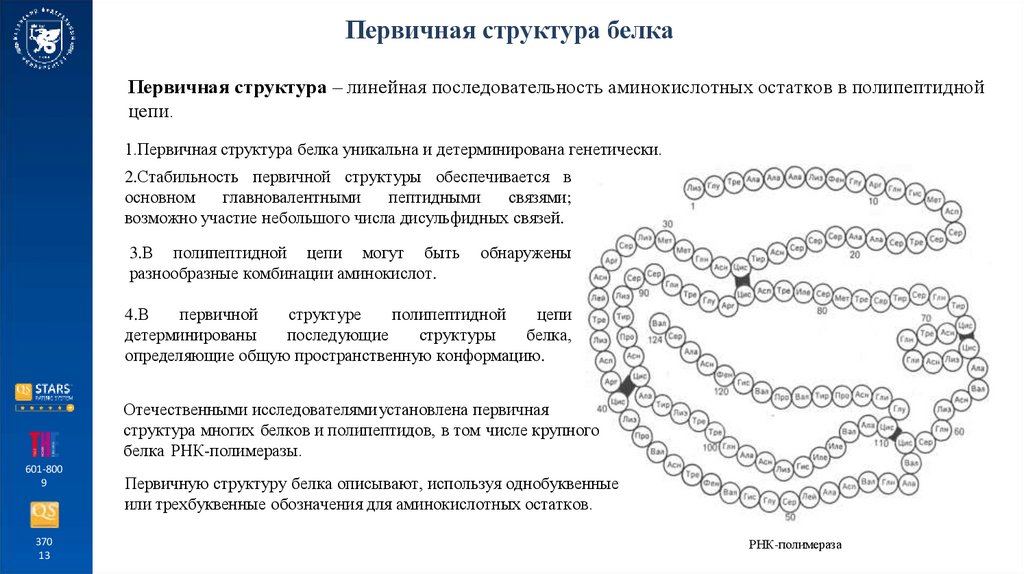
Первичная структура белкаПервичная структура – линейная последовательность аминокислотных остатков в полипептидной
цепи.
1.Первичная структура белка уникальна и детерминирована генетически.
2.Стабильность первичной структуры обеспечивается в
основном
главновалентными
пептидными
связями;
возможно участие небольшого числа дисульфидных связей.
3.В полипептидной цепи могут быть
разнообразные комбинации аминокислот.
обнаружены
4.В
первичной
структуре
полипептидной
цепи
детерминированы
последующие
структуры
белка,
определяющие общую пространственную конформацию.
Отечественными исследователями установлена первичная
структура многих белков и полипептидов, в том числе крупного
белка РНК-полимеразы.
601-800
9
370
13
Первичную структуру белка описывают, используя однобуквенные
или трехбуквенные обозначения для аминокислотных остатков.
РНК-полимераза
6.
Определение первичной структуры белка методом масс-спектрометрииПроцесс съемки масс-спектра соединения состоит из нескольких стадий: переведение
исследуемого образца в газообразное состояние; ионизация его, при которой
происходит распад большинства образующихся молекулярных ионов; ускорение
полученных ионов в электрическом поле, последующее их разделение (в зависимости
от отношения массы к заряду) в магнитном поле; и наконец регистрация масс-спектра.
Вследствие цвиттер-ионного характера пептиды с большим трудом подвергаются
испарению. Летучесть их может быть повышена путем ацилирования и этерификации.
601-800
9
370
13
7.
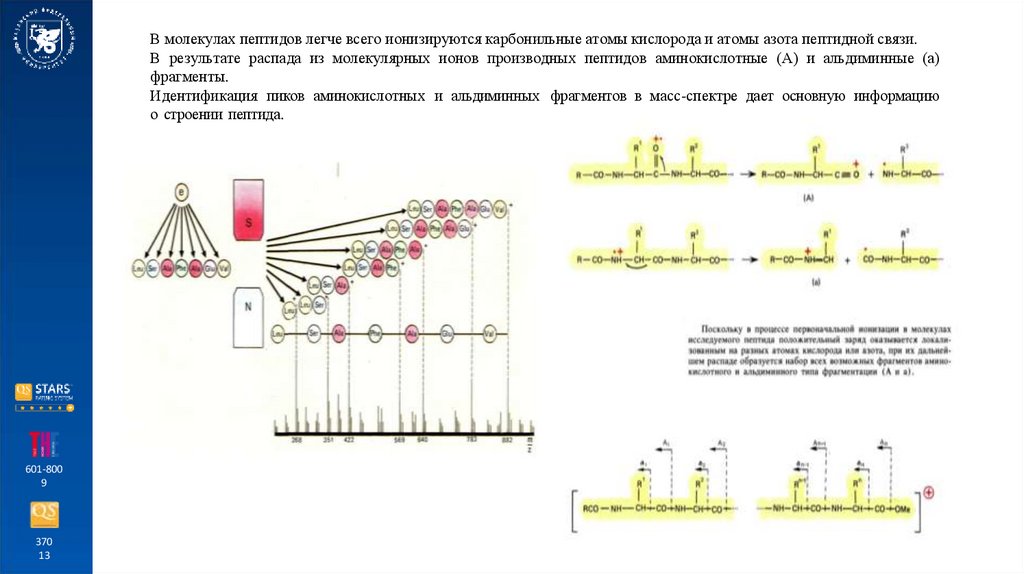
В молекулах пептидов легче всего ионизируются карбонильные атомы кислорода и атомы азота пептидной связи.В результате распада из молекулярных ионов производных пептидов аминокислотные (А) и альдиминные (а)
фрагменты.
Идентификация пиков аминокислотных и альдиминных фрагментов в масс-спектре дает основную информацию
о строении пептида.
601-800
9
370
13
8.
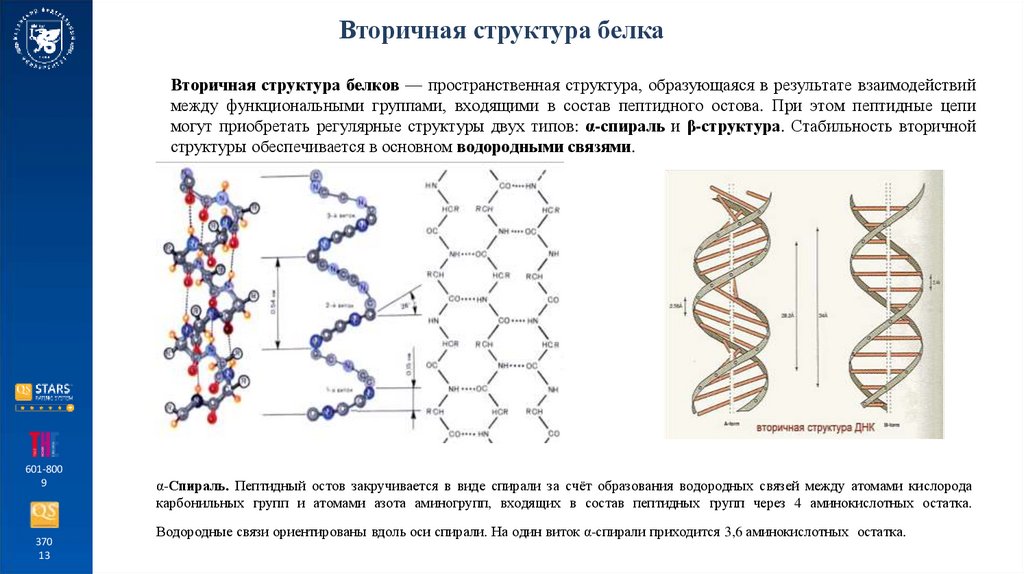
Вторичная структура белкаВторичная структура белков — пространственная структура, образующаяся в результате взаимодействий
между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи
могут приобретать регулярные структуры двух типов: α-спираль и β-структура. Стабильность вторичной
структуры обеспечивается в основном водородными связями.
601-800
9
370
13
α-Спираль. Пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода
карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка.
Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка.
9.
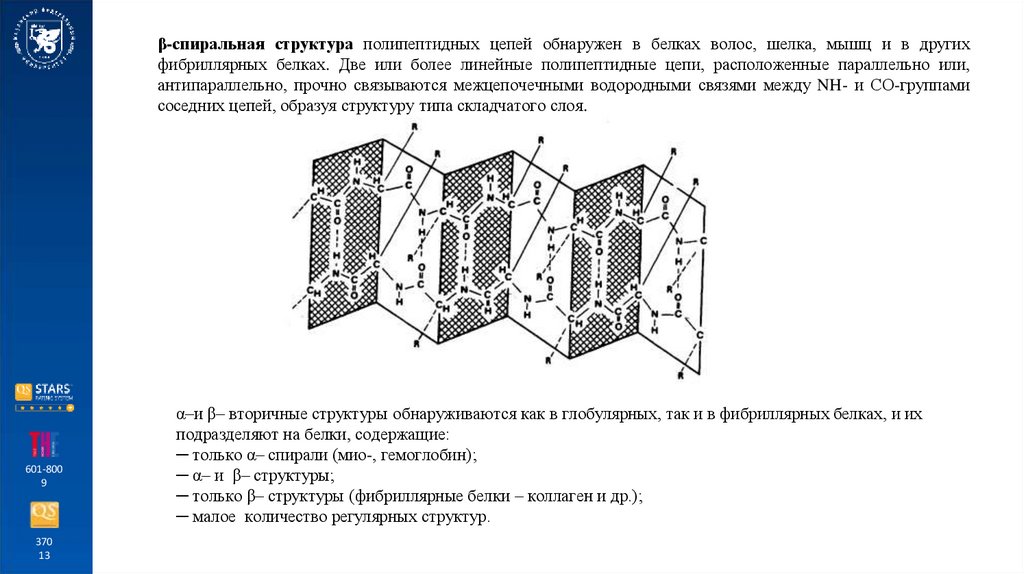
β-спиральная структура полипептидных цепей обнаружен в белках волос, шелка, мышц и в другихфибриллярных белках. Две или более линейные полипептидные цепи, расположенные параллельно или,
антипараллельно, прочно связываются межцепочечными водородными связями между NH- и СО-группами
соседних цепей, образуя структуру типа складчатого слоя.
601-800
9
370
13
α–и β– вторичные структуры обнаруживаются как в глобулярных, так и в фибриллярных белках, и их
подразделяют на белки, содержащие:
─ только α– спирали (мио-, гемоглобин);
─ α– и β– структуры;
─ только β– структуры (фибриллярные белки – коллаген и др.);
─ малое количество регулярных структур.
10.
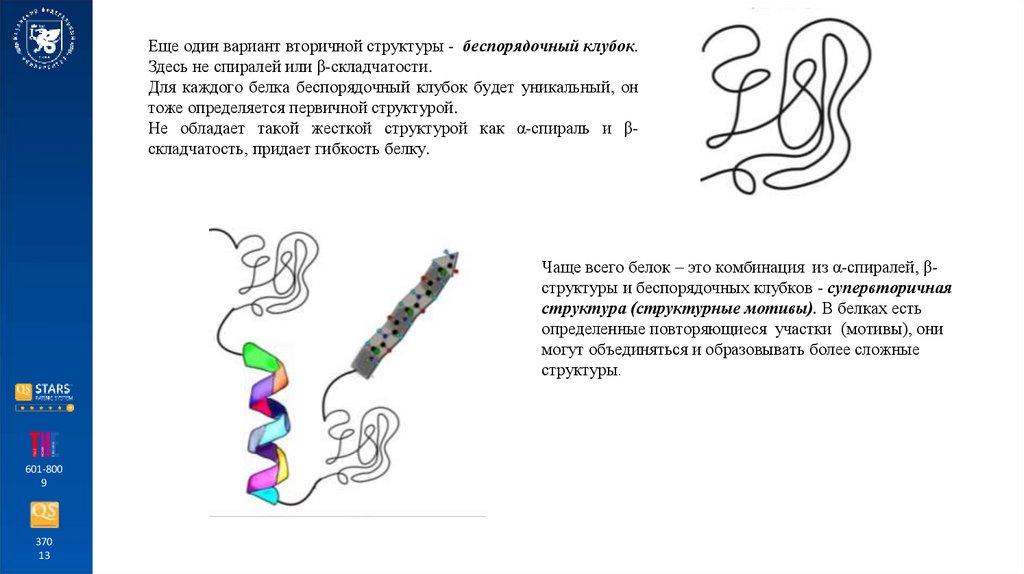
Еще один вариант вторичной структуры - беспорядочный клубок.Здесь не спиралей или β-складчатости.
Для каждого белка беспорядочный клубок будет уникальный, он
тоже определяется первичной структурой.
Не обладает такой жесткой структурой как α-спираль и βскладчатость, придает гибкость белку.
Чаще всего белок – это комбинация из α-спиралей, βструктуры и беспорядочных клубков - супервторичная
структура (структурные мотивы). В белках есть
определенные повторяющиеся участки (мотивы), они
могут объединяться и образовывать более сложные
структуры.
601-800
9
370
13
11.
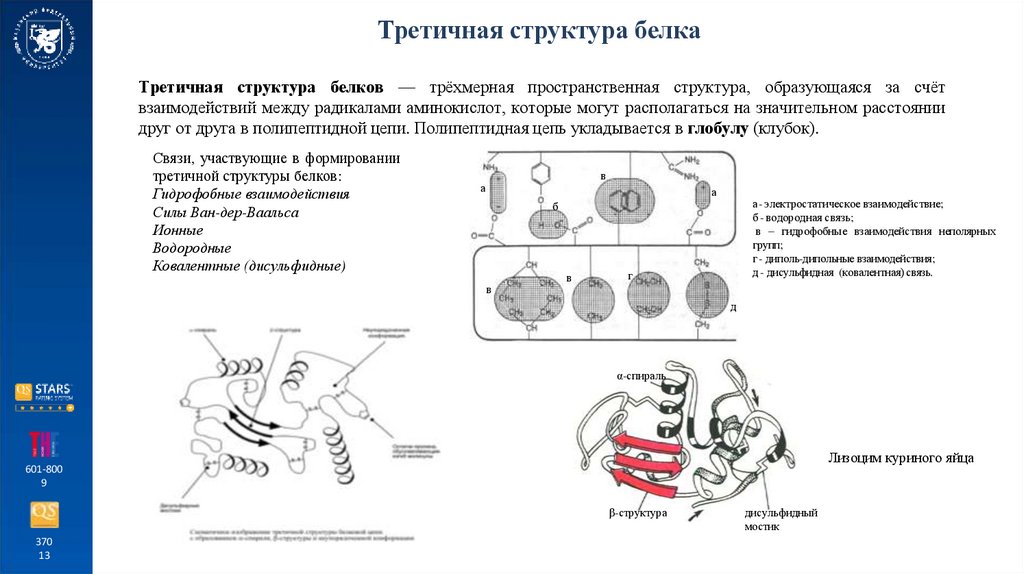
Третичная структура белкаТретичная структура белков — трёхмерная пространственная структура, образующаяся за счёт
взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии
друг от друга в полипептидной цепи. Полипептидная цепь укладывается в глобулу (клубок).
Связи, участвующие в формировании
третичной структуры белков:
Гидрофобные взаимодействия
Силы Ван-дер-Ваальса
Ионные
Водородные
Ковалентные (дисульфидные)
в
а
а
а- электростатическое взаимодействие;
б - водородная связь;
в – гидрофобные взаимодействия неполярных
групп;
г - диполь-дипольные взаимодействия;
д - дисульфидная (ковалентная) связь.
б
в
в
г
д
α-спираль
Лизоцим куриного яйца
601-800
9
β-структура
370
13
дисульфидный
мостик
12.
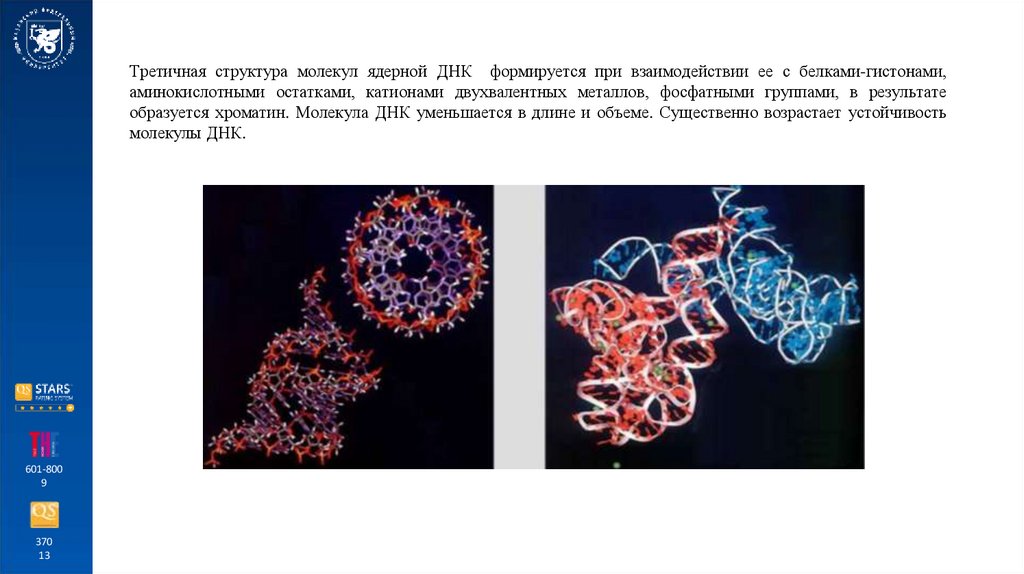
Третичная структура молекул ядерной ДНК формируется при взаимодействии ее с белками-гистонами,аминокислотными остатками, катионами двухвалентных металлов, фосфатными группами, в результате
образуется хроматин. Молекула ДНК уменьшается в длине и объеме. Существенно возрастает устойчивость
молекулы ДНК.
601-800
9
370
13
13.
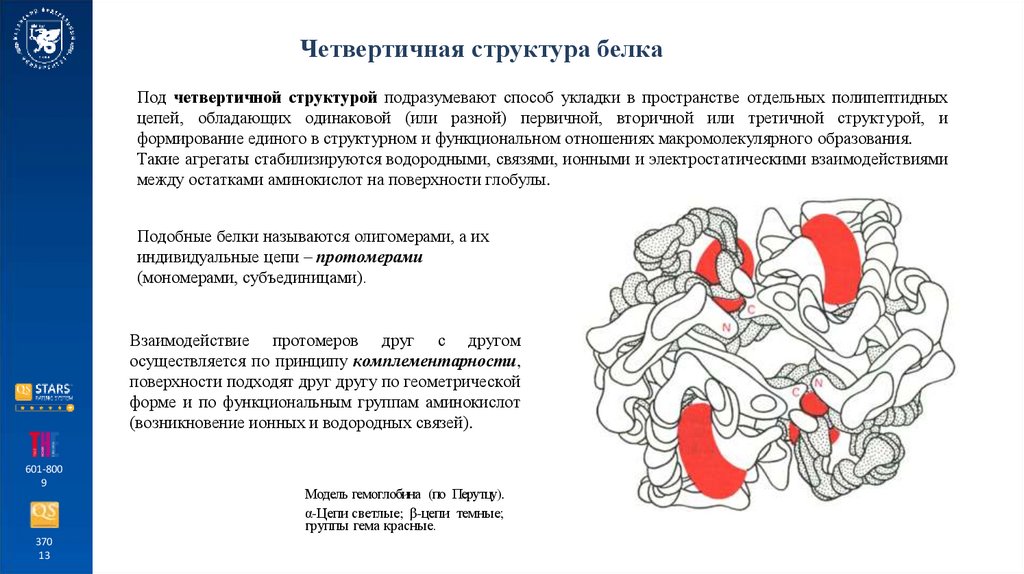
Четвертичная структура белкаПод четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных
цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и
формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Такие агрегаты стабилизируются водородными, связями, ионными и электростатическими взаимодействиями
между остатками аминокислот на поверхности глобулы.
Подобные белки называются олигомерами, а их
индивидуальные цепи – протомерами
(мономерами, субъединицами).
Взаимодействие протомеров друг с другом
осуществляется по принципу комплементарности,
поверхности подходят друг другу по геометрической
форме и по функциональным группам аминокислот
(возникновение ионных и водородных связей).
601-800
9
370
13
Модель гемоглобина (по Перутцу).
α-Цепи светлые; β-цепи темные;
группы гема красные.
14.
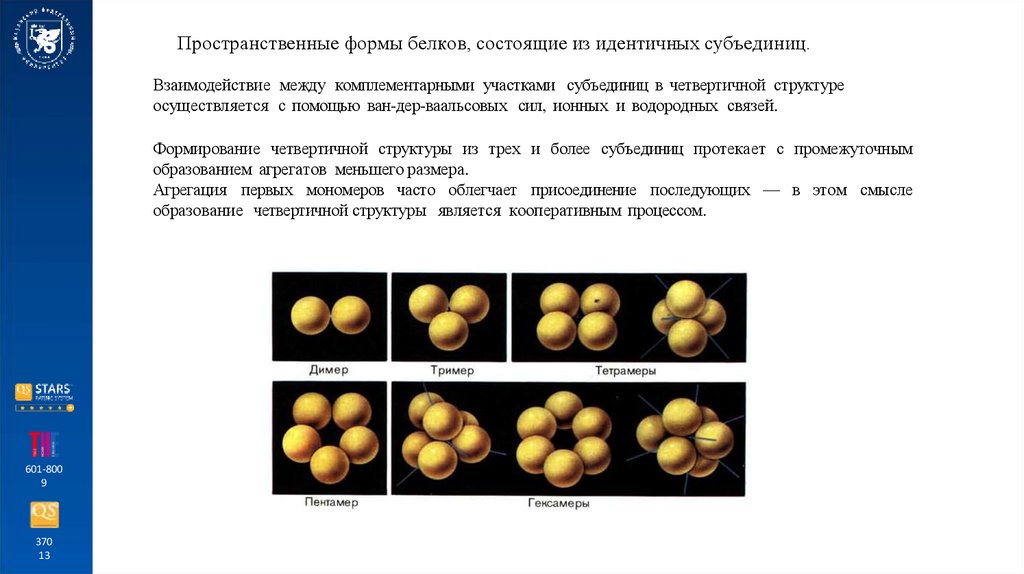
Пространственные формы белков, состоящие из идентичных субъединиц.Взаимодействие между комплементарными участками субъединиц в четвертичной структуре
осуществляется с помощью ван-дер-ваальсовых сил, ионных и водородных связей.
Формирование четвертичной структуры из трех и более субъединиц протекает с промежуточным
образованием агрегатов меньшего размера.
Агрегация первых мономеров часто облегчает присоединение последующих — в этом смысле
образование четвертичной структуры является кооперативным процессом.
601-800
9
370
13
15.
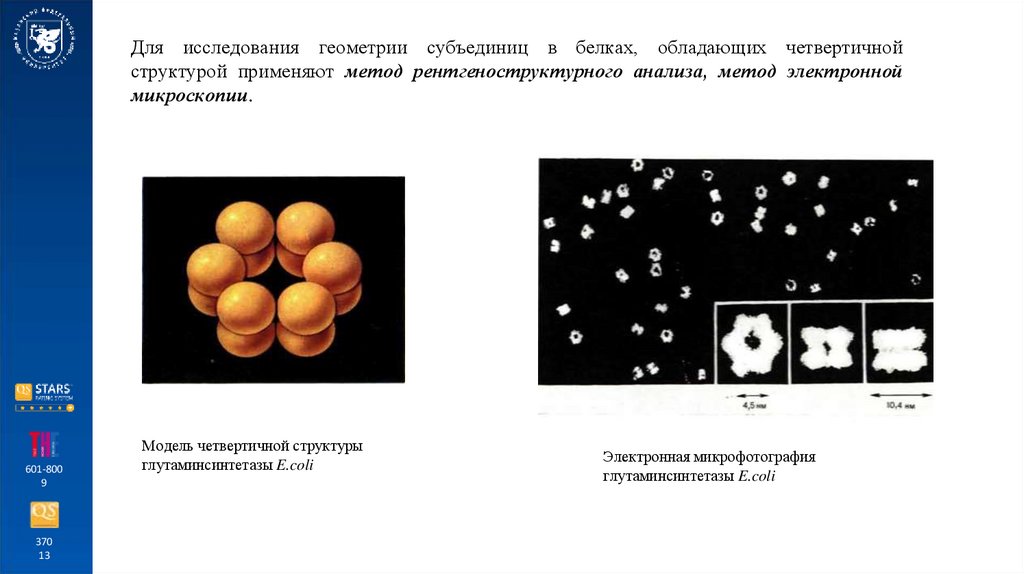
Для исследования геометрии субъединиц в белках, обладающих четвертичнойструктурой применяют метод рентгеноструктурного анализа, метод электронной
микроскопии.
601-800
9
370
13
Модель четвертичной структуры
глутаминсинтетазы E.coli
Электронная микрофотография
глутаминсинтетазы E.coli
16.
Исследование структуры белкаПрямую информацию о пространственном строении
белка в растворе дает метод ядерно-магнитного
резонанса.
Изменение конформации белка изучают с помощью
дифференциальной
спектроскопии
комбинационного рассеяния и флуоресценции.
О пространственном расположении атомов в
молекуле
белка
судят
на
основе
рентгеноструктурного анализа его кристаллов.
Для определения вторичной структуры белка
используют
методы кругового дихроизма и
дисперсии оптического вращения
Выяснение первичной структуры белков и пептидов
осуществляется в несколько этапов:
1.Выделение белка в чистом виде и определение его
молекулярной массы
2.Определение аминокислотного состава
3.Определение N-концевой аминокислоты
4.Определение C-концевой аминокислоты
5.Определение аминокислотной последовательности.
1.Выделение белка в чистом виде и определение его молекулярной массы
1.Гомогенизация белков
601-800
9
370
13
2.Экстракция белков (перевод белков в растворенное состояние)
3.Фракционирование и очистка белков (разделение на индивидуальные белки)
а) высаливание
б) хроматографические методы (адсорбционная, распределительная, ионнообменная, аффинная и гель-хроматография)
в) электрофорез
4.Определение гомогенности белка (ультрацентрифугирование, диск-электрофорез в полиакрилатном слое, изоэлектрическое
фокусирование, иммунохимические методы)
17.
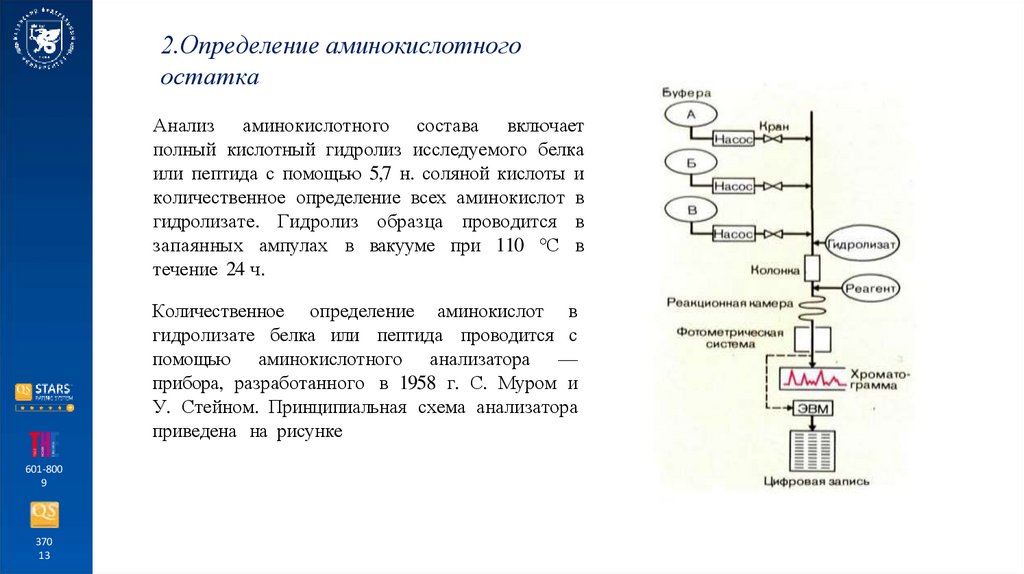
2.Определение аминокислотногоостатка
Анализ аминокислотного состава включает
полный кислотный гидролиз исследуемого белка
или пептида с помощью 5,7 н. соляной кислоты и
количественное определение всех аминокислот в
гидролизате. Гидролиз образца проводится в
запаянных ампулах в вакууме при 110 °С в
течение 24 ч.
Количественное определение аминокислот в
гидролизате белка или пептида проводится с
помощью аминокислотного анализатора —
прибора, разработанного в 1958 г. С. Муром и
У. Стейном. Принципиальная схема анализатора
приведена на рисунке
601-800
9
370
13
18.
601-8009
370
13
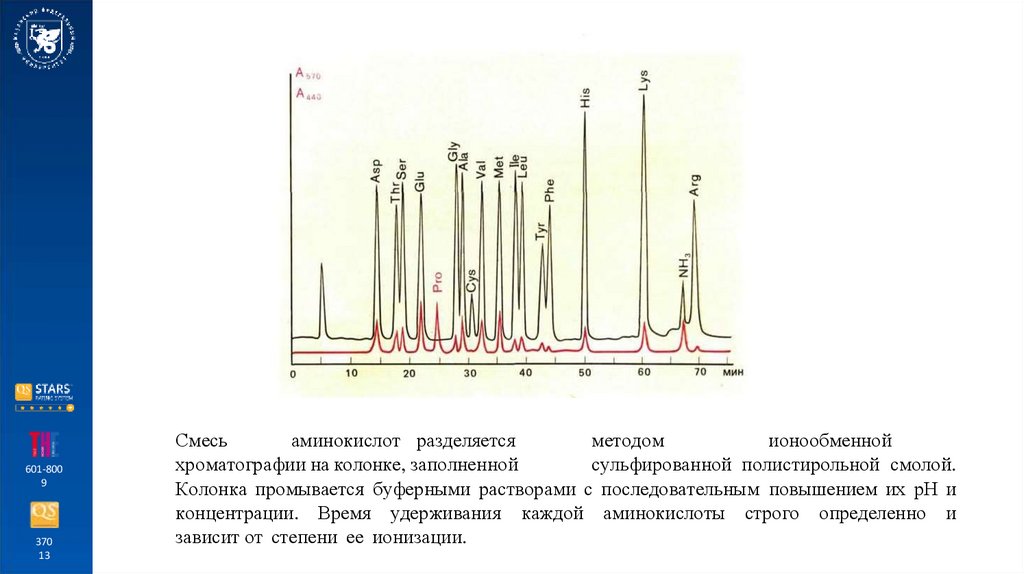
Смесь
аминокислот разделяется
методом
ионообменной
хроматографии на колонке, заполненной
сульфированной полистирольной смолой.
Колонка промывается буферными растворами с последовательным повышением их рН и
концентрации. Время удерживания каждой аминокислоты строго определенно и
зависит от степени ее ионизации.
19.
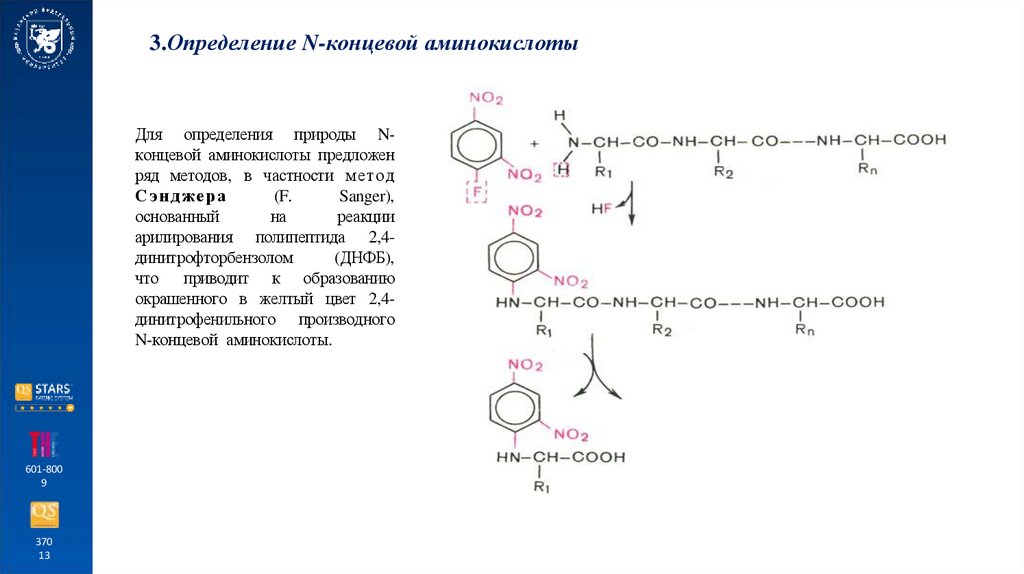
3.Определение N-концевой аминокислотыДля определения природы Nконцевой аминокислоты предложен
ряд методов, в частности метод
Сэнджера
(F.
Sanger),
основанный
на
реакции
арилирования полипептида 2,4динитрофторбензолом
(ДНФБ),
что приводит к образованию
окрашенного в желтый цвет 2,4динитрофенильного производного
N-концевой аминокислоты.
601-800
9
370
13
20.
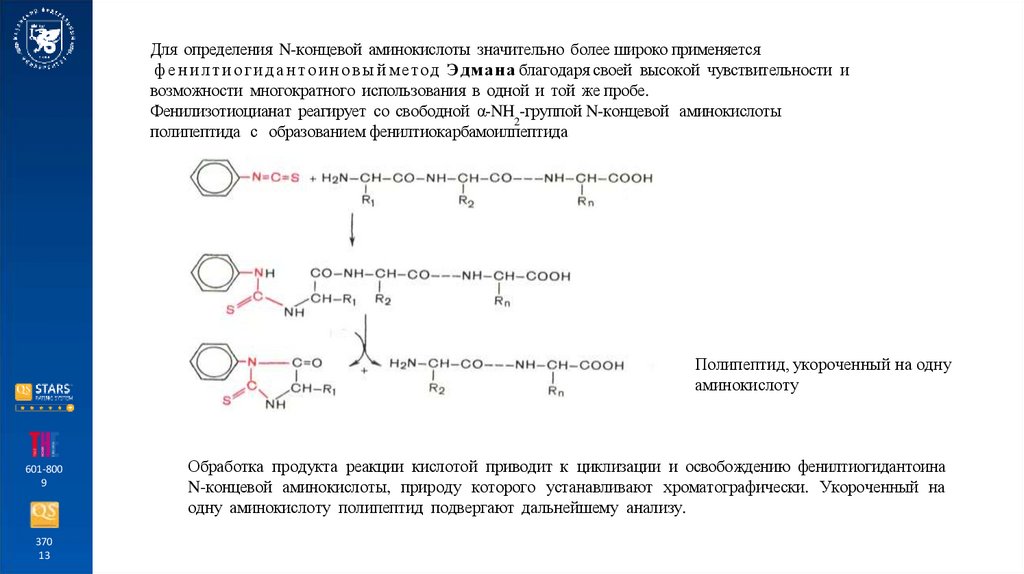
Для определения N-концевой аминокислоты значительно более широко применяетсяф е н и л т и о г и д а н т о и н о в ы й мет о д Э д ман а благодаря своей высокой чувствительности и
возможности многократного использования в одной и той же пробе.
Фенилизотиоцианат реагирует со свободной α-NH2-группой N-концевой аминокислоты
полипептида с образованием фенилтиокарбамоилпептида
Полипептид, укороченный на одну
аминокислоту
601-800
9
370
13
Обработка продукта реакции кислотой приводит к циклизации и освобождению фенилтиогидантоина
N-концевой аминокислоты, природу которого устанавливают хроматографически. Укороченный на
одну аминокислоту полипептид подвергают дальнейшему анализу.
21.
4.Определение С-концевой аминокислотыДля определения С-концевой аминокислоты часто используют ферментативные методы.
Обработка полипептида карбоксипептидазой приводит к освобождению С-концевой
аминокислоты, которая может быть идентифицирована методом хроматографии.
Химический метод Акабори (S.Akabori)
основан на гидразинолизе полипептида
5.Определение аминокислотной последовательности
Для определения последовательности аминокислот проводят избирательный, частичный (химический и ферментативный), гидролиз
полипептидной цепи на короткие пептидные фрагменты, последовательность аминокислот в которых может быть точно
определена описанными ранее методами.
Эти методы основаны на применении реактивов, которые вызывают селективный, высокоспецифический разрыв пептидных связей,
образованных определенными аминокислотами, оставляя незатронутыми остальные пептидные связи. К этим избирательно
гидролизующим веществам относятся цианогенбромид, CNBr (по остаткам метионина), гидроксиламин (по связям между
остатками аспарагиновой кислоты и глицина), N-бромсукцинамид (по остаткам триптофана).
601-800
9
370
13
Ферментативные методы гидролиза основаны на избирательности действия протеолитических ферментов, расщепляющих
пептидные связи, образованные определенными аминокислотами. В частности, пепсин ускоряет гидролиз связей, образованных
остатками фенилаланина, тирозина и глутаминовой кислоты, трипсин – аргинина и лизина, химотрипсин – триптофана, тирозина и
фенилаланина.
В результате полипептидная цепь расщепляется на мелкие пептиды, содержащие иногда всего несколько аминокислот, которые
отделяют друг от друга сочетанными электрофоретическими и хроматографическими методами, получая своеобразные пептидные
карты.
Далее определяют чередование аминокислот в каждом индивидуальном пептиде.



 chemistry
chemistry








