Similar presentations:
Инструментальные методы исследования органических веществ
1.
Федоров Сергей ВладимировичИнструментальные методы
исследования органических
веществ
2.
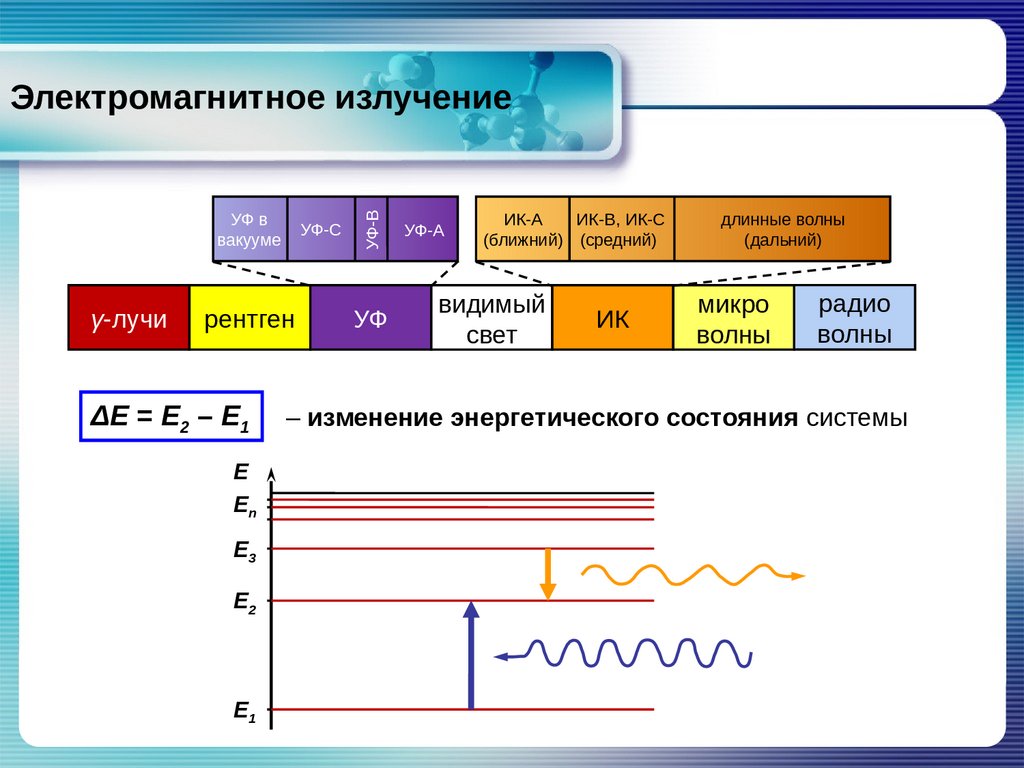
Спектроскопические методы3.
УФ ввакууме
γ-лучи
УФ-С
рентген
ΔЕ = Е2 – Е1
Е
Еn
Е3
Е2
Е1
УФ-В
Электромагнитное излучение
УФ
УФ-А
ИК-А
ИК-В, ИК-С
(ближний) (средний)
видимый
свет
ИК
длинные волны
(дальний)
микро
волны
радио
волны
– изменение энергетического состояния системы
4.
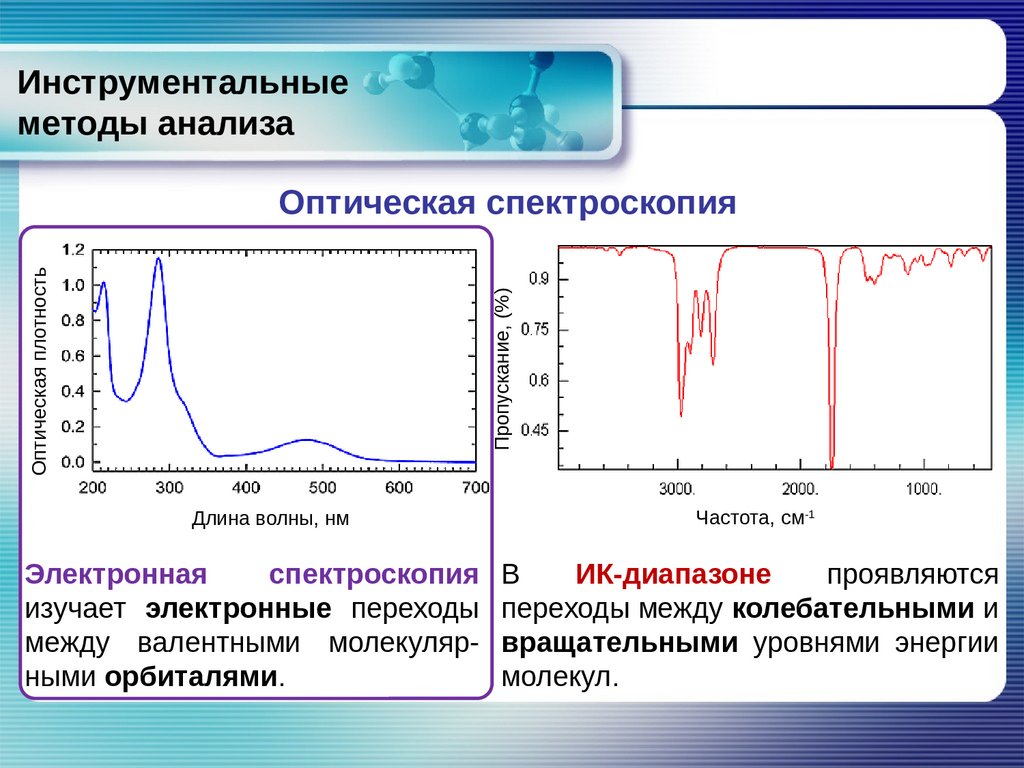
Инструментальныеметоды анализа
Пропускание, (%)
Оптическая плотность
Оптическая спектроскопия
Длина волны, нм
Электронная
спектроскопия
изучает электронные переходы
между валентными молекулярными орбиталями.
Частота, см-1
В
ИК-диапазоне
проявляются
переходы между колебательными и
вращательными уровнями энергии
молекул.
5.
Оптическая спектроскопия – УФ(часть 2)
6.
УФ спектроскопияУльтрафиолетовая
(электронная)
спектроскопия
–
раздел
оптической спектроскопии, который включает получение, исследование
и применение спектров испускания, поглощения и отражения в
ультрафиолетовой области.
Электронная спектроскопия изучает электронные переходы между
валентными молекулярными орбиталями.
Орбиталь – область наиболее вероятного местонахождения электрона
в атоме (атомная орбиталь) или в молекуле (молекулярная
орбиталь).
В зависимости от строения, молекула органического соединения
может содержать три типа молекулярных орбиталей:
, ;
*,
*;n
7.
УФ спектроскопияЭлектронные переходы
Е
→
*,
→
*, n→
*, n→
*
* - МО
* - МО
*
*
n
*
n
n - МО
DE (
→
*) > DE (n→
*)
D E (
→
*) > DE (n→
*)
*
Е
- МО
- МО
Разрыхляющие
МО
l (
→
*) < l (n→
*)
l (
→
*) < l (n→
*)
n (
→
*) > n (n→
*) n (
→
*) > n (n→
*)
Связывающие
МО
E = hn = hc/l
с – скорость света в вакууме (3*108 м/с)
h – постоянная Планка (6.63*10–34 Дж*с)
8.
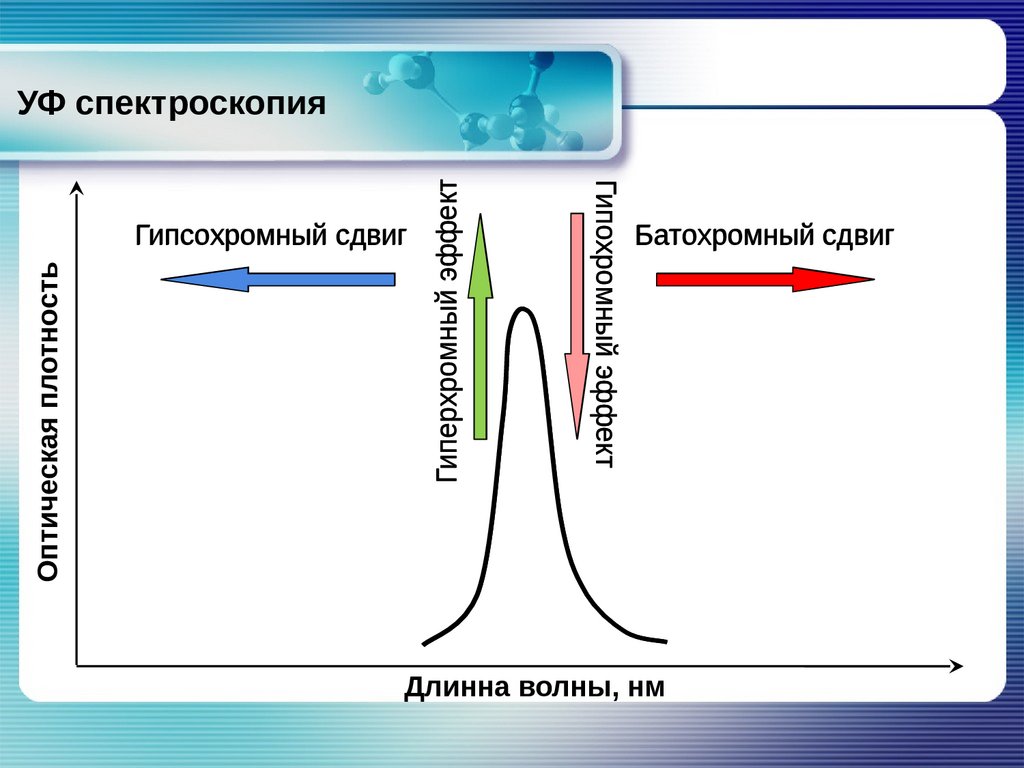
Оптическая плотностьГипохромный эффект
Гипсохромный сдвиг
Гиперхромный эффект
УФ спектроскопия
Батохромный сдвиг
Длинна волны, нм
9.
УФ спектроскопияОсновные хромофорные группы
Тип перехода
max
нитрилы
n→π*
160
алкины
π→π*
170
алкены
π→π*
175
спирты, простые эфир
n→σ*
180
π→π*
180
n→π*
280
π→π*
190
n→π*
290
амины
n→σ*
190
кислоты, сложные эфиры
n→π*
205
амиды, тиоспирты
n→π*
210
нитросоединения
n→π*
271
азосоединения
n→π*
340
Хромофор
кетоны
альдегиды
10.
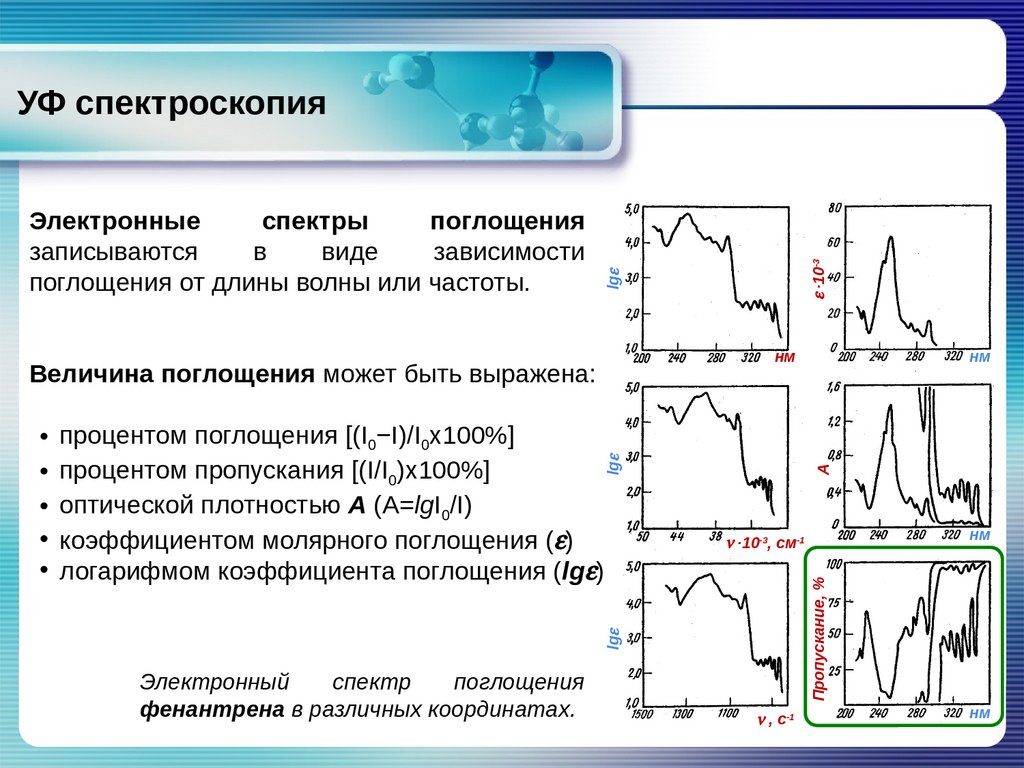
lgeЭлектронные
спектры
поглощения
записываются
в
виде
зависимости
поглощения от длины волны или частоты.
e ∙10-3
УФ спектроскопия
нм
Величина поглощения может быть выражена:
A
lge
• процентом поглощения [(I0−I)/I0х100%]
• процентом пропускания [(I/I0)х100%]
• оптической плотностью А (А=lgI0/I)
• коэффициентом молярного поглощения (e)
• логарифмом коэффициента поглощения (lge)
нм
Пропускание, %
n ∙10-3, см-1
lge
Электронный
спектр
поглощения
фенантрена в различных координатах.
нм
n , с-1
нм
11.
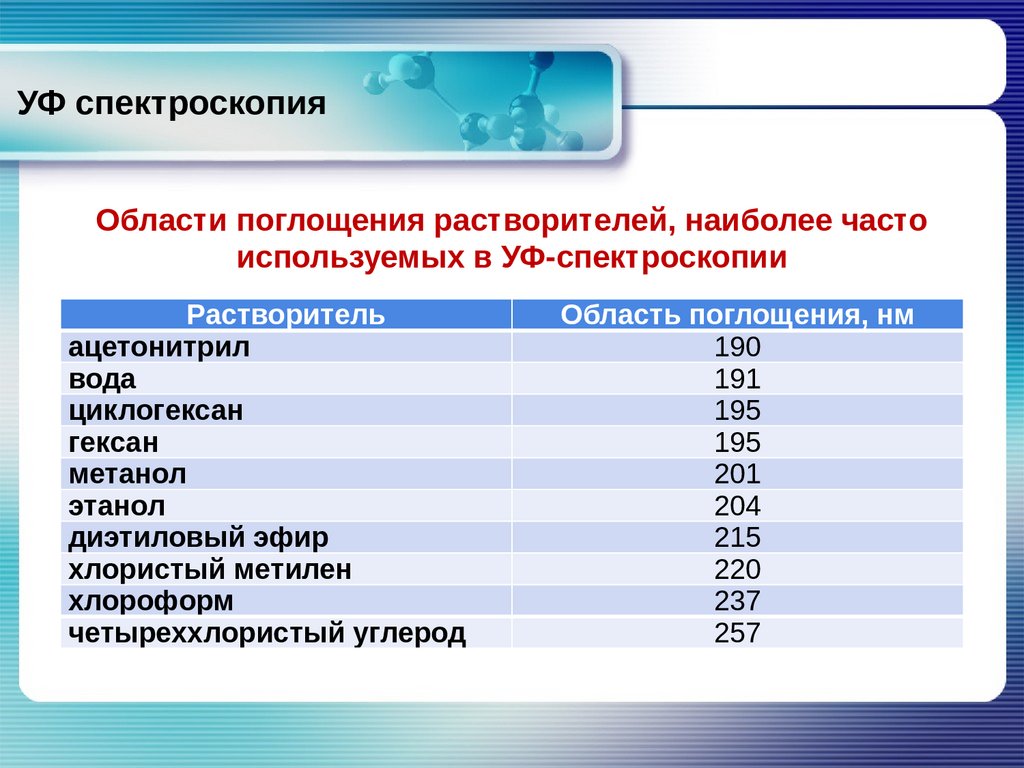
УФ спектроскопияОбласти поглощения растворителей, наиболее часто
используемых в УФ-спектроскопии
Растворитель
ацетонитрил
вода
циклогексан
гексан
метанол
этанол
диэтиловый эфир
хлористый метилен
хлороформ
четыреххлористый углерод
Область поглощения, нм
190
191
195
195
201
204
215
220
237
257
12.
УФ спектроскопияЭлектронные переходы
→
*
Электронные переходы
→
* имеют наибольшую энергию и
характерны для всех классов органических соединений. Однако, как
единственный тип электронного перехода встречаются только в
насыщенных углеводородах.
Для всех органических соединений, полосы
переходов находятся в области вакуумного УФ.
поглощения
→
*
Полосы поглощения обладают средней интенсивностью.
Полосы поглощения
→
* переходов для анализа не используются и
имеют наименьшую характеристичность.
13.
УФ спектроскопияЭлектронные переходы n→
*
Электронные переходы n→
* имеют меньшую энергию, чем
→
*
переходы.
Большинство полос n→
* переходов попадают в дальнюю УФ
область.
Длины волн максимумов полос
находятся в диапазоне 150-250 нм.
поглощения
n→
* переходов
Обладают от средней до высокой интенсивности.
Как правило,
размытые.
полосы
n→
* переходов
довольно
широкие
и
Переходы n→
* характерны для органических молекул, содержащих
гетероатомы с неподеленной электронной парой.
14.
УФ спектроскопияЭлектронные переходы
→
*
Электронные переходы
→
* можно наблюдать
ненасыщенных органических соединений.
в
спектрах
всех
Переходы данного типа обладают высокой интенсивностью.
В несопряжённых системах переходы
→
* близки по энергии с n→
*
переходами, поэтому они также, в основном, регистрируются в вакуумной
УФ области.
Характеристики
→
* переходов в простых хромофорах
Хромофор
С=С
С≡С
C=O
С=N
С≡N
N=O
lмакс, нм
173 – 195
173 – 190
155 – 187
~190
100 – 180
200
lge
3.9 – 4.1
3.3 – 3.6
3.0 – 4.4
2.0 – 3.0
–
~3.7
15.
УФ спектроскопияЭлектронные переходы
→
*
Для электронной спектроскопии большее значение имеют
→
*
электронные переходы в молекулах с сопряжёнными кратными
связями.
Переходы
→
* в сопряжённых системах иногда имеют тонкую
колебательную структуру.
В сопряженных системах полосы поглощения обладают гораздо
большей интенсивностью, чем в несопряженных.
При смене неполярного растворителя на полярный полосы
→
*
переходов сдвигаются батохромно.
16.
УФ спектроскопиявода эфир
диэтиловый
метанол
этанол
Батохромный сдвиг полосы
p
p*
при
увеличении
полярности растворителя
230
237
238
244
l, нм
17.
УФ спектроскопияЭлектронные переходы
→
*
К типичным хромофорам, для которых характерны
→
* переходы, относятся ароматические системы.
Для них наблюдается три полосы, соответствующие
→
* переходам:
две высокой интенсивности и одна (самая
длинноволновая) средней.
Например:
В спектре бензола наблюдаются полосы с lмакс:
• 180 нм (e 60000 л/моль•см)
• 204 нм (e 7400 л/моль•см) (тонкая структура)
• 254 нм (e 204 л/моль•см) (тонкая структура)
180
204
бензол
254
18.
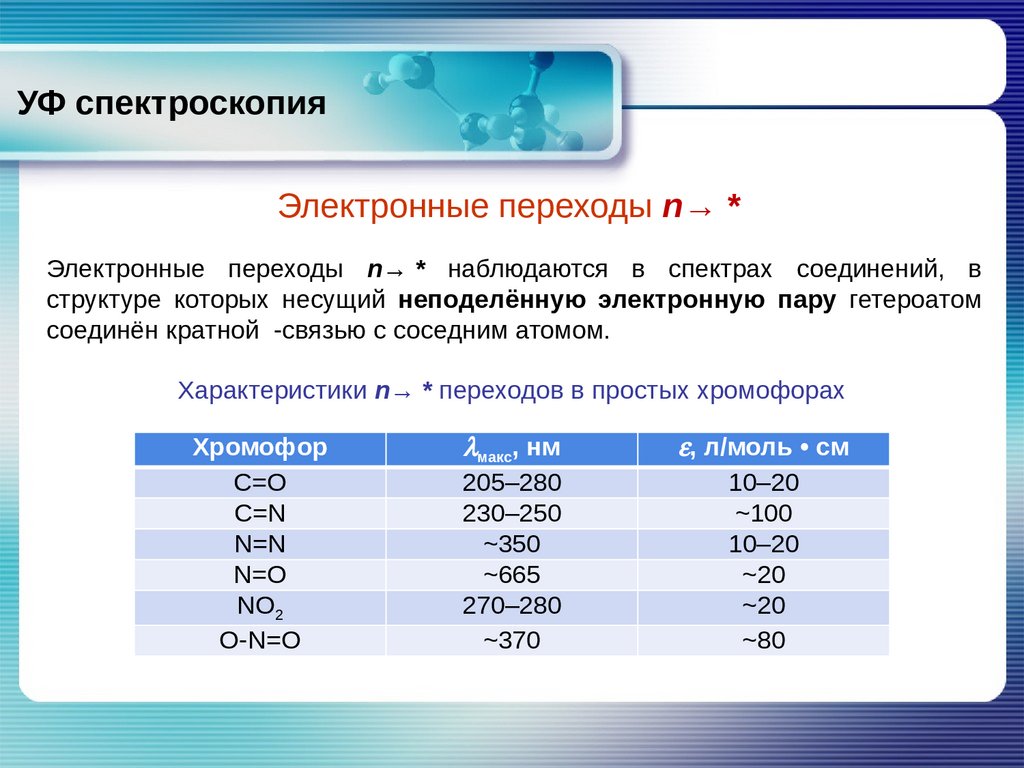
УФ спектроскопияЭлектронные переходы n→
*
Электронные переходы n→
* наблюдаются в спектрах соединений, в
структуре которых несущий неподелённую электронную пару гетероатом
соединён кратной
-связью с соседним атомом.
Характеристики n→
* переходов в простых хромофорах
Хромофор
C=O
С=N
N=N
N=O
NO2
О-N=O
lмакс, нм
205–280
230–250
~350
~665
270–280
~370
e, л/моль • см
10–20
~100
10–20
~20
~20
~80
19.
УФ спектроскопияЭлектронные переходы n→
*
Переходы n→
* имеют наименьшую энергию из всех видов электронных
переходов.
Полосы поглощения в УФ-спектре являются малоинтенсивными.
Полосы поглощения n→
* переходов обычно находятся в области, не
закрытой полосами остальных переходов – lмакс > 250 нм.
Ауксохромы с неподеленной электронной парой вызывают гипсохромный
сдвиг n→
* полос поглощения; алкильные заместители – батохромный.
Переходы n→
* типа, наряду с
→
* переходами в сопряжённых системах,
составляют наибольшую часть всех практически значимых переходов в
электронной спектроскопии.
Распознать полосу n→
* перехода можно по гипсохромному сдвигу при
смене неполярного растворителя на полярный или по исчезновению
полосы поглощения при регистрации спектра в кислой среде.
20.
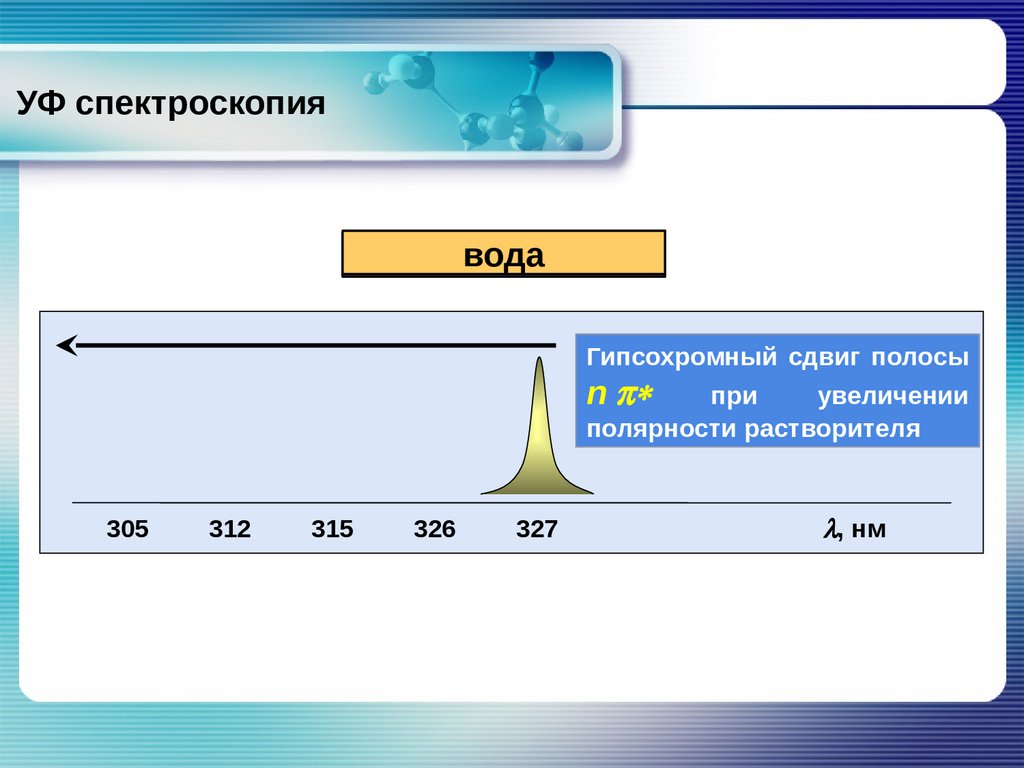
УФ спектроскопиявода эфир
диэтиловый
метанол
этанол
гексан
Гипсохромный сдвиг полосы
n
p*
при
увеличении
полярности растворителя
305
312
315
326
327
l, нм
21.
s–связи:УФ спектроскопия
Электронные спектры поглощения основных классов
органических соединений
Предельные углеводороды
C
s→s*
R
Соответствующие полосы поглощения лежат в дальнем УФ:
• метан – 122 нм
H2C CH2
циклопропан
• этан
–
135 нм
C
lмакс – 190 нм
• алканы – < 150 нм
H2
H
H
H H
H H
H
H
CH3
CH2
кубан
lмакс – ~300 нм
Насыщенные углеводороды с гетероатомами (О, S, N, галоген)
(
→
*), нм
Соединение
CH3OH
150
(CH3)2O
150
CH3NH2
170
(C2H5)3N
199
C2H5SH
192
CH3Cl
150
(n→
*), нм
183
184
215
227
225
173
s→s* и n→s*
В
области
200-800
нм
большинство
углеводородов и их производных «прозрачны»,
что позволяет использовать их в качестве
растворителей.
Для функциональных производных эта область:
250-800 нм.
22.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Ненасыщенные соединения – этилены
s→s*, p→p*
C
C
H
Алкильные заместители в этилене смещают p→p* полосу поглощения в
красную область, и с ростом числа алкильных заместителей величина
батохромного сдвига увеличивается.
Система
С=С
С=С–С=С
С=С–С=С–С=С
(–С=С–)4
(–С=С–)11
С=С–С≡С
С=С–С≡C–С=С
циклические
Соединение
этилен
1,3-бутадиен
гексатриен-1,3,5
декатетраен-2,4,6,8
ликопин
винилацетилен
окта-3,7-диен-5-ин-2-ол
циклопентадиен
lмакс, нм
162
217
256
310
504
219
237
238
eмакс
10000
21000
22400
76500
170000
6500
17000
3400
Сопряжение проявляется в УФ-спектрах батохромным сдвигом для полосы
p→p* перехода.
23.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Сопряженные полиеновые хромофоры
бутадиен-1,3
гексатриен-1,3,5
октатетраен-1,3,5,7
lмакс = 218 нм
e ~ 2,3*104
lмакс = 257 нм
e ~ 4,3*104
lмакс = 290 нм
e ~ 6*104
b-каротин
(11 сопряженных фрагментов >C=C<)
lмакс = 453 нм (оранжевый цвет)
e ~ 4,3*105
24.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Природные каротиноидные пигменты
OH
HO
лютеин (яичный желток)
желтый цвет
lмакс = 430 нм
b-каротин (морковь)
оранжевый цвет
lмакс = 453 нм
ликопин (томаты, шиповник)
красный цвет
lмакс = 500 нм
25.
УФ спектроскопияЭлектронные переходы в сопряженных системах
H
2*
*
H
H
1*
НСМО
D Е2
l2 217 нм
ВЗМО
H
D Е1
l1 162 нм
2
ВЗМО
СН2=СН2
СН2=СН2
1
HC
H2 C
CH
CH2
H
H
* НСМО
DЕ 1
H
H
этилен
H
H
1,3-бутадиен
Соединение
Этилен
1,3-Бутадиен
D Е2 < D Е1
l2 > l1
n1 > n2
Электронные переходы
→
* в молекулах этилена и бутадиена-1,3
lмакс, нм
162
217
26.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Ненасыщенные соединения
Зависимость положения полос поглощения сопряженных диенов от
структуры соединения позволила вывести эмпирические правила, с
помощью которых можно определить lмакс диеновых соединений.
Значения положения максимумов полос поглощения (lмакс),
обусловленных
→
* переходами, некоторых хромофоров можно
рассчитать теоретически.
27.
УФ спектроскопияПравила Вудворда-Физера
Правила Вудворда-Физера представляют собой аддитивную схему,
в которой есть базовый хромофор, а каждому структурному
фрагменту приписан соответствующий инкремент li.
Расчёт значения максимума полосы поглощения lмакс проводится
путём прибавления инкрементов li к значению l0, отвечающему
базовому хромофору:
lмакс = l0 +
li
28.
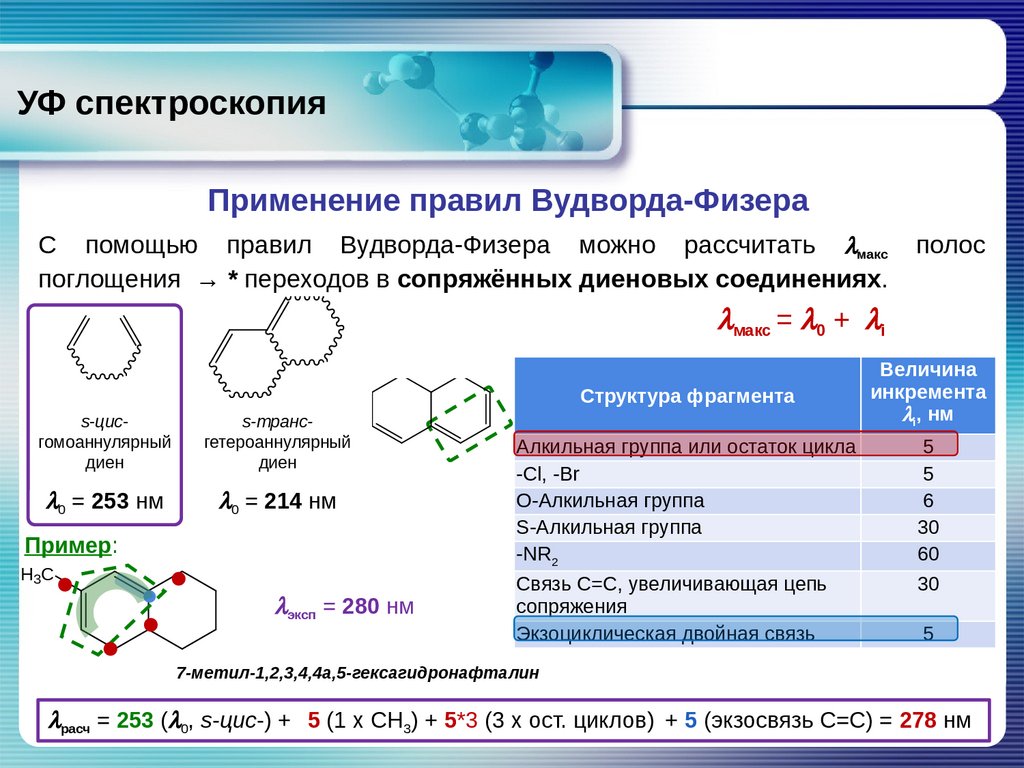
УФ спектроскопияПрименение правил Вудворда-Физера
С помощью правил Вудворда-Физера можно рассчитать lмакс
поглощения
→
* переходов в сопряжённых диеновых соединениях.
полос
lмакс = l0 +
li
Структура фрагмента
s-цисгомоаннулярный
диен
s-трансгетероаннулярный
диен
l0 = 253 нм
l0 = 214 нм
Пример:
H3 C
lэксп = 280 нм
Алкильная группа или остаток цикла
-Cl, -Br
O-Алкильная группа
S-Алкильная группа
-NR2
Связь C=C, увеличивающая цепь
сопряжения
Экзоциклическая двойная связь
Величина
инкремента
li, нм
5
5
6
30
60
30
5
7-метил-1,2,3,4,4a,5-гексагидронафталин
lрасч = 253 (l0, s-цис-) + 5 (1 x CH3) + 5*3 (3 x ост. циклов) + 5 (экзосвязь C=C) = 278 нм
29.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Ненасыщенные соединения – ацетилены
C
C
H
Для ацетиленовых углеводородов с изолированной С≡С связью
наблюдается полоса поглощения
→
* перехода.
Сопряжение тройных связей также приводит к батохромному и
гиперхромному смещению полос поглощения.
Полосы поглощения полиинов также имеют колебательную
структуру.
30.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Ненасыщенные соединения
C
C
H
Сопряжённые полииновые хромофоры
H
H
H
ацетилен
lмакс = 173 нм
H
диацетилен
lмакс = 235 нм
Dl = 62 нм
H3C
3
CH3
октатрин-2,4,6
lмакс = 286 нм
Dl = 51 нм
Сопряжение проявляется в УФ-спектрах батохромным сдвигом для
полосы
→
* перехода.
31.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Карбонилсодержащие соединения
n→p*, n→s*, p→p*
Обнаруживается в УФ-спектре по полосе n→p* перехода.
Положение чувствительно
характеру заместителей R.
O
H
C
R
к
полярности
растворителя
и
В полярных растворителях (особенно склонных к образованию
водородных связей) эта полоса смещается гипсохромно.
Соединение
O
Замена
Н-атома
другими
заместителями R также приводит к
гипсохромному сдвигу.
H
C
H
O
H3C
C
H
O
H3C
C
CH3
lмакс, нм
e макс
295
10
290
16,6
279
14,8
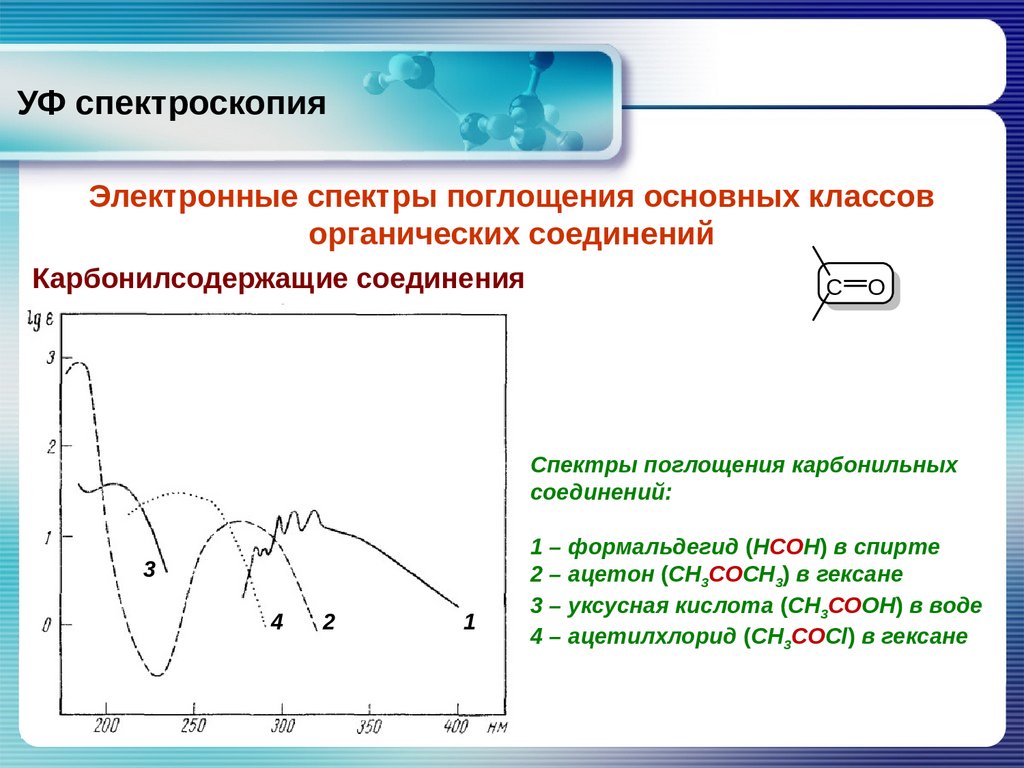
32.
УФ спектроскопияЭлектронные спектры поглощения основных классов
органических соединений
Карбонилсодержащие соединения
C
O
Спектры поглощения карбонильных
соединений:
3
4
2
1
1 – формальдегид (НСОН) в спирте
2 – ацетон (СН3СОСН3) в гексане
3 – уксусная кислота (СН3СООН) в воде
4 – ацетилхлорид (СН3СОСl) в гексане
33.
УФ спектроскопия34.
CУФ спектроскопия
H
Электронные спектры поглощения основных классов
органических соединений
Ароматические соединения
Полоса бензольного поглощения
p→p*
180
204
бензол
На положение полосы поглощения значительное
влияние оказывают заместители и растворители.
Влияния
заместителей
на
положение
полосы
поглощения ароматических соединений определяется
характером заместителя.
Монозамещенные бензола как с донорными, так и с
акцепторными группами имеют полосы поглощения в
более длинноволновой области спектра, чем бензол.
254
35.
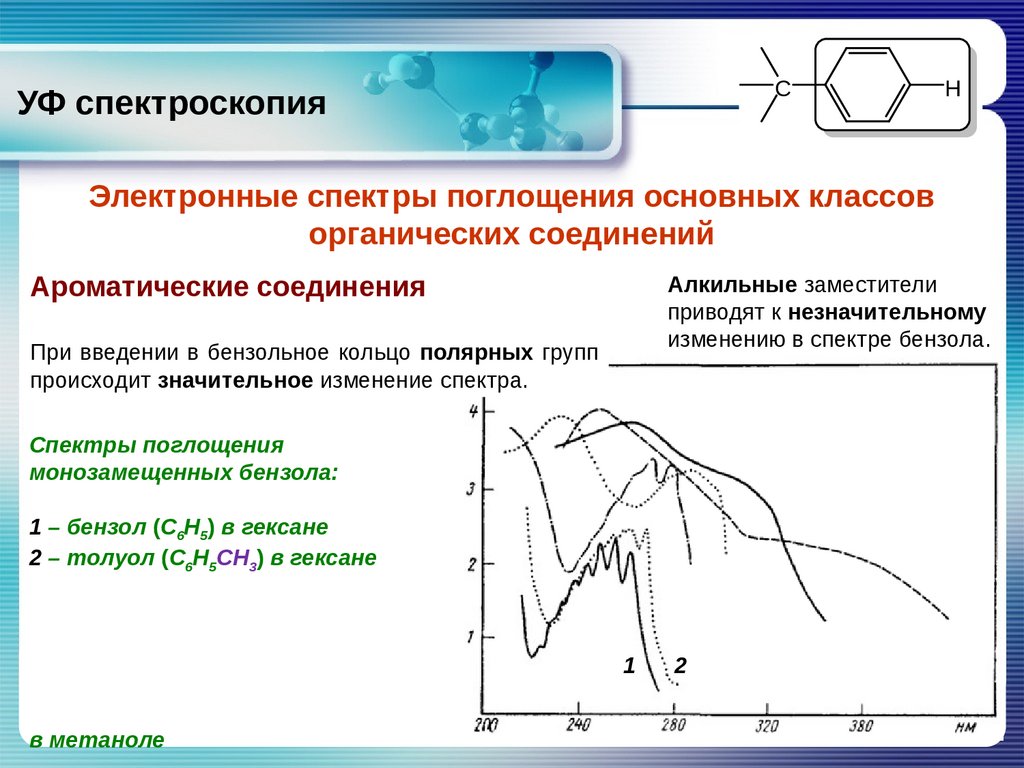
CУФ спектроскопия
H
Электронные спектры поглощения основных классов
органических соединений
Ароматические соединения
Алкильные заместители
приводят к незначительному
изменению в спектре бензола.
При введении в бензольное кольцо полярных групп
происходит значительное изменение спектра.
Спектры поглощения
монозамещенных бензола:
1 – бензол (С6Н5) в гексане
2 – толуол (С6Н5СН3) в гексане
3 – анилин (С6Н5NH2) в метаноле
4 – фенол (С6Н5ОН) в гексане
5 – нитробензол (С6Н5NО2) в гексане
6 – хлорид фенилдиазония (С6Н5N2Cl)
в метаноле
4 3
6
1
2
5
36.
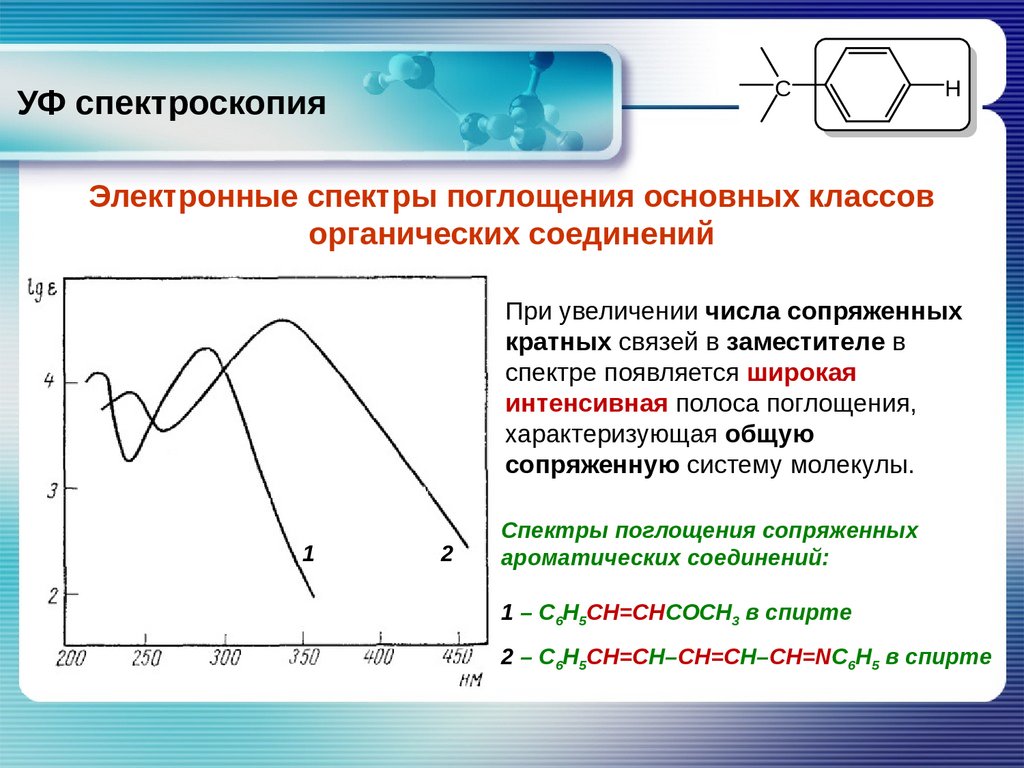
УФ спектроскопияC
H
Электронные спектры поглощения основных классов
органических соединений
Ароматические соединения
Галогенидные заместители приводят к
незначительному изменению в спектре
бензола.
Спектры поглощения моногалоидных
производных бензола в гексане:
1 – бензол
2 – хлорбензол
3 – бромбензол
4 – фторбензол
4
1 2
3
37.
CУФ спектроскопия
H
Электронные спектры поглощения основных классов
органических соединений
При увеличении числа сопряженных
кратных связей в заместителе в
спектре появляется широкая
интенсивная полоса поглощения,
характеризующая общую
сопряженную систему молекулы.
1
2
Спектры поглощения сопряженных
ароматических соединений:
1 – С6Н5СН=СНСОСН3 в спирте
2 – С6H5CH=CH–CH=CH–CH=NC6H5 в спирте
38.
УФ спектроскопия39.
УФ спектроскопия40.
УФ спектроскопияИспользование УФ-спектров при исследовании органических соединений
При практическом использовании спектров поглощения для
структурных исследований органических соединений необходимо
сравнивать спектры изучаемых объектов со спектрами веществ с
заведомо известными структурами.
Вследствие того, что в УФ-спектрах в области 800-200 нм проявляется
в основном система сопряженных кратных связей, в качестве
модельных соединений могут быть использованы спектры веществ,
имеющих такую же систему кратных связей.
При сравнении поглощения исследуемого и модельного соединений
недостаточно пользоваться только значениями длин волн
максимумов и интенсивностью в них – необходимо проводить
сравнение всей кривой поглощения.
41.
УФ спектроскопияУстройство спектрофотометра
I
0
Спектрофотометры – оборудование,кювета
предназначенное
для изучения
с
лампа
растворителем
свойств веществ посредством анализа
спектра оптического диапазона
электромагнитного
излучения,
прошедшего через образец путем
lk
l1, l2, … li
сравнения потока моносвета, изначально направленного на детектор
изучаемый
хроматор
образец, с потоком света, прошедшим через образец.
Лампа – источник УФ-излучения.
кювета с
растворенным
веществом
I
Монохроматор
–
прибор,
используется
для
пространственного разделения света различных длин волн
компьютер
Кювета – изготавливается из прозрачного в исследуемой области
спектр
материала.
Детектор – приемник излучения (фотоэлемент, фотоумножитель
или фотодиодная матрица.
42.
УФ спектроскопияУФ-лампы для спектрофотометра
43.
УФ спектроскопияМонохроматор
CaF2, LiF, кварц, стекто
призма
дифракционная решетка
44.
УФ спектроскопияМонохроматоры для работы в вакуумном УФ-диапазоне спектра
45.
УФ спектроскопияКюветы для спектрофотометра
46.
УФ спектроскопияДетекторы
47.
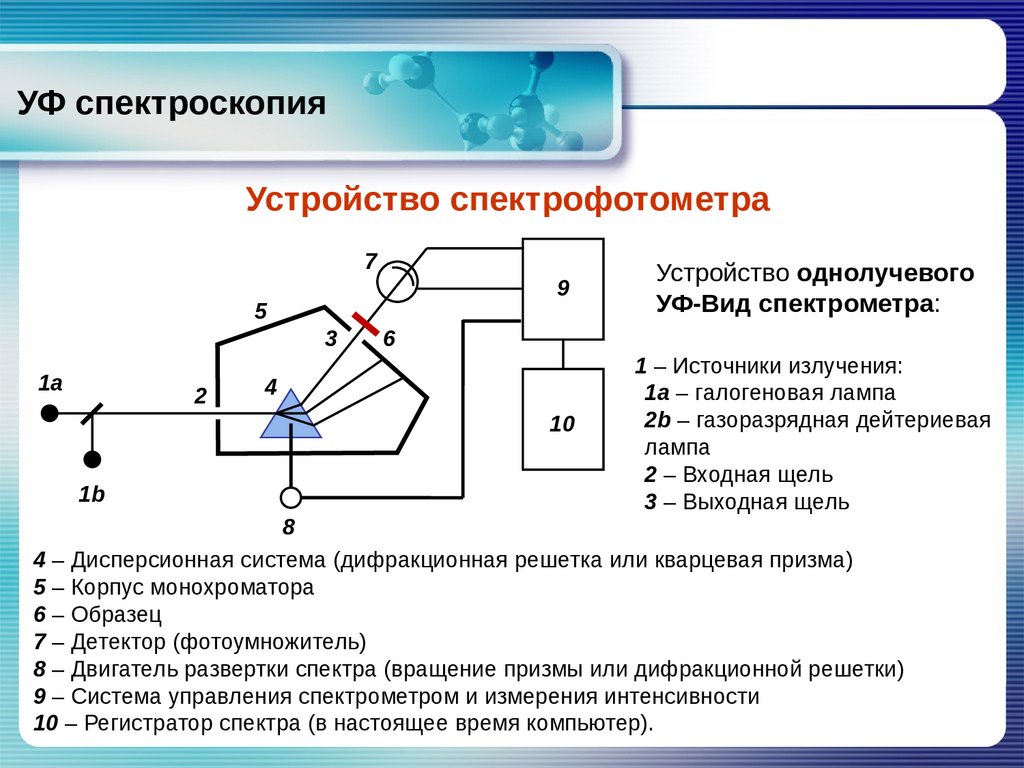
УФ спектроскопияУстройство спектрофотометра
7
5
1a
2
1b
3
9
Устройство однолучевого
УФ‐Вид спектрометра:
10
1 – Источники излучения:
1а – галогеновая лампа
2b – газоразрядная дейтериевая
лампа
2 – Входная щель
3 – Выходная щель
6
4
8
4 – Дисперсионная система (дифракционная решетка или кварцевая призма)
5 – Корпус монохроматора
6 – Образец
7 – Детектор (фотоумножитель)
8 – Двигатель развертки спектра (вращение призмы или дифракционной решетки)
9 – Система управления спектрометром и измерения интенсивности
10 – Регистратор спектра (в настоящее время компьютер).
48.
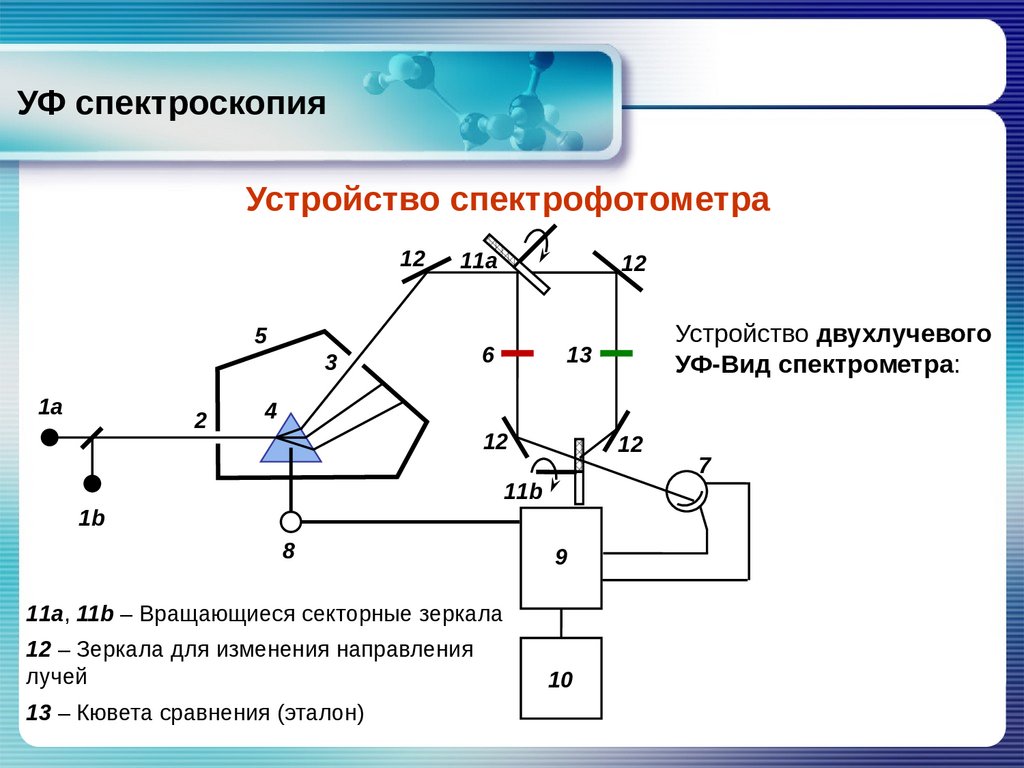
УФ спектроскопияУстройство спектрофотометра
12
5
1a
2
11a
3
12
6
Устройство двухлучевого
УФ‐Вид спектрометра:
13
4
12
12
11b
1b
8
9
11a, 11b – Вращающиеся секторные зеркала
12 – Зеркала для изменения направления
лучей
13 – Кювета сравнения (эталон)
10
7
49.
УФ спектроскопияСпектрофотометр для работы в УФ и видимом диапазоне спектра
Спектрофотометр СФ-46
50.
УФ спектроскопияСпектрофотометр для работы в УФ и видимом диапазоне спектра
51.
УФ спектроскопияСпектрофотометр для работы в УФ и видимом диапазоне спектра
52.
УФ спектроскопияУФ спектрофотометр ПЭ-5400УФ
53.
УФ спектроскопияУФ спектрофотометр LEKI SS2109UV
54.
УФ спектроскопияСпектрофотометр двухлучевой для работы в УФ и видимом
диапазоне спектра Shimadzu UV-1800
55.
УФ спектроскопияУФ-спектрофотометр Evolution 600
56.
УФ спектроскопияУФ-спектрофотометр PerkinElmer Lambda 35 в ИрИХ СО РАН
57.
Потренируемся!Определение концентрации вещества
Задача. Рассчитайте количество (г) бензола в 100 л этанольного
раствора, если известны следующие характеристики электронного
спектра данного раствора: lмакс 260 нм, А = 0.0295, e = 230, длина
кюветы L = 1 см.
Решение.
А = ∙L∙c
с = А/( ∙L) = 0.0295/230∙1 = 0.0001 моль/л.
Ответ.
В 100 л этанола содержится 0.01 моль бензола – 0.78 г.
58.
Потренируемся!H3C
CH3
C
H3C
C
H
C
O
мезитил
1 2
3
Задача.
УФ-спектр снимали в воде, гексане,
спирте.
Определить
какому
растворителю
принадлежат кривые сканирования 1, 2, 3?
Решение.
С увеличением полярности растворителя
максимум
полосы
поглощения
n→
*
перехода смещается в коротковолновую
область (гипсохромный сдвиг).
Ответ.
1 – вода, 2 – спирт, 3 – гексан
59.
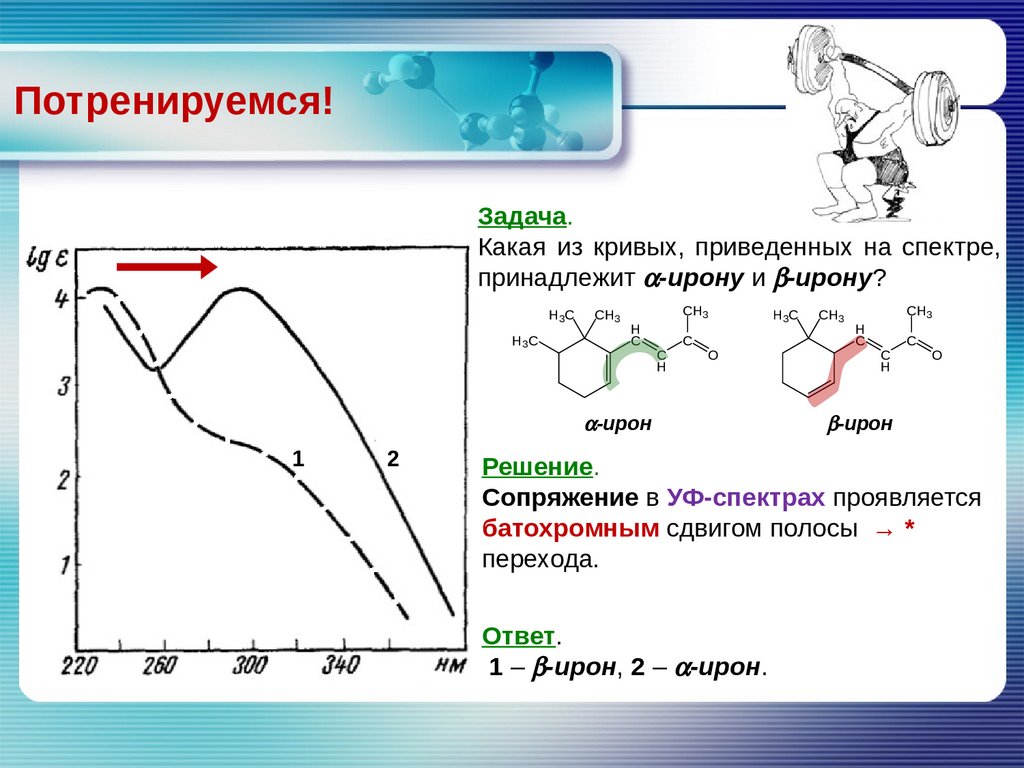
Потренируемся!Задача.
Какая из кривых, приведенных на спектре,
принадлежит a-ирону и b-ирону?
H3C
H3C
CH3
H
C
CH3
C
H
C
O
a-ирон
1
2
H 3C
CH3
H
C
CH3
C
H
C
O
b-ирон
Решение.
Сопряжение в УФ-спектрах проявляется
батохромным сдвигом полосы
→
*
перехода.
Ответ.
1 – b-ирон, 2 – a-ирон.
60.
Потренируемся!Задача.
На рисунке приведены спектры поглощения:
пропенилбензола (С6Н5СН=СНСН3)
аллилбензола (С6Н5СН2СН=СН2)
1-фенилпентадиена-1,3 (С6Н5СН=СН-СН=СНСН3)
Какому соединению принадлежит каждая кривая?
2
1
3
Решение.
С удлинением сопряженной цепи полосы
поглощения смещаются в длинноволновую
область и их интенсивность возрастает. Самая
длинная сопряженная цепь наблюдается в случае
1-фенилпентадиен-1,3 (кривая 3).
Ответ.
1 – аллилбензол, 2 – пропенилбензол, 3 – 1-фенилпентадиен-1,3.
61.
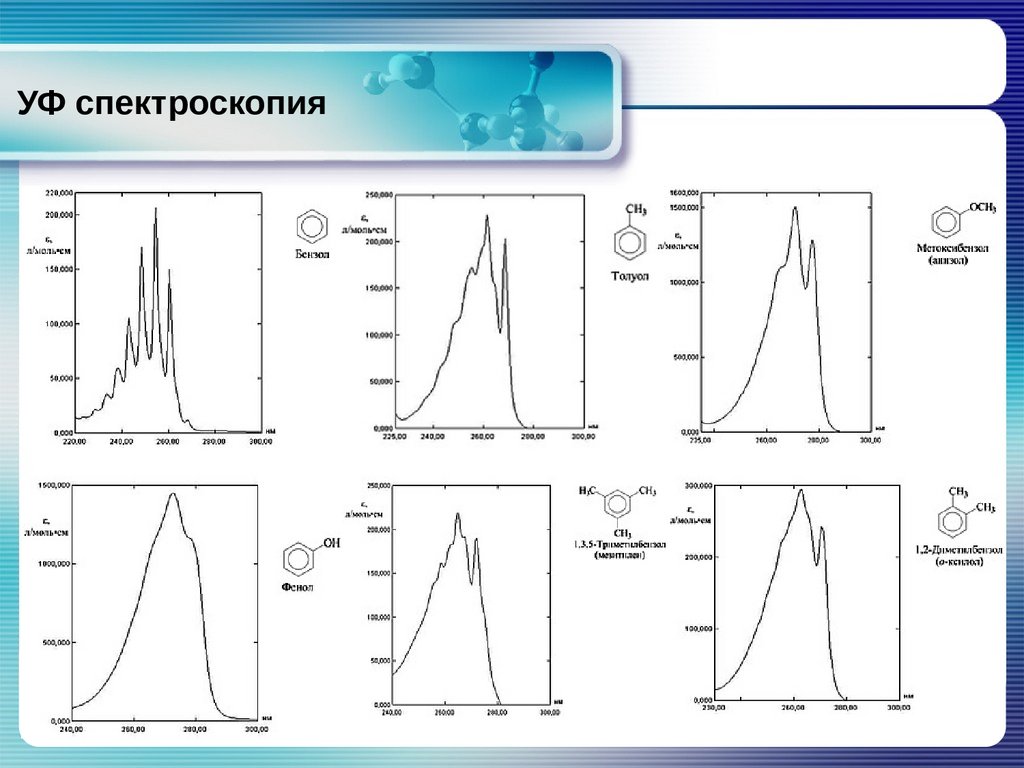
Потренируйтесь,самостоятельно!
OH
Задача:
На
рисунке
приведены
спектры
поглощения фенола в растворе гексана,
спирта и щелочном растворе.
Определите,
какому
растворителю
соответствует каждая кривая?
62.
Федоров Сергей ВладимировичИнструментальные методы
исследования органических
веществ















































 chemistry
chemistry








