Similar presentations:
Патогенность и вирулентность микроорганизмов
1.
ФГБОУ МО «Коломенский аграрный колледж имени Н.Т. Козлова»Патогенность и вирулентность
микроорганизмов.
Преподаватель, к.б.н.
Семанина Екатерина Николаевна
2.
3.
Патогенность и вирулентность• Вирулентность (индивидуальный, штаммовый
признак) – степень (количественная мера)
реализации патогенного генотипа вида
каждым конкретным штаммом по отношению
к конкретному индивидууму – хозяину.
• Патогенность (видовой признак) - это
способность
определенного
вида
микроорганизмов вызывать соответствующий
инфекционный процесс у одного или
нескольких видов организма хозяина.
4.
Факторы патогенности:• адгезия - способность прикрепляться к
клеткам макроорганизма;
• колонизация - способность размножаться и
размещаться на поверхности
эукариотических клеток;
• инвазия - способность проникать во
внутреннюю среду организма;
• агрессия - противостоять факторам защиты
организма.
5.
Экспериментальное заражениелабораторных животных (биопроба).
• для выделения из исследуемого материала
возбудителя болезни,
• испытания патогенности изучаемого
микроорганизма,
• определения эффективности вакцин, иммунных сывороток и т. д.
6.
Виды животных7.
Скарификация (накожноезаражение):
на месте заражения
предварительно
выстригают шерсть и
дезинфицируют кожу,
затем
скальпелем
делают
небольшие
надрезы кожи (насечки)
и в них втирают жесткой
щеточкой исследуемый
материал
или
бактериальную
культуру.
8.
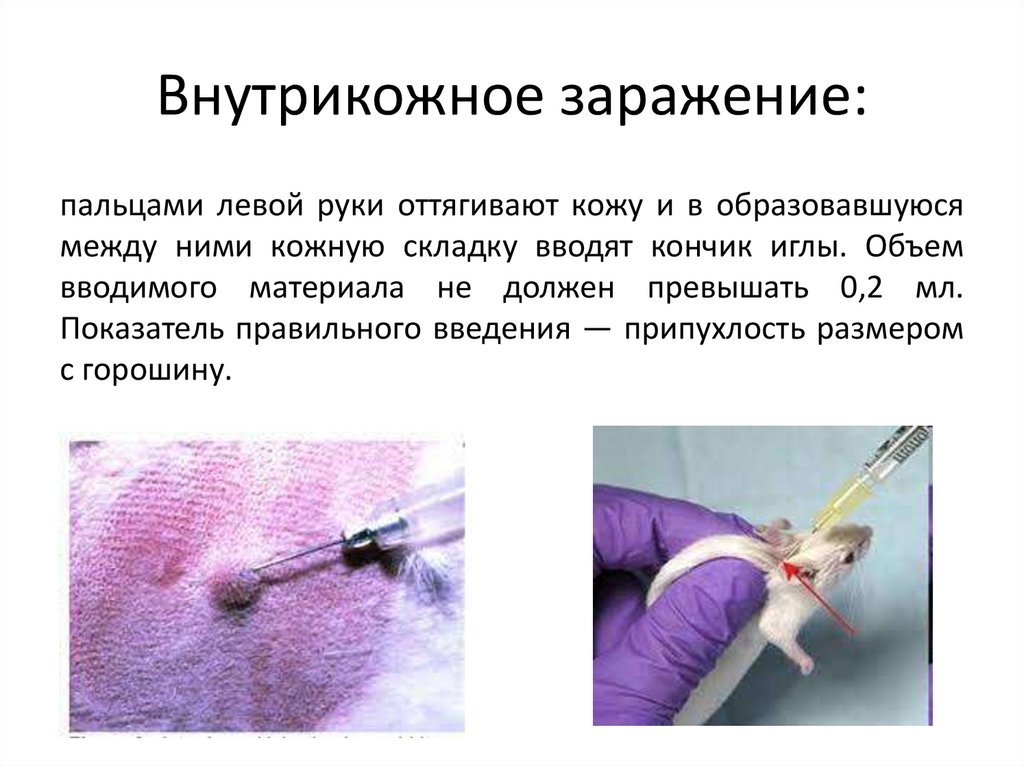
Внутрикожное заражение:пальцами левой руки оттягивают кожу и в образовавшуюся
между ними кожную складку вводят кончик иглы. Объем
вводимого материала не должен превышать 0,2 мл.
Показатель правильного введения — припухлость размером
с горошину.
9.
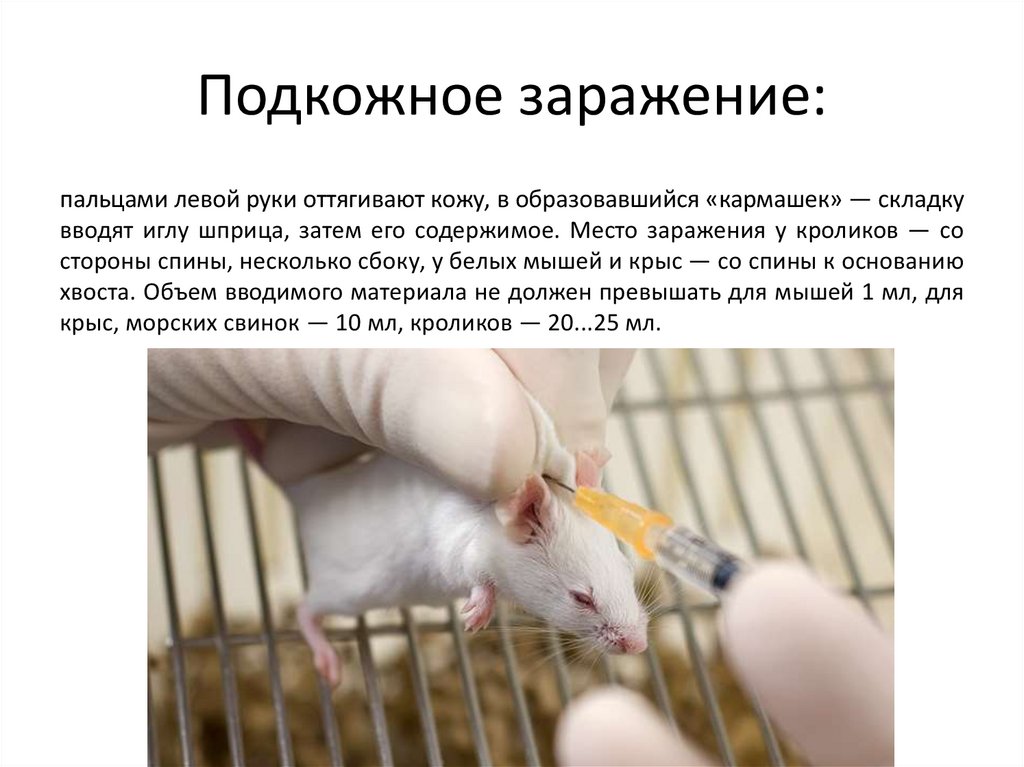
Подкожное заражение:пальцами левой руки оттягивают кожу, в образовавшийся «кармашек» — складку
вводят иглу шприца, затем его содержимое. Место заражения у кроликов — со
стороны спины, несколько сбоку, у белых мышей и крыс — со спины к основанию
хвоста. Объем вводимого материала не должен превышать для мышей 1 мл, для
крыс, морских свинок — 10 мл, кроликов — 20...25 мл.
10.
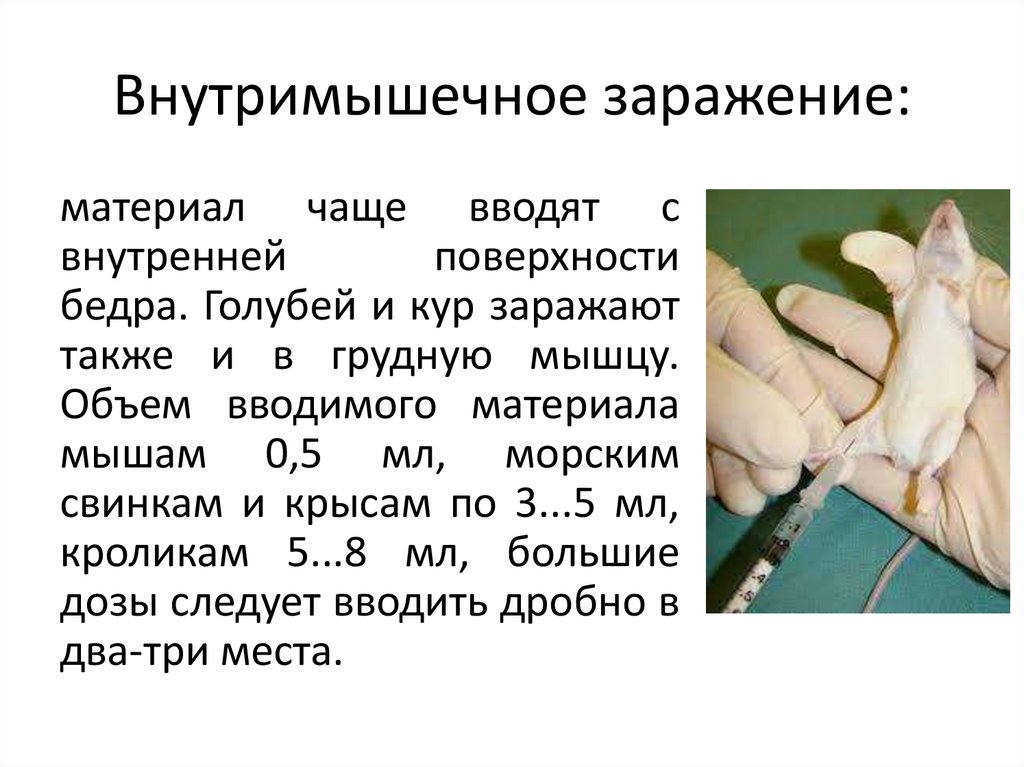
Внутримышечное заражение:материал чаще вводят с
внутренней
поверхности
бедра. Голубей и кур заражают
также и в грудную мышцу.
Объем вводимого материала
мышам 0,5 мл, морским
свинкам и крысам по 3...5 мл,
кроликам 5...8 мл, большие
дозы следует вводить дробно в
два-три места.
11.
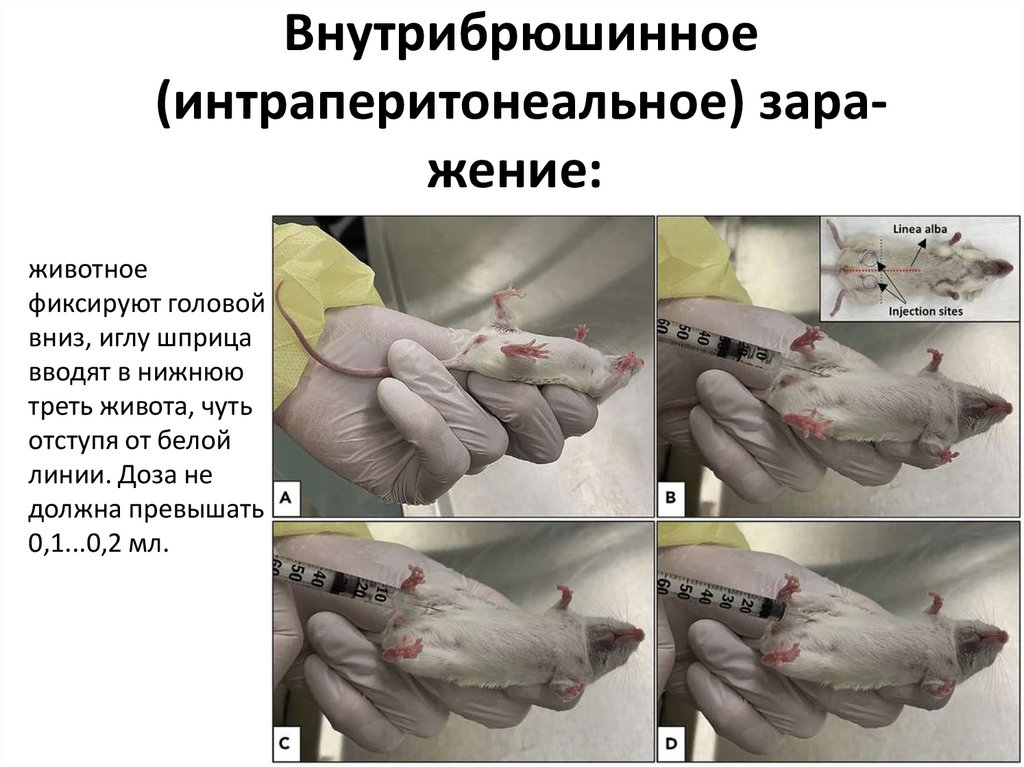
Внутрибрюшинное(интраперитонеальное) заражение:
животное
фиксируют головой
вниз, иглу шприца
вводят в нижнюю
треть живота, чуть
отступя от белой
линии. Доза не
должна превышать
0,1...0,2 мл.
12.
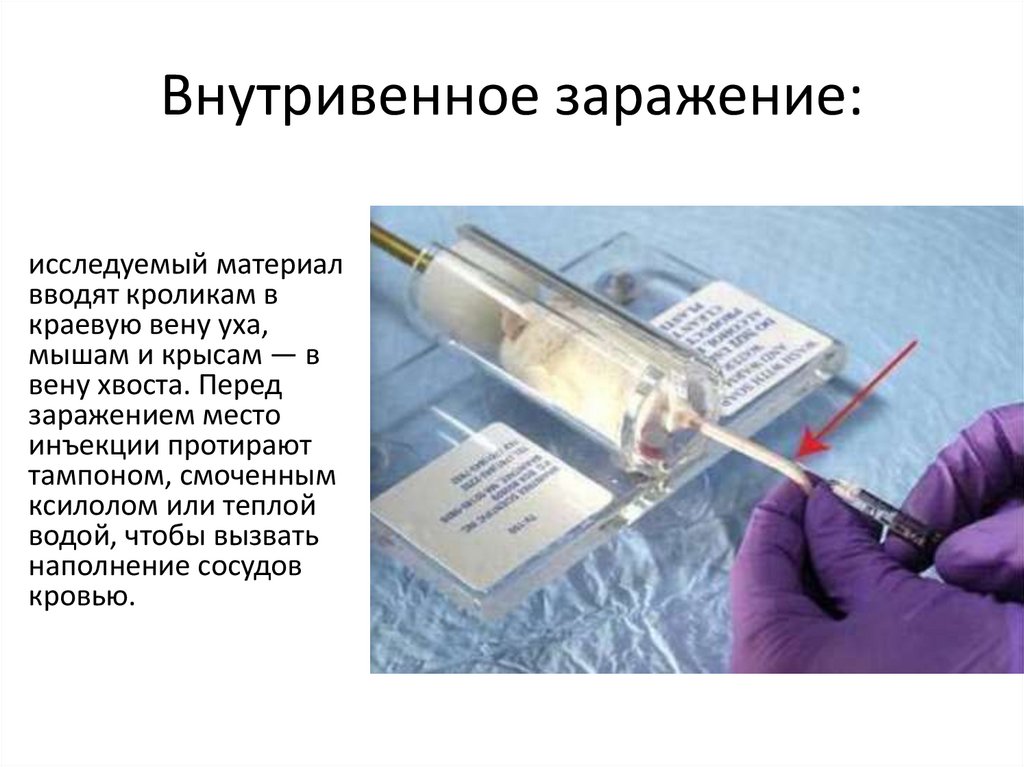
Внутривенное заражение:исследуемый материал
вводят кроликам в
краевую вену уха,
мышам и крысам — в
вену хвоста. Перед
заражением место
инъекции протирают
тампоном, смоченным
ксилолом или теплой
водой, чтобы вызвать
наполнение сосудов
кровью.
13.
Интрацеребральное заражение:животных фиксируют в положении на
спине. У кроликов трепанируют череп на
участке между надбровным углом и
черепным гребнем. Выстригают шерсть и
дезинфицируют кожу, пальцами левой
руки растягивают ее над глазницей
параллельно черепному гребню и
рассекают (края раздвигают),
крестообразно разрезают надкостницу,
маленьким трепаном прокалывают
осторожно черепную кость, осторожным
поворотом выпиливают диск и этот
небольшой кусочек кости извлекают.
Шприцем вводят 0,2 мл исследуемого
материала. После этого осторожно
соединяют края надкостницы, кожную
рану закрывают тампоном и заливают
коллодием. У мышей и крыс трепанацию
не делают, а легким проколом костной
ткани черепа вводят кончик тонкой иглы и
инъецируют материал.
14.
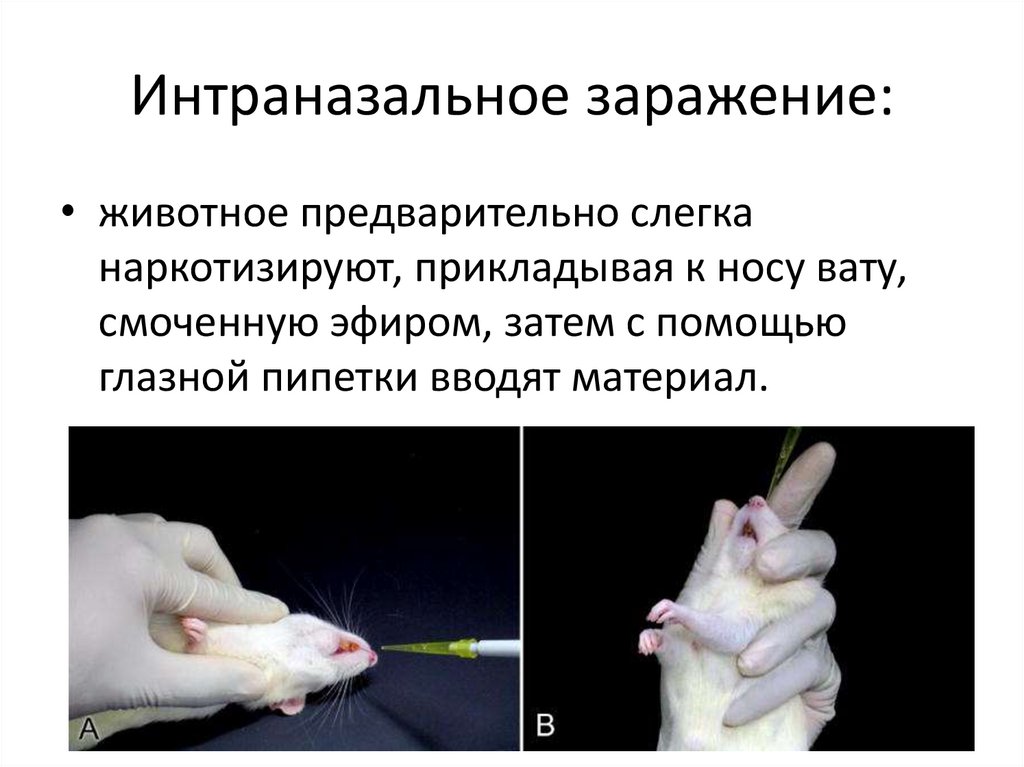
Интраназальное заражение:• животное предварительно слегка
наркотизируют, прикладывая к носу вату,
смоченную эфиром, затем с помощью
глазной пипетки вводят материал.
15.
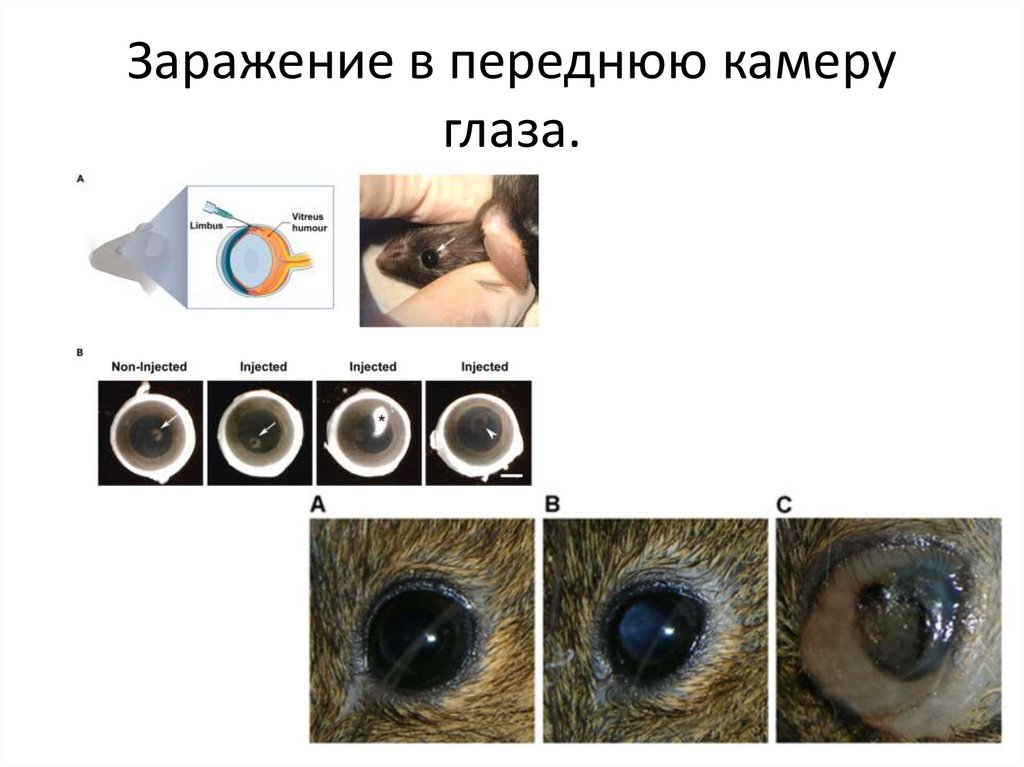
Заражение в переднюю камеруглаза.
16.
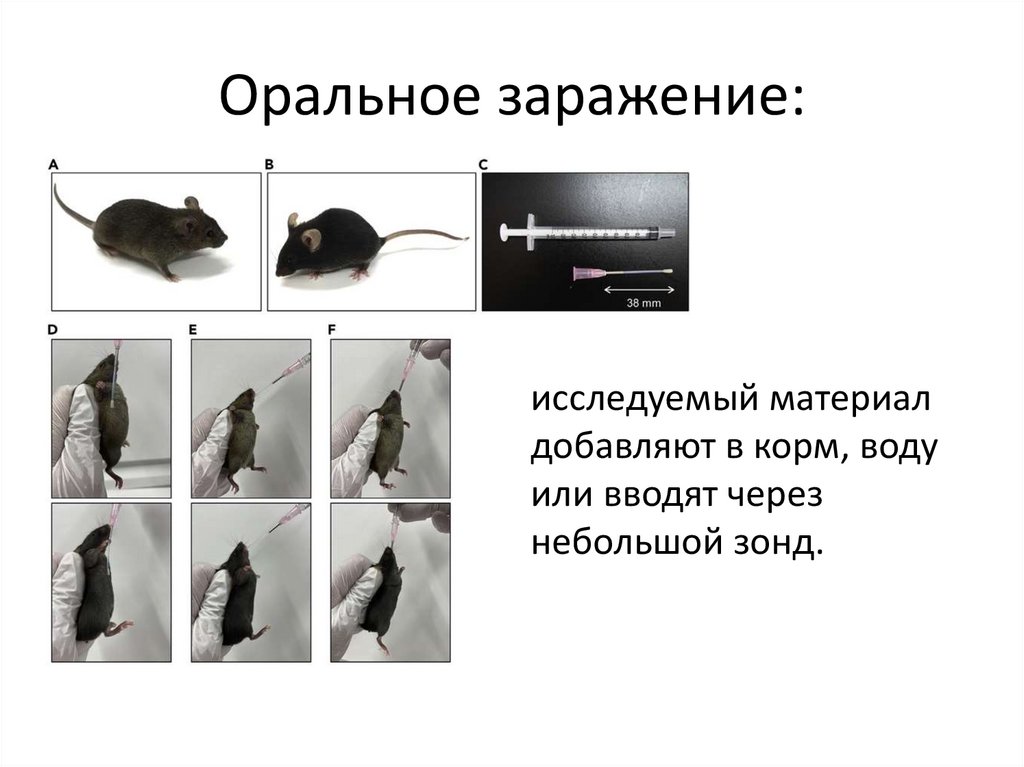
Оральное заражение:исследуемый материал
добавляют в корм, воду
или вводят через
небольшой зонд.
17.
Выявление других факторовпатогенности микроорганизмов
Заключение о патогенности микроорганизма делают как
по результатам биопробы (прямое доказательство), так и
по ряду признаков, косвенно свидетельствующих о
патогенных свойствах выделенного микроба. Наиболее
часто применяют следующие тесты.
• Тест на плазмокоагулазу.
• Тест на гиалуронидазу
• Тест на гемолизин
• Тест на фибринолизин
• Тест на лецитиназу.
• Тест на ДНК-азу.
18.
Тест на плазмокоагулазу.Коагулаза
—
фермент
бактерий
(стафилококков), который в сочетании с
некоторыми компонентами сыворотки
коагулирует плазму. Благодаря коагулазе
вокруг
стафилококковых
поражений
образуется
фибринозный
барьер,
облегчающий персистенцию бактерий в
тканях, кроме того, отложения фибрина на
поверхности
бактериальных
клеток
затрудняют их фагоцитоз.
Петлю бактериальной массы исследуемой
культуры, снятой с поверхности агаровой
среды, смешивают с 0,5 мл плазмы крови
кролика (человека), не разведенной или
разведенной
стерильным
физиологическим
раствором
в
соотношении 1 : 4, инкубируют при 37 ºС,
результаты учитывают через 4 и 24 ч.
Положительная реакция — образование
сгустка.
19.
Тест на гиалуронидазу.Гиалуронидаза
—
фермент,
расщепляющий гиалуроновую кислоту и,
как
следствие,
деполимеризующий
межклеточное вещество. На практике
используют тест декапсуляцию бактерий.
В качестве субстрата в этом случае берут
культуры бактерий, в капсульном
веществе которых есть гиалуроновая
кислота (P. multocida серовар A, S. equi).
На поверхность агара в чашке Петри
дробно засевают культуру P. multocida
или S. equi. Затем в виде линии высевают
на
поверхность
среды
культуру
микроорганизма, у которого выявляют
способность к синтезу гиалуронидазы.
Чашки с посевами инкубируют при 37 °С
16...24
ч.
Если
исследуемый
микроорганизм выделяет гиалуронидазу,
то
она
диффундирует
в
толщу
питательной среды и разрушает капсулу
тест-микроба. При анализе посевов в
косопроходящем пучке света колонии S.
equi (P. multocida) вблизи «штриха»
исследуемой культуры меньше по
размеру, серого или голубого цвета в
отличие от флуоресцирующих отдаленных колоний.
20.
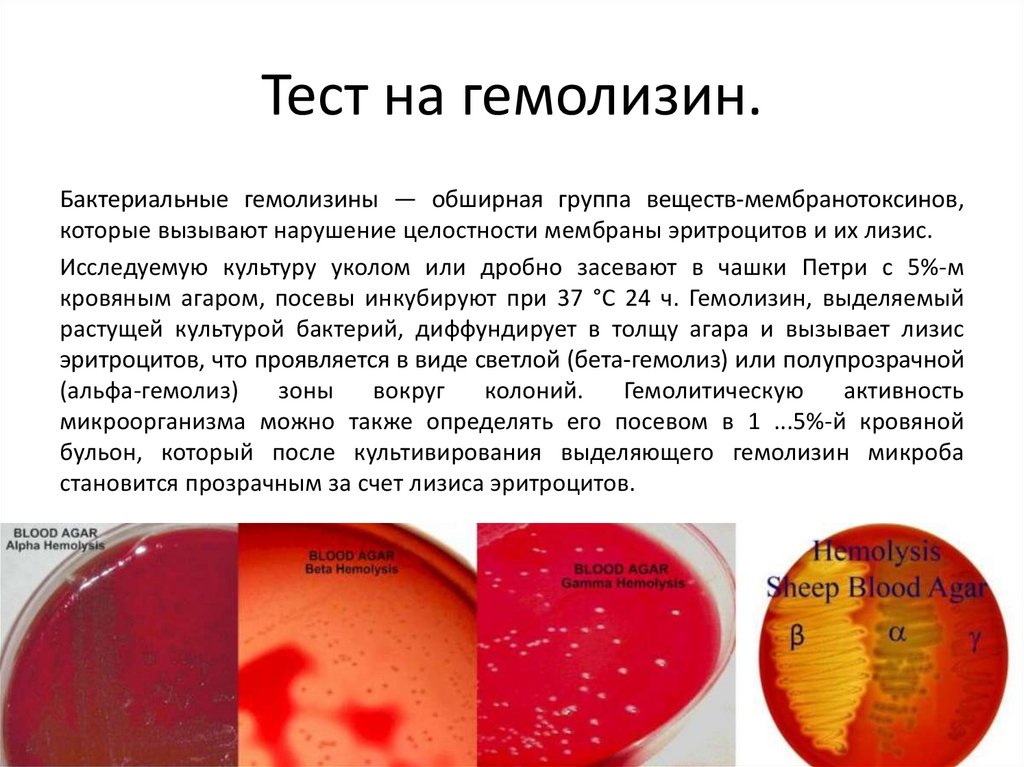
Тест на гемолизин.Бактериальные гемолизины — обширная группа веществ-мембранотоксинов,
которые вызывают нарушение целостности мембраны эритроцитов и их лизис.
Исследуемую культуру уколом или дробно засевают в чашки Петри с 5%-м
кровяным агаром, посевы инкубируют при 37 °С 24 ч. Гемолизин, выделяемый
растущей культурой бактерий, диффундирует в толщу агара и вызывает лизис
эритроцитов, что проявляется в виде светлой (бета-гемолиз) или полупрозрачной
(альфа-гемолиз)
зоны
вокруг
колоний.
Гемолитическую
активность
микроорганизма можно также определять его посевом в 1 ...5%-й кровяной
бульон, который после культивирования выделяющего гемолизин микроба
становится прозрачным за счет лизиса эритроцитов.
21.
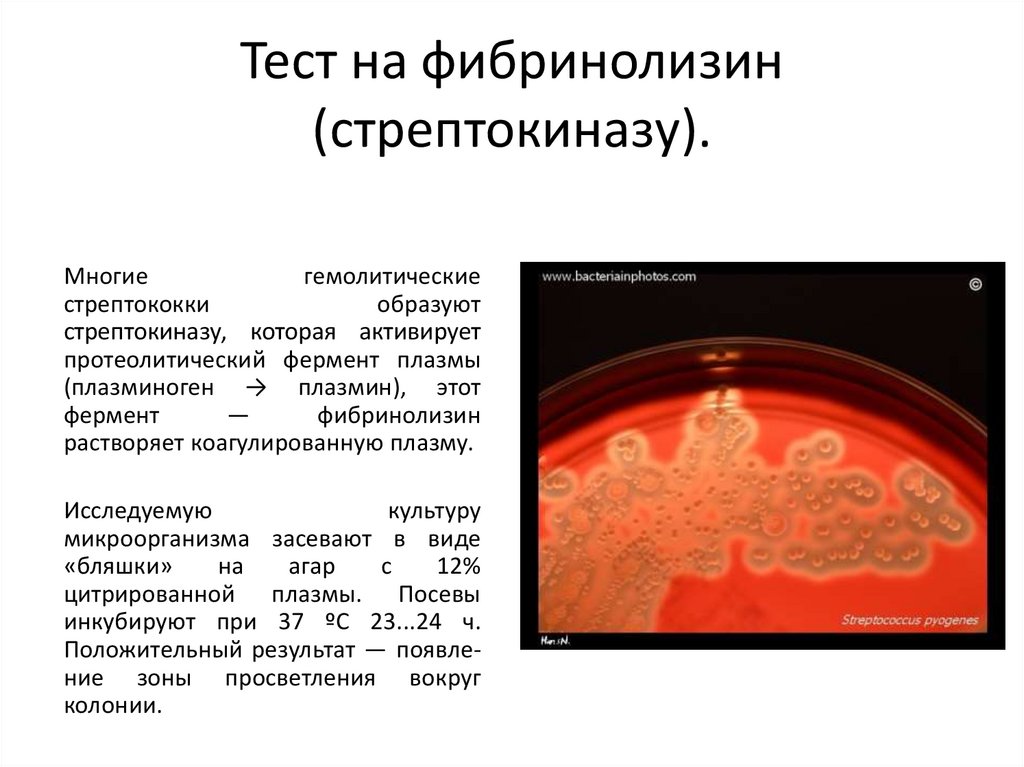
Тест на фибринолизин(стрептокиназу).
Многие
гемолитические
стрептококки
образуют
стрептокиназу, которая активирует
протеолитический фермент плазмы
(плазминоген → плазмин), этот
фермент
—
фибринолизин
растворяет коагулированную плазму.
Исследуемую
культуру
микроорганизма засевают в виде
«бляшки»
на
агар
с
12%
цитрированной плазмы. Посевы
инкубируют при 37 ºС 23...24 ч.
Положительный результат — появление зоны просветления вокруг
колонии.
22.
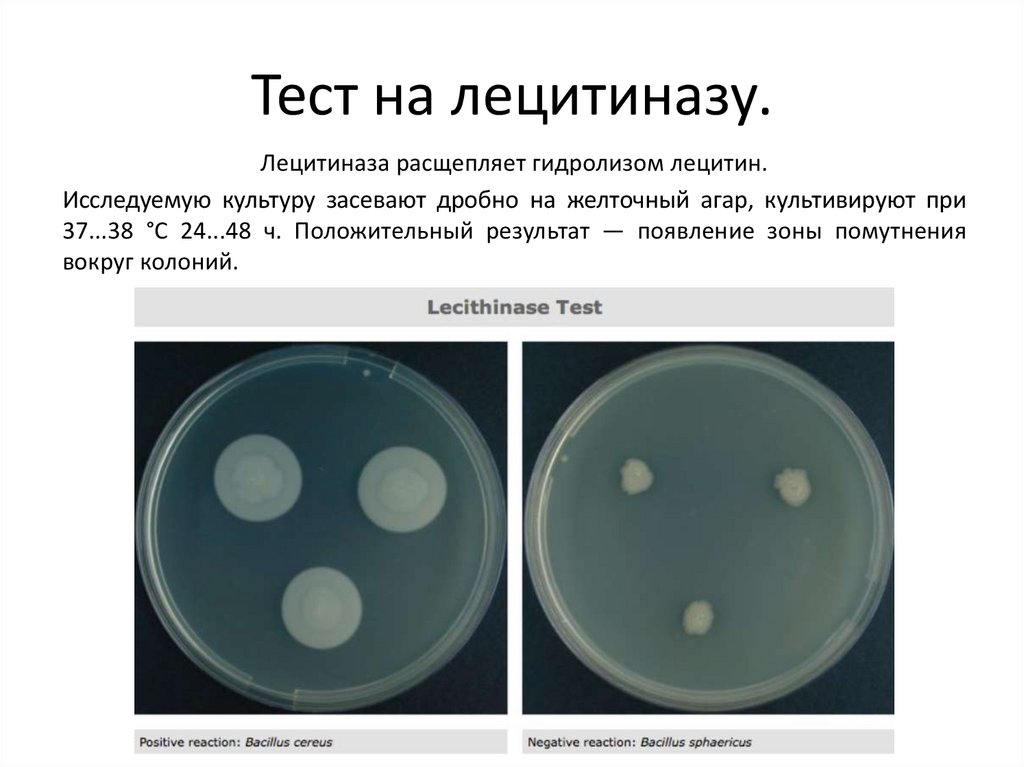
Тест на лецитиназу.Лецитиназа расщепляет гидролизом лецитин.
Исследуемую культуру засевают дробно на желточный агар, культивируют при
37...38 °С 24...48 ч. Положительный результат — появление зоны помутнения
вокруг колоний.
23.
Тест на ДНК-азу.Исследуемую культуру бактерий засевают «штрихом» на
питательный агар с ДНК и культивируют при 37 °С 24 ч. Затем
на поверхность среды с бактериальной культурой наливают 1
н. раствор соляной кислоты. Положительный результат —
при гидролизе ДНК вдоль «штриха» культуры видна светлая
зона.











 medicine
medicine biology
biology








