Similar presentations:
Физиология микроорганизмов. Особенности метаболизма у прокариот
1.
Тема: ФИЗИОЛОГИЯ МИКРООРГАНИЗМОВОсобенности метаболизма у
прокариот
2.
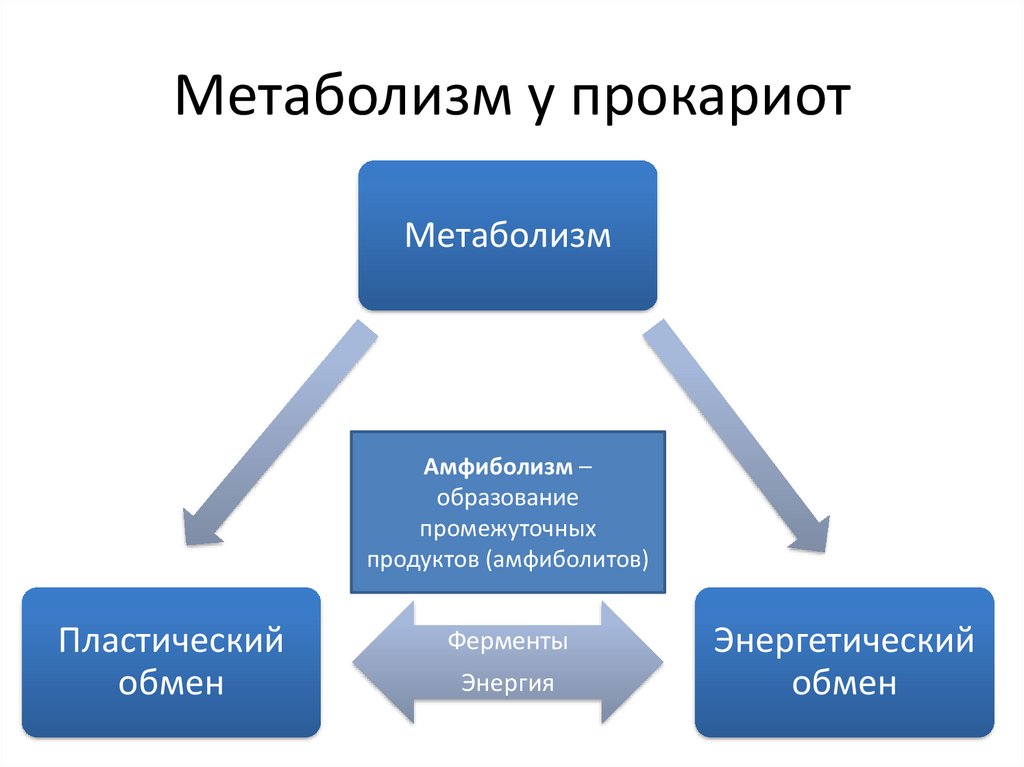
Метаболизм у прокариотМетаболизм
Амфиболизм –
образование
промежуточных
продуктов (амфиболитов)
Пластический
обмен
Ферменты
Энергия
Энергетический
обмен
3.
Пластический обмен (анаболизм) - этосовокупность
процессов
биосинтеза
органических веществ, компонентов клетки.
Анаболизм обеспечивает рост, развитие,
обновление биологических структур, а также
непрерывный
ресинтез
макроэргических
соединений и их накопление.
Энергетический обмен (катаболизм) - это
совокупность процессов расщепления сложных
молекул, компонентов клеток
до простых
веществ (с использованием части из них в
качестве предшественников биосинтеза) и до
конечных
продуктов
метаболизма
(с
образованием
макроэргических
и
восстановленных соединений).
4.
Виды обмена у прокариот1. БЕЛКОВЫЙ
2. УГЛЕВОДНЫЙ
3. ЛИПИДНЫЙ
4. НУКЛЕИНОВЫЙ
5. МИНЕРАЛЬНЫЙ
5.
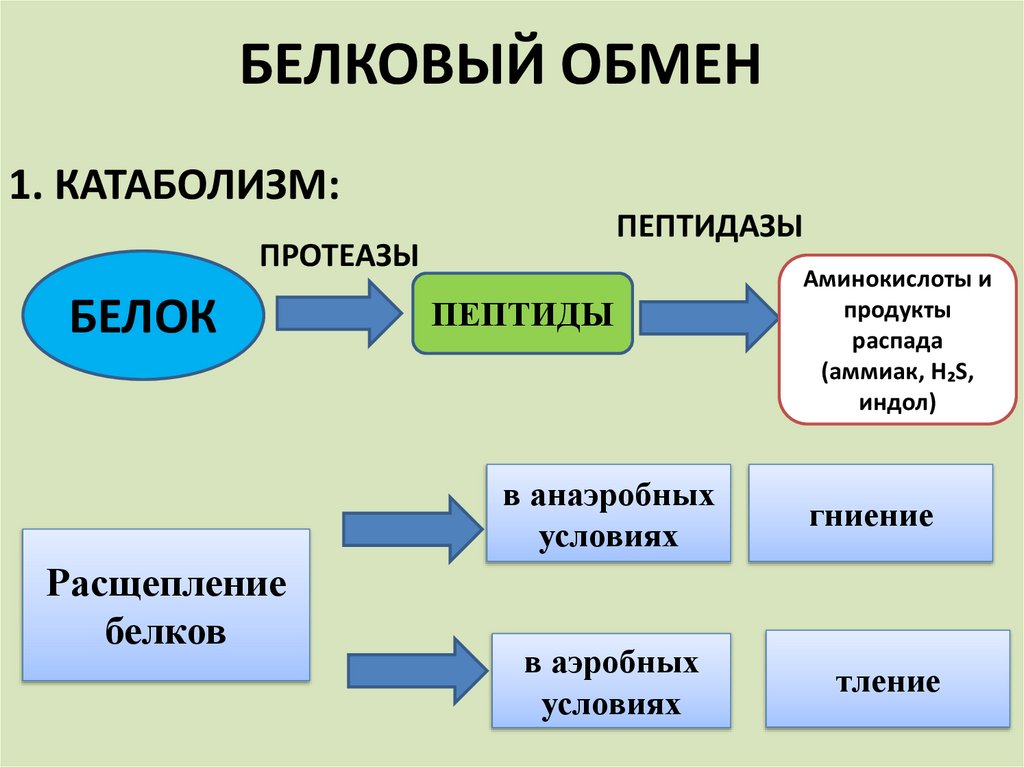
БЕЛКОВЫЙ ОБМЕН1. КАТАБОЛИЗМ:
ПЕПТИДАЗЫ
ПРОТЕАЗЫ
БЕЛОК
Расщепление
белков
ПЕПТИДЫ
Аминокислоты и
продукты
распада
(аммиак, H₂S,
индол)
в анаэробных
условиях
гниение
в аэробных
условиях
тление
6.
2. Биосинтез белкаЭто создание молекул белка на основе
информации о последовательности
аминокислот в его первичной структуре,
заключенной в структуре ДНК
Необходимые компоненты:
рибосомы,
энергия АТФ,
аминокислоты,
ферменты,
различные виды РНК,
специальные белковые факторы
7.
Рибосомы состоят из нескольких десятков белков ирРНК. У бактерий они мельче (70S), у эукариот – 80S
Большая
субъединица
Малая
субъединица
8.
9.
10.
Предварительно: активация - соответствующая аминокислотаприсоединяется к соответствующей тРНК с помощью ферментов.
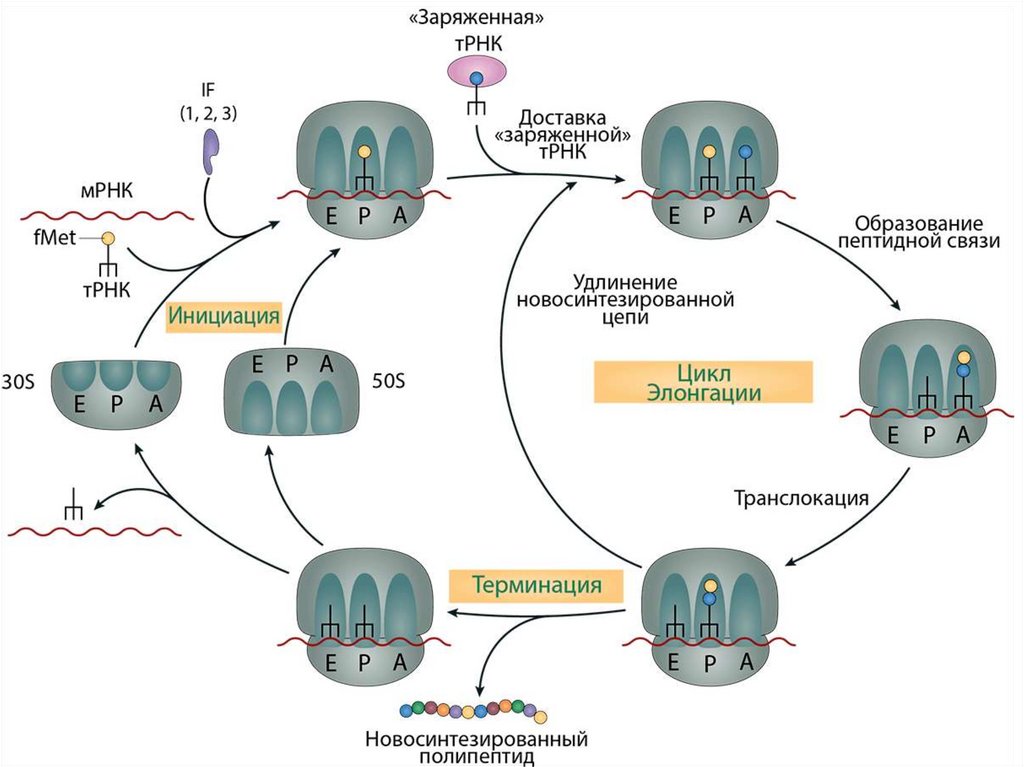
Трансляция у прокариот
Инициация трансляции (начало считывания)
Основными задачами инициации являются:
1) Связывание малой субъединицы рибосомы с мРНК.
2) Нахождение инициаторного, или стартового, кодона АУГ, как
правило, это первый АУГ с 5'-конца мРНК. Точное
позиционирование рибосомы относительно него обеспечивает
установление нужной рамки считывания. Рамка считывания —
это разбиение последовательности на триплеты, а таких разбиений
возможно три, но кодирует нужный белок только одна. Если рамка
сдвинется, то получится совершенно другой полипептид.
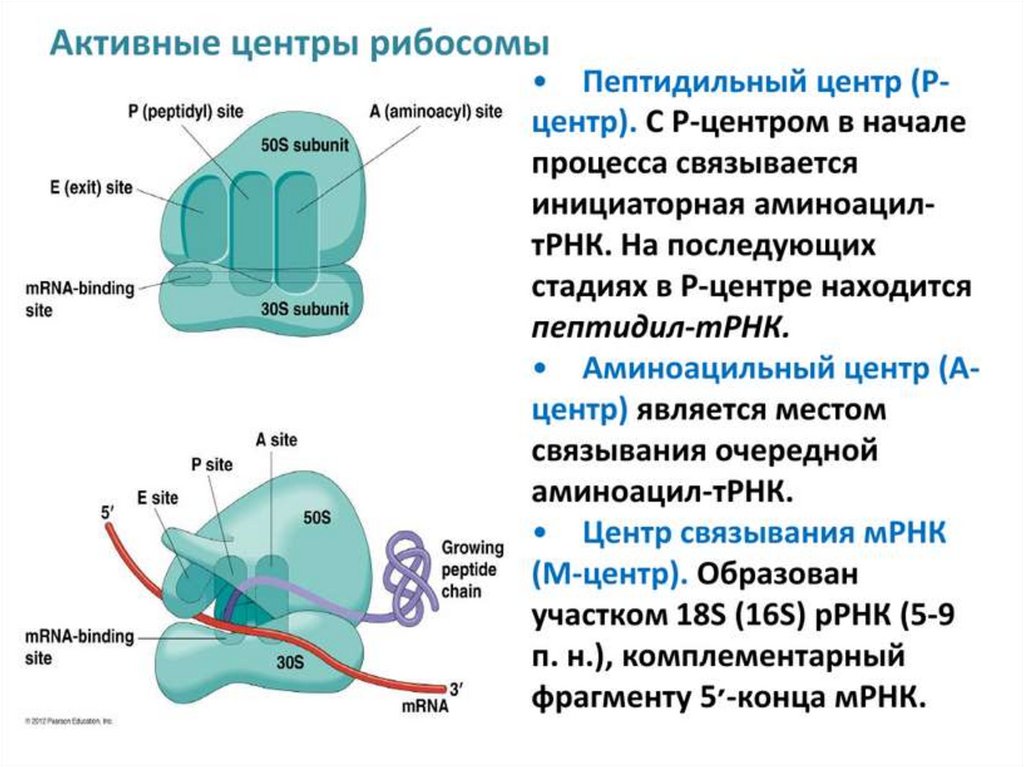
3) Установка формилметионил-тРНК в Р-участок рибосомы,
привлечение следующей аминоацил-тРНК, присоединение большой
субъединицы и сборка полной рибосомы.
Таким образом, в результате инициации мы получаем рибосому,
точно установленную в нужное положение на мРНК, в Р-участке
11.
Элонгация трансляции представляет собой цикл из 3повторяющихся событий:
1) Присоединение новой аминоацил-тРНК в А-участок в соответствии с кодоном,
который там оказался. При этом происходит комплементарное взаимодействие
антикодона тРНК с кодоном в мРНК.
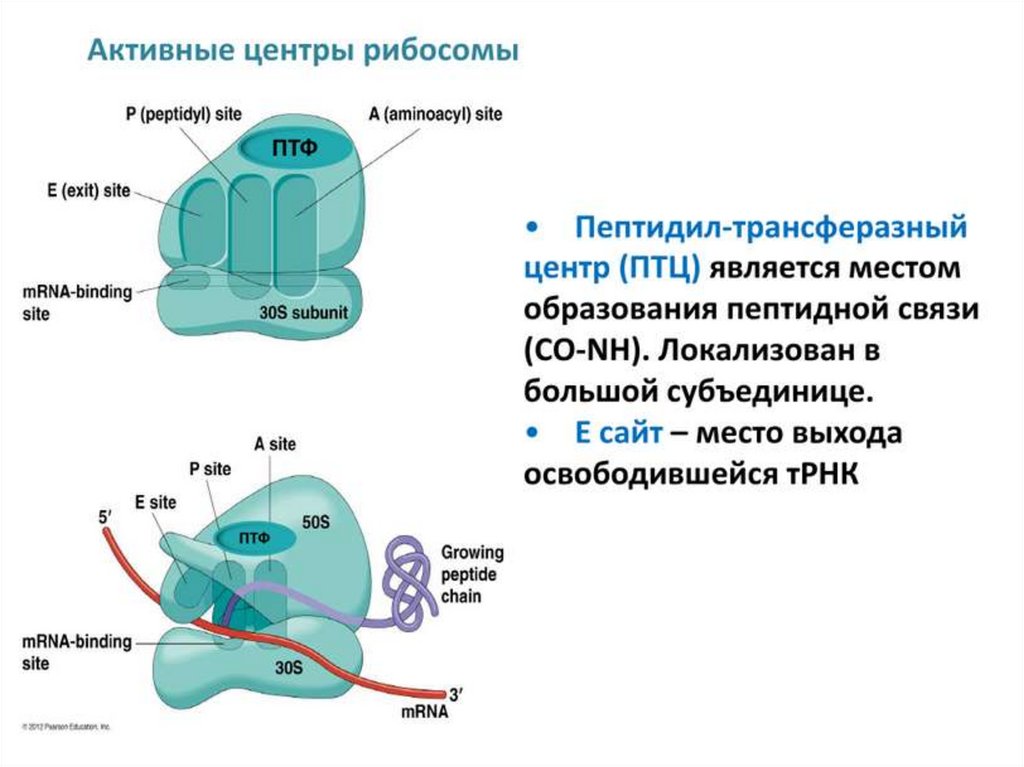
2) Образование пептидной связи с перевешиванием растущего пептида с тРНК в
Р-участке на новопришедшую аминоацил-тРНК в А-участке. Осуществляется за
счет каталитической активности большой субъединицы рибосомы, главную роль
здесь играет рРНК.
Этот процесс называют транспептидацией ("перевешиванием пептида"). В
катализе его ключевую роль играет рРНК, поэтому ее иногда считают примером
РНК-фермента — рибозима.
3) Транслокация — шаг рибосомы на один триплет в сторону 3'-конца мРНК. Всё,
что было в А-участке, оказывается в Р-участке, а А-участок теперь свободен для
присоединения новой аминоацил-тРНК. Цикл замыкается.
Процесс элонгации продолжается до тех пор, пока в А-участок не попадет стопкодон, для которого в клетке нет тРНК с комплементарным антикодоном (стопкодонами являются три кодона: UAA, UAG, UGA). На этих кодонах процесс
элонгации останавливается, и начинается завершающий этап биосинтеза белка,
называемый терминацией.
12.
Терминация:В действие вступают вспомогательные белки,
называемые факторами терминации. Эти белки
узнают стоп-кодоны и связываются в рибосоме на
место тРНК в А-участке. При этом происходит
гидролиз связи синтезированного пептида с тРНК.
Это приводит к тому, что освободившаяся тРНК
покидает рибосому, а образовавшийся пептид
освобождается
и
начинает
самостоятельное
существование.
Рибосома
диссоциирует
на
субъединицы и освобождает мРНК.
13.
14.
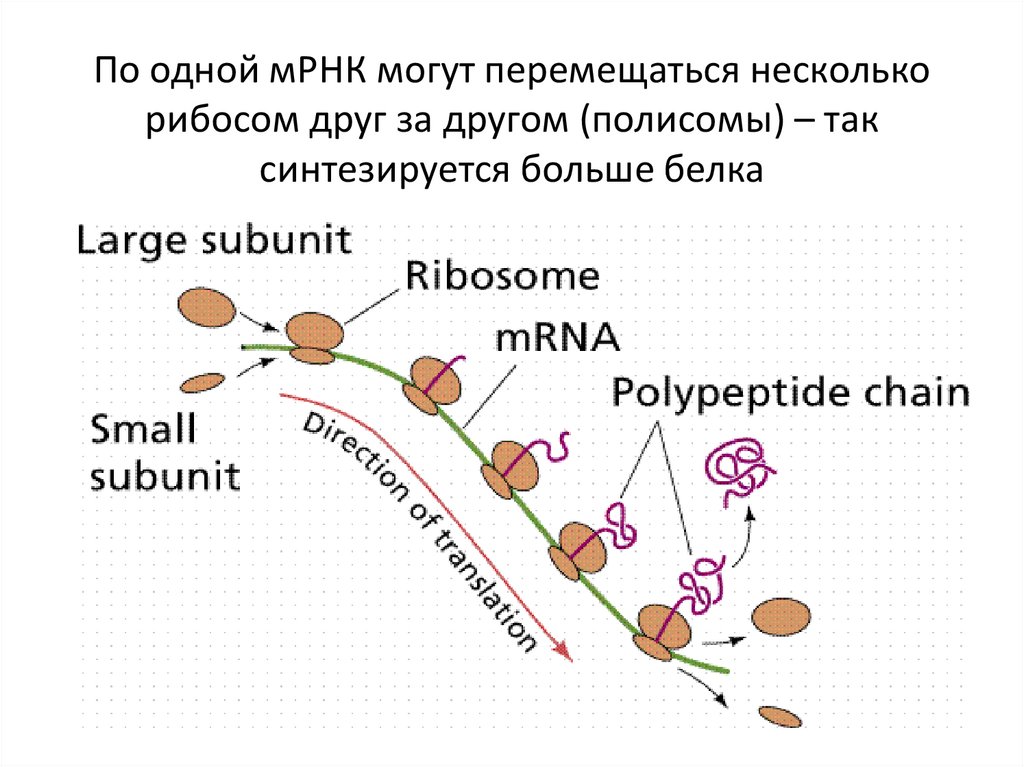
По одной мРНК могут перемещаться несколькорибосом друг за другом (полисомы) – так
синтезируется больше белка
15.
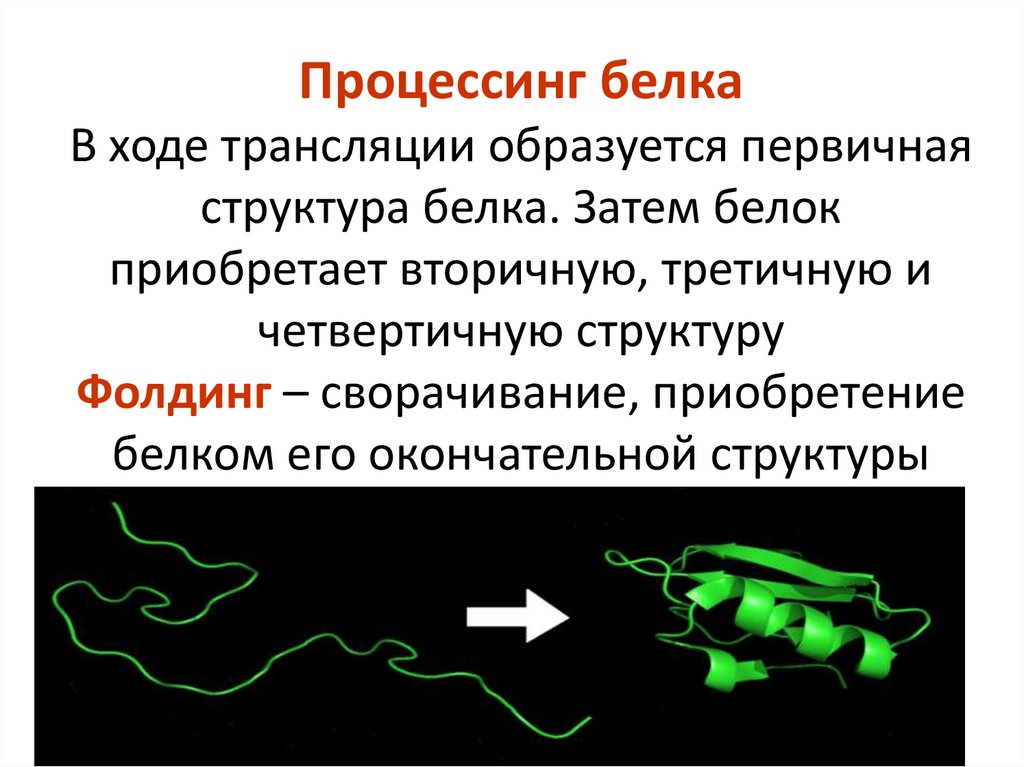
Процессинг белкаВ ходе трансляции образуется первичная
структура белка. Затем белок
приобретает вторичную, третичную и
четвертичную структуру
Фолдинг – сворачивание, приобретение
белком его окончательной структуры
16.
17.
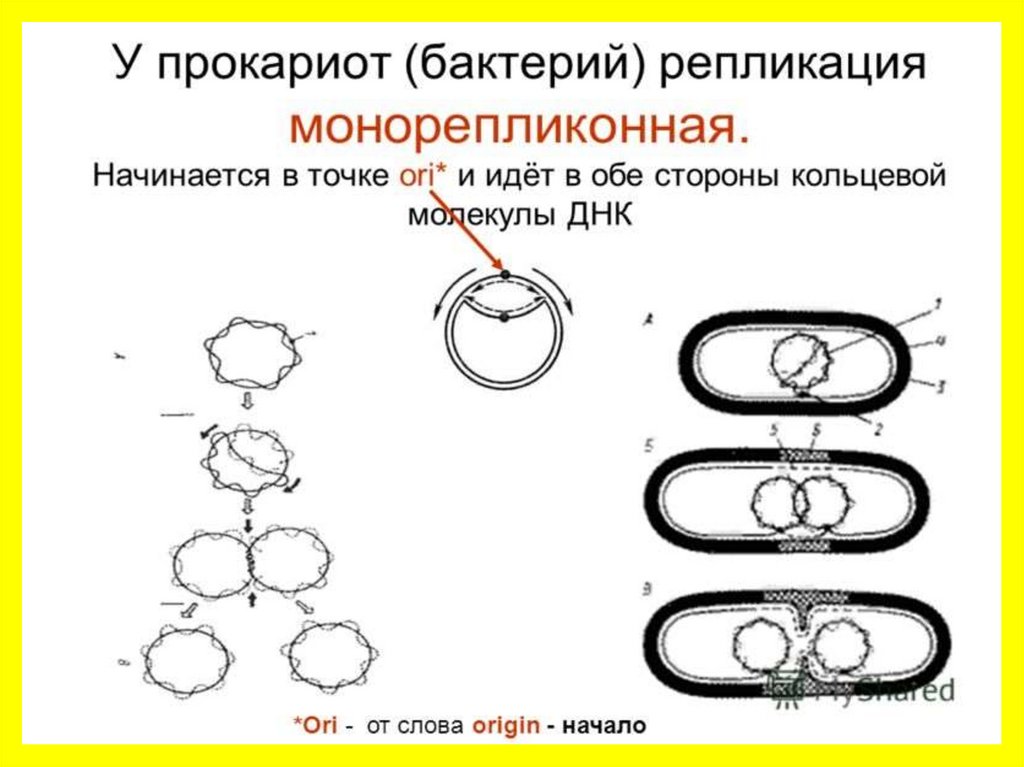
Нуклеиновый обмен у прокариот связан сгенетическим обменом
1. Синтез НУКЛЕИНОВЫХ КИСЛОТ имеет
значение для процесса деления клетки
2. Принимают участие ферменты:
• рестриктазы (вырезают участки ДНК, убирая
нежелательные вставки),
• ДНК-полимеразы (ответственны за репликацию
дочерней ДНК по материнской),
• лигазы (обеспечивают сшивку фрагментов НК),
• ДНК-зависимые РНК-полимеразы
(осуществляют построение РНК на матрице ДНК)
18.
19.
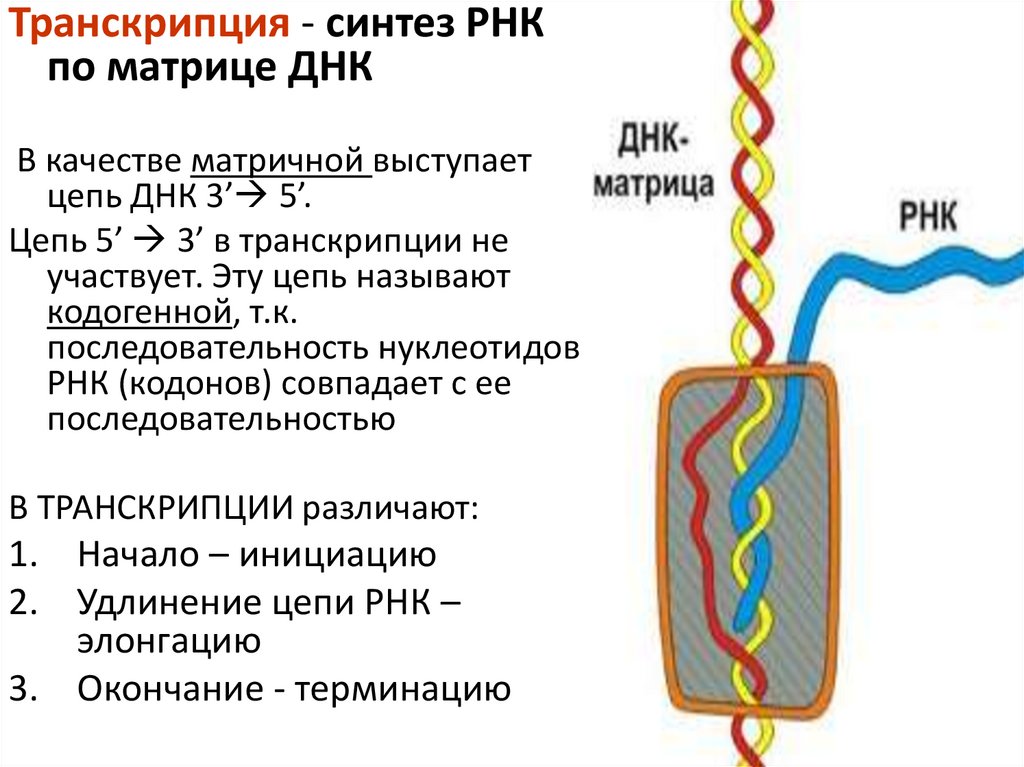
Транскрипция - синтез РНКпо матрице ДНК
В качестве матричной выступает
цепь ДНК 3’ 5’.
Цепь 5’ 3’ в транскрипции не
участвует. Эту цепь называют
кодогенной, т.к.
последовательность нуклеотидов
РНК (кодонов) совпадает с ее
последовательностью
В ТРАНСКРИПЦИИ различают:
1. Начало – инициацию
2. Удлинение цепи РНК –
элонгацию
3. Окончание - терминацию
20.
1.Инициация транскрипции: фермент РНКполимераза связывается с промотором на
одной из цепей ДНК.
(РНК-полимераза I и III транскрибируют гены т- и
р-РНК; РНК-полимераза II – гены белков)
5
3
3
5
промотор
РНК-полимераза
ДНК
21.
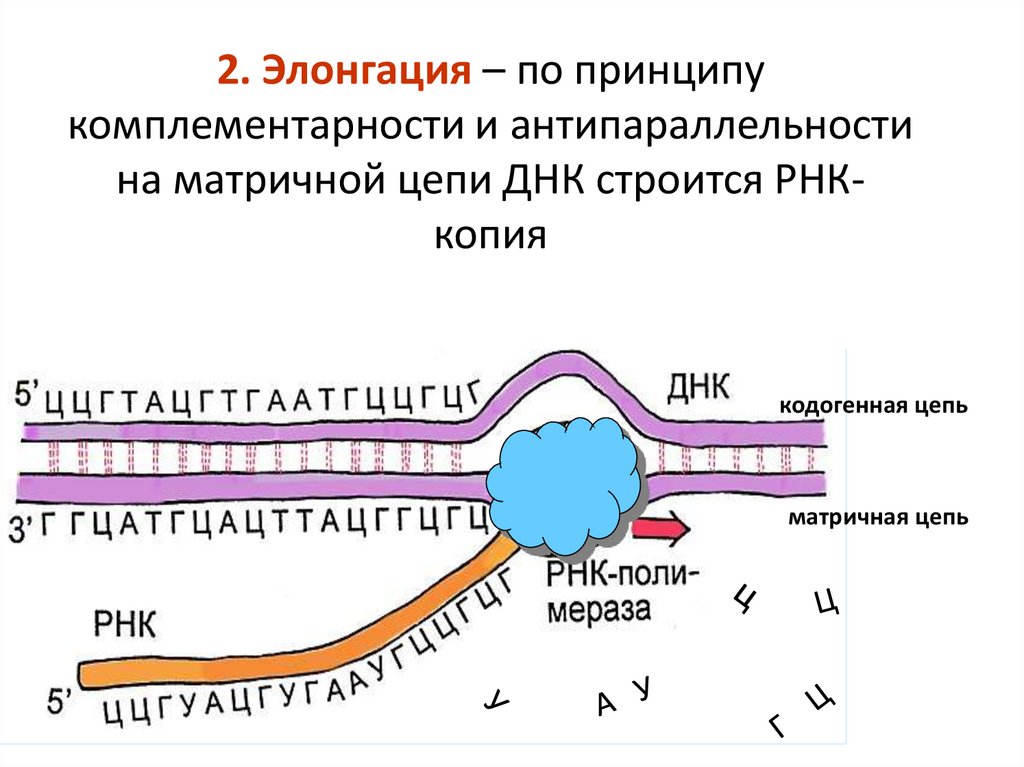
2. Элонгация – по принципукомплементарности и антипараллельности
на матричной цепи ДНК строится РНКкопия
кодогенная цепь
матричная цепь
22.
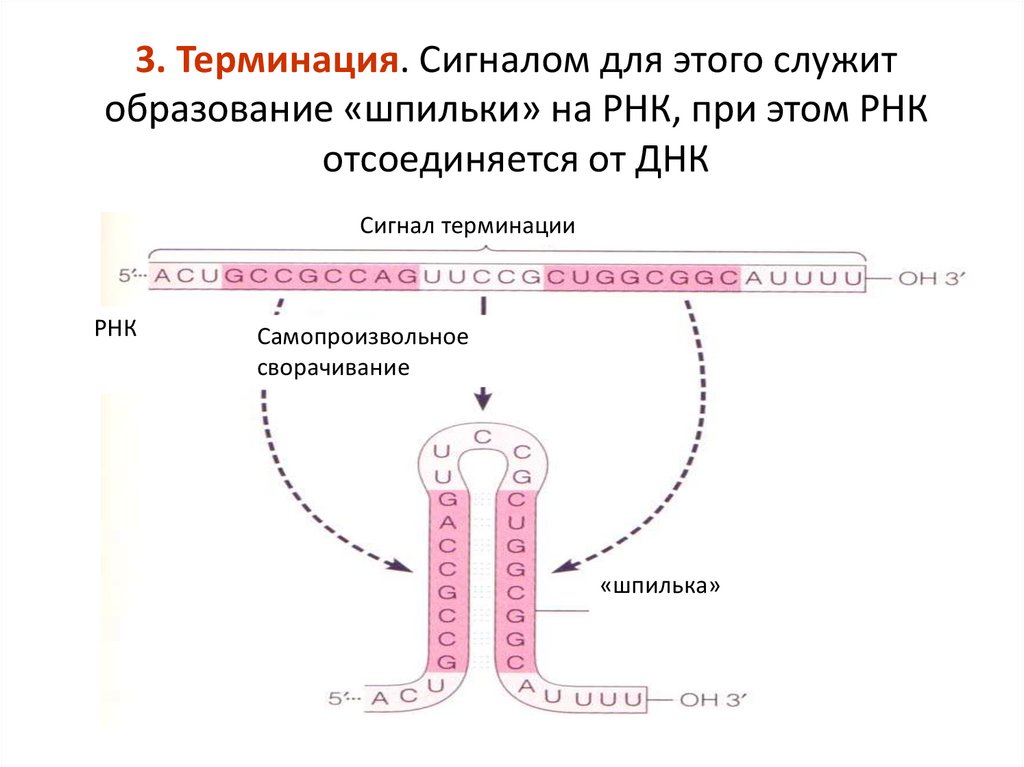
3. Терминация. Сигналом для этого служитобразование «шпильки» на РНК, при этом РНК
отсоединяется от ДНК
Сигнал терминации
РНК
Самопроизвольное
сворачивание
«шпилька»
23.
В ОТЛИЧИЕ ОТ ЭУКАРИОТ УПРОКАРИОТ НОВАЯ
СИНТЕЗИРОВАННАЯ МОЛЕКУЛА
РНК НЕ ВСТУПАЕТ В
ПОСТТРАНСКРИПЦИОННЫЙ
ПРОЦЕСС - ПРОЦЕССИНГ ИЛИ
СОЗРЕВАНИЕ РНК
24.
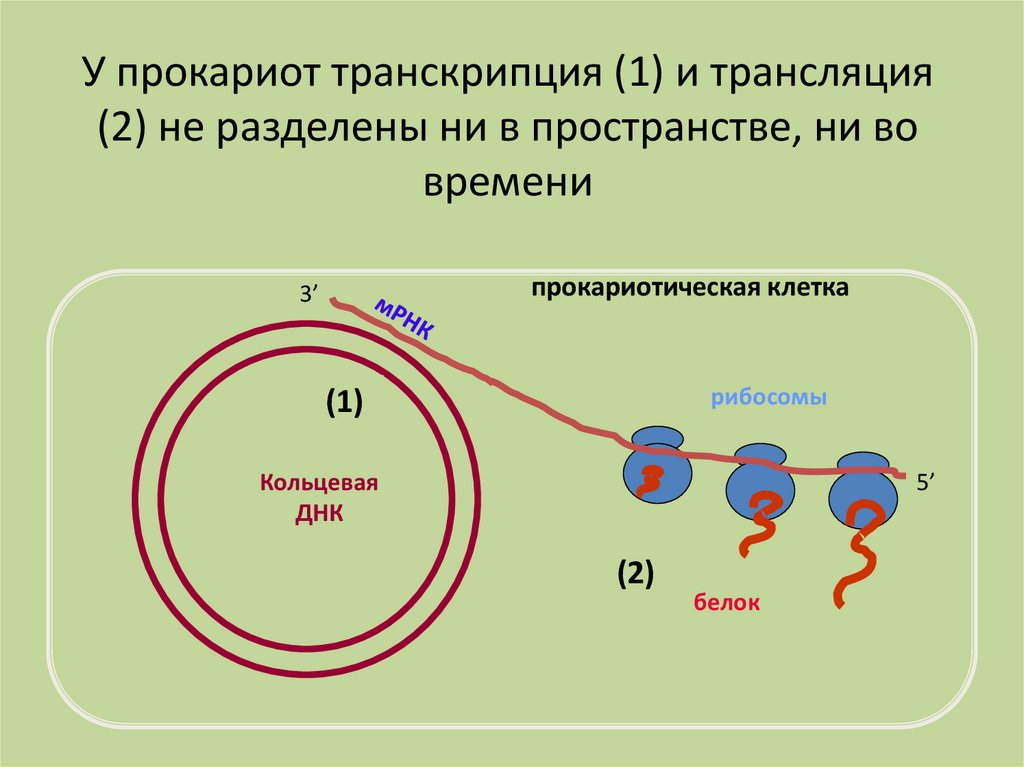
У прокариот транскрипция (1) и трансляция(2) не разделены ни в пространстве, ни во
времени
прокариотическая клетка
3’
рибосомы
(1)
Кольцевая
ДНК
5’
(2)
белок
25.
ЛИПИДНЫЙ ОБМЕН У ПРОКАРИОТКАТАБОЛИЗМ:
1. Принимают участие
ферменты:
липопротеиназы,
лецитиназы, липазы,
фосфолипазы
2. При распаде ЖК клетка
запасает энергию
3. Конечным продуктом
распада является
АЦЕТИЛ-КоА
АНАБОЛИЗМ:
участвуют
ацетилпереносящие белки
– переносят ацетильные
группы на глицерофосфат
ФОСФАТИДНЫХ КИСЛОТ
СЛОЖНЫЕ ЭФИРЫ И
СПИРТЫ
ФОСФОЛИПИДЫ ЦПМ
26.
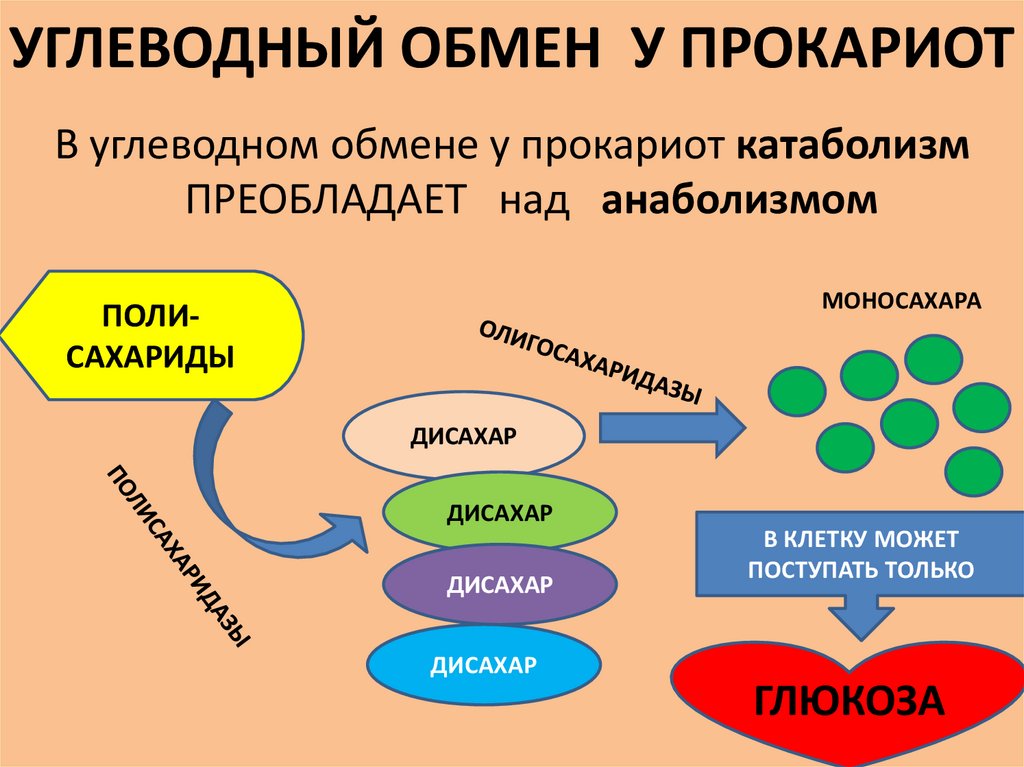
УГЛЕВОДНЫЙ ОБМЕН У ПРОКАРИОТВ углеводном обмене у прокариот катаболизм
ПРЕОБЛАДАЕТ над анаболизмом
МОНОСАХАРА
ПОЛИСАХАРИДЫ
ДИСАХАР
ДИСАХАР
ДИСАХАР
В КЛЕТКУ МОЖЕТ
ПОСТУПАТЬ ТОЛЬКО
ДИСАХАР
ГЛЮКОЗА
27.
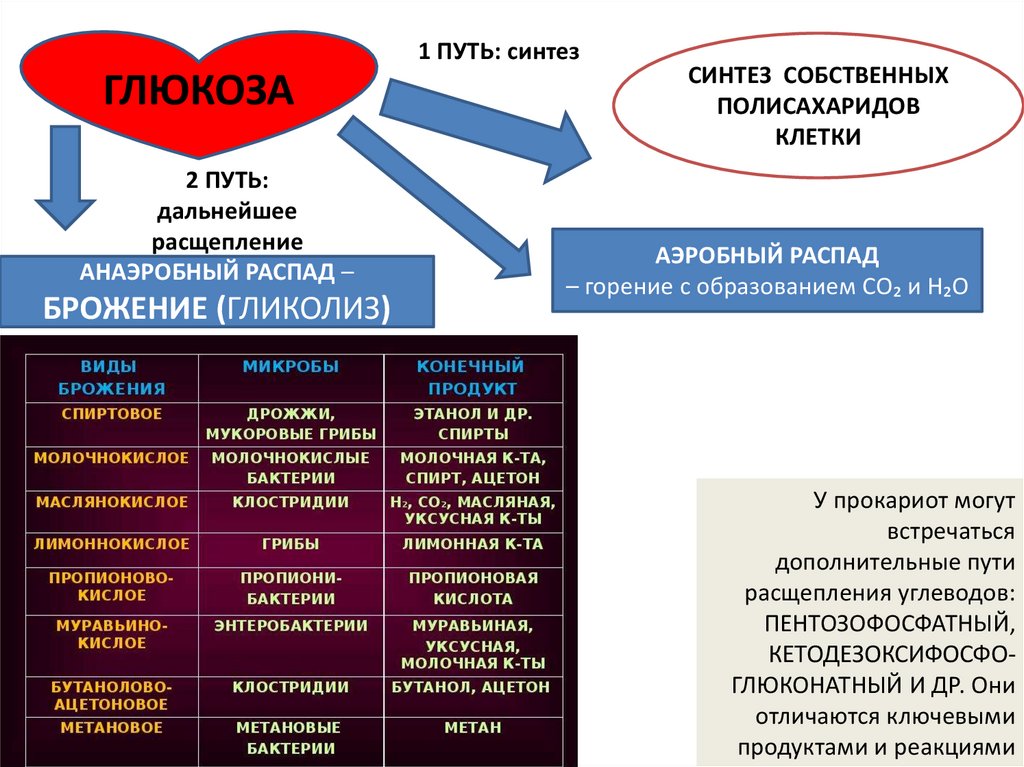
1 ПУТЬ: синтезГЛЮКОЗА
2 ПУТЬ:
дальнейшее
расщепление
АНАЭРОБНЫЙ РАСПАД –
БРОЖЕНИЕ (ГЛИКОЛИЗ)
СИНТЕЗ СОБСТВЕННЫХ
ПОЛИСАХАРИДОВ
КЛЕТКИ
АЭРОБНЫЙ РАСПАД
– горение с образованием CO₂ и H₂O
У прокариот могут
встречаться
дополнительные пути
расщепления углеводов:
ПЕНТОЗОФОСФАТНЫЙ,
КЕТОДЕЗОКСИФОСФОГЛЮКОНАТНЫЙ И ДР. Они
отличаются ключевыми
продуктами и реакциями
28.
МИНЕРАЛЬНЫЙ ОБМЕНВажен для синтеза органических соединений
прокариот
ОРГАНОГЕННЫЕ
:
МАКРОЭЛЕМЕНТЫ:
С, О, N, H
ЗОЛЬНЫЕ
МАКРОЭЛЕМЕНТЫ:
S, P, K, Ca и др.
МИКРОЭЛЕМЕНТЫ:
B, Mo, Zn, Mn, Co, Ni,
I, Br, Cu и др.
Например: сера в составе R-SH входит в состав цитоплазмы и регулирует все
ОX-RED реакции; фосфор входит в состав НК, многих ферментов,
фосфолипидов, через АТФ и АДФ-кислоты участвует в энергетическом
обмене клеток
29.
Ферменты бактерий• Синтезируются самой клеткой
• Обладают высокой активностью
• Специфичностью (ценное
диагностическое значение)
• Имеют сложное строение:
30.
Классификация ферментов- по строению:
простые: белки с высокой молекулярной массой (пепсин, трипсин);
сложные: белковая часть- апофермент + кофактор (Ме, витамины).
Кофактор, прочно связанный с белком, называют простетической группой. (биотин,
тиамин и т.д.)
- по месту действия:
● Эндоферменты катализируют метаболизм внутри клетки.
● Экзоферменты выделяются клеткой в окружающую среду, расщепляя
макромолекулы питательных субстратов до простых соединений, которые
усваиваются клеткой.
Могут инактивировать антибиотики (пенициллиназа и др.), выполняя защитную
функцию
Различают:
● конститутивные
ферменты -
синтезируются непрерывно, независимо от
наличия в питательной среде субстрата;
● индуцибельные (адаптивные) ферменты - синтезируются только при наличии
в среде субстрата данного фермента;
● репрессибельные ферменты– синтез подавляется избытком продукта
реакции.
31.
По типу реакций, которые они катализируют:Оксидоредуктазы – катализируют окислительновосстановительные реакции.
Трансферазы – переносят ту или иную функциональную
группу от одного субстрата на другой.
Гидролазы – также участвуют в переносе групп, однако
акцептором всегда является молекула воды.
Лиазы (синтазы) – катализируют расщепление или образование
химических соединений или образование химических связей,
при этом образуются или исчезают двойные связи.
Изомеразы – перемещают группы в пределах одной молекулы.
Лигазы (синтетазы) – катализируют энергозависимые реакции
присоединения и поэтому их действие сопряжено с гидролизом
АТФ.
32.
Ферменты патогенности: нейраминидаза,гиалуронидаза, плазмокоагулаза, лецитиназа, ДНК-аза,
протеаза, фибринолизин
Прикладное значение ферментов
В генной инженерии и генодиагностике:
рестриктазы (эндонуклеазы), ДНК-синтетазы, ДНКполимераза, обратная транскриптаза
Для
идентификации
бактерий
–
сахаролитические,
протеолитические,
ферменты
патогенности,
оксидоредуктазы,
аутолитические
ферменты
В медицине – стрептокиназы, стрептодорназы.
33.
КУЛЬТУРАЛЬНЫЙ МЕТОДИССЛЕДОВАНИЯ
«золотой стандарт»
диагностики ИНФЕКЦИОННЫХ
ЗАБОЛЕВАНИЙ, так как
результаты
микробиологических
исследований позволяют точно
установить факт наличия
возбудителя в исследуемом
материале пациента
34.
Задачи КУЛЬТУРАЛЬНОГОметода исследований
1. Идентифицировать
микроорганизмы в исследуемом
материале
2. Определить их видовую
принадлежность по
морфологическим, биохимическим,
токсигенным, антигенным и др.
свойствам
3. Установить чувствительность к
антимикробным препаратам (АМП)
35.
Применение культурального метода• В клинической медицине: для диагностики
инфекционных заболеваний
• В эпидемиологии: для определения
микробоносительства и для выявления
источника инфекции
• В санитарной микробиологии: для
определения патогенных микроорганизмов
во внешней среде и определения
санитарного состояния объектов внешней
среды.
36.
1 ЭТАП: ПОСЕВ ИССЛЕДУЕМОГОМАТЕРИАЛА
• Подготовка исследуемого материала к
посеву
•Посев исследуемого материала на плотные
питательные среды (для получения
изолированных колоний) и на жидкие
питательные среды (среды обогащения)
•В отдельных случаях проводится
микроскопия нативного материала
37.
2 ЭТАП: ВЫДЕЛЕНИЕ ЧИСТОЙКУЛЬТУРЫ
• Изучение колоний, выросших на
плотных питательных средах
• Приготовление мазков из
выросших колоний для изучения
морфологических и
тинкториальных свойств
микроорганизмов
• Выделение чистой культуры
• При отсутствии роста на плотных
питательных средах пересев со
сред обогащения на плотные
питательные среды
38.
3 ЭТАП: ИЗУЧЕНИЕ СВОЙСТВВЫДЕЛЕННОЙ ЧИСТОЙ КУЛЬТУРЫ
МИКРООРГАНИЗМА
1. Изучение характера роста чистой
культуры
2. Приготовление и микроскопия мазков
для проверки чистоты культуры
3. Изучение культуральных,
биохимических, серологических свойств
выделенного микроорганизма
4. Определение чувствительности
выделенного микроорганизма к АМП
39.
4 ЭТАП. ОПРЕДЕЛЕНИЕ ВИДАВЫДЕЛЕННОГО МИКРООРГАНИЗМА И
ВЫДАЧА БАКТЕРИОЛОГИЧЕСКОГО
ЗАКЛЮЧЕНИЯ
• Учет результатов изучения культуральных,
биохимических, серологических свойств
выделенного микроорганизма
• Определение вида возбудителя
• Учет результатов определения
чувствительности выделенного
микроорганизма к АМП и бактериофагам
• Выдача бактериологического заключения
40.
Свойства микроорганизмов, используемые дляих идентификации
• Морфологические признаки – форма, размеры и
взаиморасположение микробных клеток, изучаемые
микроскопическим методом исследования
• Тинкториальные признаки – способность микробных
клеток окрашиваться красителями, изучаемые
микроскопическим методом исследования
• Культуральные признаки – характер роста на жидких и
плотных питательных средах
• Биохимические (ферментативные) признаки –
способность микроорганизмов расщеплять различные
субстраты
• Антигенные признаки – определение специфических
антигенов с использованием серологических реакций
• Фаголизабельность – разрушение микробной клетки
специфическим бактериофагом
• Выделение биологически активных веществ –
определение факторов патогенности микроорганизмов
41.
КОЛОНИЯ – это видимое изолированное скоплениепредставителей одного вида микроорганизмов,
образующееся при размножении одной
колониеобразующей единицы (КОЕ) на плотной
питательной среде (на ее поверхности или в глубине)
42.
СВОЙСТВА МИКРОБНЫХ КОЛОНИЙ• по величине — крупные (диаметр более 4—5 мм), средние
(2—4 мм) и малые (1—2 мм)
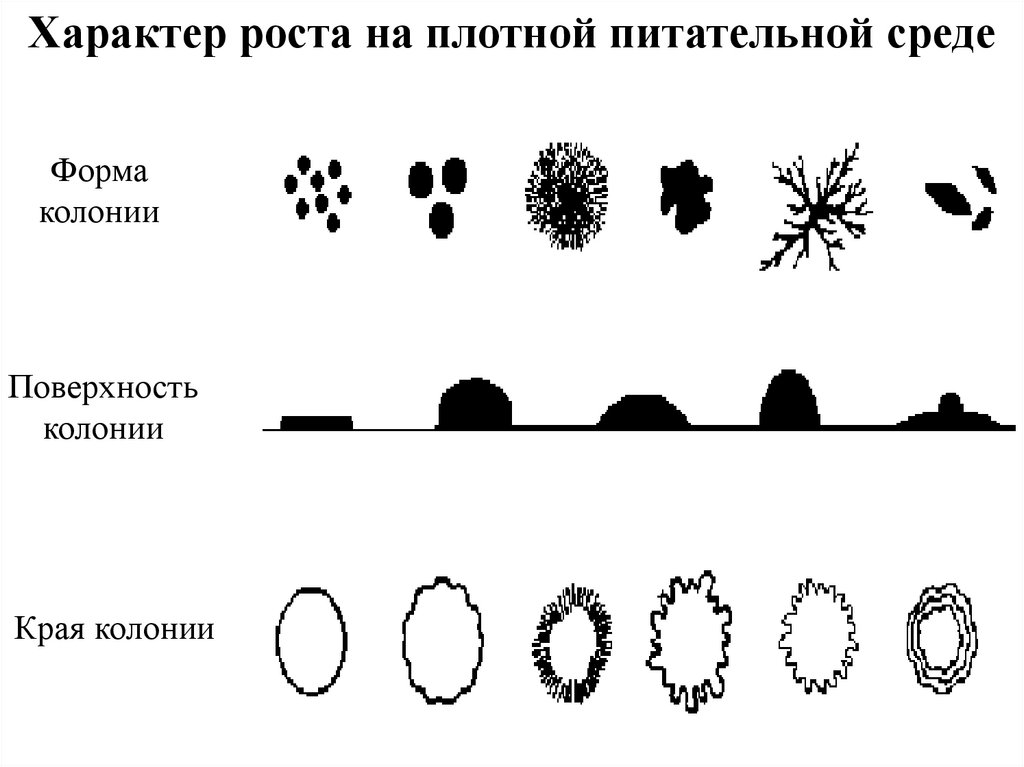
• по форме — круглые, розеткообразные, листовидные и т. д.
• по цвету, зависящему от пигмента — белого, ярко-синего,
красного цветов и т. д.
• по консистенции — сухие, влажные, сочные, слизистые
• по поверхности — гладкие, морщинистые, исчерченные,
плоские, выпуклые, плосковыпуклые, вдавленные
• по краю — с ровными, волнистыми, бахромчатыми краями
• по структуре — могут иметь аморфную, зернистую,
волокнистую внутреннюю структуру
• в чистой культуре, выращенной на скошенном питательном
агаре, характер роста может быть сухим, влажным,
ползучим, складчатым, пигментированным.
43.
Характер роста на плотной питательной средеФорма
колонии
Поверхность
колонии
Края колонии
44.
Типы микробных колоний• S тип колоний [от англ. Smooth – гладкий]
характеризуется круглой, выпуклой и
правильной формой, гладкой поверхностью,
влажной консистенцией.
• R тип колоний [от англ. Rough- шероховатый]
характеризуется шероховатой поверхностью,
неправильными краями, сухой
консистенцией.
• М тип колоний [от англ. Mucoid - слизистый]
• D тип колоний [от англ. dwar карликовый]
45.
ПРИЗНАКИ РОСТА КУЛЬТУР НА ЖИДКОЙПИТАТЕЛЬНОЙ СРЕДЕ
• Диффузное помутнение
• Образуют придонный или
пристеночный рост
• Образуют пленки на
поверхности среды или осадок
на дне пробирки
46.
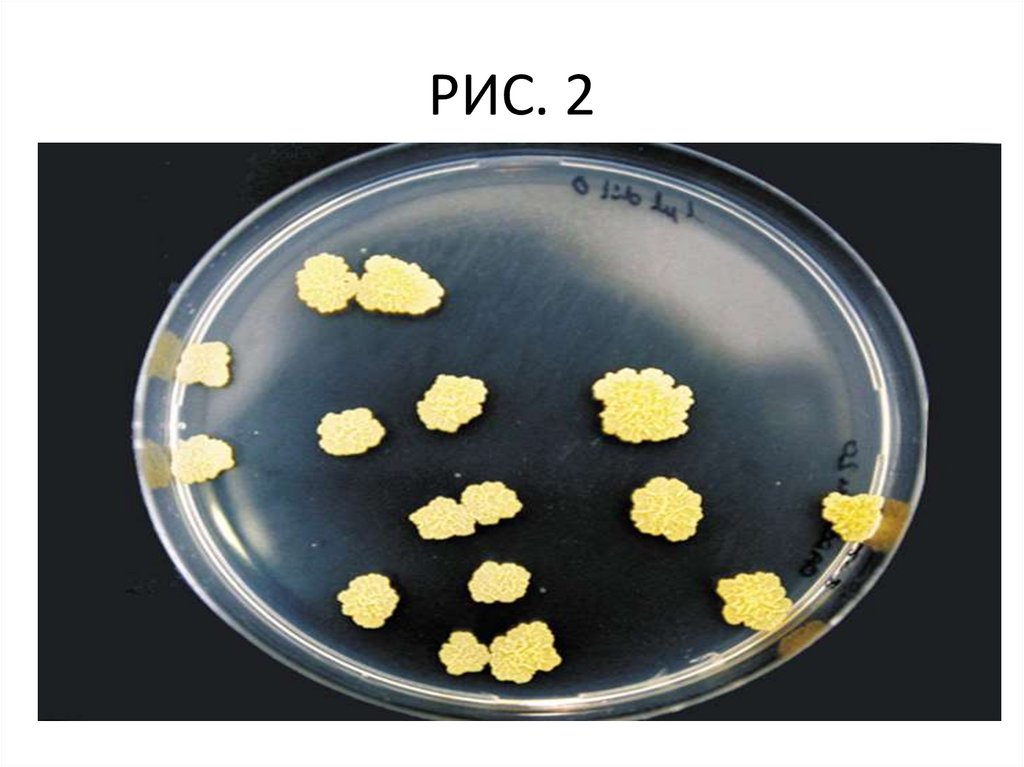
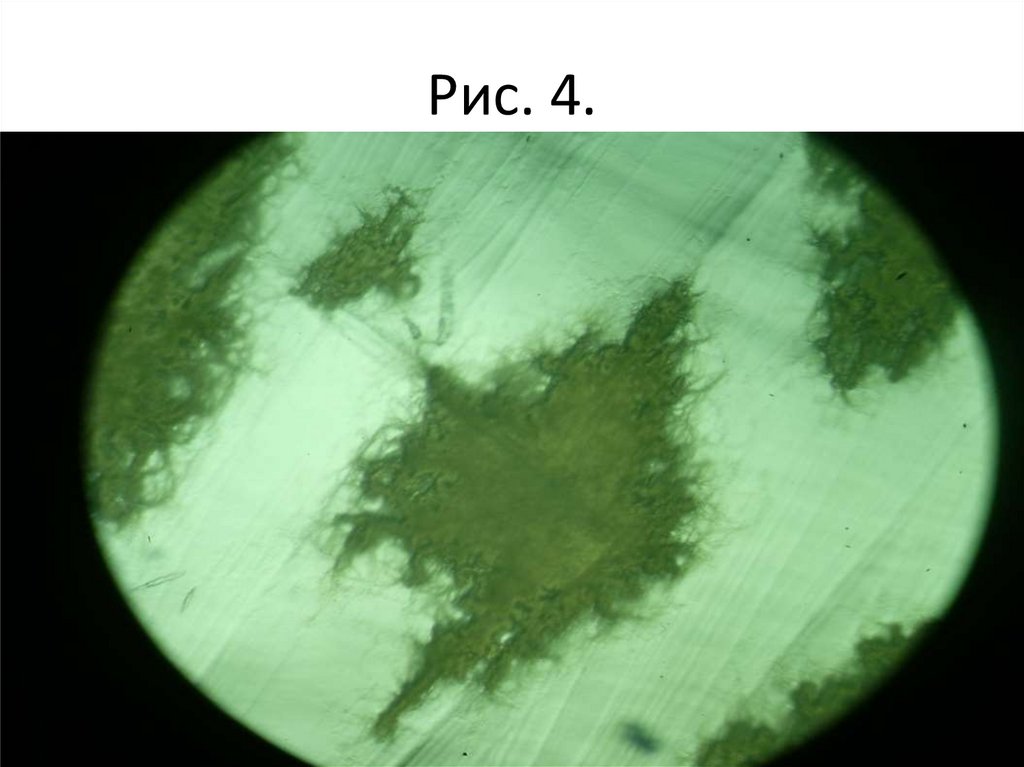
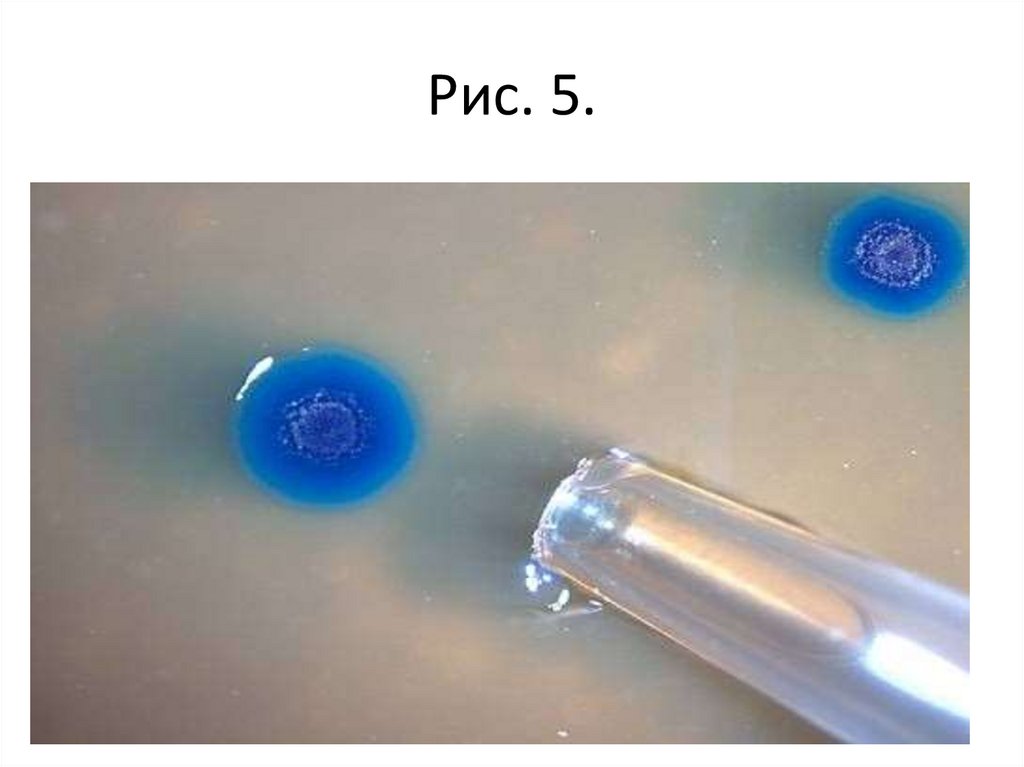
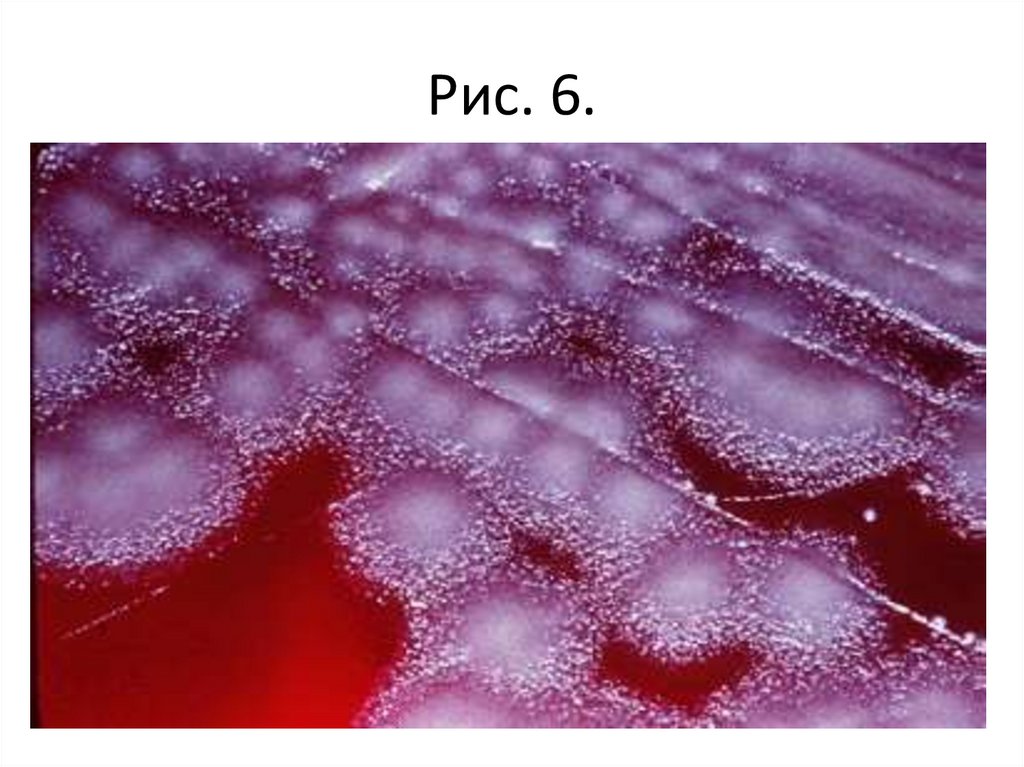
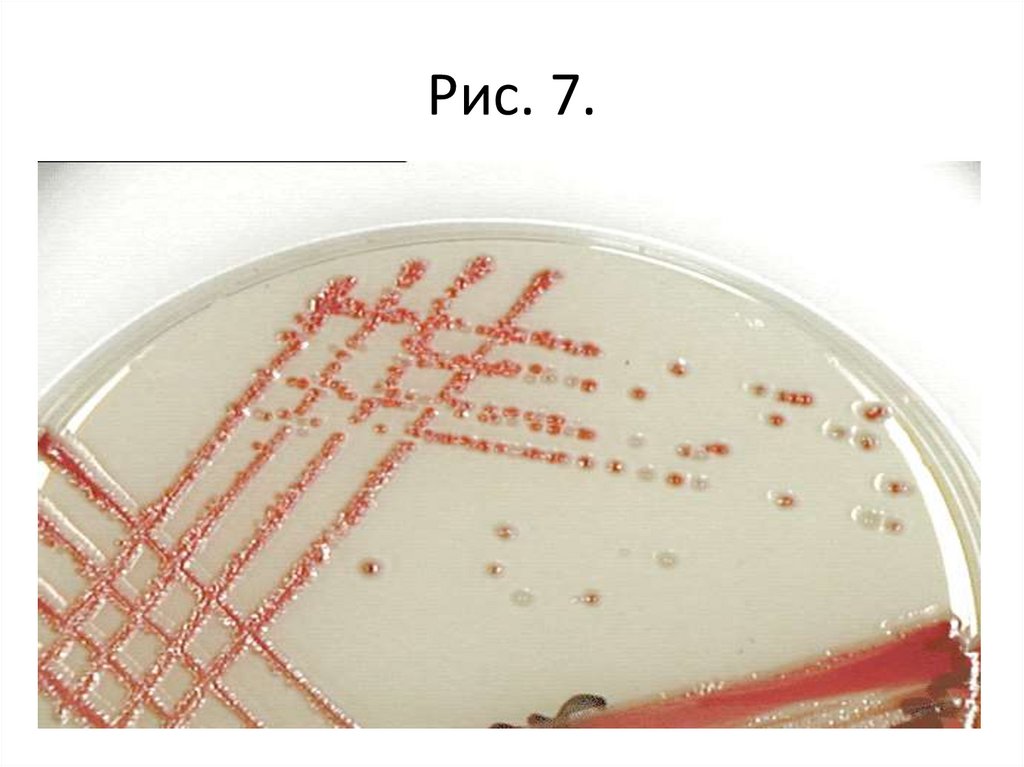
• Задание 1. Изучить культуральные свойствабактерий при росте на твердых питательных
средах, используя рисунок 1 – 7 (описать в
тетради).
Рис. 1.
47.
РИС. 248.
Рис. 3.49.
Рис. 4.50.
Рис. 5.51.
Рис. 6.52.
Рис. 7.53.
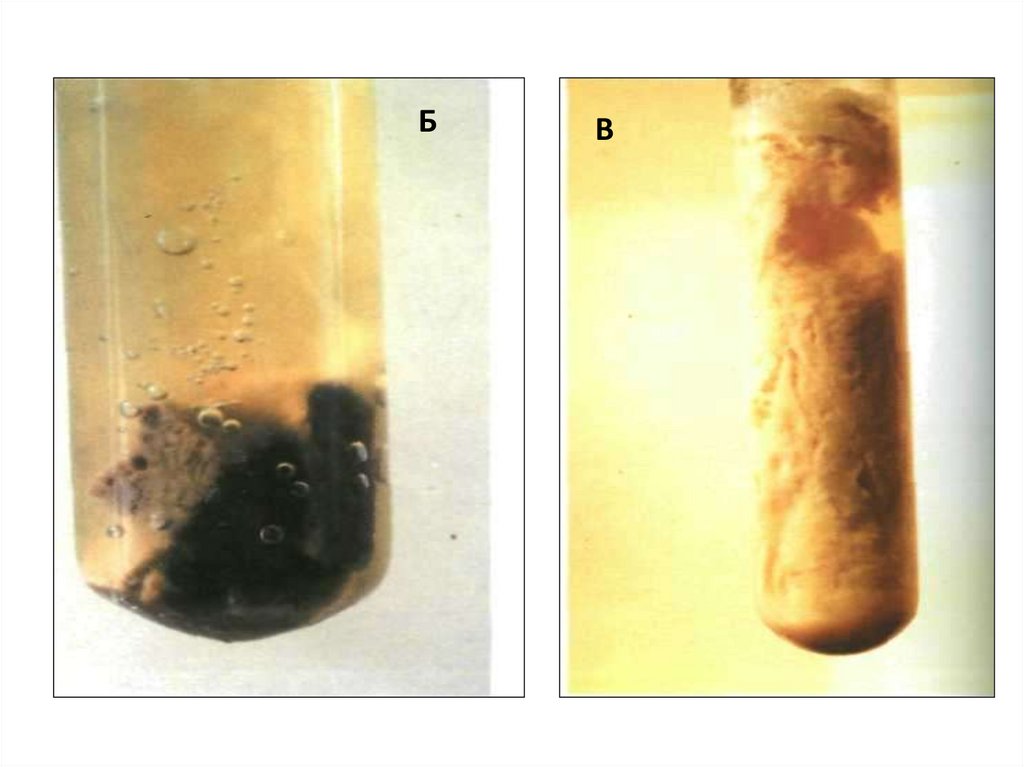
Задание 2. Определить характер ростамикробных культур на жидких питательных
средах
А
1
2
1 – ПРОБИРКА С КУЛЬТУРОЙ; 2 – КОНТРОЛЬНАЯ ПРОБИРКА
54.
БВ
55.
ИДЕНТИФИКАЦИЯМИКРООРГАНИЗМОВ
Важным диагностическим признаком при
идентификации микроорганизмов являются
биохимические свойства бактерий, которые
определяются составом ферментов:
• сахаролитические – расщепление
углеводов;
• протеолитические – расщепление белков;
• липолитические – расщепление жиров.
56.
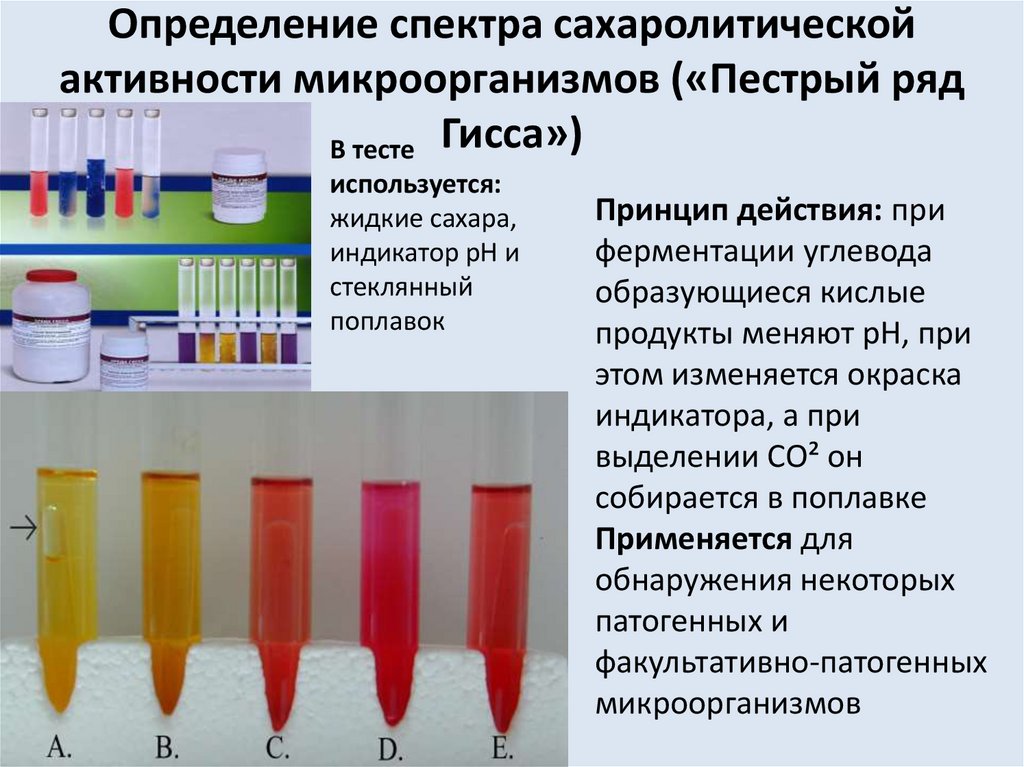
Определение спектра сахаролитическойактивности микроорганизмов («Пестрый ряд
В тесте Гисса»)
используется:
жидкие сахара,
индикатор рН и
стеклянный
поплавок
Принцип действия: при
ферментации углевода
образующиеся кислые
продукты меняют рН, при
этом изменяется окраска
индикатора, а при
выделении СО² он
собирается в поплавке
Применяется для
обнаружения некоторых
патогенных и
факультативно-патогенных
микроорганизмов
57.
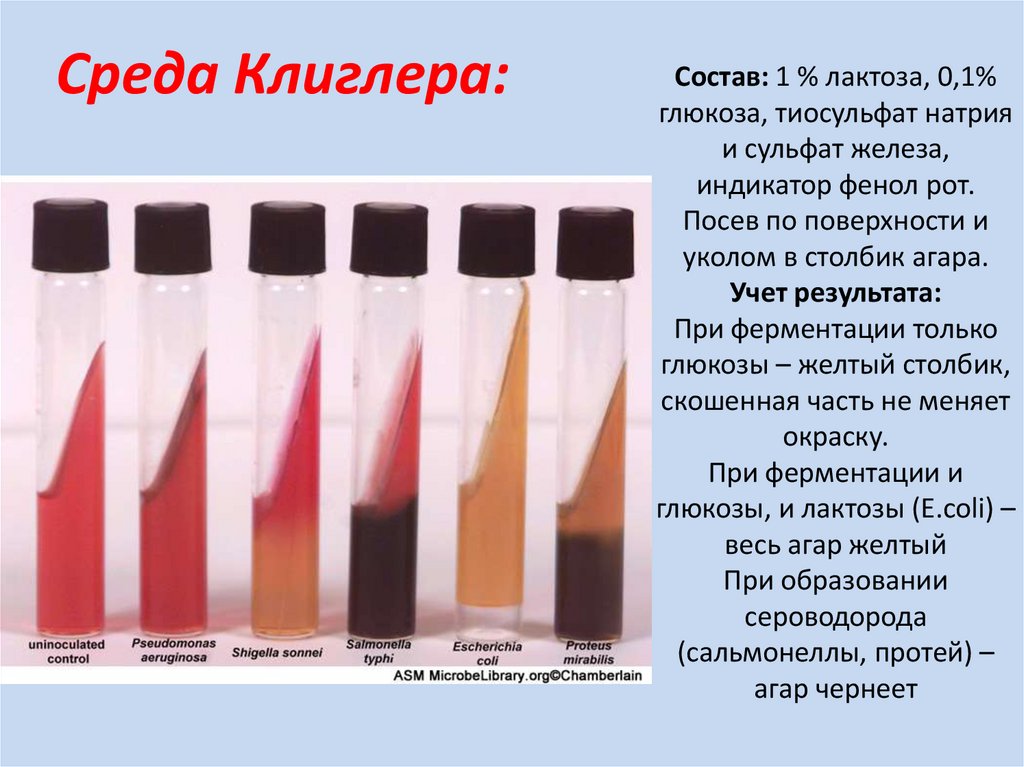
Среда Клиглера:Состав: 1 % лактоза, 0,1%
глюкоза, тиосульфат натрия
и сульфат железа,
индикатор фенол рот.
Посев по поверхности и
уколом в столбик агара.
Учет результата:
При ферментации только
глюкозы – желтый столбик,
скошенная часть не меняет
окраску.
При ферментации и
глюкозы, и лактозы (E.coli) –
весь агар желтый
При образовании
сероводорода
(сальмонеллы, протей) –
агар чернеет
58.
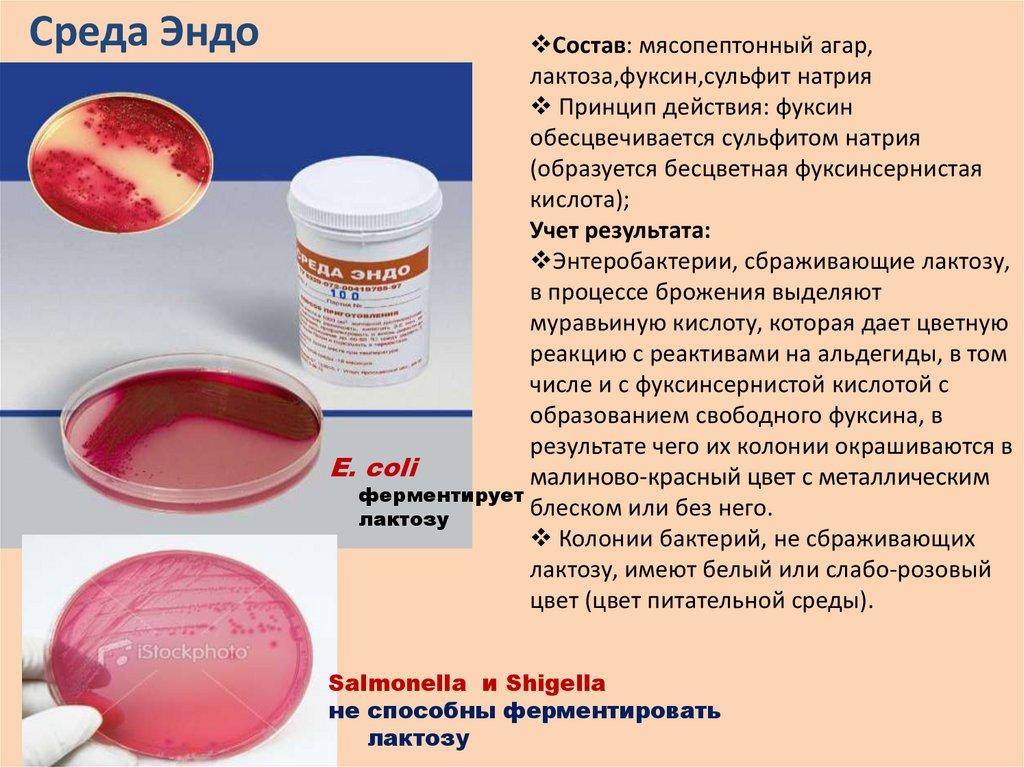
Среда ЭндоСостав: мясопептонный агар,
лактоза,фуксин,сульфит натрия
Принцип действия: фуксин
обесцвечивается сульфитом натрия
(образуется бесцветная фуксинсернистая
кислота);
Учет результата:
Энтеробактерии, сбраживающие лактозу,
в процессе брожения выделяют
муравьиную кислоту, которая дает цветную
реакцию с реактивами на альдегиды, в том
числе и с фуксинсернистой кислотой с
образованием свободного фуксина, в
результате чего их колонии окрашиваются в
E. coli
малиново-красный цвет с металлическим
ферментирует
блеском или без него.
лактозу
Колонии бактерий, не сбраживающих
лактозу, имеют белый или слабо-розовый
цвет (цвет питательной среды).
Salmonella и Shigella
не способны ферментировать
лактозу
59.
Среда ПлоскиреваСелективная среда для выделения
шигелл и сальмонелл.
В состав входят ингибирующие
вещества (желчные соли,
бриллиантовый зеленый, йод),
вследствие чего она должна полностью
подавлять рост грамположительной
флоры, значительно задерживать
(первые 24 ч) рост эшерихий и другой
сопутствующей микрофлоры
Дифференцирующие свойства агара
Плоскирева основаны на изменении рН
в кислую сторону при росте
лактозоферментирующих бактерий,
которые образуют колонии брусничного
цвета (индикатор нейтральный красный).
Лактозоотрицательные бактерии
вырастают в виде бесцветных или
слабоокрашенных колоний.
60.
Среда СиммонсаТест, указывающий на
способность бактерий
использовать цитраты в
качестве единственного
источника углерода.
Применяют для
идентификации и
дифференциации
энтеробактерий. Появление
роста и изменение цвета
среды на синий дает
основание считать пробу
положительной, отсутствие
роста и изменения цвета отрицательной.
61.
Определение протеолитическойактивности прокариот
ТЕСТ С ЛАКМУСОВЫМ МОЛОКОМ
Тест позволяет
определить не
только способность
прокариот
расщеплять белки,
но и степень
выраженности их
протеолитической
активности по «+++
системе»
62.
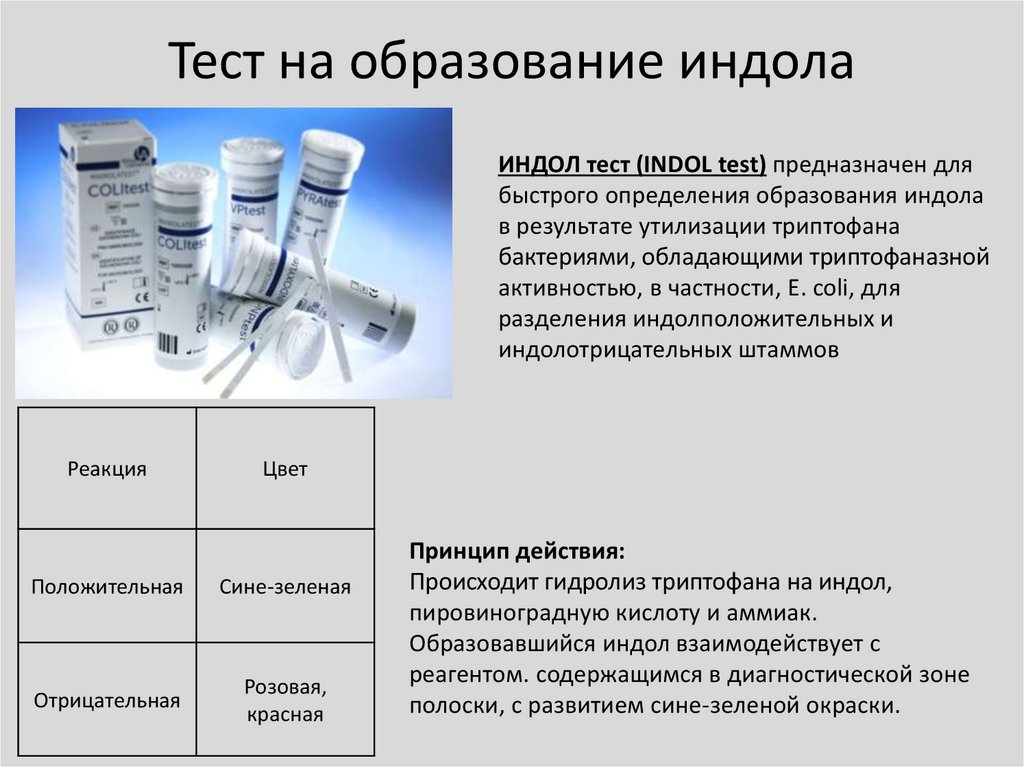
Тест на образование индолаИНДОЛ тест (INDOL test) предназначен для
быстрого определения образования индола
в результате утилизации триптофана
бактериями, обладающими триптофаназной
активностью, в частности, E. сoli, для
разделения индолположительных и
индолотрицательных штаммов
Реакция
Цвет
Положительная
Сине-зеленая
Отрицательная
Розовая,
красная
Принцип действия:
Происходит гидролиз триптофана на индол,
пировиноградную кислоту и аммиак.
Образовавшийся индол взаимодействует с
реагентом. содержащимся в диагностической зоне
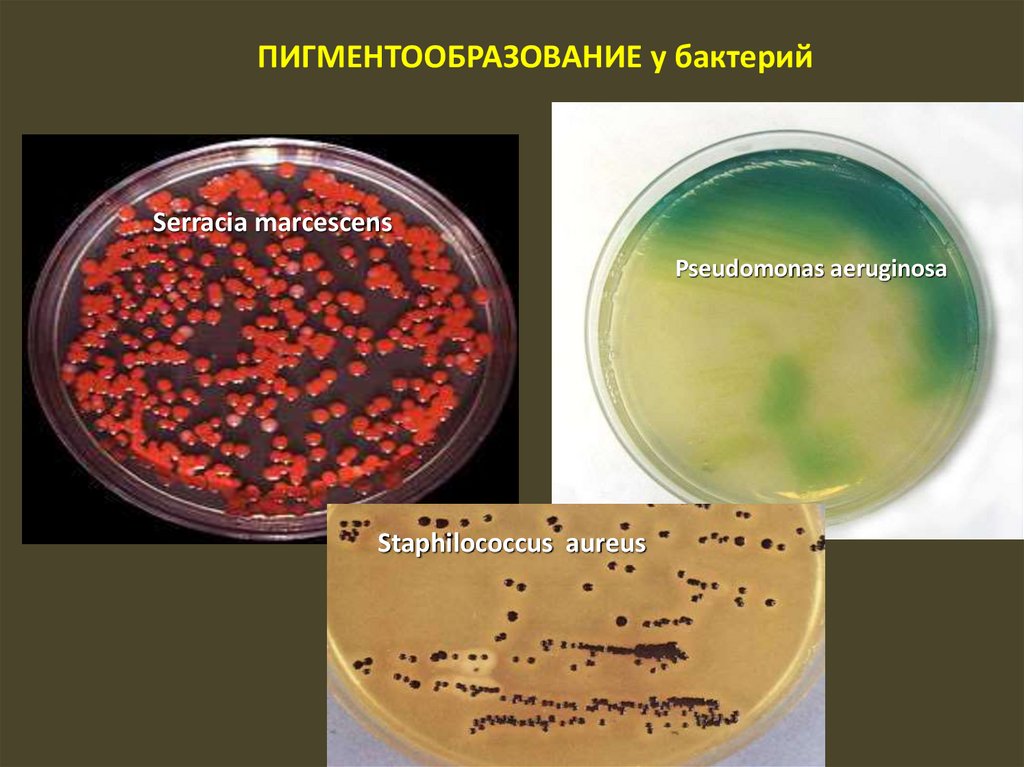
полоски, с развитием сине-зеленой окраски.
63.
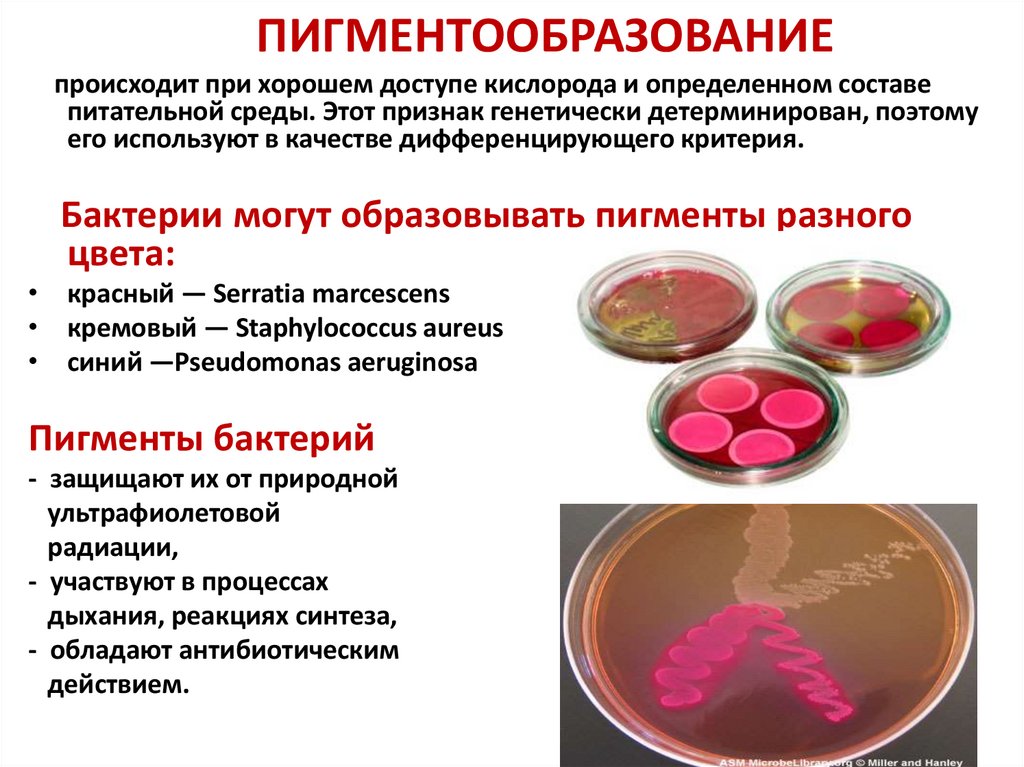
ПИГМЕНТООБРАЗОВАНИЕпроисходит при хорошем доступе кислорода и определенном составе
питательной среды. Этот признак генетически детерминирован, поэтому
его используют в качестве дифференцирующего критерия.
Бактерии могут образовывать пигменты разного
цвета:
• красный — Serratia marcescens
• кремовый — Staphylococcus aureus
• синий —Pseudomonas aeruginosa
Пигменты бактерий
- защищают их от природной
ультрафиолетовой
радиации,
- участвуют в процессах
дыхания, реакциях синтеза,
- обладают антибиотическим
действием.
64.
ПИГМЕНТООБРАЗОВАНИЕ у бактерийSerracia marcescens
Pseudomonas aeruginosa
Staphilococcus aureus
65.
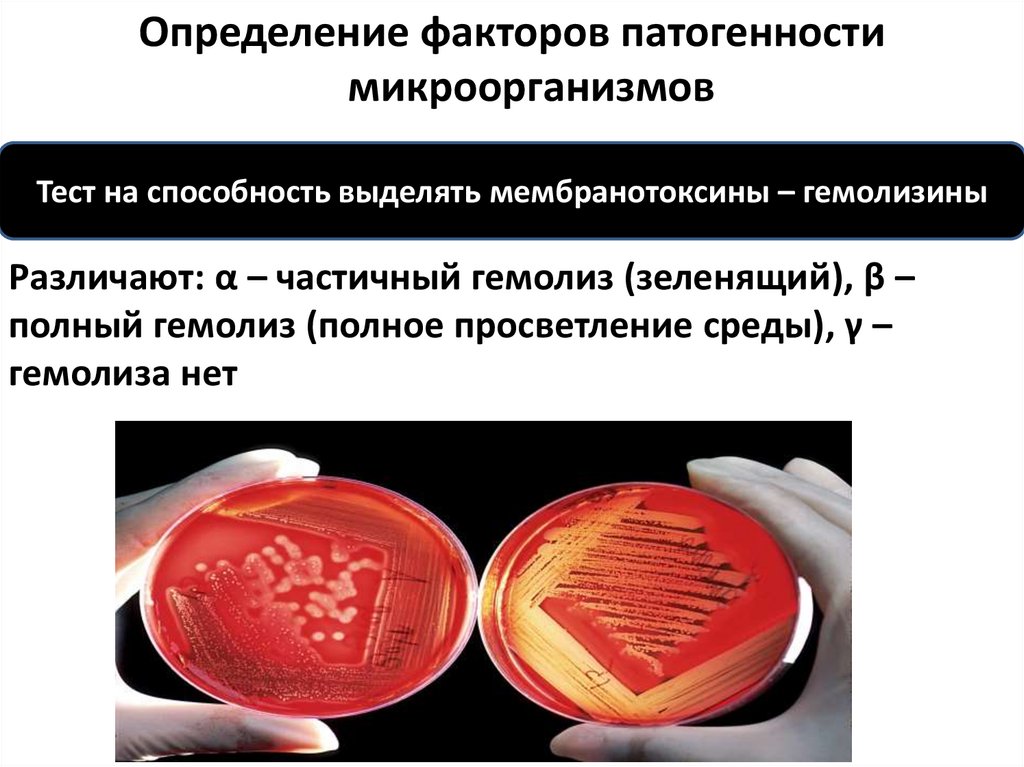
Определение факторов патогенностимикроорганизмов
Тест на способность выделять мембранотоксины – гемолизины
Различают: α – частичный гемолиз (зеленящий), β –
полный гемолиз (полное просветление среды), γ –
гемолиза нет
66.
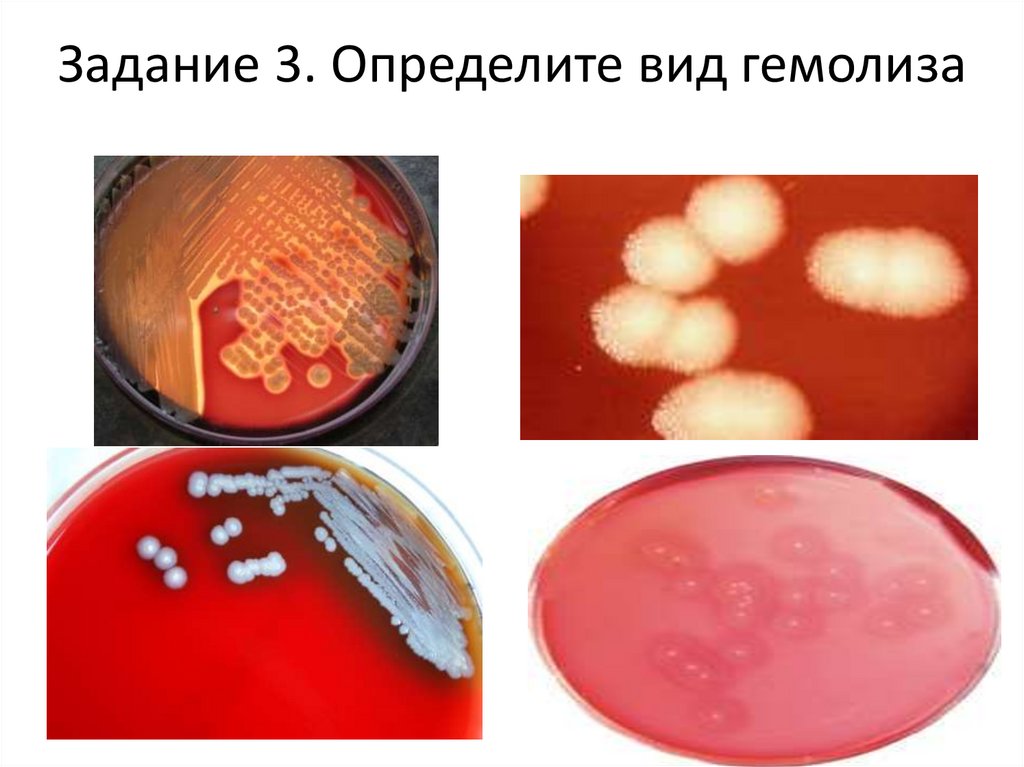
Задание 3. Определите вид гемолизаА
в
67.
Тест на ДНКазу - ДНКазу секретируетбольшинство патогенных микроорганизмов.
Она способна разрушать НК клеток человека
ДНКаза положительные колонии
Используется
ДНКазный агар с
толуидиновым
синим. Колонии
способные
секретировать
ДНКазу образуют
вокруг себя
«мутный венчик»
68.
Определение липолитическойактивности прокариот
Тест на
лецитовителазу
Лецитовителазоположительные колонии
S. aureus
ПРИНЦИП:
Лецитовителаза
расщепляет
лецитин
–
фосфатид, содержащийся в
каждой клетке эукариот в виде
фосфолипидного слоя клеточных
мембран
и
митохондрий.
Микроорганизмы,
продуцирующие этот фермент,
способны повреждать клетки и
длительно персистировать в
организме человека.
Лецитовителазо «+» колонии
образуют на плотной среде
(желточно-солевом
агаре)
«венчик»
69.
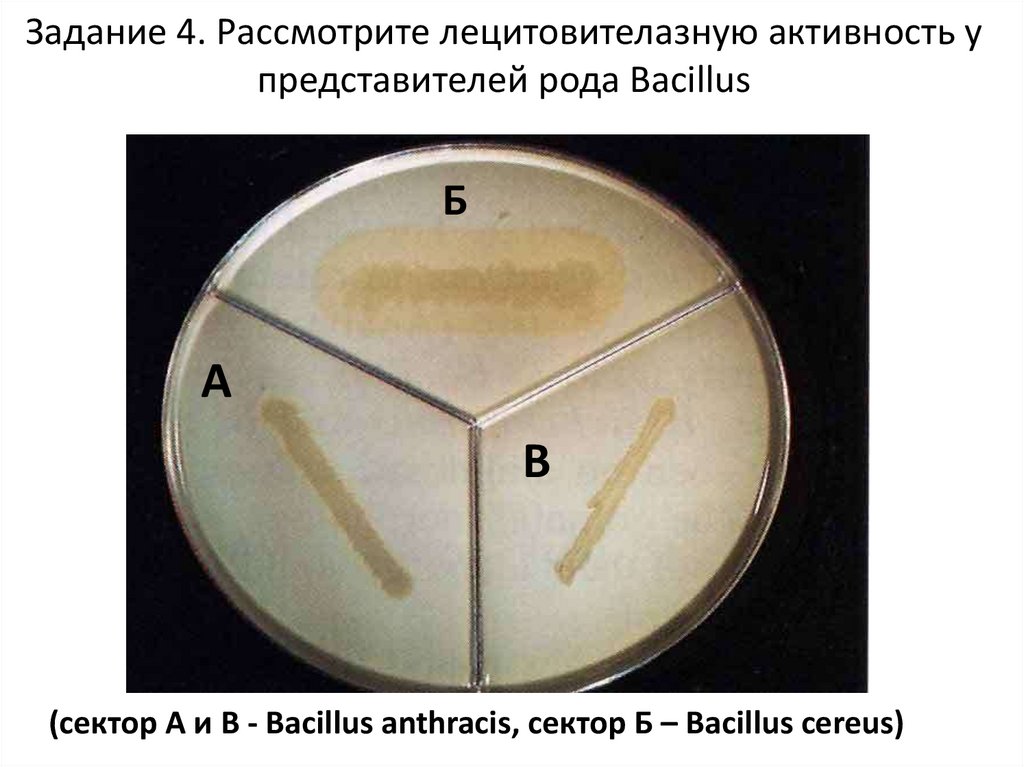
Задание 4. Рассмотрите лецитовителазную активность упредставителей рода Bacillus
Б
А
В
(сектор А и В - Bacillus anthracis, сектор Б – Bacillus cereus)
70.
Энергетическийметаболизм микробов
71.
• Все процессы жизнедеятельностимикробной клетки сопряжены с
тратой энергии и требуют ее
возобновления
У прокариот известны три способа
получения энергии:
• ФОТОСИНТЕЗ
• БРОЖЕНИЕ
• ДЫХАНИЕ
72.
Значение фотосинтезаФотосинтезирующая деятельность первичных одноклеточных
микроорганизмов имела три последствия, оказавшие решающее
влияние на всю дальнейшую эволюцию живого
1. Фотосинтез освободил организмы от конкуренции
за природные запасы абиогенных органических
соединений, количество которых значительно
сократилось
2. обеспечивал насыщение атмосферы достаточным
количеством кислорода для возникновения и
развития организмов, энергетический обмен
которых основан на процессе дыхания
3. в верхней части атмосферы образовался озоновый
экран, защищающий земную жизнь от губительного
действия ультрафиолетового излучения космоса
73.
Дыхание микроорганизмов –сложный процесс, представляющий
собой длинную цепь
последовательных окислительновосстановительных реакций с
участием многих ферментов,
которые катализируют реакции
переноса электронов от системы с
наибольшим положительным
потенциалом
74.
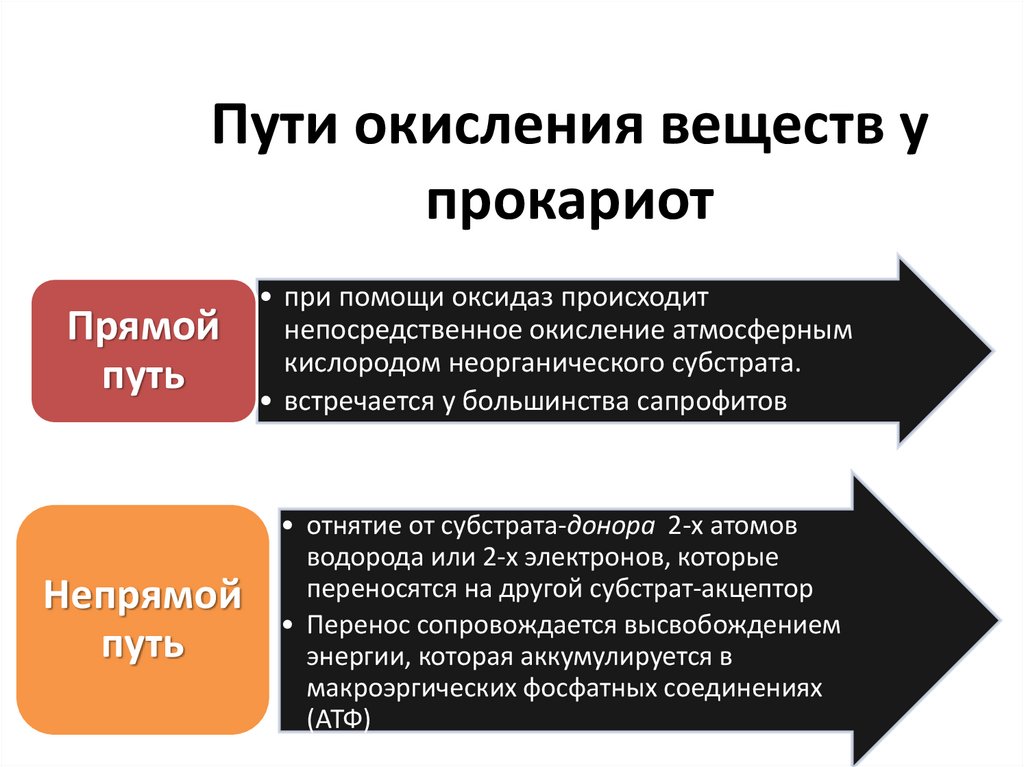
Пути окисления веществ упрокариот
Прямой
путь
• при помощи оксидаз происходит
непосредственное окисление атмосферным
кислородом неорганического субстрата.
• встречается у большинства сапрофитов
Непрямой
путь
• отнятие от субстрата-донора 2-х атомов
водорода или 2-х электронов, которые
переносятся на другой субстрат-акцептор
• Перенос сопровождается высвобождением
энергии, которая аккумулируется в
макроэргических фосфатных соединениях
(АТФ)
75.
АТФ (аденозинтрифосфат) -«энергетическая валюта» клетки
УНИВЕРСАЛЬНЫЙ АККУМУЛЯТОР ХИМИЧЕСКОЙ
ЭНЕРГИИ
76.
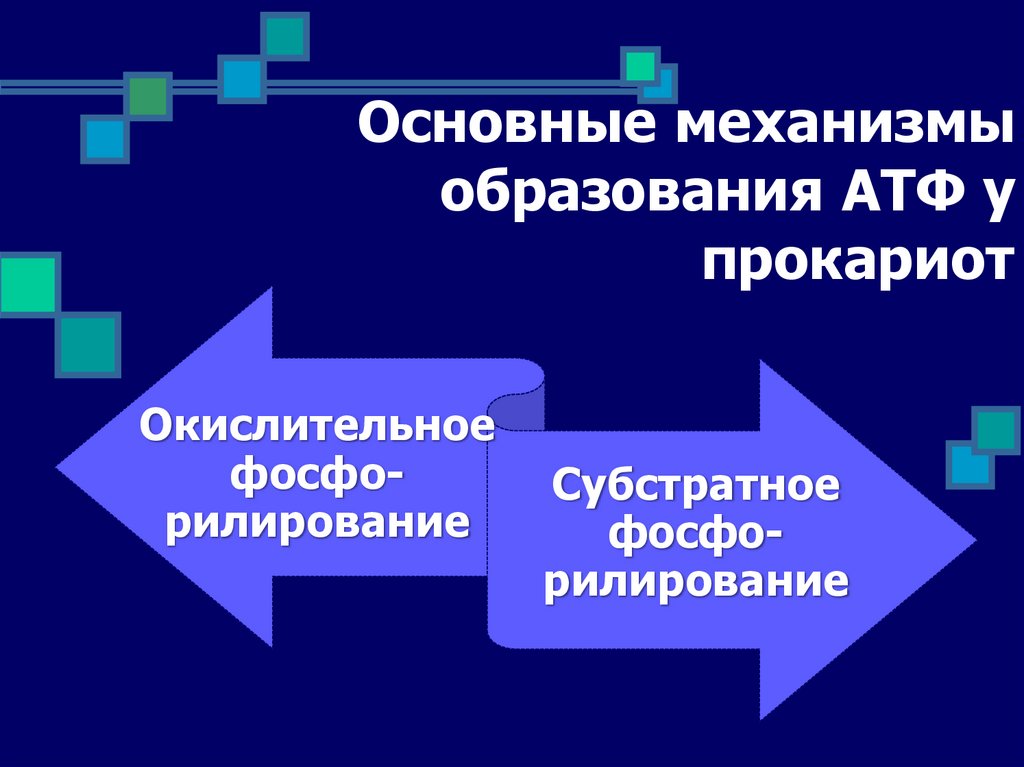
Основные механизмыобразования АТФ у
прокариот
Окислительное
фосфорилирование
Субстратное
фосфорилирование
77.
Окислительноефосфорилирование
Осуществляется путем отнятия электронов от
органического или неорганического субстрата
и передачи их конечным акцепторам,
которые при этом восстанавливаются
Конечные акцепторы: кислород – у аэробов;
сульфаты, нитраты и карбонаты и др. – у
анаэробов
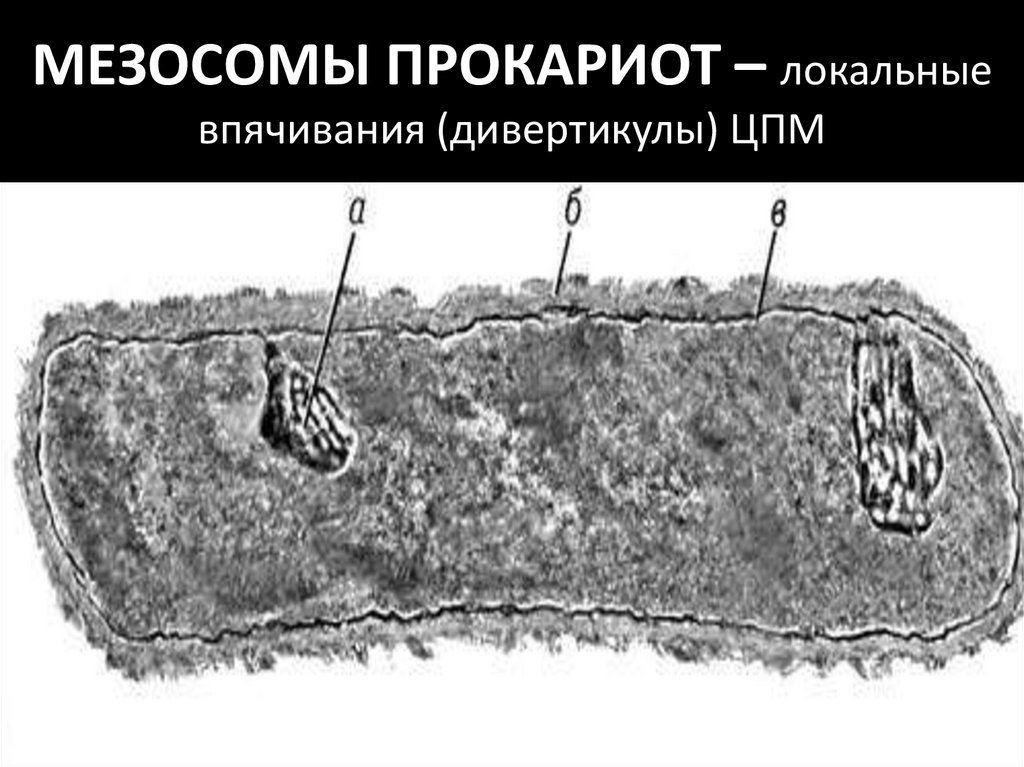
Происходит в мезосомах, путем переноса
электронов в дыхательной цепи
78.
МЕЗОСОМЫ ПРОКАРИОТ – локальныевпячивания (дивертикулы) ЦПМ
79.
Субстратноефосфорилирование
Ферментативное расщепление органических
веществ без участия кислорода
Донорами и акцепторами электронов
являются органические соединения (чаще
гексозы)
Окисление субстрата происходит в
циклических процессах (цикл трикарбоновых
кислот, пентозофосфатный цикл)
80.
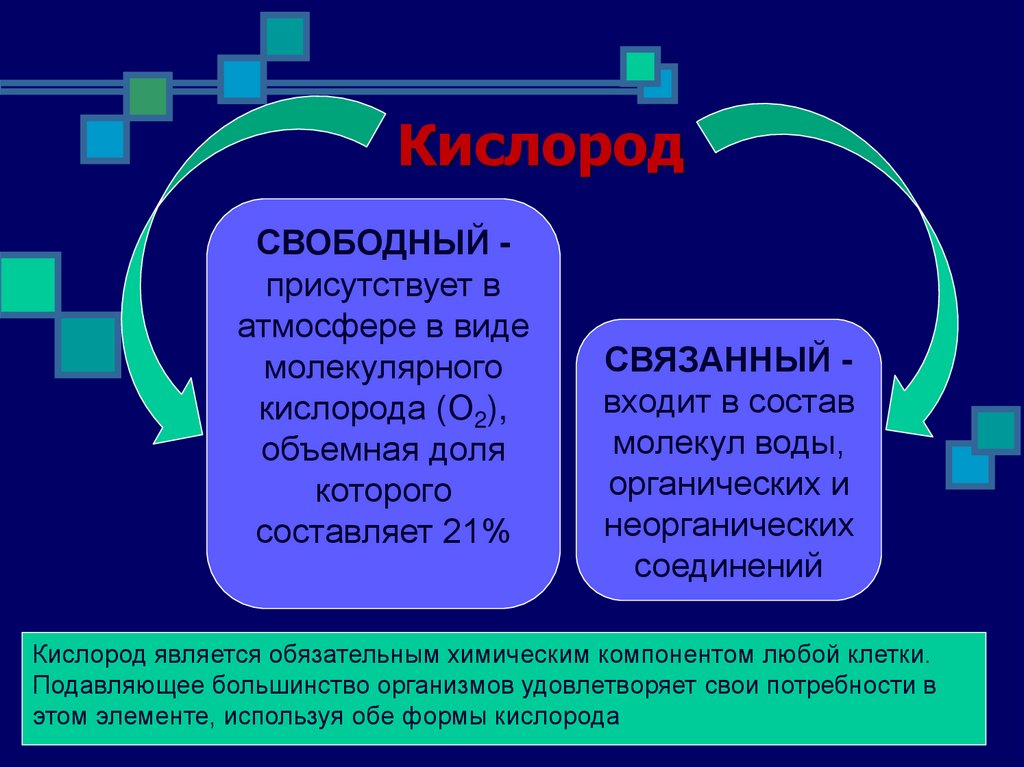
КислородСВОБОДНЫЙ присутствует в
атмосфере в виде
молекулярного
кислорода (O2),
объемная доля
которого
составляет 21%
СВЯЗАННЫЙ входит в состав
молекул воды,
органических и
неорганических
соединений
Кислород является обязательным химическим компонентом любой клетки.
Подавляющее большинство организмов удовлетворяет свои потребности в
этом элементе, используя обе формы кислорода
81.
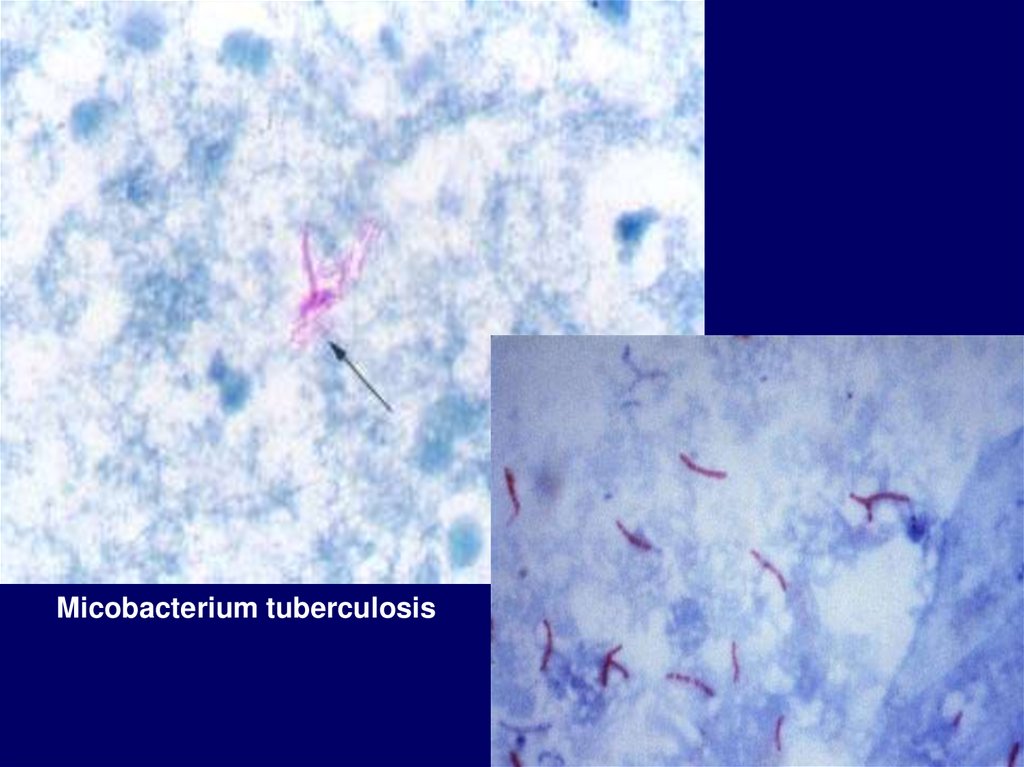
По типу дыхания прокариотыделятся на:
1. Облигатные аэробы – бактерии у
которых конечным акцептором водорода (е )
является свободный молекулярный кислород
воздуха (микобактерия туберкулеза)
2. Микроаэрофилы – бактерии-аэробы, у
которых рост и размножение оптимальны при
сниженном парциальном давлении О² ,не более
2% (ЛЕПТОСПИРЫ, БОРРЕЛИИ, АКТИНОМИЦЕТЫ)
82.
Micobacterium tuberculosis83.
Бактерии-микроаэрофилы хорошорастущие при повышенном содержании
СО² называют «КАПНОФИЛЬНЫМИ»
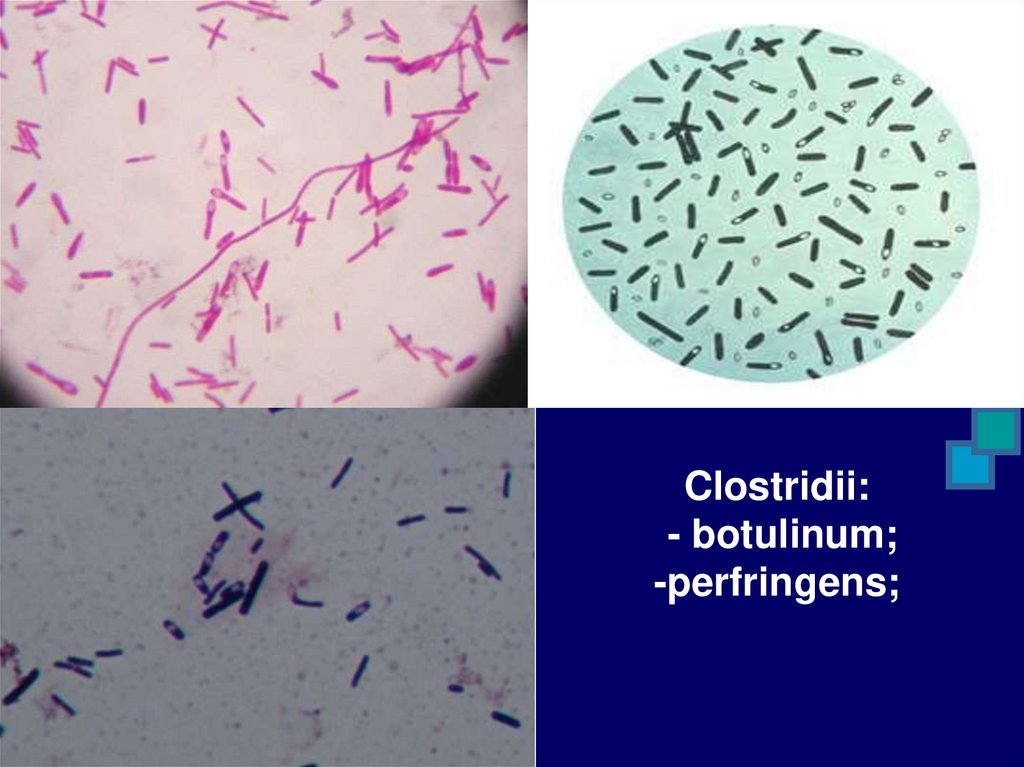
3. Облигатные анаэробы – бактерии,
которые получают энергию при
окислении органических или
неорганических веществ без доступа
свободного О² воздуха или анаэробным
фотосинтезом (клостридии столбняка,
ботулизма, газовой гангрены)
84.
Clostridii:- botulinum;
-perfringens;
85.
Облигатные анаэробы способные размножатьсяв среде с остаточным содержанием О² относят к
«АЭРОТОЛЕРАНТНЫМ»
4. Факультативные анаэробы бактерии способные извлекать энергию
из субстратов аэробным и анаэробным
путями биологического окисления в
зависимости от источника кислорода
(большинство сапрофитных и патогенных
микробов)
86.
Род Streptococcus spp.Род Morganella spp.
Род Lactobacillus spp.
87.
Наличие свободного кислорода дляоблигатных анаэробов является
губительным. Это связано с тем, что в
присутствии кислорода конечным
продуктом окисления органических
соединений оказывается перекись
водорода. А поскольку анаэробы не
обладают способностью продуцировать
фермент каталазу, расщепляющую
перекись водорода, то она
накапливается и оказывает токсическое
действие на бактерии
88.
Облигатно анаэробные бактерии в природе могутнаходиться в аэробных зонах, что обеспечивается :
- широкое распространение представителей
рода Clostridium в местах с высоким парциальным
давлением O2 объясняется наличием у них
эндоспор, нечувствительных к молекулярному
кислороду
- совместное развитие с облигатными
аэробами, активно потребляющими
молекулярный кислород, приводящее к
образованию зон с низкой концентрацией O2,
создает возможности и для развития строго
анаэробных видов
89.
Аэробный тип дыхания вэнергетическом
отношении является
наиболее эффективным
Примером может служить окисление 1 моль
глюкозы:
- в аэробных условиях этот процесс
сопровождается выделением 688,5 ккал
- в анаэробных условиях образуется 31,2
ккал
90.
В процессе аэробного дыхания образуютсятоксические продукты окисления (H2O2 - перекись
водорода, О2 - свободные кислородные радикалы), от
которых защищают специфические ферменты,
прежде всего каталаза,
пероксидаза, пероксиддисмутаза.
У анаэробов эти ферменты отсутствуют, также как
и система регуляции окислительно-
восстановительного потенциала (rH2)
91.
Виды анаэробного дыхания1. Нитратное (акцептор е НИТРАТЫ)
2. Сульфатное (акцептор е СУЛЬФАТЫ)
3. Серное (акцептор е СЕРА)
4. «Железное» (акцептор е ЖЕЛЕЗО)
5. Карбонатное (акцептор е УГЛЕКИСЛЫЙ
ГАЗ)
6. Фумаратное (акцептор е фумарат)
92.
Нитратное дыхание осуществляется 2 путями:• АММОНИФИКАЦИЯ НИТРАТА с образованием
аммиака
• ДЕНИТРИФИКАЦИЯ НИТРАТА с образованием
молекулярного азота
• Нитратное дыхание характерно для факультативных
анаэробов
Сульфатное дыхание
• Хемоорганогетеротрофы в качестве доноров
водорода используют органические кислоты и спирты
• Хемолитотрофы в качестве донора водорода
используют молекулярный водород
• Конечным продуктом окисления является уксусная
кислота
• Встречается у облигатных анаэробов: археи,
сульфатредуцирующие бактерии
93.
«Железное» дыхание• Возникло раньше сульфатного, нитратного и
аэробного типов дыхания
• Участвуют комплексообразователи сидерофоры
• Происходит восстановление трехвалентного
железа в двухвалентное
• Синтезируется около 11 молекул АТФ
Карбонатное дыхание
• Конечным акцептором электронов служит
углекислота или СО;
• Встречается у метанообразующих бактерий
(метаногены), обитающих в болотах, в илах,
отстойниках очистных сооружений
94.
Серное дыханиеВстречается у серных бактерий,
обитающих в местах связанных
с вулканической деятельностью,
где много абиогенной
элементарной серы
Фумаратное дыхание
Конечным акцептором электронов является
фумарат - промежуточный продукт распада
АЦЕТИЛ-КОА в цикле трикарбоновых кислот
К фумаратному дыханию способны
энтеробактерии, вибрионы,
пептострептококки
95.
Большинство прокариот способныосуществлять брожение
БРОЖЕНИЕ - совокупность
энергетических процессов при
которых органические соединения
служат и донорами и акцепторами
электронов. Кислород в брожении не
участвует. Микроорганизмы,
вызывающие брожение относятся к
облигатным или факультативным
анаэробам
96.
Особенности брожения упрокариот:
Бактерии не способны поглощать полимерные
молекулы органических веществ, поэтому
макромолекулы сначала расщепляются вне клетки
экзоферментами на мономеры, а затем
поглощаются и расходуются;
Субстратом при брожении чаще всего являются
углеводы (глюкоза)
Конечным продуктом брожения является не только
пировиноградная кислота, но и другие соединенияэтиловый спирт, уксусная, молочная, маслянная
кислоты и др.
При расщеплении 1 моля глюкозы образуется от 1
до 4 молей молекулы АТФ
97.
Правила проведения посева напитательные среды для получения
чистых культур анаэробных
бактерий
Анаэробные бактерии можно культивировать только на специальных
бескислородных питательных средах с низким окислительновосстановительным потенциалом (ОВП).
Для контролем за насыщением этих сред кислородом используют
специальные редокс-индикаторы.
Для сохранения низкого ОВП среды должны быть агаризованы.
Для культивирования облигатно-анаэробных бактерий среды должны
быть свежеприготовленными (не позднее 2 часов).
Для успешного выращивания требуется внесение большого
количества посевного материала. Это связано с тем, что в больших
количествах анаэроб способны быстрее понижать ОВП среды.
Среды должны очень богаты питательными субстратами и
витаминами, факторами роста, т.к. анаэробный типа дыхания менее
продуктивный, чем аэробный.
98.
Основные методы созданияанаэробных условий для
культивирования
микроорганизмов
ФИЗИЧЕСКИЕ
МЕТОДЫ
ХИМИЧЕСКИЕ
МЕТОДЫ
БИОЛОГИЧЕСКИЕ
МЕТОДЫ
СМЕШАННЫЕ
МЕТОДЫ
99.
Физические методыпосев в глубину плотных питательных сред
(способ Вейон-Виньяль);
механическое удаление воздуха из
сосудов, в которых выращиваются
анаэробные микроорганизмы;
замена воздуха в сосудах каким-либо
индифферентным газом
100.
Химические методыиспользование химических веществ, поглощающих
молекулярный кислород поглотителем молекулярного
кислорода в лабораторной практике является щелочной
раствор пирогаллола, дитионит натрия, металлическое
железо, хлорид одновалентной меди и некоторые другие
реактивы
использование восстанавливающих агентов, которые
добавляют в большинство сред для снижения
окислительно-восстановительного потенциала среды:
тиогликолат натрия, цистеин, аскорбиновая кислота
посев в среды, содержащие редуцирующие и легко
окисляемые вещества;
101.
Биологические методыоснованы на совместном
выращивании анаэробов со
строгими аэробами
Например, питательную среду в чашке Петри
разделяют желобком на две половины, на одну
половину засевают какой-либо аэробный
микроорганизм, на другой - анаэроб. Края чашки
заливают парафином. Рост анаэробного
микроорганизма начнется только после полного
использования кислорода аэробом.
102.
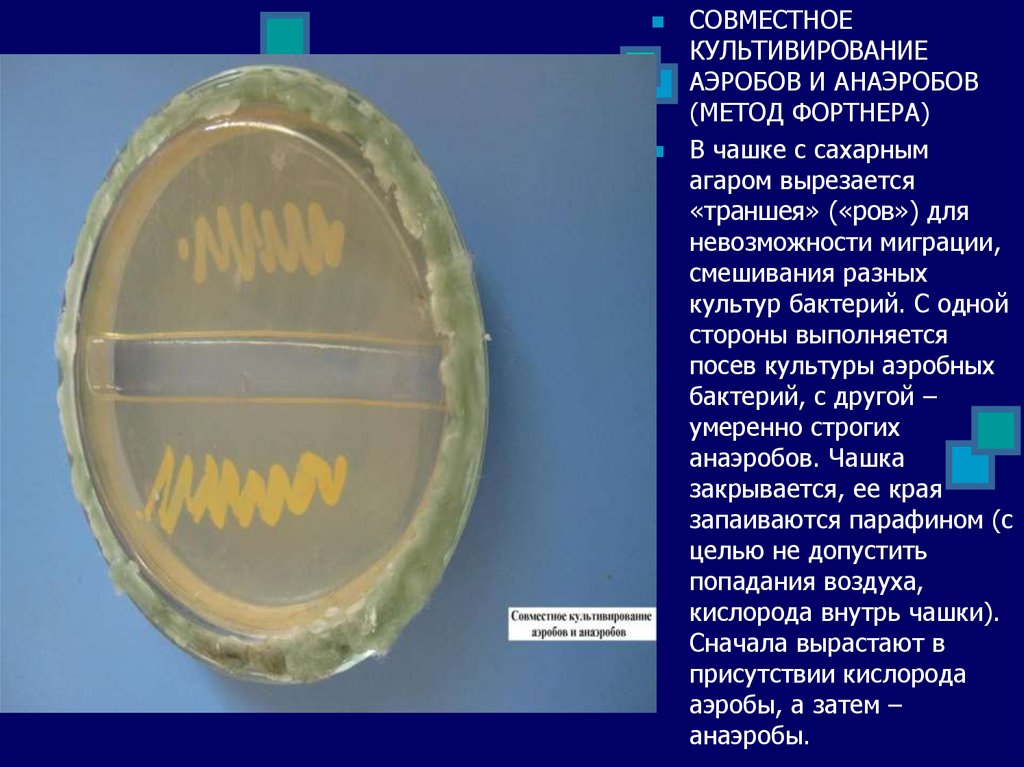
СОВМЕСТНОЕКУЛЬТИВИРОВАНИЕ
АЭРОБОВ И АНАЭРОБОВ
(МЕТОД ФОРТНЕРА)
В чашке с сахарным
агаром вырезается
«траншея» («ров») для
невозможности миграции,
смешивания разных
культур бактерий. С одной
стороны выполняется
посев культуры аэробных
бактерий, с другой –
умеренно строгих
анаэробов. Чашка
закрывается, ее края
запаиваются парафином (с
целью не допустить
попадания воздуха,
кислорода внутрь чашки).
Сначала вырастают в
присутствии кислорода
аэробы, а затем –
анаэробы.
103.
Комбинированныеметоды основаны на
сочетании физических,
химических и биологических
методов создания
анаэробиоза
104.
Методы выделения чистых культуранаэробов
Метод Цейсслера. Исследуемый материал сеют штрихами по
поверхности плотной среды. Создают анаэробные условия. И
инкубируют при 37° 24-72ч. Изолированные колонии анаэробов
пересевают на среду контроля стерильности (СКС) или среду КиттаТароцци.
Метод Вейнберга. Несколько капель исследуемого материал вносят
в пробирку с 4-5мл изотонического раствора. Перемешивают
запаянным капилляром переносят в пробирку с расплавленным, а
затем остуженным до 45-50 градусов сахарным агаром, разлитым
высоким столбиком. После перемешивания этим же капилляром
засевают еще две пробирки с сахарным агаром и быстро охлаждают
под струей воды. Выросшие в глубине колонии пересевают на СКС
или среду Китта-Тароцци.
105.
Метод Перетца. Готовятразведение материала, как
указано выше. Содержимое
пробирки с соответствующим
разведением выливают в
чашку Петри, на дне которой
на двух палочках лежит
стеклянная пластина 6х6см.
среду заливают так, что бы
она заполнила пространство
между пластиной и дном
чашки. При появлении роста
пластинку поднимают и
чистые колонии пересевают
106.
Схема выделения чистой культурыоблигатных анаэробов.
Взятие исследуемого материала осуществляется
шприцем с притертым поршнем, после чего материал
вносят в пробирку с транспортной средой.
Выделение чистой культуры проводится со строгим
соблюдением анаэробных условий на всех этапах
исследования.
1-й этап – получение изолированных колоний.
Готовят ряд разведений исследуемого материала и
делают посев на чашки Петри со средой для
культивирования анаэробов. Посевы инкубируют в
микроанаэростатах. заполненных газовой смесью,
при температуре 37С в течение 48-72 часов.
107.
Схема выделения чистойкультуры облигатных
анаэробов.
2-й этап - получение чистой культуры анаэробов.
На этом этапе:
1.Изучают морфологические и культуральные свойства
выросших колоний.
2. Проводят параллельный рассев каждой отобранной
колонии на две чашки Петри с питательной средой. Одну
чашку инкубируют в аэробных условиях, другую - в
анаэробных условиях.
Дня дальнейшего исследования отбирают культуры,
выросшие только в анаэробных условиях (так исключают
факультативные анаэробы).
108.
Схема выделения чистой культурыоблигатных анаэробов.
3-й этап - идентификация выделенных
облигатных анаэробов.
Проводят биохимическую идентификацию в
микротест-системе. Суспензию выделенной
культуры засевают на пластину с набором
биохимических тестов, инкубируют в
анаэробных условиях в течение 48 часов,
учитывают биохимические свойства культуры по
изменению окраски индикаторов системы и
определяют ее родовую и/или видовую
принадлежность.


































































 biology
biology








